Вакцинация способствует формированию у реципиента иммунитета к патогенным микроорганизмам и тем самым защищает его от инфекции. В ответ на пероральное или парентеральное введение вакцины в организме хозяина вырабатываются антитела к патогенному микроорганизму, которые при последующей инфекции приводят к его инактивации (нейтрализации или гибели), блокируют его пролиферацию и не позволяют развиться заболеванию.
Эффект вакцинации открыл более 200 лет назад – в 1796 г. – врач Эдвард Дженнер. Он доказал экспериментально, что человек, перенесший коровью оспу, не очень тяжелую болезнь крупного рогатого скота, становится невосприимчивым к оспе натуральной. Натуральная оспа – высококонтагиозное заболевание с высокой смертностью; даже если больной не погибает, у него нередко возникают различные уродства, психические расстройства и слепота. Дженнер публично провел прививку коровьей оспы 8-летнему мальчику Джеймсу Фиппсу, использовав для этого экссудат из пустулы больной коровьей оспой, а затем через определенное время дважды инфицировал ребенка гноем из пустулы больного натуральной оспой. Все проявления заболевания ограничились покраснением в месте прививки, исчезнувшим через несколько дней.
Ранее такие инфекционные болезни, как туберкулез, оспа, холера, брюшной тиф, бубонная чума и полиомиелит, были настоящим бичом для человечества. С появлением вакцин, антибиотиков и внедрением мер профилактики эти эпидемические болезни удалось взять под контроль. Однако защитные меры со временем становились неэффективными, и возникали новые вспышки заболеваний. В 1991 г. эпидемия холеры поразила Перу; в течение трех следующих лет было выявлено примерно 1 млн. заболевших, несколько тысяч из них умерли. К сожалению, против многих болезней человека и животных вакцин не существует. Сегодня во всем мире более 2 млрд. людей страдают заболеваниями, которые можно было бы предотвратить с помощью вакцинации. Вакцины могут оказаться полезными и для профилактики постоянно появляющихся «новых» болезней (например, СПИДа).
Как правило, современные вакцины создают на основе убитых (инактивированных) патогенных микроорганизмов либо живых, но невирулентных (аттенуированных) штаммов. Для этого штамм дикого типа выращивают в культуре, очищают, а затем инактивируют или модифицируют таким образом, чтобы он вызывал иммунный ответ, достаточно эффективный в отношении вирулентного штамма. Несмотря на значительные успехи в создании вакцин против таких заболеваний, как краснуха, дифтерия, коклюш, столбняк, оспа и полиомиелит, производство современных вакцин сталкивается с целым рядом ограничений.
- Не все патогенные микроорганизмы удается культивировать, поэтому для многих заболеваний вакцины не созданы.
- Для получения вирусов животных и человека необходима дорогостоящая культура животных клеток.
- Титр вирусов животных и человека в культуре и скорость их размножения часто бывают очень низкими, что удорожает производство вакцин.
- Необходимо строго соблюдать меры предосторожности, чтобы не допустить инфицирования персонала.
- При нарушении производственного процесса в некоторые партии вакцины могут попасть живые или недостаточно ослабленные вирулентные микроорганизмы, что может привести к неумышленному распространению инфекции.
- Аттенуированные штаммы могут ревертировать к исходному штамму, поэтому необходимо постоянно контролировать вирулентность.
- Некоторые заболевания (например, СПИД) нельзя предупреждать с помошью традиционных вакцин.
- Большинство современных вакцин имеют ограниченный срок годности и сохраняют активность только при пониженной температуре, что затрудняет их использование в развивающихся странах.
В последнее десятилетие, с развитием технологии рекомбинантных ДНК, появилась возможность создать новое поколение вакцин, не обладающих недостатками традиционных вакцин. Для их разработки применяют методы генной инженерии.
- Патогенный микроорганизм модифицируют, делегируя гены, ответственные за вирулентность. Способность вызывать иммунный ответ при этом сохраняется. Такой микроорганизм можно безбоязненно использовать в качестве живой вакцины, поскольку выращивание в чистой культуре исключает возможность спонтанного восстановления целого гена.
- Создают живые непатогенные системы переноса отдельных антигенных детерминант неродственного патогенного организма. Такая система переноса способствует развитию выраженного иммунного ответа на патогенный микроорганизм.
- Если патогенные микроорганизмы не растут в культуре, можно изолировать, клонировать и экспрессировать в альтернативном хозяине (например, в Е. coli или линии клеток млекопитающих) гены тех белков, которые содержат основные антигенные детерминанты, и использовать эти белки как «субъединичные» вакцины (см. следующий раздел).
- Некоторые патогенные микроорганизмы действуют опосредованно, вызывая развитие аутоиммунной реакции на инфицированные клетки организма-хозяина. Для таких заболеваний можно создать систему специфического уничтожения клеток-мишеней, сконструировав ген, кодирующий химерный белок, одна часть которого будет связываться с инфицированной клеткой, а другая – уничтожать ее. Эта система не является истинной вакциной, хотя она и действует только на инфицированные клетки, устраняя саму причину развития аутоиммунной реакции.
К вакцинам для животных предъявляются менее жесткие требования, поэтому первыми вакцинами, полученными с помощью технологии рекомбинантных ДНК, были вакцины против ящура, бешенства, дизентерии и диареи поросят. Создаются и другие вакцины для животных, а в скором времени появятся и рекомбинантные вакцины, предназначенные для человека (табл. 11.1).
Таблица 11.1. Патогенные микроорганизмы,
против которых в настоящее время разрабатываются вакцины

СУБЪЕДИНИЧНЫЕ ВАКЦИНЫ
Как правило, вакцины содержат неповрежденные патогенные микроорганизмы, но при этом неживые или аттенуированные. Антитела, вырабатываемые в ответ на их введение, связываются с поверхностными белками патогенного организма и запускают иммунный ответ. В связи с этим возникает вопрос: должна ли вакцина содержать целые клетки или лишь какие-то специфические поверхностные компоненты? Что касается вирусов, то, как было показано, для выработки в организме-хозяине антител в ответ на вирусную инфекцию достаточно очищенных поверхностных белков вируса (белков капсида или внешней оболочки) (рис. 11.1). Вакцины, содержащие лишь отдельные компоненты патогенного микроорганизма, называют «субъединичными», для их разработки с успехом используется технология рекомбинантных ДНК.
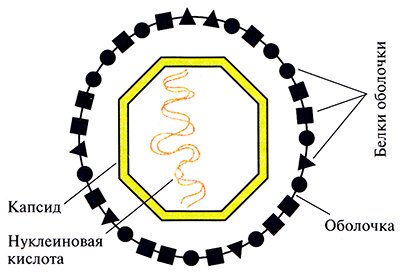
Рис. 11.1. Строение вируса животных. Геном вируса обычно представлен относительно небольшой молекулой нуклеиновой кислоты (одно- или двухцепочечной ДНК или РНК длиной от 3 до 200 т. п. н.), заключенной в белковый капсид. У некоторых вирусов капсид окружен еще и белковой оболочкой.
Субъединичные вакцины имеют свои достоинства и недостатки. Достоинства состоят в том, что препарат, содержащий очищенный иммуногенный белок, стабилен и безопасен, его химические свойства известны, в нем отсутствуют дополнительные белки и нуклеиновые кислоты, которые могли бы вызывать нежелательные побочные эффекты в организме-хозяине. Недостатки заключаются в том, что очистка специфического белка стоит дорого, а конформация выделенного белка может отличаться от той, которую он имеет in situ (т. е. в составе вирусного капсида или оболочки), что может приводить к изменению его антигенных свойств. Решение о производстве субъединичной вакцины принимается с учетом всех имеющих отношение к делу биологических и экономических факторов.
Противогерпетические вакцины
Вирус простого герпеса (HSV, herpes simplex virus) вызывает инфекционные заболевания генерализованного или местного характера (тяжелые поражения глаз, энцефалит, урогенитальные инфекции и т. д.). Кроме того, он является онкогенным, поэтому вакцинация убитым или аттенуированным вирусом сопряжена с определенным риском развития рака. Для защиты от HSV-инфекции можно использовать неонкогенную субъединичную вакцину.
Для создания любой субъединичной вакцины прежде всего нужно идентифицировать те компоненты патогенного микроорганизма, которые индуцируют выработку антител. В случае HSVTHna 1 (HSV-1) таким компонентом является гликопротеин D оболочки (gD). В ответ на введение этого гликопротеина мышам у них вырабатываются антитела, нейтрализующие интактный HSV. Ген gD HSV-1 был изолирован, клонирован в одном из экспрессирующих векторов в клетках млекопитающих и введен в яйцеклетки китайского хомячка (СНО), в которых в отличие от Е. coli происходит гликолизирование чужеродных белков. Полноразмерный ген gD кодирует белок, в норме связывающийся с мембраной клетки млекопитающего (рис. 11.2, А). Такой белок труднее очистить, чем растворимый, поэтому ген gD модифицировали, удалив ту его часть, которая кодирует С-концевой трансмембранный домен (рис. 11.2, Б). Затем модифицированным геном трансформировали СНО-клетки, которые гликозилировали белковый продукт и секретировали его во внешнюю среду, поскольку он не мог встраиваться в клеточную мембрану. Лабораторные испытания показали, что антитела, вырабатываемые в ответ на введение модифицированного белка gD, эффективны в отношении как HSV-1, так и HSV-2.
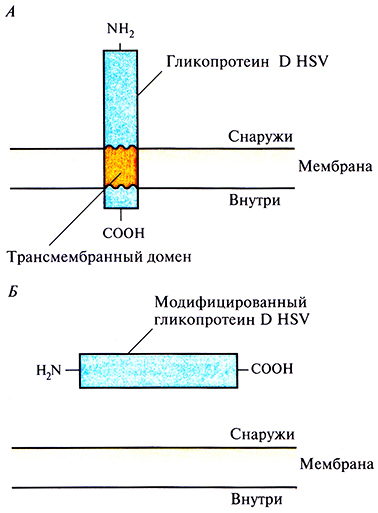
Рис. 11.2. А. Молекула gD HSV-1 с трансмембранным доменом, погруженным в плазматическую мембрану. Б. Растворимый белок gD, не содержащий трансмембранного домена.
Противоящурные вакцины
Вирус ящура (FMDV, foot-and-mouth disease virus) в высшей степени вирулентен и вызывает массовую гибель крупного рогатого скота и свиней. Для защиты от FMDV-инфекции используют вакцину, содержащую вирус, инактивированный формалином. В мире ежегодно производится примерно 1 млрд. доз этой вакцины.
Основной антигенной детерминантой, индуцирующей образование антител, является вирусный капсидный белок 1 (VP1, viral protein 1). Это более слабый антиген, чем интактные вирусные частицы, но все же он индуцирует образование антител и обеспечивает защиту животных от инфекции. Поэтому были предприняты попытки клонировать VP1-ген.
Геном FMDV представляет собой одноцепочечную РНК. Поэтому сначала синтезировали полноразмерную двухцепочечную кДНК длиной примерно 8000 п. н. Затем ее расщепили с помощью рестрицирующих эндонуклеаз и клонировали полученные фрагменты в экспрессирующем Е. соLI-векторе. Продукт кодирующей последовательности VP 1-гена идентифицировали иммунологическими методами как часть слитого (химерного) белка, синтез которого контролируется системой pL-промотор–сl-репрессор. Белок состоит из 396 аминокислотных остатков, содержит часть молекулы репликазы бактериофага MS2 и полноразмерный VPl-белок FMDV, благодаря чему он и индуцирует выработку нейтрализующих FMDV антител.
Получить разрешение на применение вакцины, содержащей химерный белок, очень трудно, поэтому, вероятно, придется субклонировать VPl-последовательность в другом экспрессирующем векторе. Так или иначе, субъединичная вакцина против ящура скоро будет готова для проведения доклинических испытаний.
Противотуберкулезные вакцины
Туберкулез – системное инфекционное заболевание, широко распространенное во всем мире. Его возбудителем является бактерия Mycobacterium tuberculosis. Она инфицирует разные ткани и органы (чаще всего легкие) и приводит к гибели клеток. У пациентов наблюдаются лихорадка, потеря веса, а в отсутствие лечения заболевание заканчивается смертью. По оценкам, этим патогенным микроорганизмом инфицировано около 2 млрд. людей, а туберкулез ежегодно уносит примерно 3 млн. жизней. Последние 50 лет для лечения туберкулеза использовали антибиотики, но уже появилось множество устойчивых к ним штаммов М. tuberculosis, так что заболевание, казавшееся побежденным, вновь стало серьезной проблемой.
В настоящее время в ряде стран в качестве противотуберкулезной вакцины используют один из штаммов Mycobacterium bovis, бациллу Кальмета–Герена (BCG, bacillus Calmette–Guerin). Однако эффективность такого подхода вызывает сомнения по двум причинам: 1) живые BCG-клетки могут вызвать серьезное заболевание у лиц со сниженным иммунным статусом (например, у больных СПИДом); 2) лица, которым ввели BCG-вакцину, дают положительный ответ на обычную процедуру выявления вызывающих туберкулез бактерий, что не позволяет отличить их от больных туберкулезом. В связи с этим в некоторых странах, в том числе и в США, BCG-вакцина к использованию не разрешена. В попытках создания более безопасной и эффективной субъединичной противотуберкулезной вакцины были изучены иммуннопротективные свойства очищенных внеклеточных белков М. tuberculosis. Из жидкой бактериальной культуры выделили и очистили шесть основных из 100 секретируемых белков, и каждый из них по отдельности, а затем различные их комбинации использовали для иммунизации морских свинок. Животным вводили в виде аэрозоля примерно 200 живых клеток М. tuberculosis, что является для них весьма высокой дозой. Через 9–10 нед животных умерщвляли и исследовали их легкие и селезенку на предмет присутствия этой патогенной бактерии. При введении некоторых комбинаций очищенных белков потеря веса, поражение легких и селезенки и уровень смертности были такими же, как и при иммунизации живой BCG-вакциной. Теперь нужно провести сравнение эффективности белков М. tuberculosis, полученных с помощью технологии рекомбинантных ДНК, с эффективностью секреторных белков и разработать безопасную и эффективную вакцину для профилактики туберкулеза у человека.
Пептидные вакцины
Далее возникает следующий вопрос: может ли небольшой участок белковой молекулы (домен) служить эффективной субъединичной вакциной и индуцировать выработку антител? Интуитивно кажется, что те домены, которые доступны для антитела (т. е. те, которые находятся на поверхности вируса), обладают иммуногенными свойствами, а внутренние домены несущественны, если только они не влияют на конформацию иммуногенного домена (рис. 11.3). Если это предположение верно, то короткие пептиды, имитирующие эпитопы (антигенные детерминанты), можно использовать для создания вакцин.
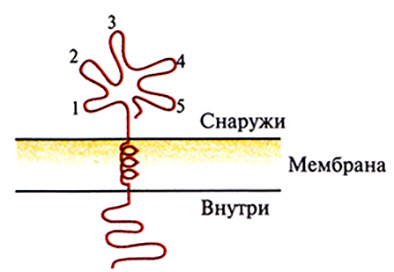
Рис. 11.3. Обобщенный мембраносвязанный белок, внешние эпитопы (1–5) которого могут индуцировать иммунный ответ.
Имея все это в виду, синтезировали химическими методами домены VP! FMDV и проверили возможность создания на их основе пептидных вакцин. Каждый из пептидов, соответствующих аминокислотным остаткам 141–160, 151–160 и 200–213 С-концевого участка VP1 и аминокислотным остаткам 9–24, 17–32 и 25–41 N-концевого участка, сшили по отдельности с инертным белком-переносчиком (гемоцианином моллюска фиссурелии), чтобы предотвратить их разрушение, и ввели морским свинкам (рис. 11.4). Синтез антител в количестве, достаточном для зашиты животного от последующих FMDV-инфекций, наблюдался только при введении пептида141–160. Введение же целого VP1 или пептидов 9–24, 17–32 и 25–41 индуцировало синтез антител в меньших количествах.
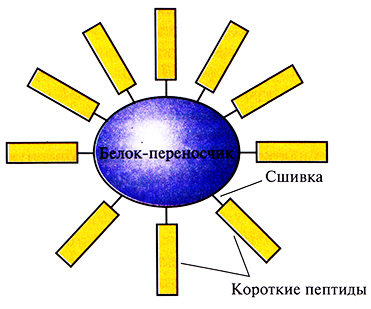
Рис. 11.4. Короткие пептиды, сшитые с белком-переносчиком и служащие основой пептидной вакцины.
Более длинный пептид, состоящий из аминокислотных остатков 141–158 и 200–213, которые были соединены двумя пролиновыми остатками, индуцировал эффективный синтез антител у морских свинок даже в том случае, когда он не был сшит с белком-носителем. Эта «двухпептидная» молекула оказалась эффективнее любого изолированного пептида и блокировала пролиферацию FMDV у крупного рогатого скота и морских свинок.
Эти результаты являются весьма многообещающими, однако количество (доза) пептидного материала, необходимого для индукции иммунного ответа, примерно в 1000 раз выше, чем в случае убитой FMDV-вакцины. Чтобы решить эту проблему, фрагмент ДНК, кодирующий пептид из аминокислотных остатков 142–160 VP1 FMDV, сшили с геном, кодирующим коровый белок гепатита В (HBcAg). При экспрессии этого химерного гена в Е. coli или культуре животных клеток его продукты – белковые молекулы – в процессе самосборки образовывали стабильные «27нм-частицы», на поверхности которых находился пептид из VP1 FMDV. Эти частицы обладали высокой иммуногенностью. Таким образом, HBcAg можно использовать в качестве эффективной молекулы-носителя синтетических пептидов. Сравнение иммуногенности различных пептидных FMDV-вакцин, содержащих домен 142–160 VPl-белка, проведенное на морских свинках, показало, что иммуногенность химерного белка, состоящего из HBcAg и указанного домена, в 10 раз ниже, чем у инактивированных FMDV-частиц, в 35 раз выше, чем у химерного белка, содержащего β-галактозидазу Е. coli и домен 137-162 из VP] FMDV, и в 500 раз выше, чем у свободного синтетического пептида, состоящего из аминокислотных остатков 142–160. Поскольку синтетический пептид, сшитый с HBcAg, образует 27нм-частицы, сходные с вирусом гепатита В, и они обладают почти такой же иммуногенностью, как и интактный вирус, на основе которого получен синтетический пептид, этот подход может стать основным способом доставки пептидных вакцин к месту их действия.
И все же существует несколько ограничений на использование коротких пептидов в качестве вакцин.
- Эпитоп, использующийся для создания эффективной пептидной вакцины, должен представлять собой короткий, но непрерывный участок белковой молекулы, а это бывает не всегда.
- Конформация пептида должна быть такой же, как у эпнтопа в интактной вирусной частице.
- Изолированный эпитоп может не обладать достаточной иммуногенностью. В будущем синтетические пептидные вакцины могут стать высокоспецифичной, относительно недорогой, безопасной и эффективной альтернативой традиционным вакцинам, хотя для этого необходимо провести еще немало исследований.
Генная иммунизация
Новый подход, позволяющий индуцировать у организма иммунный ответ без введения антигена, основан на включении в клетки животного-мишени гена, кодирующего белок-антиген. В первых экспериментах такого рода Е. coli-плазмиду, содержащую клонированный ген белка-антигена, транскрипция которого находилась под контролем промотора вируса животных, конъюгировали с микрочастицами золота и бомбардировали ими клетки уха мыши. Впоследствии выяснилось, что клонированную кДНК можно вводить в клетки и с помощью внутримышечной инъекции раствора с большим количеством плазмиды, несущей соответствующую ДНК. Для этого необходимо в 103–104 раз больше ДНК, чем при бомбардировке микрочастицами. В одном из экспериментов более чем в 75% случаев ген включался в клетки мыши, и синтезированный белок-антиген индуцировал синтез антител. Этот подход позволяет избежать очистки антигена, что требует много времени и средств, или использования для создания вакцины технологии рекомбинантных ДНК. Кроме того, получаемые с его помощью белки с большей вероятностью подвергаются правильной посттрансляционной модификации, чем белки, синтезируемые организмами-хозяевами. Этот метод, получивший название генной иммунизации, можно использовать для вакцинации домашних животных.
Перспективы генной иммунизации были тщательно изучены. В одной из серий экспериментов мышам в квадрицепсы обеих задних конечностей вводили раствор с Е. соli-плазмидой, несущей кДНК нуклеопротеина вируса гриппа А, транскрипция которой находилась под контролем промотора вируса саркомы Рауса или цитомегаловируса. Хотя уровень экспрессии гена нуклеопротеина был настолько низок, что не поддавался регистрации, через 2 нед после иммунизации в крови мышей обнаруживались антитела к нему. Выживаемость иммунизированных мышей оказалась значительно выше, чем мышей из контрольной группы (рис. 11.5). Более того, они были нечувствительны и к другому штамму вируса гриппа. Такая перекрестная защита не вырабатывается при введении традиционных противогриппозных вакцин, полученных на основе поверхностных антигенов вируса, и поэтому каждая вакцина специфична лишь к одному штамму вируса. Более того, традиционные вакцины сохраняют свою эффективность только до тех пор, пока остаются неизмененными поверхностные антигены. К сожалению, для генов поверхностных антигенов характерна высокая частота мутаций, что приводит к появлению существенно различающихся штаммов вируса. Коровые же белки, такие как нуклепротеин, относительно стабильны и активируют иммунную систему по другому механизму, чем поверхностные антигены.
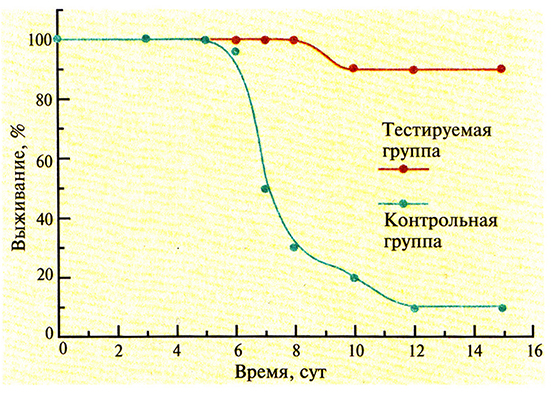
Рис. 11.5. Выживание мышей, иммунизированных вирусной ДНК. Тестируемых мышей иммунизировали Е. coli-плазмидой, несущей кДНК нуклеопротеина вируса гриппа А под контролем промотора вируса саркомы Рауса. Контрольным мышам вводили только плазмидную ДНК. По оси абсцисс отложено время, прошедшее после контакта животных с вирусом гриппа.
ДНК-иммунизация позволяет не только избежать очистки белковых антигенов, но и индуцировать иммунный ответ, направленный именно на кодируемый плазмидой белок, а не на саму плазмиду. Поэтому один и тот же вектор можно использовать для доставки разных белков или для многократного введения одного и того же гена.
Судьба введенной в клетку ДНК точно неизвестна. В принципе она может интегрировать в геном хозяина с весьма серьезными последствиями, если при этом затрагивается какой-то важный ген или происходит злокачественная трансформация клетки. Однако такое развитие событий считается крайне маловероятным. Скорее всего такая ДНК какое-то время просуществует в клетке в виде нереплицирующегося внехромосомного элемента, а затем разрушится. Генную иммунизацию пока используют для выработки иммунитета к некоторым патогенным микроорганизмам (вирусу гриппа А, вирусу иммунодефицита человека типа I, вирусу бычьего герпеса, вирусу бешенства, Plasmodium sp., вызывающему малярию, вирусу гепатита В) у животных, но не у человека.
Для облегчения доставки ДНК в клетки животных при проведении генной иммунизации был создан модифицированный штамм Shigella flexneri. Эта бактерия проникает в эпителиальные клетки животных путем фагоцитоза, и присутствующая в ней плазмидная ДНК попадает в цитоплазму клетки-хозяина, где и происходят транскрипция и трансляция переносимого ею гена, находящегося под контролем эукариотического промотора. Shigella – это патогенный микроорганизм, и как таковой он не может использоваться для доставки ДНК. Ее непатогенный штамм можно получить, введя делецию в ген asd, кодирующий фермент аспартат-β-полуальдегид–дегидрогеназу, который участвует в синтезе компонента клеточной стенки диаминопимелиновой кислоты. Штаммы с мутацией в asd-тене растут только в присутствии диаминопимелиновой кислоты и их можно использовать для доставки плазмидной ДНК в эпителиальные клетки животных, поскольку они в них не пролиферируют.
Эксперименты, в которых в качестве вектора для доставки ДНК в клетки использовалась Shigella, были проведены на морских свинках, и хотя они оказались успешными, судить о безопасности данной системы можно будет лишь после проведения клинических испытаний. Огромным преимуществом этого подхода является возможность перорального введения вакцин.
АТТЕНУИРОВАННЫЕ ВАКЦИНЫ
В некоторых случаях в качестве живых вакцин можно использовать генетически модифицированные (рекомбинантные) микроорганизмы (бактерии или вирусы). Такие вакцины содержат либо непатогенные микроорганизмы, синтезирующие антигенные детерминанты определенного патогенного агента, либо штаммы патогенных микроорганизмов, у которых модифицированы или делетированы гены вирулентности. В этих случаях основные антигенные детерминанты являются составными компонентами бактериальных или вирусных частиц и имеют такую же конформацию, какую они принимают в болезнетворном микроорганизме. Изолированный же антиген часто утрачивает исходную конформацию и вызывает лишь слабый иммунный ответ.
ВАЖНАЯ ВЕХА
Иммунизация с помощью пептида, синтезированного исходя из данных о нуклеотидной последовательности РНК вируса ящура
J. L. Bittle, R. A. Houghten, Н. Alexander, Т. М. Shinnick, J. G. Sutcliffe, R. A. Lerner, D. J. Rowlands, F. Brown Nature 298: 30-33, 1982
Начиная с первой вакцины, созданной Дженнером более 200 лет назад, большинство человеческих противовирусных вакцин содержали убитые или аттенуированные патогенные вирусы или сходные с ними непатогенные штаммы. Этот подход достаточно эффективен и предотвращает распространение ряда вирусных инфекций, однако его применение ограничено по ряду причин: не все вирусы могут расти в культуре, что не позволяет создавать вакцины против них; производство традиционных вакцин – дорогостоящая и потенциально опасная процедура; не все вирусные заболевания можно предотвратить с помощью традиционных вакцин. С развитием молекулярной биотехнологии во многих лабораториях были предприняты попытки создания более безопасных и эффективных и в то же время менее дорогих вакцин, не имеющих ограничений в применении. Введение вакцины индуцирует выработку антител к антигенным детерминантам, в норме присутствующим на поверхности вирусной частицы, поэтому разумно было предположить, что аналогичный иммунный ответ могут вызвать короткие синтетические пептиды с такой же аминокислотной последовательностью, как у вирусной антигенной детерминанты. Конечно, такой подход применим лишь в том случае, когда антигенная область представляет собой короткий, но непрерывный домен. Биттл и др. выделили и охарактеризовали РНК вируса ящура и определили аминокислотную последовательность основного вирусного белка – VP1. Проведя соответствующие эксперименты, они пришли к выводу, что его антигенные детерминанты находятся на N- или С-конце белковой молекулы. Определив их аминокислотные последовательности, они синтезировали серию пептидов, которые сшили с белками-переносчиками и ввели кроликам. В ответ на иммунизацию С-концевыми пептидами VP1 у кроликов и морских свинок вырабатывались антитела, защищающие их от инфекции интактным вирусом ящура. Эта работа показала, что для индукции синтеза антител, нейтрализующих ин тактные вирусные частицы, достаточно одного (или нескольких) домена (доменов) специфического вирусного белка, и, следовательно, можно создавать вакцины нового типа, не содержание патогенных вирусов.
Противохолерные вакцины
Живые вакцины, как правило, гораздо более эффективны, чем неживые или субъединичные. Основное требование, предъявляемое к ним, – отсутствие в инокуляционном материале вирулентных микроорганизмов. Это требование учитывалось и при создании живой противохолерной вакцины. Холера – быстро развивающаяся кишечная инфекция, характеризующаяся лихорадкой, диареей, болью в животе, дегидратацией; передается через питьевую воду, загрязненную фекалиями. В развивающихся странах, где системы очистки воды и удаления сточных вод недостаточно развиты, угроза холеры вполне реальна.
Возбудителем холеры является Vibrio cholerae. Бактерия размножается в тонком кишечнике и выделяет в большом количестве энтеротоксин, который и ответствен за патогенный эффект. Энтеротоксин – это гексамерный белок: он состоит из одной субъединицы А, которая обладает ADP-рибозилирующей активностью и стимулирует аденилатциклазу, и пяти субъединиц В, которые специфически связываются с клеточным рецептором слизистой кишечника. Субъединица А имеет два функциональных домена: А1, обладающий токсической активностью, и А2, отвечающий за ее связывание с субъединицами В. В настоящее время используется противохолерная вакцина, содержащая убитые фенолом холерные вибрионы; она обеспечивает только частичную защиту от инфекции и лишь в течение 3–6 мес. Поэтому были предприняты попытки создать другие типы противохолерной вакцины.
Как показали проведенные ранее исследования, субъединичная вакцина, содержащая инактивированный холерный энтеротоксин, не приводит к выработке полноценного иммунитета. Поскольку V. cholerae колонизирует слизистую кишечника, разумно было предположить, что наиболее эффективной будет пероральная противохолерная вакцина. Имея это в виду, создали штамм V. cholerae, из генома которого была делетирована часть кодирующей А1-пептид нуклеотидной последовательности. Этот штамм не синтезирует энтеротоксин, а потому не является патогенным и подходит для создания живой вакцины.
Эксперимент состоял в следующем. В ген A1-пептида V. cholerae был встроен ген устойчивости к тетрациклину. При этом прерывалась рамка считывания для А1-пептида, но штамм становился устойчивым к тетрациклину. Его нельзя было использовать в качестве вакцины и потому, что со временем происходила спонтанная утрата тетрациклинового гена, и синтез энтеротоксина восстанавливался. Чтобы обойти эту проблему, создали штамм с дефектной нуклеотидной последовательностью, кодирующей A1-пептид, которая не могла восстанавливаться (рис. 11.6). Для этого использовали следующий подход.
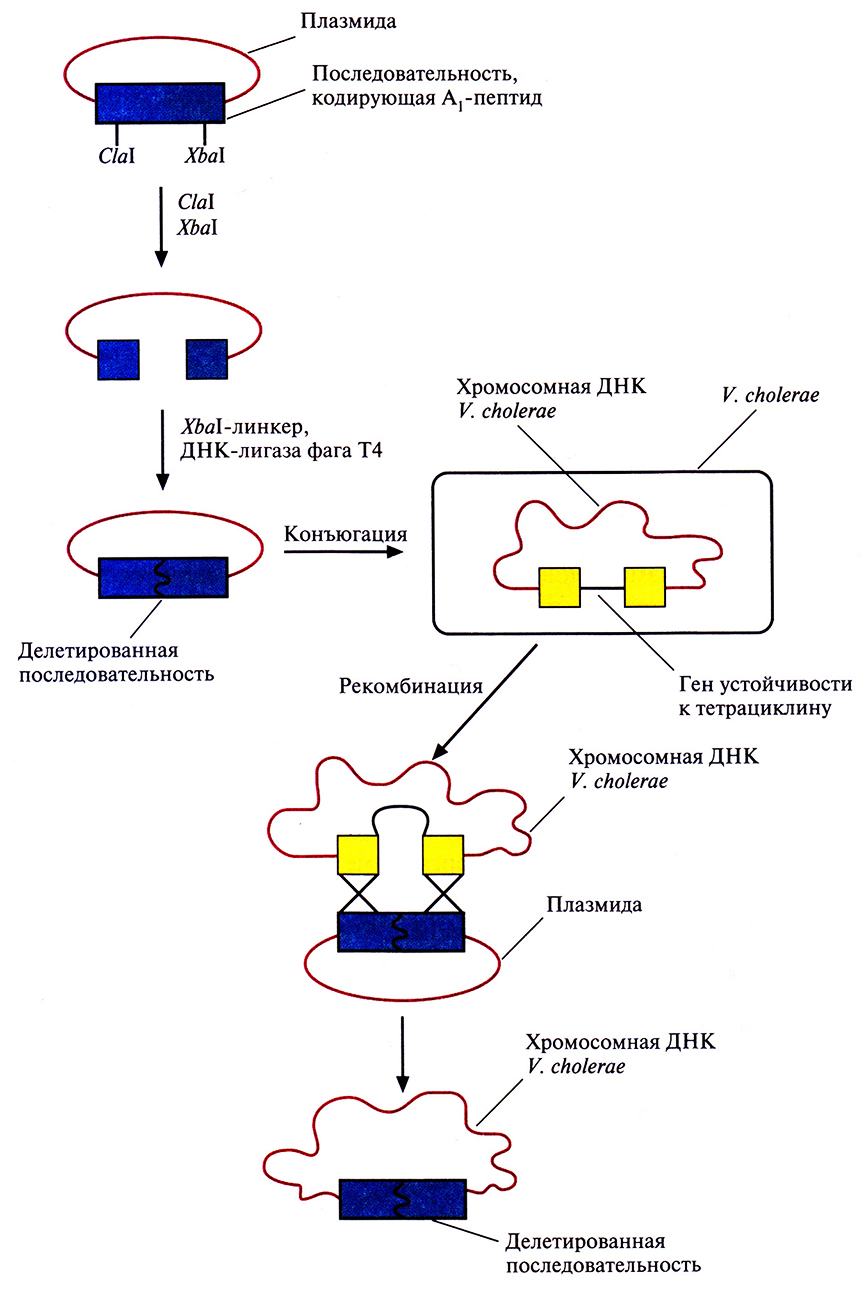
Рис. 11.6. Создание штамма V. cholerae с делецией части нуклеотидной последовательности, кодирующей А1-пептид холерного токсина.
- Плазмиду, которая содержала сегмент ДНК, кодирующий А1-пептид, обработали рестрицирующими эндонуклеазами Clal и ХЬаl, каждая из которых расщепляла только кодирующую А1-пептид последовательность вставки.
- Чтобы замкнуть плазмиду в кольцо, к Clal-сайту пришили ХЬаl-линкер и обработали плазмиду рестриктазой ХЬаl.
- С помощью ДНК-лигазы фага Т4 соединили ХЬаl-сайты плазмиды. В результате из середины кодирующей A1-пептид последовательности оказался удаленным сегмент длиной 550 п. н., соответствующий аминокислотным остаткам 183-194.
- С помощью конъюгации перенесли эту плазмиду в штамм cholerae, несущий ген устойчивости к тетрациклину в локусе, кодирующем А1-пептид.
- В результате рекомбинации между оставшейся в составе плазмиды частью последовательности, кодирующей А1-пептид, и геном A1-пeптида, прерванным Tetr-гeном, кодирующая A1-пептид последовательность в хромосоме была замещена гомологичным плазмидным сегментом с делецией.
- Внехромосомная плазмида не могла долго существовать в холерном вибрионе и через несколько поколений была утрачена.
- Отобрали клетки с интегрированной дефектной А1-кодирующей последовательностью, используя их чувствительность к тетрациклину.
Полученный таким способом стабильный штамм с делетированной кодирующей A1-пeптид последовательностью не синтезировал активный энтеротоксин и при этом сохранял все остальные биохимические свойства патогенной формы V. cholerae. Проводимые в настоящее время клинические испытания эффективности этой формы как противохолерной вакцины пока не дали однозначного результата. Вакцина обеспечивает почти 90%-ную защиту от холеры, но у некоторых испытуемых наблюдаются побочные эффекты. Возможно, понадобится изменить другой хромосомный локус этого штамма, чтобы можно было использовать его как вакцину.
Противосальмонеллезные вакцины
Другой способ получения непатогенных штаммов, пригодных для создания на их основе живых вакцин, состоит в удалении из генома патогенных бактерий хромосомных областей, отвечающих за независимые жизненноважные функции. При этом лучше делегировать по крайней мере две такие области, поскольку вероятность их одновременного восстановления очень мала. Предполагается, что штамм с двойной делецией будет обладать ограниченной пролиферативной способностью и сниженной патогенностью, но обеспечит выработку иммунного ответа.
Разные штаммы Salmonella вызывают острые кишечные инфекции, постнатальную инфекцию, брюшной тиф, пищевую токсикоинфекцию. Для профилактики всех этих заболеваний совершенно необходимо иметь эффективную вакцину. Чтобы получить аттенуированные штаммы Salmonella, вносили делеции в гены аго, кодирующие ферменты биосинтеза ароматических соединений, и в гены риг, кодирующие ферменты метаболизма пуринов. Такие штаммы с двойной делецией вызывают легкую форму инфекции и обладают в 106 раз меньшей вирулентностью. На их основе уже созданы эффективные пероральные вакцины для мышей, овец, крупного рогатого скота, цыплят, а совсем недавно – и для человека.
Противолейшманиозные вакцины
Простейшие паразиты Leishmania тоже могут вызывать у человека развитие иммунного ответа, однако создание эффективных вакцин против них представляет собой нелегкую задачу. С этой целью можно использовать аттенуированные линии Leishmania, но они часто ревертируют и становятся вирулентными, а кроме того, могут длительное время бессимптомно персистировать в организме человека – резервуаре инфекции – и передаваться другим людям. Чтобы решить эти проблемы, попытались создать аттенуированную неревертирующую линию Leishmania с помощью делении одного из важных для метаболизма генов (например, гена дигидрофолатредуктазы–тимидилатсинтазы). У одного из таких паразитов, Leishmania major Е10-5АЗ, два гена дигидрофолатредуктазы–тимидилатсинтазы были заменены генами устойчивости к антибиотикам G-418 и гигромицину. В отличие от паразитов дикого типа, при выращивании L. major Е10-5АЗ в обычной культуре или в культуре макрофагов в среду необходимо добавлять тимидин (рис. 11.7). В организме мышей BALB/c паразиты оставались жизнеспособными в течение нескольких дней, что достаточно для создания стойкого иммунитета у животных (рис. 11.8), но недостаточно для развития заболевания. Ни персистирующая инфекция, ни заболевание не возникали даже у наиболее чувствительных видов мышей, так что данная линия вполне подходит для создания вакцины. Проведя дополнительные эксперименты на животных, можно будет проверить ее эффективность при иммунизации человека.
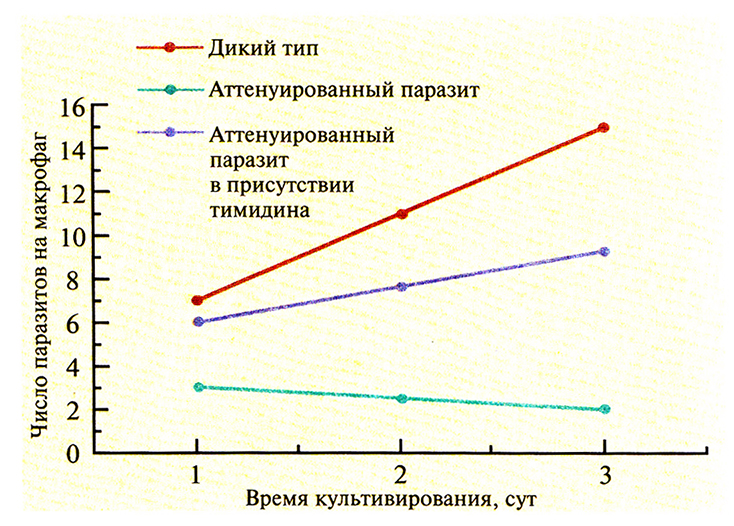
Рис. 11.7. Пролиферация L. major дикого типа и аттенуированного паразита в мышиных макрофагах. Для инвазии в обоих случаях использовали одинаковое количество L. major, находящихся в стационарной фазе. (Из работы Titus et al., Proc. Natl. Acad. Sci. USA 92: 10267-10268, 1995, с изменениями.)
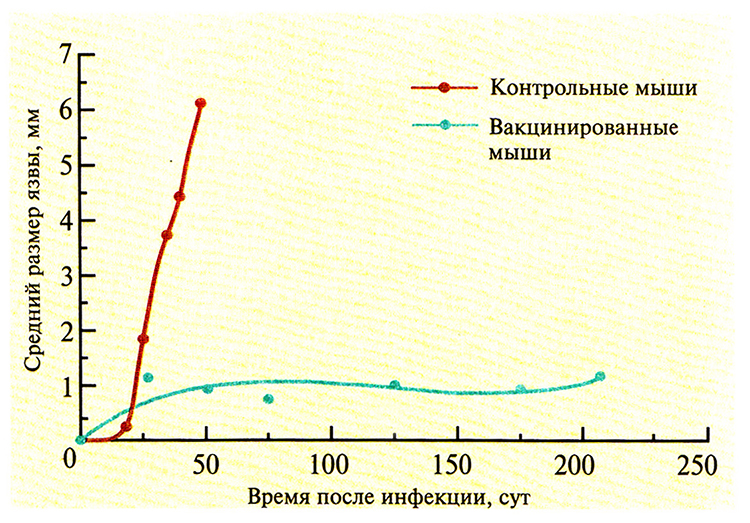
Рис. 11.8. Иммунитет к вирулентному паразиту L. major, вырабатывающийся у мышей BALB/c после инвазии аттенуированного паразита L. major. В момент времени 0 мышей, предварительно вакцинированных аттенуированным паразитом, заражали вирулентным паразитом, а затем определяли средний размер лейшманиозных язв. Контрольных мышей не вакцинировали. (Из работы Titus et al., Proc. Natl. Acad. Sci. USA 92: 10267-10268, 1995, с изменениями.)
«ВЕКТОРНЫЕ» ВАКЦИНЫ
Противовирусные вакцины
В качестве эффективной живой противооспенной вакцины широко используют вирус коровьей оспы (ВКО), относящийся к роду поксвирусов. Геном этого вируса полностью секвенирован; он представляет собой двухцепочечную ДНК длиной 187 т.п.н., кодирующую примерно 200 разных белков. ДНК ВКО реплицируется в цитоплазме инфицированных клеток, а не в ядре, благодаря наличию у вируса генов ДНК-полимеразы, РНК-полимеразы и ферментов, осуществляющих кэпирование, метилирование и полиаденилирование мРНК. Поэтому, если в геном ВКО встроить чужеродный ген, так чтобы он находился под контролем ВКО-промотора, то он будет экспрессироваться независимо от регуляторных и ферментных систем хозяина.
ВКО имеет широкий спектр хозяев (позвоночных и беспозвоночных), остается жизнеспособным в течение многих лет после лиофилизации (испарения воды с помощью замораживания) и не обладает онкогенными свойствами, а потому может использоваться для создания так называемых векторных вакцин. С их помощью осуществляется доставка и экспрессия в организме-хозяине клонированных генов, кодирующих антигенные белки, которые индуцируют выработку протективных антител. Геном ВКО имеет большие размеры и не содержит уникальных сайтов рестрикции, что не позволяет встраивать в него дополнительные нуклеотидные последовательности. Однако нужные гены можно вводить в геном ВКО с помощью гомологичной рекомбинации in vivo следующим образом.
1. Сегмент ДНК, кодирующий специфичный антиген (например, HBcAg), встраивают в плaзмидный вектор непосредственно после клонированного ВКО-промотора, включенного в какой-либо несущественный ген ВКО, например ген тимидинкиназы (рис. 11.9, А).
2. Этой плазмидой трансформируют культуру дефектных по тимидинкиназе животных клеток, обычно фибробластов куриного эмбриона, предварительно инфицированных ВКО дикого типа, который синтезирует функциональную тимидинкиназу.
3. В результате рекомбинации между нуклеотидными последовательностями, фланкирующими промотор и ген протективного антигена, и гомологичными последовательностями вирусного генома происходит встраивание клонированного гена в вирусную ДНК (рис. 11.9, Б). Частота таких рекомбинаций невысока, однако популяцию клеток, содержащих рекомбинантный ВКО, можно обогатить, используя селективную среду с бромдезоксиуридином. Этот токсичный аналог тимидина в отсутствие тимидинкиназы не включается в синтезируемую ДНК и не оказывает токсического действия. Дефектные по тимидинкиназе клетки-хозяева, которые содержат обычный ВКО, в присутствии бромдезоксиуридина погибают, а клетки, несущие рекомбинантный ВКО с разрывом в гене тимидинкиназы, становятся устойчивыми к его токсическому действию. 4. Проводят окончательный отбор с помощью ДНК-зонда, гибридизующегося с геном антигенного белка.
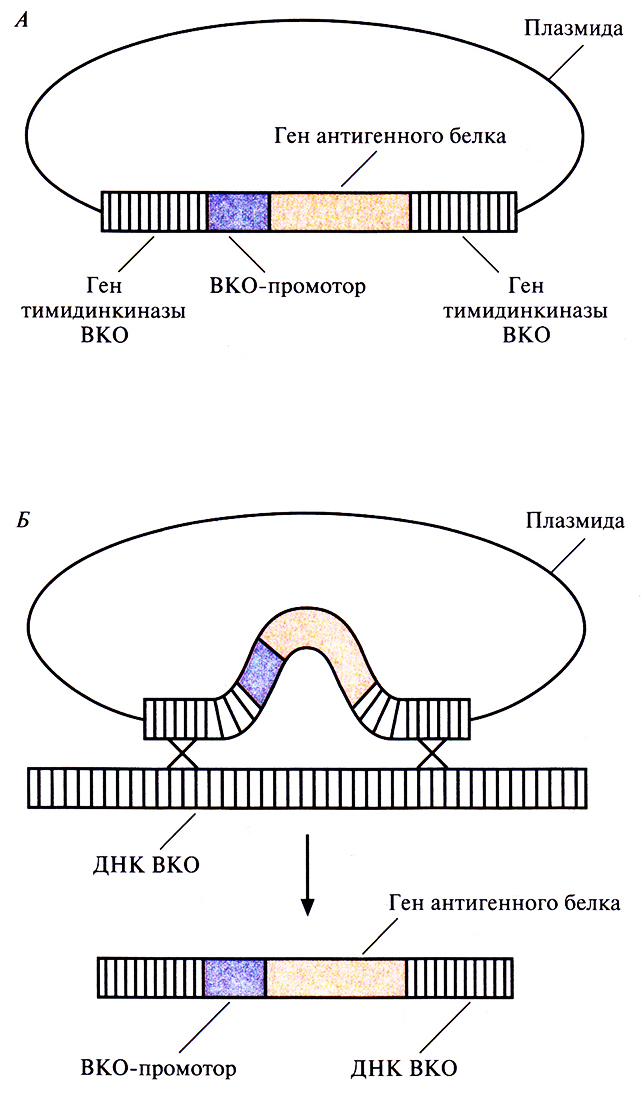
Рис. 11.9. Встраивание в ДНК ВКО гена, белковый продукт которого (обычно вирусный антиген) индуцирует иммунный ответ. А. Плазмида, несущая ген антигенного белка, способный экспрессироваться. Б. Двойной кроссинговер, приводящий к встраиванию этого гена в ДНК ВКО.
Поскольку дефектные по тимидинкиназе ВКО спонтанно возникают с относительно высокой частотой (примерно 1 на 101–104 вирусных частиц), нередко проводят котрансфекцию клеток каким-либо селективным маркером и нужным геном. Это облегчает разграничение спонтанных мутантов и мутантов, полученных с помощью гомологичной рекомбинации. В качестве селективного маркера обычно используют ген пео, кодирующий фермент неомицин-фосфотрансферазу II и обеспечивающий устойчивость к аналогу канамицина G-418. Этот ген, в отличие от других селективных маркеров, остается стабильным при встраивании в геном ВКО.
Разработана специальная система, позволяющая избежать прерывания рамки считывания генов ВКО при встраивании чужеродного гена. При этом отпадает необходимость в использовании селективных маркеров, поскольку каждый образующий бляшку рекомбинантный вирус будет содержать и экспрессировать ген-мишень. ДНК ВКО дикого типа несет ген vp37, отвечающий за образование бляшек при росте вируса в монослойной культуре животных клеток (рис. 11.10, А). Если заменить этот ген маркерным геном Е. coli, то образуется мутантный ВКО, который не формирует бляшки при выращивании его в течение 2–3 сут в культуре жичогных клеток (рис. 11.10, Б). Ген-мишень вводят в этот мутантный вирус с помощью гомологичной рекомбинации его ДНК с вектором, несущим ген vp37 и ген-мишень (рис. 11.10, В). Мутантный ВКО, получивший ген vp37, приобретает способность к образованию бляшек, при этом в его геном встраивается ген-мишень, а маркерный ген утрачивается. Мутантный вирус с делетированным геном vp37не может ревертировать к дикому типу, поэтому каждая вирусная частица, образующая бляшку, содержит желаемую конструкцию. Этот метод прост, применим для переноса и экспрессии любого гена-мишени, не требует каких-либо дополнительных маркерных генов и не прерывает рамку считывания генов ВКО.
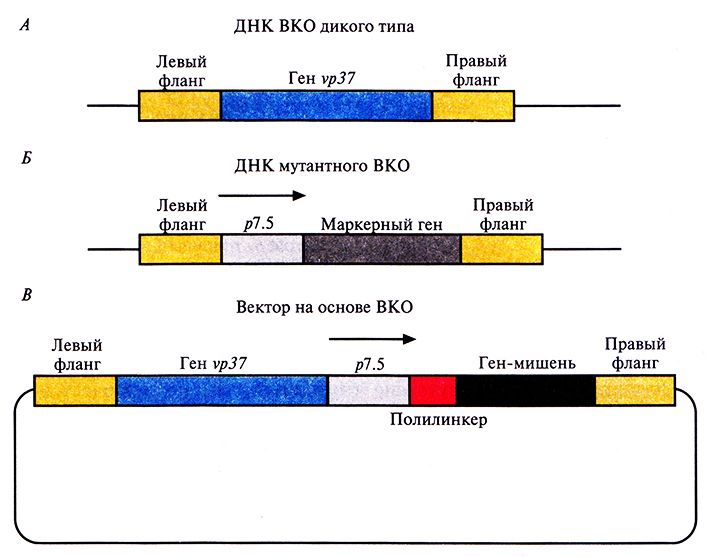
Рис. 11.10. А. ДНК ВКО дикого типа. Б. ДНК мутантного ВКО. В. Вектор на основе ВКО. Левый фланг и правый фланг – последовательности, примыкающие слева и справа соответственно к гену vp37 в геноме ВКО дикого типа. Промотор гена vp37 не показан. р7.5 – сильный «ранний» (или «поздний») ВКО-промотор. Ген-мишень встроен в полилинкер Гомологичная рекомбинация между рекомбинантным вектором и ДНК мутантного вируса приводит к замене маркерного гена Е. coli на ген vp37 и ген-мишень.
В геном ВКО уже удалось встроить и экспрессировать в культуре животных клеток несколько генов антигенных белков: G-белка вируса бешенства, поверхностного антигена гепатита В, поверхностных белков вируса Синдбис, NP- и НА-белков вируса гриппа, N- и G-белков вируса везикулярного стоматита, гликопротеинов вируса простого герпеса. Некоторые из полученных на основе ВКО рекомбинантных векторов можно использовать для создания эффективных вакцин. Так, рекомбинантный ВКО, экспрессирующий ген гликопротеина D вируса простого герпеса типа 1, предотвращает герпесные инфекции у мышей, а рекомбинантный ВКО, экспрессирующий ген поверхностного антигена вируса бешенства, индуцирует выработку протективных антител у лис, основных переносчиков вируса бешенства в Европе.
Векторные ВКО-вакцины позволяют провести иммунизацию сразу от нескольких заболеваний. Для этого можно использовать рекомбинантный ВКО, который несет несколько генов, кодирующих разные антигены.
В зависимости от используемого ВКО-промотора чужеродный белок может синтезироваться в ранней или поздней фазе инфекционного цикла, при этом его количество определяется силой промотора. Обычно для достижения высокого уровня экспрессии используют «поздние» ВКО-промоторы: pll (промотор гена, отвечающего за синтез белка мол. массой 11 кДа) или рСАЕ (промотор гена интегрального белка вируса коровьей оспы типа А). При встраивании в одну ДНК ВКО нескольких чужеродных генов каждый из них помещают под контроль отдельного ВКО-промотора, чтобы предотвратить гомологичную рекомбинацию между различными участками вирусной ДНК, которая может привести к утрате встроенных генов.
Живая рекомбинантная вирусная вакцина имеет ряд преимуществ перед неживыми вирусными и субъединичными вакцинами: 1) презентация аутентичного антигена практически не отличается от таковой при обычной инфекции; 2) вирус может реплицироваться в клетке-хозяине и увеличивать количество антигена, который активирует продукцию антител В-клетками (гуморальный иммунитет) и стимулирует выработку Т-клеток (клеточный иммунитет); 3) встраивание генов антигенных белков в один и большее число сайтов генома ВКО еще больше уменьшает его вирулентность.
Недостаток живой рекомбинантной вирусной вакцины состоит в том, что при вакцинации лиц со сниженным иммунным статусом (например, больных СПИДом) у них может развиться тяжелая вирусная инфекция. Чтобы решить эту проблему, можно встроить в вирусный вектор ген, кодирующий человеческий интерлейкин-2, который стимулирует Т-клеточный ответ и ограничивает пролиферацию вируса.
Нежелательные побочные эффекты пролиферации ВКО можно предупредить инактивацией вируса после вакцинации. Для этого был создан чувствительный к интерферону вирус (ВКО дикого типа относительно устойчив к его действию), пролиферацию которого можно регулировать в случае возникших при вакцинации осложнений.
Механизм устойчивости ВКО к интерферону оставался неустановленным, пока не была обнаружена открытая рамка считывания K3L, кодирующая белок мол. массой 10,5 кДа. Этот белок содержит аминокислотную последовательность, гомологичную N-концевой части эукариотического фактора инициации elF-2α мол. массой 36,1 кДа. N-концевые области обоих белков содержат 87 практически идентичных аминокислотных остатков, причем в положении 51 в обоих случаях находится серин, который в elF-2α фосфорилируется активируемой интерфероном Р1-киназой, что приводит к ингибированию синтеза белка в обработанных интерфероном клетках. КЗЬ-белок действует как конкурентный ингибитор фосфорилирования elF-2α, обеспечивая устойчивость ВКО к интерферону, и если из генома ВКО удалить ген K3L или его часть, то вирус станет чувствительным к интерферону. С помощью ПЦР-мутагенеза гена K3L, находящегося в составе плазмиды, и последующей гомологичной рекомбинации между ДНК ВКО и плазмидой с целью замены КЗL-последовательности дикого типа модифицированным вариантом был сконструирован мутантный ВКО K3L . Этот штамм оказался в 10–15 раз более чувствительным к интерферону, чем штамм дикого типа (рис. 11.11). Эта работа является важным этапом на пути создания более безопасных ВКО-векторов. Последовательности, сходные с K3L, могут содержать и другие устойчивые к интерферону вирусы, что позволит с помощью делеций создавать их штаммы, чувствительные к интерферону.
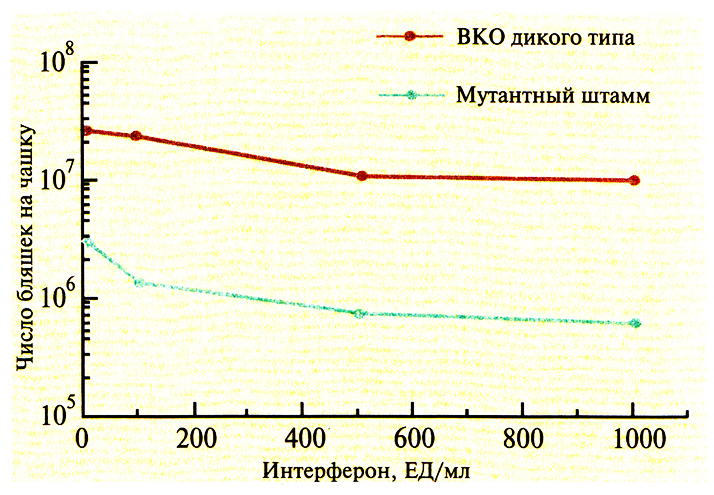
Рис. 11.11. Чувствительность к интерферону ВКО дикого типа (K3L+) и мутантного штамма (K3L–). Мышиные клетки L929 перед инокуляцией вирусом обрабатывали в течение 24 ч смесью мышиных альфа- и бета-интерферонов. На каждой чашке, не обработанной интерфероном, было примерно 3·107 бляшек. (Paoletti, Tartaglia, U.S. patent 5,378,657, 1995, с изменениями).
Большинство работ по созданию живых вирусных вакцин проводились на ВКО, однако в качестве кандидатов на роль векторов для вакцинации рассматриваются и другие вирусы: аденовирус, полиовирус и вирус ветряной оспы. Вектор на основе живого аттенуированного полиовируса (его исследования только начинаются) привлекателен тем, что позволяет проводить пероральную вакцинацию. Такие «слизистые» вакцины (вакцины, компоненты которых связываются с рецепторами, расположенными в легких или желудочно-кишечном тракте) пригодны для профилактики самых разных заболеваний: холеры, брюшного тифа, гриппа, пневмонии, мононуклеоза, бешенства, СПИДа, болезни Лайма. Но до любых клинических испытаний любого на первый взгляд безобидного вируса как системы доставки и экспрессии соответствующего гена необходимо убедиться в том, что он действительно безопасен. Например, повсеместно используемый ВКО вызывает у людей осложнения с частотой примерно 3,0·10–6. Поэтому из генома рекомбинантного вируса, который предполагается использовать для вакцинации человека, желательно удалить последовательности, ответственные за вирулентность.
Противобактериальные вакцины
Для лечения заболеваний, вызываемых бактериями, широко используются антибиотики, и лишь совсем недавно начались работы по созданию противобактериальных вакцин. Стимулом к этому стали весьма веские причины.
- Не все бактериальные инфекции поддаются лечению антибиотиками.
- Широкое использование антибиотиков в последние 40 лет привело к появлению большого числа устойчивых к ним бактериальных штаммов.
- Во многих тропических странах отсутствуют условия для хранения антибиотиков.
- Часто больные прекращают лечение раньше, чем это предписано врачом, или принимают антибиотики в недостаточной дозе.
Имея в виду, что создаваемая противобактериальная вакцина должна быть достаточно эффективной, важно выбрать правильную стратегию. Если патогенная бактерия плохо растет в культуре и сложно получить ее аттенуированный штамм, необходимо использовать альтернативные способы. Например, Rickettsia rickettsii, грам-отрицательная облигатная внутриклеточная бактерия, вызывающая пятнистую лихорадку Скалистых гор, не растет в культуре. Чтобы обойти эту трудность, создали субъединичную вакцину, содержащую основной поверхностный антиген R. rickettsii, белок мол. массой 155 кДа. Она эффективно защищала мышей от этой патогенной бактерии.
Бактерии как системы доставки антигенов
Антигены, находящиеся на наружной поверхности бактериальной клетки, обладают более высокой иммуногенностью, чем локализованные в цитоплазме. Поэтому один из подходов, используемых при создании вакцин, состоит в размещении протективного антигена патогенной бактерии на поверхности живой непатогенной бактерии. Многие бактерии имеют жгутики, состоящие из белка флагеллина; под микроскопом они выглядят как нити, отходящие от бактериальной клетки. Если сделать так, что жгутики непатогенного микроорганизма будут нести специфический эпитоп патогенного микроорганизма, то можно будет индуцировать выработку протективных антител.
Именно такой подход использовали при создании противохолерной вакцины. Синтетический олигонуклеотид, кодирующий эпитоп субъединицы В холерного токсина, встроили в гипервариабельный участок гена флагеллина Salmonella и полученную конструкцию ввели в дефектный по флагеллину штамм Salmonella. При этом было известно, что эпитоп, включающий 50–64 аминокислотные остатки субъединицы В холерного токсина, индуцирует выработку антител к интактному холерному токсину. Химерный флагеллин нормально функционировал, а эпитоп холерного токсина размещался на поверхности жгутиков. Иммунизация мышей с помощью интраперитонеальной инъекции примерно 5·106 живых или убитых формалином бактерий с модифицированным флагеллином индуцировала выработку большого количества антител как к пептиду (50–64 аминокислотным остаткам), так и к молекуле интактного холерного токсина. Аналогичным образом можно встраивать два и даже три разных эпитопа в один флагеллиновый ген Salmonella и создать поливалентную протавобактериальную вакцину.
С помощью перорального введения аттенуированных штаммов Salmonella можно осуществлять доставку в организм хозяина многих бактериальных, вирусных и паразитарных антигенов. Большую роль при этом играет выбор промотора, контролирующего транскрипцию чужеродного гена. Если используется слишком сильный промотор, может возникнуть метаболическая «перегрузка», сдерживающая пролиферацию бактерий. В отличие от ферментера, организм животного-хозяина не является замкнутой системой, и экспрессию чужеродного гена нельзя регулировать изменением температуры или добавлением специфических метаболитов. Регуляторную роль может играть только промотор, реагирующий на те или иные сигналы. Например, работу промотора nirB Е. coli можно регулировать, изменяя содержание нитритов и кислорода в среде, а наиболее активен он в анаэробных условиях. В одном из экспериментов промотор nirB использовали для контроля экспрессии гена нетоксичного иммуногенного С-фрагмента столбнячного токсина в аттенуированном штамме Salmonella. В развивающихся странах инфекция Clostridium tetani уносит более 1 млн. жизней в год. Если генетически модифицированный штамм Salmonella выращивать в аэробных условиях, то С-фрагмент столбнячного токсина синтезироваться не будет. При пероральном же введении этой бактерии тестируемым мышам С-фрагмент синтезируется, и у животных вырабатываются антитела к нему. Таким образом, штамм Salmonella, в который встроен С-фрагмент столбнячного токсина, находящийся под контролем промотора nirB, можно использовать как живую пероральную противостолбнячную вакцину. Чтобы выяснить, насколько эффективен этот подход при вакцинации человека, необходимо провести дополнительные исследования.
ЗАКЛЮЧЕНИЕ
Традиционные вакцины содержат инактивированные или аттенуированные патогенные микроорганизмы (бактерии или вирусы). Эти вакцины имеют ряд недостатков: не все патогенные микроорганизмы можно вырастить в необходимых для производства вакцины количествах; работа с большим количеством патогенных микроорганизмов требует соблюдения строжайших мер предосторожности; аттенуированные штаммы нередко ревертируют и становятся вирулентными; инактивация часто бывает неполной; срок годности вакцины зависит от условий ее хранения.
Технология рекомбинантных ДНК позволяет создавать надежные вакцины, используя при этом разные подходы. Делетируя гены, ответственные за вирулентность, получают живые вакцины, содержащие непатогенные, иммунологически активные штаммы, которые не могут ревертировать и становиться патогенными. Клонированные гены, кодирующие основные антигенные детерминанты патогенного организма, встраивают в геном непатогенного носителя (обычно вируса) и получают безопасную, не содержащую болезнетворных микроорганизмов вакцину. Наконец, гены или их сегменты, кодирующие основные антигенные детерминанты патогенных микроорганизмов, встраивают в экспрессирующие векторы, получают нужный продукт в большом количестве и используют его как вакцину. Последний подход позволяет производить субъединичные и пептидные вакцины (если используются полноразмерные гены в первом случае и фрагменты генов, кодирующих домены основных антигенных детерминант – во втором). Пептидные вакцины получают и с помощью химического синтеза пептидов.

