До настоящего времени основной целью исследований в области молекулярной биотехнологии было получение различных белков. Однако технологию рекомбинантных ДНК можно использовать также для крупномасштабного производства многих ценных низкомолекулярных соединений – витаминов, аминокислот, антибиотиков и т. д.
При наличии эффективной системы экспрессии получение белка – продукта специфического гена – не составляет особого труда. Белок может представлять собой либо тот конечный продукт, который хотят получить (например, рестрицирующую эндонуклеазу), либо фермент, катализирующий определенную химическую реакцию (например, одну из реакций биосинтеза антибиотиков). Иногда в результате генетических манипуляций микроорганизм приобретает способность к синтезу нового фермента и может использоваться для получения in vivo низкомолекулярных соединений – витаминов, аминокислот, красителей, антибиотиков, предшественников различных биополимеров и т. д. Такой микроорганизм становится «фабрикой» по производству полезных метаболитов.
ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ
Развитие технологии рекомбинантных ДНК было бы невозможно, если бы в распоряжении исследователей не было нужных эндонуклеаз рестрикции (рестриктаз). В настоящее время в продаже имеется более 300 различных рестриктаз. Эти ферменты синтезируются самыми разными микроорганизмами: аэробными, анаэробными, фотосинтезирующими, диазотрофными, мезотрофными, термофильными, психрофильными, медленно- и быстрорастущими. Для культивирования каждого из них необходимо подобрать оптимальные условия ферментации – температуру, рН, состав среды, концентрацию кислорода – с тем чтобы максимизировать выход необходимого фермента. Чтобы не пришлось выращивать большое число разных микроорганизмов, готовить многокомпонентные среды, разрабатывать разные ферментеры и тратить время на подбор оптимальных условий роста для многочисленных организмов, часто клонируют гены эндонуклеаз рестрикции в Escherichia coli. Это позволяет стандартизовать условия получения необходимых продуктов. Кроме того, культура клеток Е. coli быстро достигает высокой плотности и может быть приспособлена для сверхпродукции необходимого фермента.
Технология выделения и экспрессии чужеродных генов в Е. coli и в некоторых других микроорганизмах достаточно хорошо отработана, однако не стоит забывать, что синтез гетерологичного белка в организме-хозяине может оказывать на него негативное влияние. Например, сверхпродукция такого белка может привести к истощению метаболических ресурсов хозяйского организма и отрицательно повлиять на его рост. Присутствие гетерологичного белка может оказаться даже губительным для клетки-хозяина. Так, сайты рестрикции имеются во всех молекулах ДНК, и если продуктом клонированного гена является эндонуклеаза рестрикции, то в отсутствие специальных защитных механизмов хозяйская ДНК будет расщепляться ею.
Микроорганизмы, синтезирующие эндонуклеазы рестрикции, выработали систему самозащиты: они метилируют одно или несколько оснований рестриктазного сайта, и расщепление ДНК в этом сайте гомологичной эндонуклеазой рестрикции блокируется. Грамотрицательные микроорганизмы имеют еще один механизм защиты: эндонуклеазы рестрикции у них локализованы в периплазматическом пространстве. Благодаря такой компартментализации происходит физическое разделение рестриктаз и ДНК и при этом обеспечивается свободный доступ метилирующего (модифицирующего) фермента к хромосомной ДНК. Кроме того, это защищает клетку от проникновения в нее любой чужеродной ДНК, например вирусной.
Один из подходов к решению проблемы деградации хозяйской ДНК гетерологичными эндонуклеазами рестрикции состоит в клонировании и экспрессии в реципиентном организме как гена фермента рестрикции, так и гена соответствующего модифицирующего фермента. Однако клонирование обоих этих генов в одном микроорганизме технически затруднено, если они расположены на хромосоме донорного организма далеко друг от друга. Кроме того, чтобы не допустить расшепления хозяйской ДНК эндонуклеазами рестрикции, метилирующий фермент после трансформации должен синтезироваться еще до начала синтеза рестриктазы.
На рис. 12.1 представлена стратегия выделения и клонирования в Е. coli гена рестриктазы Pstl грамотрицательной бактерии Providencia stuartii.
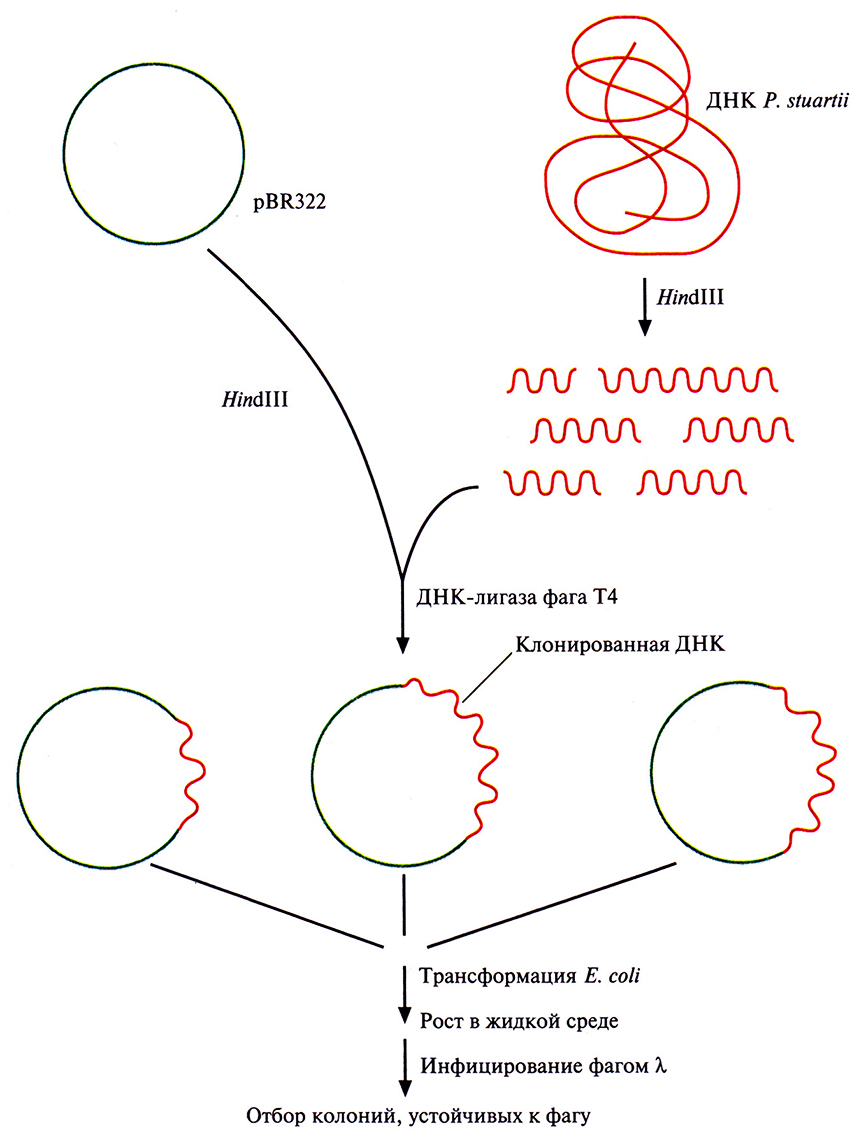
Рис. 12.1. Клонирование гена рестриктазы Pstl и отбор несущих его трансформированных бактериальных клеток. Хромосомную ДНК P. stuartii расщепляют Hindilll и встраивают фрагменты в плазмиду pBR322. Трансформируют рекомбинантной плазмидой Е. coli, выращивают клетки в жидкой среде и инфицируют фагом λ. Отбирают трансформанты, устойчивые к фагу; именно они несут и экспрессируют клонированный ген Pstl.
1. ДНК P. stuartii расщепляют с помощью Hindlll и встраивают фрагменты в Hindlll-сайт плазмиды pBR322.
2. Рекомбинантными плазмидами трансформируют клетки Е. coli НВ101 и выращивают их в жидкой среде, а затем инфицируют бактериофагом К. Если в хозяйской клетке экспрессируется ген фермента рестрикции, то она оказывается устойчивой к литическому действию фагов типа К, ДНК которых активно расщепляется синтезируемой рестриктазой.
3. Трансформированные клетки, устойчивые к фагу λ, подвергают осмотическому шоку, чтобы высвободить периплазматические белки. Определяют активность рестриктазы Pstl в белковом экстракте.
4. Положительные клоны тестируют на наличие Pstl-метилирующей активности.
Один положительный клон, выявленный в этом эксперименте, содержал встроенный фрагмент ДНК длиной 4 т. п. н. с интактным опероном рестриктазы и метилазы Pstl и промотором P. stuartii. В клоне, несущем эту генетическую конструкцию, соблюдался естественный временной порядок синтеза: вначале синтезировался метилирующий фермент, затем эндонуклеаза рестрикции. Уровень экспрессии гена рестриктазы Pstl в Е. coli был примерно в 10 раз выше, чем в P. stuartii. Как и предполагалось, рестриктаза находилась в периплазматическом пространстве, а метилаза – в цитоплазме. Метод получения Pstl клонированием соответствующего гена в Е. coli гораздо более эффективен, чем выделение этого фермента из P. stuartii.
Для выделения генов, кодирующих ферменты рестрикции и модификации (метилирования), можно использовать также другой подход, который состоит в следующем.
1. Создают банк клонов ДНК организма-донора, продуцирующего известную эндонуклеазу рестрикции. Используемый при этом плазмидный вектор должен содержать по крайней мере один сайт узнавания для этой рестриктазы.
2. Трансформируют Е. coli гибридными плазмидами.
3. Из трансформированных клеток, выросших в жидкой селективной среде (т.е. из клеток, содержащих плазмиду), выделяют плазмидную ДНК.
4. Обрабатывают ее интересующей исследователя эндонуклеазой рестрикции.
5. Трансформируют Е. coli плазмидными ДНК, обработанными эндонуклеазой рестрикции
Ключевым моментом этого метода является то, что плазмидная ДНК клонов, несущих и экспрессирующих ген фермента модификации, оказывается устойчивой к расщеплению соответствующей эндонуклеазой рестрикции, поскольку сайты узнавания в ней метилированы. Рассмотрим следующий пример. В плазмиду pBR322 встраивали Hindilll-фрагменты ДНК Desulfovibrio desulfuricans и трансформировали ею клетки Е. coli. Выделенную из трансформированных клеток плазмидную ДНК обрабатывали рестриктазой DdeI. Плазмиды, несущие и экспрессирующие ген метилирующего фермента, не расщеплялись, поскольку все восемь сайтов узнавания Ddel в pBR322 были метилированы. Смесь плазмид, обработанных DdeI, использовали для трансформации Е. coli. Образование трансформантов, несущих ген функционального модифицирующего фермента Ddel, обеспечивали только целые кольцевые молекулы плазмидных ДНК. Остальные плазмиды были расщеплены эндонуклеазой рестрикции. Для того чтобы определить, какие клоны содержат и ген фермента модификации, и ген эндонуклеазы рестрикции, трансформанты тестировали на наличие в них активной рестриктазы Ddel. Описанный подход можно с успехом использовать для выделения гена любой рестриктазы, лишь бы он находился достаточно близко к гену соответствующего модифицирующего фермента и был встроен в плазмидный вектор, имеющий по меньшей мере один сайт узнавания для данного фермента.
МАЛЫЕ БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
Используя технологию рекомбинантных ДНК, можно направленно изменять метаболизм микроорганизмов, вводя в них новые гены или модифицируя уже существующие. Основной целью таких изменений является создание рекомбинантного микроорганизма с новой ферментативной активностью, способного превращать существующий субстрат в ценный продукт, который обычно получают только сочетанием химических и микробиологических методов.
Синтез L-аскорбиновой кислоты
В настоящее время для крупномасштабного производства L-аскорбиновой кислоты (витамина С) используют весьма трудоемкий процесс, включающий одну микробиологическую стадию и несколько химических; исходным субстратом для него является D-глюкоза (рис. 12.2). На последнем этапе этого процесса 2-кето-L-гулоновая кислота (2-KLG) превращается в кислых условиях в L-аскорбиновую кислоту. Биохимические исследования метаболизма различных микроорганизмов показали, что 2-KLG можно получить другим путем. Так, одни бактерии (Acetobacter, Gluconobacter и Erwinia) могут превращать глюкозу в 2,5-дикето-D-глюконовую кислоту (2,5-DKG), а другие (Corynebacterium, Brevibacterium и Arthrobacter), синтезирующие фермент 2,5-DKG-редукгазу, – преобразовывать 2,5-DKG в 2-KLG.
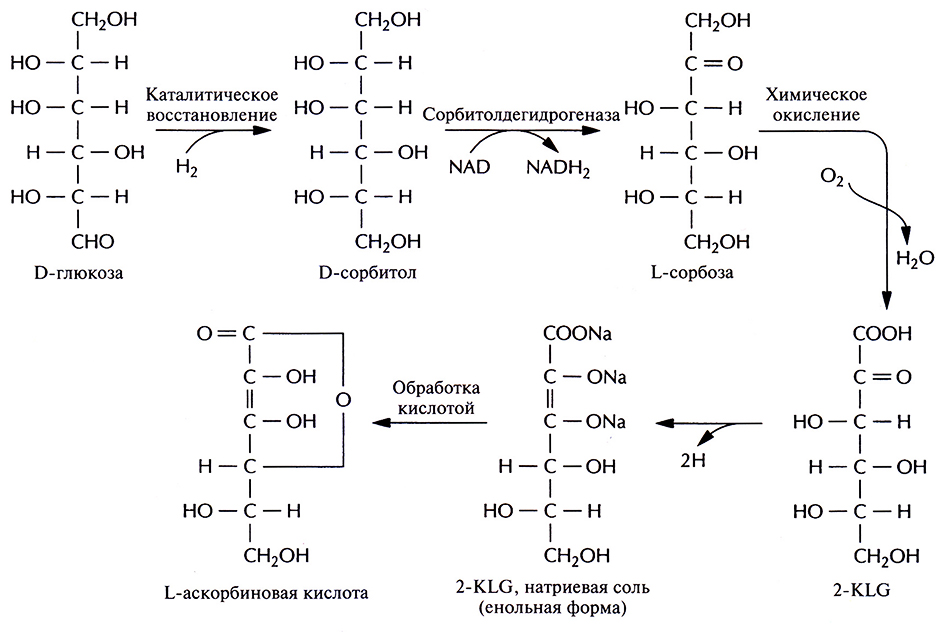
Рис. 12.2. Промышленный синтез L-аскорбиновой кислоты. Одна из стадий процесса, а именно превращение D-сорбитола в L-сорбозу, осуществляется при участии бактерии Acetobacter suboxydans, которая синтезирует фермент сорбитолдегидрогеназу. Остальные стадии представляют собой чисто химические реакции.
Использующийся в настоящее время способ получения аскорбиновой кислоты можно усовершенствовать, если включить в него совместное культивирование указанных микроорганизмов для превращения глюкозы в 2-KLG. К сожалению, такое культивирование имеет свои трудности. Например, используемые микроорганизмы могут иметь разные оптимумы температуры и рН, могут различаться также состав среды и скорость роста. Иными словами, условия культивирования, оптимальные для одного организма, могут быть неприемлемы для другого, что приведет к спонтанному «вымыванию» из среды одного из них. В подобных случаях можно культивировать микроорганизмы последовательно (рис. 12.3), правда такой процесс трудно будет сделать непрерывным, если для роста микроорганизмов необходимы существенно разные среды. Наилучшим выходом из этой ситуации было бы создание одного микроорганизма, синтезирующего все ферменты, необходимые для превращения глюкозы в 2-KLG. Erwinia herbicola осуществляет превращение D-глюкозы в 2,5-DKG в несколько стадий, катализируемых разными ферментами, в то время как Corynebacterium sp. для превращения 2,5-DKG в 2-KLG необходима только одна стадия. Следовательно, наиболее простой способ создания одного микроорганизма, способного превращать D-глюкозу в 2-KLG, состоит в выделении гена 2,5-DKG-редуктазы Corynebacterium sp. и введении его в Erwinia herbicola.
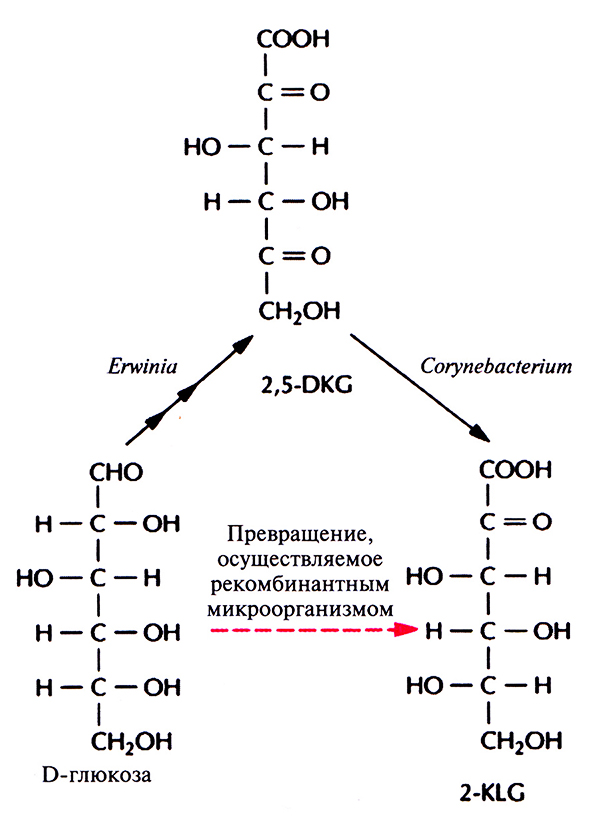
Рис. 12.3. Микробиологаческий синтез 2-KLG. Erwinia продуцирует три фермента, обеспечивающих синтез 2,5-DKG из D-глюкозы, a Corynebacterium – фермент, катализирующий превращение 2,5-DKG в 2-KLG. Таким образом, 2-KLG, непосредственный предшественник L-аскорбиновой кислоты, можно синтезировать из D-глюкозы совместным культивированием этих двух микроорганизмов. Альтернативный подход состоит в создании рекомбинантной бактерии Erwinia, экспрессирующей ген соответствуюшего фермента Corynebacterium.
Первый шаг на этом пути состоит в выделении и очистке 2,5-DKG-редуктазы Corynebacterium sp. и определении последовательности ее первых 40 N-концевых аминокислот. Исходя из этих данных были синтезированы два 43-нуклеотидных гибридизационных зонда, соответствовавших разным частям белковой молекулы. Поскольку 71% нуклеотидов ДНК Corynebacterium sp. представляют собой либо G, либо С, зонды синтезировали таким образом, чтобы в третьем положении кодонов по возможности находились именно они. Это позволяло минимизировать число неспаренных оснований между зондами и искомой ДНК.
Синтезированные зонды использовали для скрининга банка клонов ДНК Corynebacterium; клоны, гибридизующиеся только с одним из зондов, исключали из дальнейшего рассмотрения, считая, что соответствующая ДНК не является искомой. Выделяли клон, содержащий ген 2,5-ОКС-редуктазы, и секвенировали его. Нуклеотидные последовательности, расположенные до стартового кодона ATG, вырезали и заменяли их сигналами транскрипции и трансляции, функционирующими в Е. coli, поскольку регуляторные последовательности грамположительных микроорганизмов типа Corynebacterium spp. не функционируют в клетках этого микроорганизма. Полученную конструкцию вводили в Е. coli (при этом синтезировалась активная 2,5-DKG-редуктаза), а затем переклонировали в векторе с широким кругом хозяев и трансформировали им Erwinia herbicola.
Трансформированные клетки Erwinia активно превращали D-глюкозу непосредственно в 2-KLG, при этом собственные ферменты Erwinia, локализованные во внутренней мембране бактериальной клетки, преобразовывали глюкозу в 2,5-DKG, а 2,5-DKG-редуктаза, локализованная в цитоплазме, катализировала превращение 2,5-DKG в 2-KLG (рис. 12.4). Таким образом, с помощью генетических манипуляций метаболические реакции, протекающие в столь разных микроорганизмах, удалось осуществить в одном из них. Этот гибрид приобрел способность синтезировать конечный продукт комбинированного метаболического пути. Такой организм можно использовать как фабрику для производства 2-KLG, заменяющую первые три стадии в том процессе получения L-аскорбиновой кислоты, который используется в настоящее время (рис. 12.2).
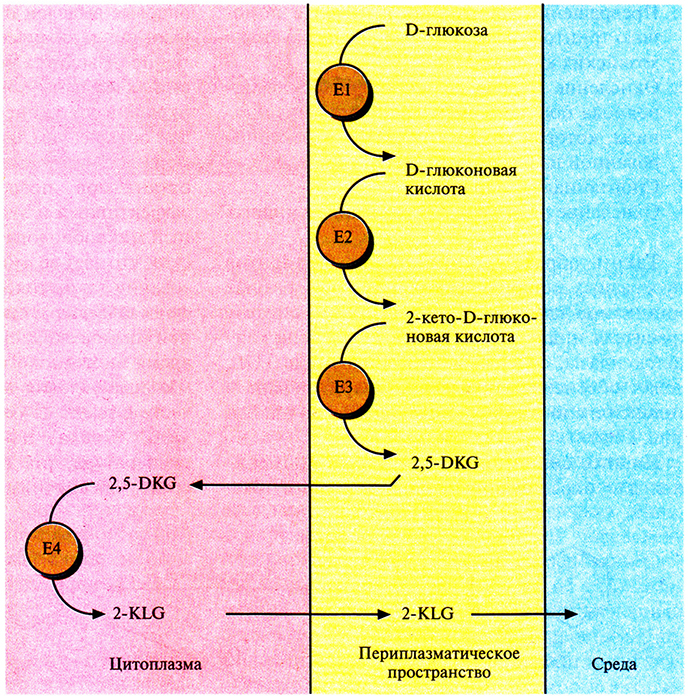
Рис. 12.4. Превращение D-глюкозы в 2-KLG рекомбинантной бактерией Erwinia herbicola. Все участвующие в этом процессе ферменты обозначены буквой Е и последовательно пронумерованы, указана также их клеточная локализация.
Коммерческую ценность 2,5-DKG-редуктазы можно повысить, если произвести аминокислотные замены, повышающие каталитическую активность фермента и его термостабильность. В то время, когда был идентифицирован ген 2,5-DKG-редуктазы, аминокислотные остатки, участвующие в образовании активного центра этого фермента, еще не были установлены. Однако, исходя из данных об аминокислотной последовательности фермента, была воссоздана его вторичная структура, состоящая из восьми тесно расположенных параллельных β-слоев, перемежающихся восемью а-спиралями, которые соединялись с β-слоями петлями разной длины (рис. 12.5). Такой характер укладки полипептидной цепи был установлен для 17 других ферментов с уже известной кристаллической структурой, и по аналогии с ними были идентифицированы три петли, возможно участвующие в связывании субстрата. С помощью олигонукдеотид-направленного мутагенеза были получены 12 мутантных белков, каждый из которых содержал одну аминокислотную замену в одной из петель. 11 мутантных форм 2,5-DKG-редуктазы обладали более низкой удельной активностью, чем нативный фермент, а 12-я, у которой остаток глутамина в положении 192 был заменен на аргинин, была примерно в два раза более активной. По данным кинетических исследований, повышение активности было связано с увеличением в 1,8 раз максимальной скорости (Vmax) и уменьшением на 25% константы Михаэлиса (KM) реакции, катализируемой ферментом. Замена глициновых остатков в положениях 55 и 57 на аланиновые позволила получить более термостабильный фермент по сравнению с нативной формой. Дальнейшие усилия будут, вероятно, направлены на получение фермента, сочетающего оба этих свойства.
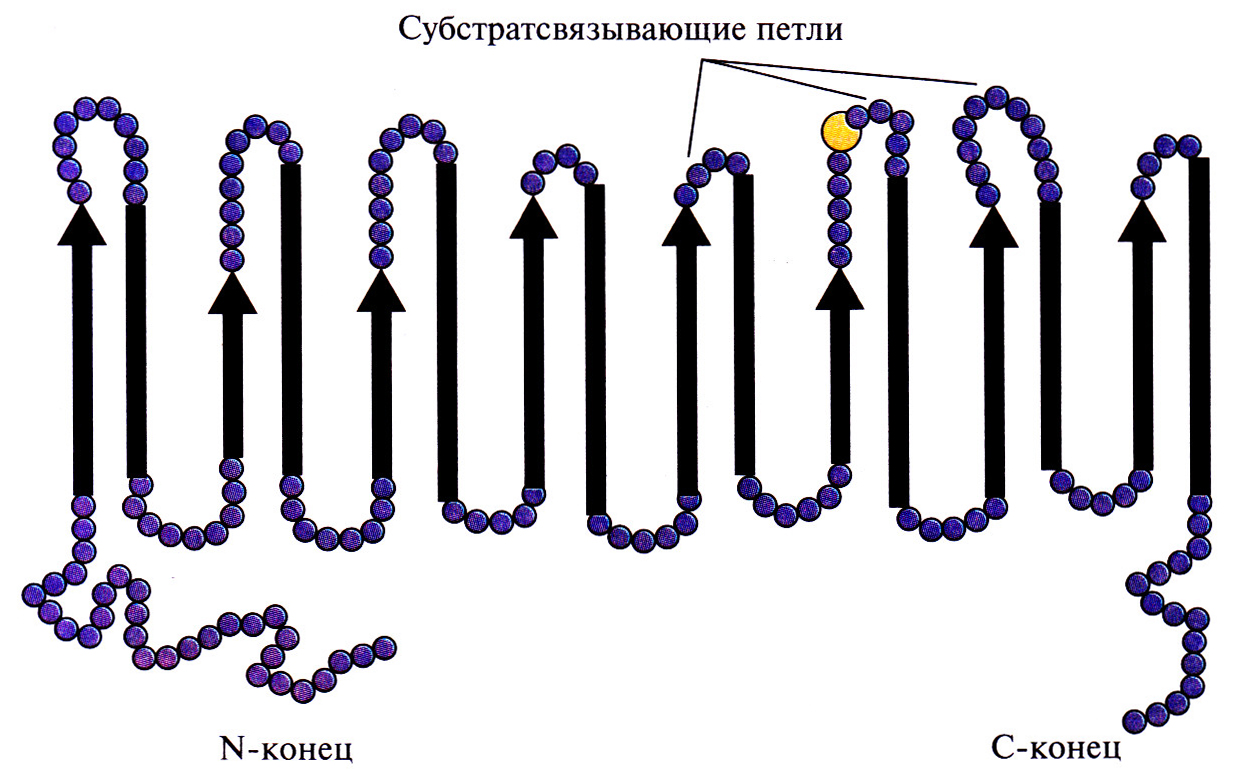
Рис. 12.5. Структура 2,5-DKG-peдуктазы, воссозданная исходя из ее аминокислотной последовательности. Стрелки – β-слои, полоски – α-спиральные участки, кружки – аминокислотные остатки, находящиеся на N- и С-концах молекулы или соединяющие β-слои и α-спирали. Показаны три петли, возможно, участвующие в связывании субстрата. Желтый кружок – 192-й аминокислотный остаток.
Синтез индиго
Множество бактерий, особенно бактерии вида Pseudomonas, способны утилизировать различные органические соединения типа нафталина, толуола, ксилола и фенола, которые являются для них единственным источником углерода. Очень часто гены ферментов, катализирующих расщепление этих органических соединений, располагаются в крупных природных плазмидах (длиной 50–200 т.п.н.). Чтобы ставить эксперименты с этими бактериями, в частности проводить целенаправленную модификацию генов ферментов, катализирующих те или иные метаболические реакции, приходится предпринимать детальные генетические и биохимические исследования, и нередко в ходе этих исследований делаются неожиданные и весьма интересные открытия. Рассмотрим следующий пример. Плазмида NAH7 содержит два разных оперона, которые позволяют несущим ее псевдомонадам использовать нафталин как единственный источник углерода. Для характеристики соответствующих генов расщепили плазмидную ДНК с помощью Hindilll и лигировали фрагменты с линеаризованной Hindilll плазмидой pBR322. Полученные гибридные молекулы ввели в клетки Е. coli и отобрали трансформантов, устойчивых к ампициллину, но чувствительных к тетрациклину. Затем проверили всех трансформантов на способность образовывать нелетучие метаболиты – возможные продукты гидролиза радиоактивно меченного нафталина.
При исследовании одного из трансформантов, содержащего вставку длиной 10,5 т.п.н. и способного превращать нафталин в салициловую кислоту, обнаружилось, что минимальная ростовая среда, содержащая триптофан, приобретает синюю окраску. Тщательный анализ этого явления показал, что трансформированные клетки Е. coli синтезировали краситель индиго. Синтез происходил в четыре стадии (рис. 12.6).
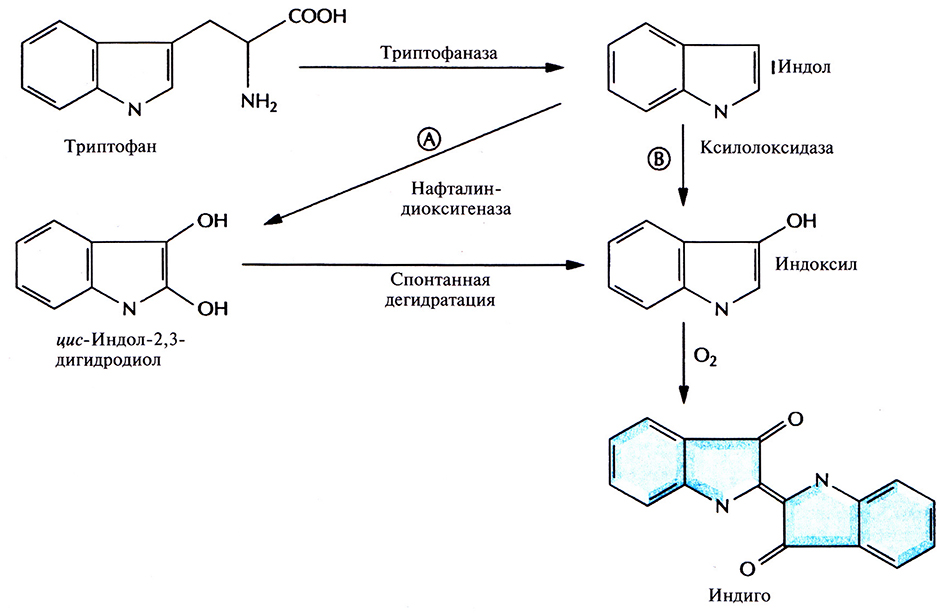
Рис. 12.6. Биосинтез индиго из триптофана, осуществляемый генетически модифицированной Е. coli. Триптофаназа – один из ферментов, продуцируемых Е. coli. Ген нафталиндиоксигеназы, катализирующей реакцию А, происходит из плазмиды NAH, а ген ксилолоксидазы, катализирующей реакцию Б, – из плазмиды TOL. В трансформированных клетках Е. coli индиго синтезируется либо по пути А, либо по пути Б, но не по ним обоим одновременно.
1. Превращение триптофана в индол с помощью триптофаназы, которая синтезируется в хозяйских клетках Е. coli.
2. Окисление индола до цис-индол-2,3-дигидродиола под действием нафталин-диоксигеназы, которая кодируется ДНК, переклонированной из плазмиды NAH7.
3. Спонтанная дегидратация.
4. Окисление на воздухе с образованием индиго.
Таким образом, комбинация ферментов двух разных метаболических путей двух разных организмов привела к неожиданному синтезу красителя индиго. Введение в Е. coli гена ксилолоксидазы, содержащегося в плазмиде TOL, может обеспечить превращение триптофана в индоксил, спонтанно окисляющийся до индиго (рис. 12.6).
Индиго, синий пигмент, который применяется для окрашивания хлопка и шерсти, был впервые выделен из растений; сейчас его получают путем химического синтеза. По оценкам, в год производится примерно 1,5-107 кг этого красителя на сумму около 200 млн. долл. Индиго окрашивают джинсовую ткань, и объем его продаж больше, чем любого другого красителя. Возможность получения индиго с помощью микроорганизмов позволяет разработать весьма эффективный и экономичный крупномасштабный микробиологический способ его производства, что дает возможность обойтись без использования таких токсичных веществ, как анилин, формальдегид и цианид, которые необходимы при химическом синтезе индиго. В настоящее время биотехнологи пытаются подобрать оптимальные условия выращивания больших количеств штамма Е. coli, способного к синтезу индиго. Среди подбираемых параметров – температура, рН и количество триптофана в среде, обеспечивающее максимальный выход продукта. Эта система еще не готова для коммерческого использования, но уже ясно, что микробиологический процесс мог бы проходить в биореакторе, в котором рекомбинантные Е. coli химически иммобилизованы на твердой матрице (например, на целлюлозе или силикагеле). Реактор мог бы работать в непрерывном режиме, с поступлением триптофана с одной его стороны и удалением индиго с другой (рис. 12.7).
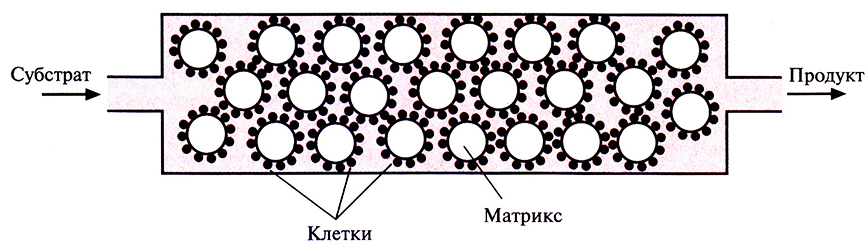
Рис. 12.7. Схематичное изображение биореактора, в котором можно было бы осуществлять синтез индиго с использованием рекомбинантных клеток Е. coli. Клетки иммобилизованы на частицах твердого матрикса. В реактор непрерывно подается субстрат (триптофан) и непрерывно выводится продукт (индиго). Скорость переноса вещества через реактор лимитируется скоростью превращения субстрата в продукт.
Синтез аминокислот
Аминокислоты широко применяются в пищевой промышленности – в качестве усилителей вкуса и аромата, антиоксидантов и пищевых добавок; в сельском хозяйстве – в качестве кормовых добавок; в медицине – для терапии послеоперационных больных; в химической промышленности – в качестве исходных веществ при синтезе полимеров и производстве косметических средств (табл. 12.1). По оценкам, ежегодно в мире производится более 800 000 т аминокислот стоимостью более 5 млрд. долларов. При этом больше половины общего объема производства приходится на долю L-глутаминовой кислоты, которая используется для получения широко известного усилителя вкуса и аромата – глутамата натрия.
Таблица 12.1. Применение аминокислот

В промышленном масштабе аминокислоты получают в основном либо экстракцией из белковых гидролизатов, либо как продукты метаболизма двух неспорулирующих грамположительных почвенных бактерий, Corynebacterium или Brevibacterium spp. Обычно для повышения продуктивности этих микроорганизмов используется мутагенез с последующим отбором штаммов – сверхпродуцентов определенных аминокислот. Однако такой способ получения штаммов требует много времени, а эффективность его невелика. Альтернативный подход мог бы состоять в выделении и изменении специфических генов, кодирующих ключевые ферменты определенных биохимических реакций, на основании детальных биохимических данных об этих ферментах. Впрочем, такой генноинженерный подход может оказаться не столь простым. Так, в биосинтезе некоторых аминокислот могут участвовать несколько ферментов, которые активируются или ингибируются различными метаболитами, присутствующими в клетке. В такой ситуации трудно определить, какой фермент нужно модифицировать, чтобы увеличить выход конечного продукта. Кроме того, ученые пока не располагают исчерпывающими данными о биохимических свойствах указанных выше микроорганизмов, а соответствующие генноинженерные подходы находятся на стадии разработки. В частности, только создаются экспрессирующие векторы и методики трансформации для грамположительных организмов типа Corynebacterium и Brevibacterium spp.
Большинство плазмидных векторов с широким кругом хозяев реплицируются только в грамотрицательных микроорганизмах, поэтому необходимо создать векторы, специально предназначенные для экспрессии в Corynebacterium и Brevibacterium spp. Это могли бы быть челночные векторы Е. coli-Corynebacterium. Та их часть, которая происходит из плазмид Е. coli, может содержать гены устойчивости к тетрациклину, хлорамфениколу или канамицину. Поскольку и Е. coli, и Corynebacterium spp. чувствительны к данным антибиотикам, эти гены могли бы служить селективными маркерами для обоих микроорганизмов.
Эффективный метод трансформации С. glutamicum, одного из видов Corynebacterium, часто используемых в такого рода экспериментах, до сих пор не разработан. Многие гены С. glutamicum неэффективно экспрессируются в Е. coli. Поэтому для систем отбора, основанных на экспрессии гена (например, при комплементации), клетки С. glutamicum должны быть трансформированы полным банком клонов. К сожалению, частота трансформации при введении ДНК в С. glutamicum обычным способом или электропорацией очень низка. Ее можно существенно повысить, если для введения чужеродной ДНК использовать конъюгацию или удалить клеточные стенки трансформируемых клеток лизоцимом (использовать протопласты). Проникновение экзогенной плазмидной ДНК в протопласты облегчается в присутствии полиэтиленгликоля.
Получены первые положительные результаты в увеличении выхода незаменимой аминокислоты триптофана, синтезируемой С. glutamicum. Для этого в клетки С. glutamicum дикого типа была введена вторая копия гена, кодирующего антранилатсинтазу, фермент лимитирующий синтез триптофана (рис. 12.8). Ниже описан один из способов выделения этого гена.
1. Библиотеку хромосомной ДНК Brevibacte-rium flavum клонировали в челночном векторе С. Glutamicum–E. coli и ввели в мутантный штамм С. glutamicum, не синтезирующий активной антранилатсинтазы.
2. Трансформантов отобрали по их способности расти в отсутствие антраниловой кислоты. Этим они отличались от мутантных нетрансформированных клеток.
3. Вектор, содержащий ген антранилатсинтазы, перенесли в штамм С. glutamicum дикого типа.
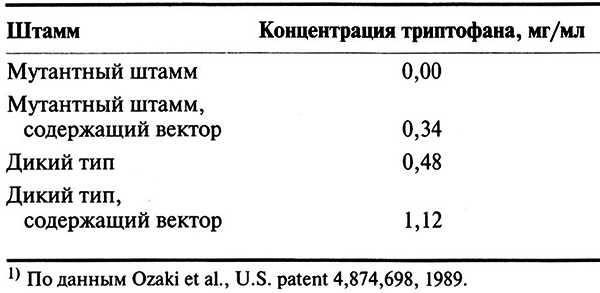
В табл. 12.2 представлены результаты определения количества триптофана, синтезированного мутантным штаммом С. glutamicum и штаммом дикого типа, которые содержали или не содержали вектор с клонированным геном антранилатсинтазы. Как видно из таблицы, клонированный ген практически полностью восстшавливал способность мутантного штамма синтезировать триптофан. Однако эффект введения этого гена в штамм дикого типа был еще сильнее: уровень синтеза триптофана в этом случае увеличивался примерно до 130%, что связано с более эффективным использованием доступных предшественников. Еще более высокий уровень синтеза триптофана достигался при введении в клетки С. glutaiacum модифицированных генов трех ключевых ферментов: З-дезокси-D-арабиногептулозонат-7-фосфатсинтазы, антранилатсинтазы и антранилатфосфооибозилтрансферазы. Гены, кодирующие эти ферменты, благодаря внесенным в них мутациям сгали нечувствительны к ингибированию конечным продуктам (ингибирование по типу обратной связи).
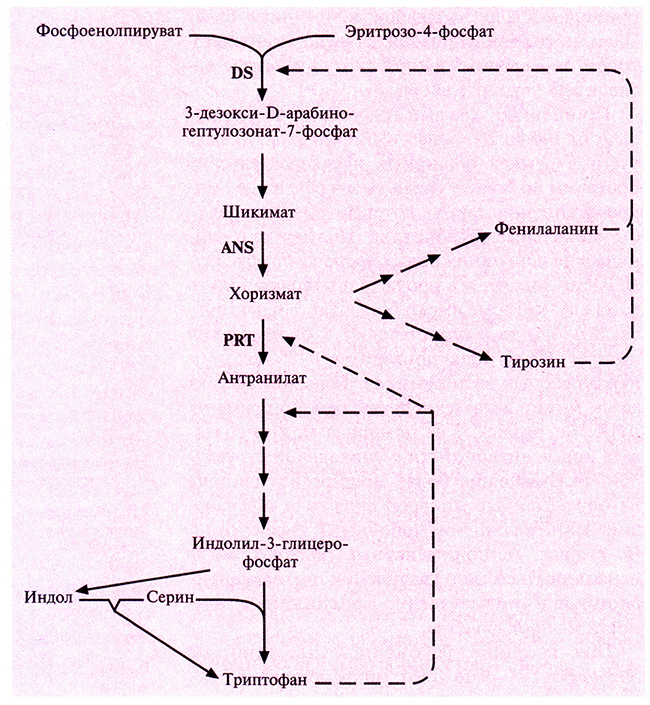
Рис. 12 8. Упрощенная схема биосинтеза триптофана в клетках С. glutamicum. Сплошные линии – биосинтетические реакции, штриховые – ингибирование по типу обратной связи. В качестве побочного продукта образуется индол который превращается в триптофан под действием триптофансин тазы β. DS – З-дезокси-D-арабиногептулозонат-7-фосфатсинтаз, ANS – антранилатсинтаза, PRT – антранилатфосфорибозилтрансфераза.
Таблица 12.2. Синтез триптофана некоторыми штаммами
С. glutamicum при стандартных условиях
В качестве альтернативы для синтеза аминокислот можно использовать Е. coli. Этот микроорганизм хорошо изучен, а генноинженерные методы работы с ним более или менее детально разработаны.
АНТИБИОТИКИ
Со времени открытия пенициллина в конце 1920-х годов из различных микроорганизмов были выделены более 6000 антибиотиков, обладающих разной специфичностью и разным механизмом действия. Их широкое применение для лечения инфекционных заболеваний помогло сохранить миллионы жизней. Подавляющее большинство основных антибиотиков было выделено из грамположительной почвенной бактерии Streptomyces, хотя их продуцирую/также грибы и другие грамположительные и грамотрицательные бактерии. Ежегодно во всем мире производится 100 000 т антибиотиков на суммупримерно 5 млрд. долларов, в том числе более 100 млн. долларов приходится на долю антибиотиков, добавляемых в корм скоту в качестве добавок или ускорителей роста.
По оценкам, каждый год ученые обнаруживают от 100 до 200 новых антибиотиков, прежде всего в рамках обширных исследовательских программ по поиску среди тысяч различных микроорганизмов таких, которые синтезировали бы уникальные антибиотики. Получение и клинические испытания новых препаратов обходятся очень дорого, и в продажу поступают только те из них, которые имеют большую терапевтическую ценность и представляют экономический интерес. На их долю приходится 1–2% всех обнаруживаемых антибиотиков. Большой эффект здесь может дать технология рекомбинантных ДНК. Во-первых, с ее помощью можно создавать новые антибиотики с уникальной структурой, оказывающие более мощное воздействие на определенные микроорганизмы и обладающие минимальными побочными эффектами. Во-вторых, генноинженерные подходы могут использоваться для увеличения выхода антибиотиков и соответственно для снижения стоимости их производства.
При создании рекомбинантных штаммов Slreptomyces – основного микроорганизма, используемого для получения антибиотиков, – важно помнить, что трансформация и отбор трансформированных клеток не должны быть слишком сложными. Однако в отличие от Е. coli Streptomyces существуют не в виде изолированных клеток, а в виде протяженных мицелл, поэтому перед трансформацией необходимо разрушить клеточную стенку и высвободить отдельные протопласты (рис. 12.9). Без этого будет невозможно отличить трансформированные клетки от нетрансформированных, поскольку видимые колонии на твердой среде будут образовываться из группы клеток, а не из индивидуальной клетки; соответственно колонии, растущие в присутствии селективного антибиотика, будут представлять собой смесь трансформированных и нетрансформированных клеток. Проникновение плазмидной ДНК в протопласты Streptomyces облегчается в присутствии полиэтиленгликоля. После трансформации протопласты сначала высевают на твердую среду, чтобы образовалась клеточная стенка, а затем для отбора трансформированных клеток переносят на селективную среду, обычно содержащую либо неомицин, либо тиострептон.
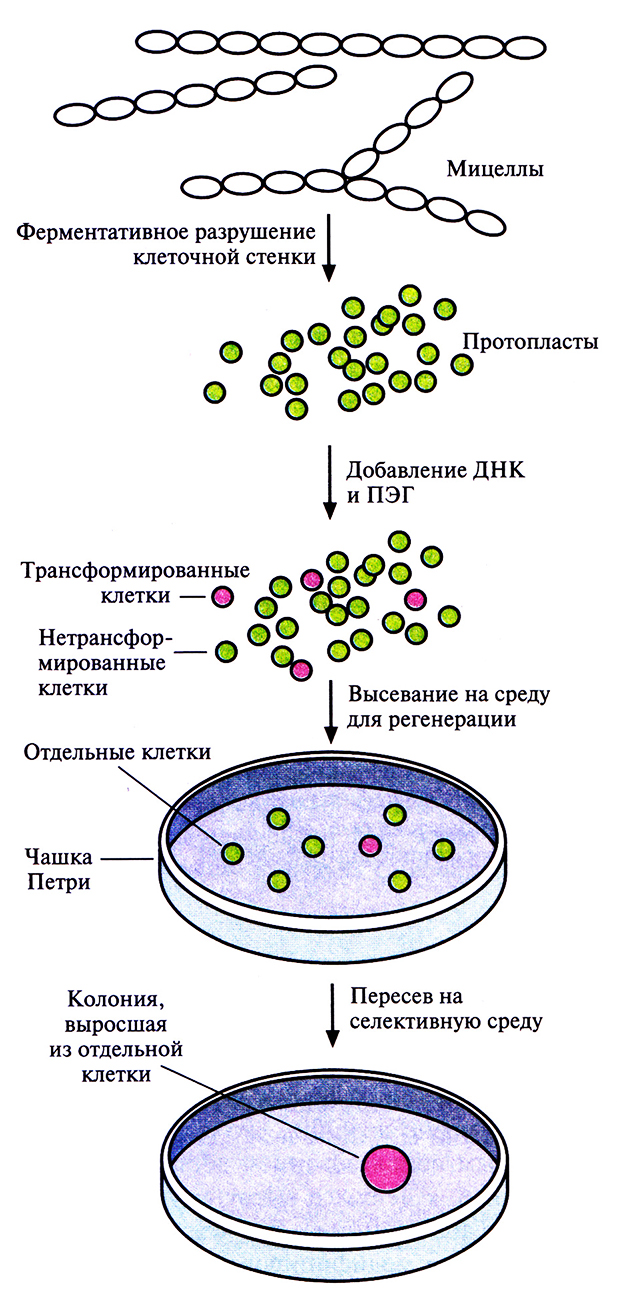
Рис. 12.9. Схема трансформации и отбора рекомби нантных штаммов Streptomyces. Трансформированные клетки обозначены розовыми кружками, нетрансформированные – зелеными. ПЭГ – полиэтиленгликоль.
Клонирование генов биосинтеза антибиотиков
Процесс биосинтеза одного антибиотика может состоять из 10–30 ферментативных реакций, так что клонирование всех генов его биосинтеза – задача не из легких. Один из подходов к выделению полного набора таких генов основан на трансформации одного или нескольких мутантных штаммов, не способных синтезировать данный антибиотик, банком клонов, созданным из хромосомной ДНК штамма дикого типа. После введения банка клонов в мутантные клетки проводят отбор трансформантов, способных синтезировать антибиотик. Затем выделяют плазмидную ДНК клона, содержащего функциональный экспрессирующийся ген антибиотика [т. е. ген, восстанавливающий (комплементирующий) утраченную мутантным штаммом функцию], и используют ее в качестве зонда для скрининга другого банка клонов хромосомной ДНК штамма дикого типа, из которого отбирают клоны, содержащие нуклеотидные последовательности, которые перекрываются с последовательностью зонда. Таким образом идентифицируют, а затем клонируют элементы ДНК, примыкающие к комплементирующей последовательности, и воссоздают полный кластер генов биосинтеза антибиотика. Описанная процедура относится к случаю, когда эти гены сгруппированы в одном сайте хромосомной ДНК Если же гены биосинтеза разбросаны в виде небольших кластеров по разным сайтам, то нужно иметь по крайней мере по одному мутанту на кластер, чтобы получить клоны ДНК, с помощью которых можно идентифицировать остальные гены кластеров.
Этот подход с успехом использовался для идентификации некоторых генов биосинтеза ундецилпродигиозина из Streptomyces coelicolor A3 (рис. 12.10). В этом случае комплементационный анализ основывается на сравнении цвета колоний: колонии микроорганизмов дикого типа имеют красный цвет, а колонии мутантных микооорганизмов – кремовый. Таким образом, в результате комплементации образуется красная колония.
Рис. 12.10. Структурная формула ундецилпродигиозина.
Помимо комплементации, для идентификации генов биосинтеза антибиотиков могут использоваться и более прямые подходы. Так, с помощью генетических или биохимических экспериментов можно идентифицировать, а затем выделить один или несколько ключевых ферментов биосинтеза, определить их N-концевые аминокислотные последовательности и, исходя из этих данных, синтезировать олигонуклеотидные зонды. Этот подход использовался для выделения из Penicillium chrysogenum гена синтетазы изопенициллина N. Этот фермент катализирует окислительную конденсацию δ-(L-α-аминоадипил)-L-цистеинил-D-валина в изопенициллин N, ключевое промежуточное звено в биосинтезе пенициллинов, цефалоспоринов и цефамицинов (рис. 12.11).
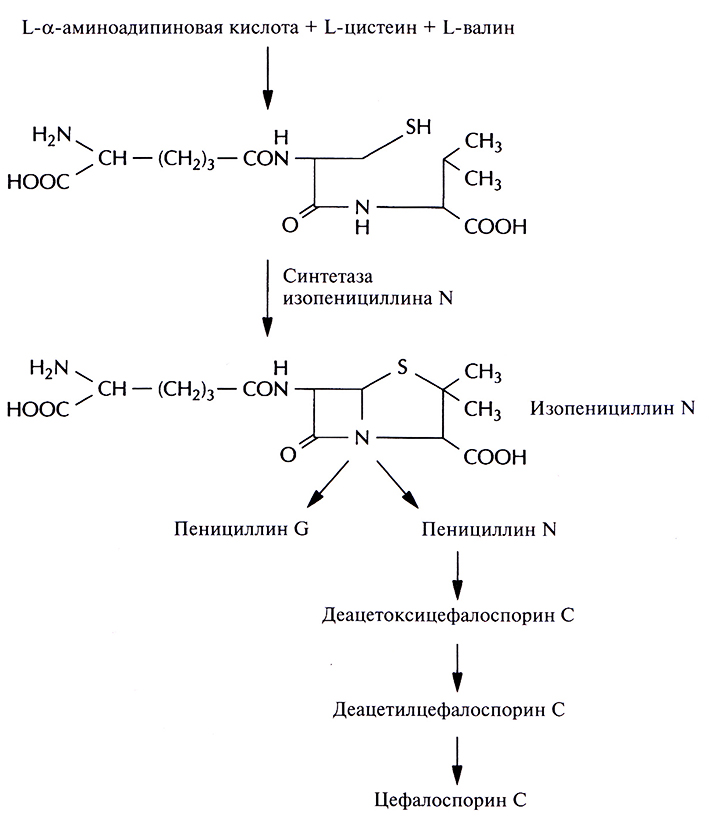
Рис. 12.11. Биосинтез пенициллинов и цефалосиоринов в P. chrysogenum. Синтетаза изопенициллина N катализирует синтез из δ-(L-α-аминоадипил)-L-цистеинил-D-валина изопенициллина N – предшественника пенициллина G, пенициллина N и цефалоспорина С.
Синтез новых антибиотиков
Новые антибиотики с уникальными свойствами и специфичностью можно получить, проводя генноинженерные манипуляции с генами, участвующими в биосинтезе уже известных антибиотиков. Один из первых экспериментов, в ходе которого был получен новый антибиотик, состоял в объединении в одном микроорганизме двух немного различающихся путей биосинтеза антибиотика.
Одна из плазмид Streptomyces, pIJ2303, несущая фрагмент хромосомной ДНК S. coelicolor длиной 32,5 т.п.н., содержит все гены ферментов, ответственных за биосинтез из ацетата антибиотика актинородина, представителя семейства изохроманхиноновых антибиотиков (рис. 12.12). Целую плазмиду и различные субклоны, несущие части 32,5 т.п.н.-фрагмента (например, рП2315), вводили либо в штамм АМ-7161 Streptomyces sp., синтезиурующий родственный антибиотик медермицин, либо в штамм В1140 или Tu22 S. violaceoruber, синтезирующие родственные антибиотики гранатицин и дигидрогранатицин.
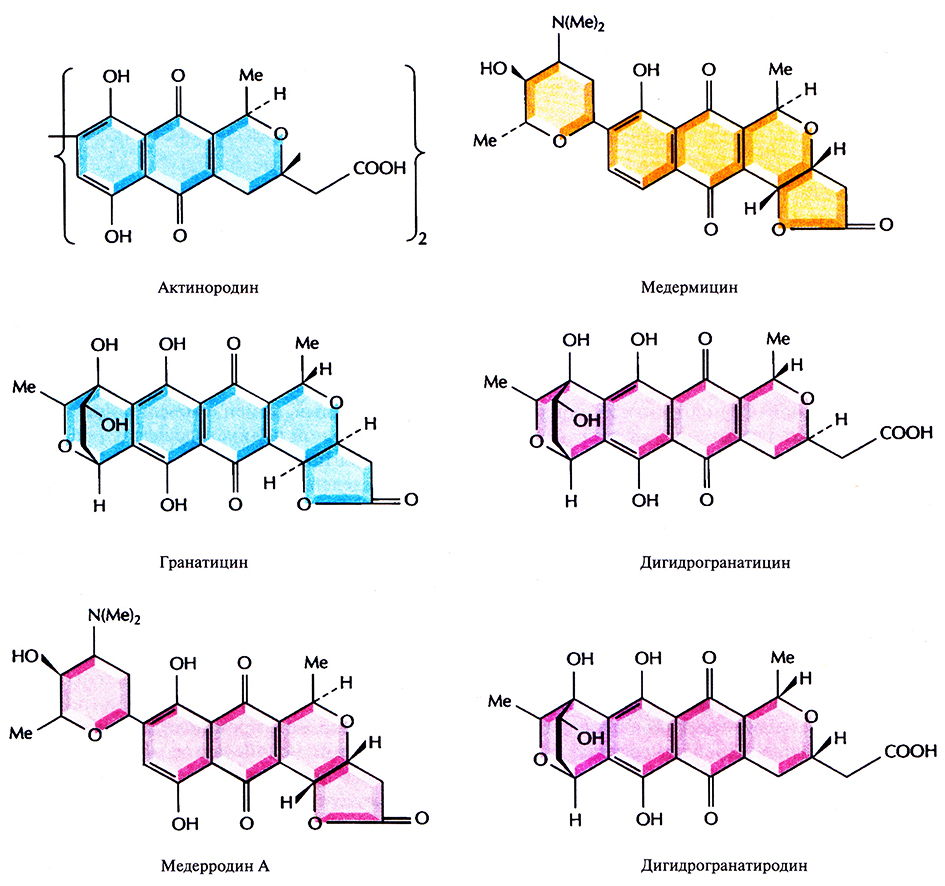
Рис. 12.12. Структурные формулы различных изохроманхиноновых антибиотиков, синтезируемых штаммами Streptomyces. S. coelicolor дикого типа и плазмида pIJ2303 кодируют актинородин; Streptomyces sp. синтезирует медермицин, a S. violaceoruber – гранатицин и дигидрогранатицин. Синтезируемые гибридные антибиотики – это медерродин А и дигидрогранатиродин.
Все указанные антибиотики являются кислотно-щелочными индикаторами, которые придают растущей культуре характерный цвет, зависящий от рН среды (табл. 12.3). В свою очередь рН (и цвет) среды зависят от того, какое соединение синтезируется. Мутанты родительского штамма S. coelicolor, не способные синтезировать актинородин, бесцветные. Появление окраски после трансформации штамма АМ-7161 Streptomyces sp. либо штаммов В1140 или TÜ22 S. violaceomher плазмидой, несущей все или несколько генов, кодирующих ферменты биосинтеза актинородина, свидетельствует о синтезе нового антибиотика (рис. 12.12, табл. 12.3). Трансформанты штамма АМ-7161 Streptomyces sp. и штамма В1140 S. violaceoruber, содержащие плазмиду pIJ2303, синтезируют антибиотики, кодируемые и плазмидой, и хромосомной ДНК. Однако при трансформации штамма TÜ22 S. violaceoruber плазмидой plJ2303 наряду с актинородином синтезируется новый антибиотик – дигидрогранатиродин, а при трансформации штамма АМ-7161 Streptomuces sp. плазмидой pIJ2315 синтезируется еще один новый антибиотик – медерродин А.
Таблица 12.3. Антибиотики, синтезируемые различными штаммами Streptomyces,
в том числе штаммами, трансформированными плазмидами pIJ2303 и pl.123151)

В структурном отношении эти новые антибиотики мало отличаются от актинородина, медермицина, гранатицина и гидрогранатицина и, вероятно, образуются в том случае, когда промежуточный продукт одного пути биосинтеза служит субстратом для фермента другого пути. Когда будут детально изучены биохимические свойства различных путей биосинтеза антибиотиков, появится возможность создавать новые уникальные высокоспецифичные антибиотики, манипулируя генами, которые кодируют соответствующие ферменты.
Разработка новых методов получения
поликетидных антибиотиков
Термин «поликетидные» относится к классу антибиотиков, которые образуются в результате последовательной ферментативной конденсации карбоновых кислот типа ацетата, пропионата и бутирата. Некоторые поликетидные антибиотики синтезируются растениями и грибами, но большая их часть образуется актиномицетами в виде вторичных метаболитов. Прежде чем проводить манипуляции с генами, кодирующими ферменты биосинтеза поликетидных антибиотиков, необходимо выяснить механизм действия этих ферментов.
Поликетидные антибиотики синтезируются по тому же пути, что и длинноцепочечные жирные кислоты. В результате каждого цикла конденсации к растущей углеродной цепи добавляется β-кетогруппа. Процесс состоит из ряда повторяющихся стадий, включающих восстановление кетогруппы, дегидратацию и восстановление β-еноильных групп в растущей поликетидной цепи. Существуют два класса поликетидсинтаз – ферментных комплексов, ответственных за синтез поликетидных антибиотиков (рис. 12.13). Первый класс составляют синтазы, катализируюшие реакции биосинтеза ароматических поликетидов; каждая синтаза представляет собой один полипептид с одним активным центром, который последовательно катализирует биосинтетические реакции (рис. 12.13, А). Второй класс включает синтазы, образованные несколькими полипептидами (А–Е на рис. 12.13, Б); каждый из них имеет свой активный центр и обладает специфической ферментативной активностью, катализирующей определенную реакцию биосинтеза.
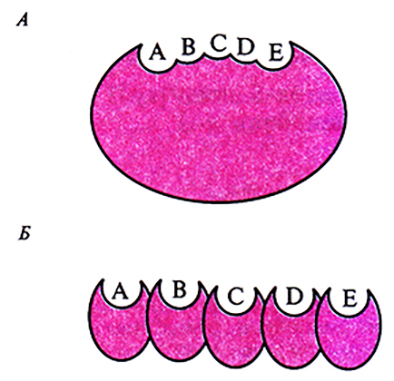
Рис. 12.13. Схематическое изображение структуры поликетидсинтазы ароматических поликетидов, у которой активный центр находится в одном полипептиде (А), и поликетидсинтазы, представляющей собой комплекс нескольких полипептидов с разными активными центрами (Б). Ферменты обоих типов содержат несколько доменов (А–Е), каждый из которых обладает собственной ферментативной активностью.
Если каждый домен субъединицы многофункциональной поликетидсинтазы, обладающий ферментативной активностью, катализирует определенную реакцию, то утрата любой из активностей затронет только одну реакцию биосинтеза, а изменение домена с известной функцией приведет к предсказуемым изменениям структуры синтезируемого антибиотика. Так, детально изучив генетические и биохимические составляющие биосинтеза эритромицина в клетках Saccharopolyspora erythraea, удалось внести специфические изменения в гены, ассоциированные с биосинтезом этого антибиотика, и синтезировать производные эритромицина с другими свойствами. Вначале была определена первичная структура фрагмента ДНК S. erythraea длиной 56 т. п. н., содержащего кластер генов ety, затем двумя разными способами модифицирована эритромицинполикетидсинтаза. Для этого 1) удаляли участок ДНК, кодирующий β-кеторедуктазу, либо 2) вносили изменение в участок ДНК, кодирующий еноилредуктазу. Делеция β-кеторедуктазного гена приводила к накоплению промежуточного продукта, у которого к C-5-атому кольца была присоединена карбонильная группа, а не гидроксильная (рис. 12.14), а мутация в гене еноилредуктазы – к образованию двойной связи между атомами С-6 и С-7 (рис. 12.14). Из этих экспериментов следует, что если идентифицировать и охарактеризовать кластер генов, кодирующих ферменты биосинтеза определенного поликетидного антибиотика, то, внося в них специфические изменения, можно будет направленно изменять структуру антибиотика. Кроме того, вырезая и соединяя те или иные участки ДНК, можно перемещать домены поликетидсинтазы и получать новые поликетидные антибиотики.
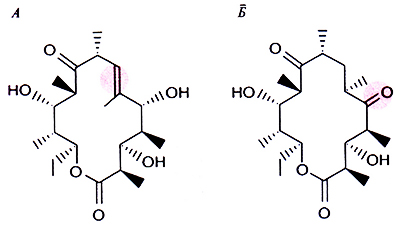
Рис. 12.14. Производные эритромицина, полученные геьноинженерными методамг. А. В результате мутации в гене еноилредуктазы образуется продукт с двойной связью между атомами С-6 и С-7 (цветной кружок). Б. Делеция гена β-кеторедуктазы сопровождается образованием производного с C-5-карбонильной, а не гидроксильной группой (цветной кружок). (По данным работы Kut7, Donadio, Аппи. Rex Microbiol. 47: 875-9i2, 1993.)
Все кластеры генов ароматических поликетидов содержат три гена, кодирующих так называемую минимальную поликетидсинтазу. Этот ферментный комплекс включает кетосинтазу (с ацилтрансферазным доменом), фактор, определяющий длину цепи, и ацилпереносящий белок. Минимальная поликетидсинтаза отвечает за синтез ароматического поликетидного остова, а его модификации осуществляются другими ферментами, действующими согласованно с ней. Гены, кодирующие все эти ферменты, обычно организованы в один кластер (рис. 12.15). Каждый кластер генов кодирует синтез определенного антибиотика. С помощью обмена генами между кластерами были синтезированы два новых ароматических поликетидных антибиотика (рис. 12.16), что еще раз иллюстрирует возможности генной инженерии.
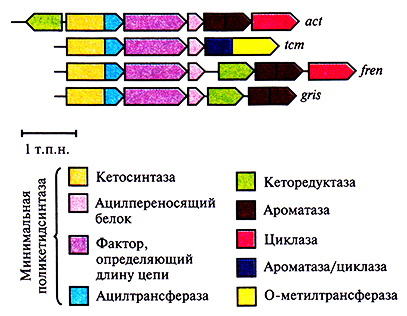
Рис. 12.15. Кластер генов биосинтеза ароматических поликетидных антибиотиков актинородина (act), тетраценомицина (tcm), френолицина (fieri) и гризеузина (gris). Каждый кластер содержит гены, кодирующие минимальную поликетидсинтазу, которая отвечает за синтез поликетидного остова. Ферменты, кодируемые другими генами, катализируют реакции его модификации. Сужающийся «конец» гена указывает направление его транскрипции.
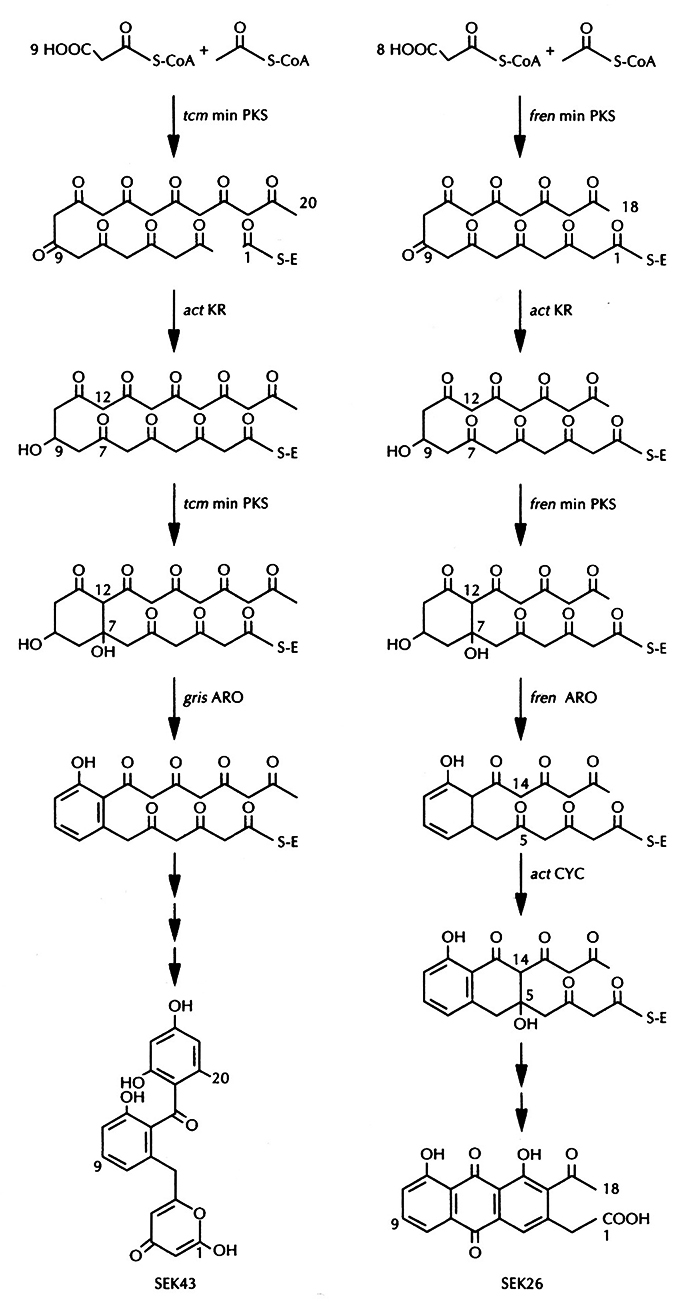
Рис. 12.16. Искусственно созданные пути биосинтеза поликетидных антчбиотиков SEK43 и SEK26. Обозначения act – актинородин. tcm – тетраценомицин, fren – фречолицин, gris – гризеузин, min PKS – минимальная полике тидсинтаза, KR – β-кеторедуктаза, ARO – ароматаза, CYC – циклаза.
Усовершенствование производства антибиотиков
С помощью генной инженерии можно не только создавать новые антибиотики, но и увеличивать эффективность синтеза уже известных. Лимитирующим фактором в промышленном производстве антибиотиков с помощью Streptomyces spp. часто является количество доступного клеткам кислорода. Вследствие плохой растворимости кислорода в воде и высокой плотности культуры Streptomyces его часто оказывается недостаточно, рост клеток замедляется и выход антибиотика снижается. Чтобы решить эту проблему, можно, во-первых, изменить конструкцию биореакторов, в которых выращивается культура Streptomyces, а во-вторых, используя методы генной инженерии, создать штаммы Streptomyces, более эффективно использующие имеющийся кислород. Эти два подхода не исключают друг друга.
Одна из стратегий, используемых некоторыми аэробными микроорганизмами для выживания в условиях недостатка кислорода, состоит в синтезе гемоглобинподобного продукта, способного аккумулировать кислород и доставлять его в клетку. Например, аэробная бактерия Vitreoscilla sp. синтезирует гомодимерный гемсодержащий белок, функционально подобный эукариотическому гемоглобину. Ген «гемоглобина» Vitreoscilla был выделен, встроен в плазмидный вектор Streptomyces и введен в клетки этого микроорганизма. После его экспрессии на долю гемоглобина Vitreoscilla приходилось примерно 0,1% всех клеточных белков S. соеliсоlor даже в том случае, когда экспрессия осуществлялась под контролем собственного промотора гена гемоглобина Vitreoscilla, а не промотора Streptomyces. Трансформированные клетки S. coelicolor, растущие при низком содержании растворенного кислорода (примерно 5% от насыщающей концентрации), синтезировали в 10 раз больше актинородина на 1 г сухой клеточной массы и имели большую скорость роста, чем нетрансформированные. Этот подход можно использовать и для обеспечения кислородом других микроорганизмов, растущих в условиях недостатка кислорода.
Исходным материалом при химическом синтезе некоторых цефалоспоринов – антибиотиков обладающих незначительным побочным эффектом и активных в отношении множества бактерий, – является 7-аминоцефалоспорановая кислота (7АСА), которая в свою очередь синтезируется из антибиотика цефалоспорина С (рис. 12.11). К сожалению, природных микроорганизмов, способных синтезировать 7 АСА, до сих пор не выявлено. Новый путь биосинтеза 7АСА был сконструирован включением специфических генов в плазмиду гриба Acremonium chrysogenum, который обычно синтеризует только цефалоспорин С. Один из этих генов был представлен кДНК гриба Fusarium solani, кодирующей оксидазу D-аминокислот, а другой происходил из геномной ДНК Pseudomonas diminuta и кодировал цефалоспоринацилазу. В плазмиде гены находились под контролем промотора A. chrysogenum. На первом этапе нового биосинтетического пути цефалоспорин С превращается в 7-β-(5-карбокси-5-оксопентанамид)цефалоспорановую кислоту (кето-АD-7АСА) при помощи оксидазы D-аминокислот (рис. 12.17). Часть этого продукта, вступая в реакцию с пероксидом водорода, одним из побочных продуктов, превращается в 7-β-(4-карбоксибутанамид)цефалоспорановую кислоту (GL-7ACA). И цефалоспорин С, и кето-AD-7ACA, и GL-7ACA могут подвергаться гидролизу цефалоспоринацилазой с образованием 7АСА, однако только 5% цефалоспорина С напрямую гигролизуется до 7АСА. Следовательно, для образования 7АСА с высоким выходом необходимы оба фермента.
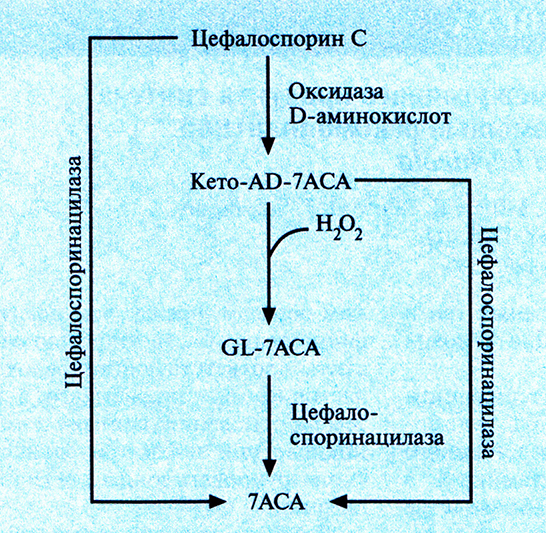
Рис. 12.17. Генетически сконструированный путь биосинтеза 7-аминоцефалоспорановой кислоты (7АСА) из цефалоспорина С. Ген оксидазы D-аминокислот выделен из гриба F. solani, а ген цефалоспоринацилазы – из бактерии P. diminuta.
ВАЖНАЯ ВЕХА
Получение 2-кето-L-гулоната – промежуточного продукта синтеза L-аскорбиновой кислоты – с помощью рекомбинантной бактерии Егм inia herbicola
S. Anderson, С. В. Marks, R. Lazarus, J. Miller, K. Stafford, J. Serymour, D. Light, W. Rastetter, D. Estell Science 230: 144-149, 1985
Для направленного изменения прокариот, синтезирующих определенные метаболиты, в принципе есть два пути. Во-первых, можно изменить активность или содержание одного или нескольких ферментов того или иного биосинтетического пути с тем, чтобы увеличить продукцию нужного метаболита. Во-вторых, в прохариотический геном можно ввести чужеродные гены, кодирующие ферменты, которые, используя эндогенный метаболит в качестве субстрата, обеспечат синтез метаболита, изначально не продуцируемого хозяйской клеткой. Такого рода манипуляции представляются достаточно простыми, однако далеко не всегда удается выделить нужный ген и подобрать подходящие условия для его экспрессии.
Чтобы создать бактерию, синтезирующую 2-кето-L-гулоновую кислоту, непосредственного предшественника витамина С в промышленном производстве этого витамина, Андерсон и др. выделили из Corynebacterium ген фермента, катализирующего превращение 2,5-дикето-D-глюконовой кислоты в 2-кето-L-гулоновую кислоту, и ввели этот ген в клетки Erwinia sp. – бактерии, синтезирующей 2,5-дикето-D-глюконовую кислоту из D-глюкозы. Выделение этого гена осложнялось тем, что сам фермент практически не был изучен. Таким образом, прежде чем идентифицировать ген, нужно было очистить соответствующий белок и частично секвенировать его, а затем на основании данных об аминокислотной последовательности сконструировать зонды для гибридизации.
Это была одна из первых работ, относящихся к той области исследований, которую иногда называют инженерией метаболизма. В такого рода работах из одного микроорганизма в другой переносят гены, ответственные за какую-то часть метаболического пути, так что второй микроорганизм приобретает способность синтезировать новые метаболиты.
БИОПОЛИМЕРЫ
Биополимеры – это высокомолекулярные соединения, синтезируемые живыми организмами. Некоторые из них обладают ценными физическими и химическими свойствами и могут использоваться в пищевой, перерабатывающей и фармацевтической промышленности. С возникновением технологии рекомбинантных ДНК появилась возможность создавать новые биополимеры, заменять синтетические продукты их биологическими аналогами, модифицировать уже существующие биополимеры с целью улучшения их физических и структурных характеристик, повышать эффективность соответствующих промышленных процессов, уменьшать их стоимость.
Создание рекомбинантной бактерии
Xanthomonas campestris с целью получения ксантановой слизи
Xanthomonas campestris – грамотрицательная облигатно аэробная почвенная бактерия, синтезирующая ценный коммерческий биополимер ксантановую слизь, высокомолекулярный экзопсшисахарид. Его структурный каркас составляет линейная полимерная цепь из молекул глюкозы К каждому второму глюкозному остатку присоединена трисахаридная боковая цепь, состоящая из однго остатка глюкуроновой кислоты и двух остатков маннозы (рис. 12.18). Ксантановая слизь имеет высокую вязкость, не разрушается в агрессивных физических и химических средах и по физическим и химическим свойствам напоминает пластик. В частности, ее можно использовать как стабилизирующий, эмульгирующий, загущающий или суспендирующий агент. Для успешного коммерческого производства ксантановой слизи необходимо выращивать X. campestris на недорогом и доступном источнике углерода. X. campestris дикого типа эффективно утилизирует глюкозу, сахарозу и крахмал, но не лактозу. При производстве сыра в большом количестве образуется такой побочный продукт, как сыворотка. Она состоит из воды (94–95%), лактозы (3,5–4%) и небольших количеств белка, минеральных веществ и низкомолекулярных органических соединений Огромные количества сыворотки дает молочная промышленность, и ее утилизация – это большая проблема. Часто сыворотку сливают в реки и озера, что приводит к уменьшению в них количества доступного кислорода и гибели многих водных организмов. Транспортировка сыворотки к местам захоронения мусора обходится очень дорого, к тому же серьезную проблему создает риск загрязнения ею грунтовых вод. Наконец, большие средства уходят на удаление твердых компонентов сыворотки. Все это заставило попытаться найти способы выгодной переработки сыворотки.
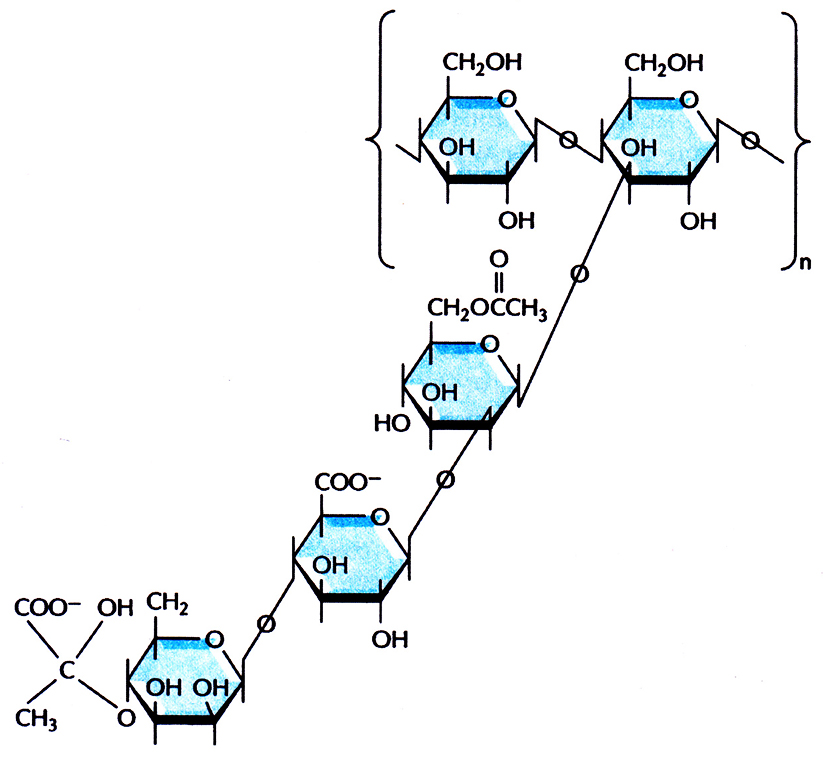
Рис. 12.18. Структурная формула полисахарида, образующего ксантановую слизь. Каркас составляет линейная полимерная цепь из молекул глюкозы К каждому второму остатку присоединена трисахаридная боковая цепь.
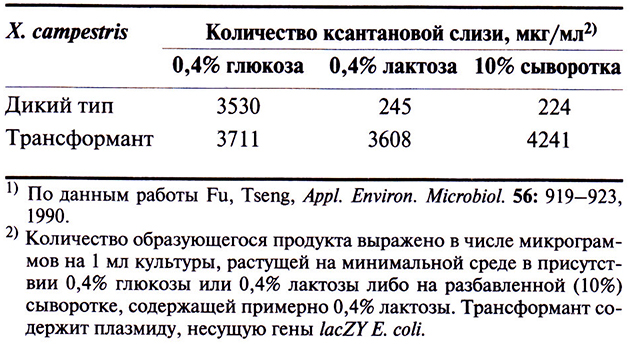
Сыворотку можно использовать как источник углерода при выращивании ценных промышленных микроорганизмов. Чтобы X. campestris приобрела способность расти на сыворотке, было проделано следующее. Гены lacZY Е. coli, кодирующие ферменты β-галактозидазу и лактозопермеазу, встроили в плазмиду с широким кругом хозяев так, чтобы они находились под транскрипционным контролем промотора одного из бактериофагов X. campestris. Эту конструкцию ввели в Е. coli, а затем перенесли из Е. coli в X. campestru тройным скрещиванием. Трансформанты, содержащие плазмиду, синтезировали β-галактозидазу и лактозопермеазу, используя лактозу как единственный источник углерода, а также продуцировали в больших количествах ксантановую слизь, используя в качестве источников углерода глюкозу, лактозу и сыворотку (табл. 12.4). Подчеркнем еще раз, что X. campestris дикого типа синтезирует много ксантановой слизи, только когда растет на глюкозе.
Таблица 12.4. Синтез ксантановой слизи в трансформированных клетках
X. campestris и клетках дикого типа,
растущих в среде с разными источниками углерода1)
Выделение генов биосинтеза меланина Меланины образуют многочисленное семейство различных поглощающих свет биополимеров их синтеризуют животные, растения, бактерии и грибы. Эти пигменты можно было бы использовать при изготовлении солнцезащитных экранов и покрытий, в качестве добавки к косметическим средствам. В настоящее время меланины получают в небольших количествах либо экстракцией из природных источников, либо путем химического синтеза. С помощью технологии рекомбинантных ДНК, возможно, удастся создать недорогое крупномасштабное производство меланинов с различными физическими свойствами.
Меланины – это нерегулярные полимеры, состоящие из остатков индола, бензотиазола и аминокислот. Первый этап их биосинтеза катализируется медьсодержащим ферментом монооксигеназой тирозиназы и представляет собой окисление тирозина до дигидроксифенилала-нинхинона. Последние этапы полимеризации не являются каталитическими реакциями и в зависимости от химической природы нехинонных соединений, включающихся в полимерную структуру, дают конечные продукты разных цветов: черного, коричневого, желтого, красного или фиолетового.
Выделены и охарактеризованы гены биосинтеза меланина в бактериальных клетках Streptomyces antibioticus. Они содержат две открытые рамки считывания (ORF), одна из которых кодирует тирозиназу (мол. масса 30 600), а вторая (ORF438) – белок (мол. масса примерно 14 800) с неизвестными функциями. Чтобы проверить, нужны ли оба этих гена для синтеза меланина, гены сначала переклонировали в экспрессирующий вектор Е. coli, при этом одна конструкция содержала только ген тирозиназы, а другая – и ген тирозиназы, и ORF438 (рис. 12.19). Вектор, несущий ген тирозиназы, обеспечивал синтез больших количеств тирозиназы, чем вектор, содержащий оба указанных гена. Однако оказалось, что уровень тирозиназы не имеет особого значения, а для биосинтеза меланина необходимы продукты обоих генов. Возможно, белок, кодируемый ORF438, поставляет ионы меди неактивному предшественнику тирозиназы апотирозиназе, которая активируется в их присутствии. В естественных условиях после образования дигидроксифенилаланинхинона при участии тирозиназы в полимер включаются различные низкомолекулярные соединения (нехиноны). С учетом этого можно изменять химические и физические свойства меланина, синтезируемого в клетках Е. coli с введенными в них ключевыми генами биосинтеза этого полимера, если добавлять в среду определенные низкомолекулярные соединения в разных количествах.
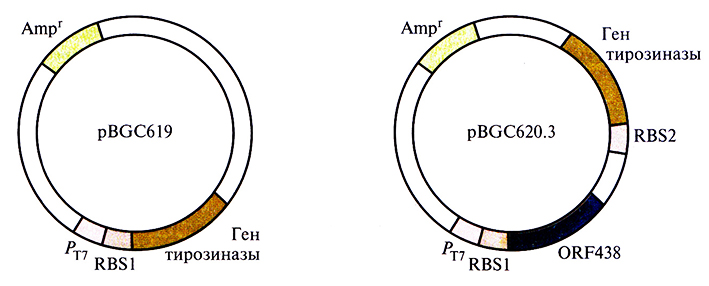
Рис. 12.19. Экспрессирующие плазмиды Е. coli, несущие гены биосинтеза меланина. pBGC619 содержит ген тирозиназы, a pBGC620.3 – открытую рамку считывания (ORF438) для синтеза меланина и ген тирозиназы. Транскрипция клонированных генов осуществляется под контролем промотора Р17 бактериофага Т7. RBS1 и RBS2 – два разных сайта связывания рибосом. Обе плазмиды несут гены устойчивости к ампициллину (Ampr).
Микробиологический синтез животного биополимера
с адгезивными свойствами
Весьма перспективной представляется также разработка недорогого способа получения белка с адгезивными свойствами, впервые выделенного из мидий Mytilus edulis. Этот водостойкий белок образует очень прочные нити, с помощью которых моллюски прикрепляются к разнообразным поверхностям. Сразу после секреции биополимера так называемой биссаловой железой между полимерными цепями образуются многочисленные поперечные сшивки, что затрудняет определение их аминокислотной последовательности. Это в свою очередь не позволяет установить нуклеотидную последовательность кодирующих их генов и синтезировать гибридизационные зонды. К счастью, удалось выделить внутриклеточный предшественник адгезивного белка (130 кДа-предшественник). Как показали биохимические исследования, он богат серином, треонином, лизином, пролином и тирозином. От 60 до 70% этих аминокислот содержат гидроксильную группу, при этом большинство остатков пролина и тирозина гидроксилированы до 3- или 4-гидроксипролина (Hyp) и 3,4-дигидроксифенилаланина (DOPA) соответственно. Кроме того, после определения аминокислотной последовательности выяснилось, что предшественник состоит в основном из повторяющихся декапептидов Ala-Lys-(Pro или Hyp)-Ser-(Tyr или DOPA)-Hyp-Hyp-Thr-DOPA-Lys.
Из библиотеки кДНК, которая была получена на основе мРНК, выделенной из биссаловой железы, была изолирована кДНК 130 кДа-предшественника адгезивного белка. И адгезивный белок, и его кДНК обладают весьма необычными свойствами, затрудняющими клонирование и экспрессию соответствующих генов и получение функционального адгезивного белка. Во-первых, кДНК содержит большое число повторов, что повышает частоту гомологичной рекомбинации и вероятность утраты части клонированной последовательности. Во-вторых, поскольку примерно 70% всех аминокислот белка приходится на долю пролина, лизина и тирозина, вряд ли его удастся получить в большом количестве вследствие ограниченности внутриклеточного пула аминоацил-тРНК.
Чтобы преодолеть все эти трудности, полноразмерную кДНК адгезивного белка или ее фрагменты встроили в дрожжевые экспрессирующие векторы и ввели эти векторы в дрожжевые клетки. После экспрессии были получены новые активные формы адгезивного белка мол. массой от 20 до 100 кДа, причем на их долю приходилось от 2 до 5% суммарного количества клеточных белков. Значительно более высокого уровня экспрессии удалось достичь после того, как был химически синтезирован ген адгезивного белка (рис. 12.20). Используя повторы ДНК, кодирующие декапептид адгезивного белка, создали синтетический ген длиной 600 п. н., который кодировал белок мол. массой примерно 25 кДа. Его основная повторяющаяся единица длиной 30 п. н. состояла из кодонов, оптимальных для экспрессии в Е. соН, а эффективная экспрессия происходила, когда он находился под контролем промотора фага Т7. Большинство микроорганизмов обладают лишь ограниченной способностью осуществлять посттрансляционное гидроксилирование аминокислот, так что образующийся белок бывает не до конца гидроксилирован. Так, некоторые из его тирозиновых остатков не превращаются в DO РА, что снижает число образующихся поперечных сшивок. Чтобы решить эту проблему, была создана система гидроксилирования in vitro, в которой бактериальная тирозиназа в присутствии аскорбиновой кислоты гидроксилировала остатки тирозина (рис. 12.21). Аскорбиновую кислоту добавляли в реакционную смесь для того, чтобы предотвратить окисление остатков DOPA в о-хинон. Этот процесс должен строго контролироваться, поскольку он приводит к сшиванию субъединиц адгезивного белка. Как и многие другие клеи или адгезивы, адгезивный белок необходимо активировать непосредственно перед использованием.

Рис. 12.20. Синтетический олигонуклеотид, послуживший основой для создания гена адгезивного белка, синтезируемого мидией М. edulis. Второй синтетический олигонуклеотид был синтезирован таким образом, чтобы после отжига с первым образовывался фрагмент двухцепочечной ДНК с липкими концами. Последующее лигирование с помощью ДНК-лигазы фага Т4 привело к образованию линейной ДНК, состоящей из представленных на рисунке повторов. Внизу дана аминокислотная последовательность полипептида, кодируемого этим повтором.
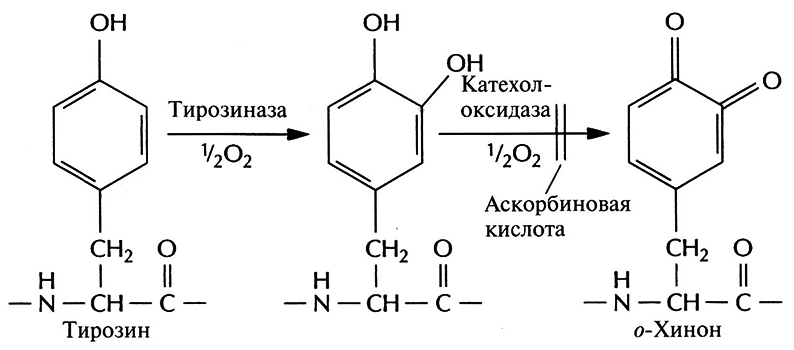
Рис. 12.21. Посттрансляционное гидроксилирование in vitro некоторых тирозиновых остатков адгезивного белка М. edulis. При участии тирозиназы тирозин превращается в DOPA, после чего он может быть окислен до о-хинона катехолоксидазой или тирозиназой. Окисление можно предотвратить добавлением аскорбиновой кислоты.
При окислении предшественника адгезивного белка и образовании сшивок белок может связываться с разнообразными поверхностями – из стекла, полистирола, коллагена и т.д. Прочность и специфичность связывания можно изменять добавлением к смеси адгезивных белков до окисления и образования сшивок других белков. Это позволяет создавать клеи с уникальными свойствами, в том числе и такие, которые можно будет использовать в медицине, в частности в стоматологии.
Микробиологический синтез каучука
Натуральный каучук, цис-1,4-полиизопрен, – это широко используемый биополимер, который получают из различных растений. Его биосинтез начинается с превращения простых Сахаров и включает 17 ферментативных реакций. В ходе последней из них происходит полимеризация изопентенилпирофосфата с образованием аллилпирофосфата.
Ввиду большой коммерческой ценности каучука были проведены исследования, направленные на то, чтобы выяснить, можно ли использовать для его получения рекомбинантные микроорганизмы. Прежде всего с помощью мРНК из растения Hevea brasiliensis, синтезирующего каучук, была создана соответствующая кДНК-библиотека. Затем проведена гибридизация с коротким ДНК-зондом, синтезированным исходя из данных об аминокислотной последовательности одного из участков молекулы полимеразы каучука. Для того чтобы доказать, что клонированная кДНК действительно кодирует этот фермент, использовали антитела к очищенному ферменту. Теперь, используя этот клон кДНК, а также, возможно, другие гены биосинтеза каучука, можно попытаться синтезировать натуральный каучук микробиологическими методами. С другой стороны, с помощью этой кДНК можно также получить полимеразу каучука и создать каталитическую систему in vitro. В любом случае исследования, которые могли бы привести к разработке нового пути биосинтеза каучука, имеет смысл продолжить.
Микробиологический синтез полигидроксиалканоатов
Полигидроксиалканоаты – это биодеградируемые полимеры, синтезируемые множеством микроорганизмов (прежде всего Alcahgenes eutrophus) и использующиеся ими как внутриклеточный источник углерода и энергии. Они обладают разными свойствами в зависимости от состава и могут применяться для получения биодеградируемых пластмасс, используемых, например, для изготовления упаковочного материала. По оценкам, годовой объем продаж биодеградируемых пластмасс составляет примерно 1,3 млрд. долларов.
Из всех полигидроксиалканоатов наиболее полно изучена и охарактеризована поли(3-гидроксимасляная кислота). Это относится как к самому полимеру, так и к кодирующим его синтез генам A. eutrophus. Поли(3-гидроксимасляную кислоту), ее сополимер поли(3-гидроксибутират-со-3-гидроксивалерат) и другой полиоксиалканоат, поли(3-гидроксивалериановую кислоту), получают в Великобритании в промышленном масштабе ферментацией при участии A. eutrophus.
Однако этот микроорганизм растет относительно медленно и использует лишь ограниченное число источников углерода, что делает производство довольно дорогим. Можно использовать другой путь: при перенесении генов биосинтеза этого полимера в Е. coli получаются быстрорастущие трансформанты, накапливающие в большом количестве (до 95% сухой массы клетки) поли(3-гидроксимасляную кислоту). Поли(3-гидроксимасляная кислота) синтезируется из ацетил-СоА в три стадии, катализируемые тремя разными ферментами (рис. 12.22). Оперон, содержащий эти гены, был встроен в плазмиду в составе фрагмента длиной 5,2 т.п.н., однако в отсутствие селективного давления, например при росте в отсутствие антибиотиков, примерно половина клеток Е. coli теряла данную плазмиду уже после 50 генераций. Это не очень существенно, когда масштабы культивирования малы, но становится серьезной проблемой при крупномасштабной или непрерывной ферментации (см. гл. 16). Чтобы обойти эту трудность, в плазмиду, несущую оперон поли(3-гидроксимасляной кислоты), встроили локус рагВ из другой плазмиды, который обеспечивал стабилизацию плазмид, обусловливая гибель клеток, не содержащих плазмиды после сегрегации. Модифицированные плазмиды оставались стабильными даже при конститутивном синтезе поли(3-гидроксимасляной кислоты). Трансформанты Е. coli, синтезирующие данный продукт, образовывали лишь очень небольшое количество ацетата, гибельного для клеток, по-видимому, вследствие того, что весь избыточный ацетил-СоА превращался в поли(3-гидроксимасляную кислоту), а не в ацетат. Еще одно преимущество синтеза поли(3-гидроксимасляной кислоты) в Е. coli состоит в том, что когда ее экстрагируют щелочным раствором хлорноватистокислого натрия (калия), то она разлагается в меньшей степени, чем при экстракции из A. eutrophus. По-видимому, это связано с тем, что большая часть полимера, синтезируемого в Е. coli, находится в кристаллическом виде, в то время как в A. eutrophus – в аморфном. При этом полимеры, получаемые этими двумя способами, идентичны.
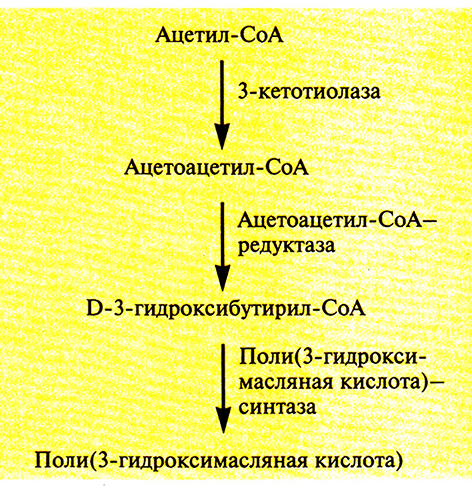
Рис. 12.22. Синтез поли(3-гидроксимасляной кислоты) из ацетил-СоА. Справа от стрелок указаны ферменты, катализирующие соответствующие реакции.
Поли(3-гидроксибутират-со-3-гидроксивалерат) аналогичен по своим свойствам широко использующемуся полипропилену, так что получение его микробиологическими методами может представлять коммерческий интерес. Однако штаммы Е. coli, в которых экспрессируются гены биосинтеза полимера, синтезируют только поли(3-гидроксимасляную кислоту), а не сополимер. Эту проблему можно решить, используя для экспрессии клетки Е. coli, несущие мутации в локусах fadR и ato С. fadR ответствен за негативную регуляцию биосинтеза жирных кислот, a atoC – за позитивную регуляцию их поглощения. Роль локуса fadR в индукции биосинтеза сополимера неясна, но продукт гена atoC влияет на синтез белков, кодируемых генами atoA и atoD и облегчающих поглощение бактериями пропионата из культуральной среды. Последний превращается в пропионил-СоА и затем реагирует с ацетил-СоА с образованием 3-кетовалерил-СоА, который в свою очередь может превращаться в 3-гидроксивалерил-СоА, включаемый в сополимер (рис. 12.23).
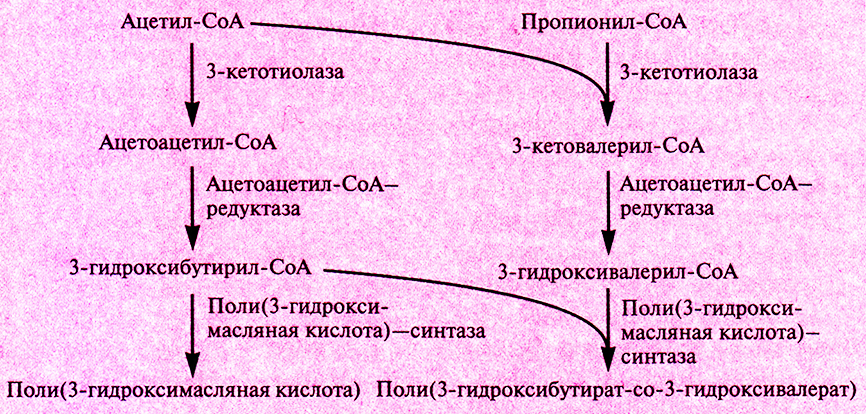
Рис. 12.23. Микробиологический синтез поли(3-гидроксибутирата-со-3-гидроксивалерата).
ЗАКЛЮЧЕНИЕ
Бактерии можно не только использовать как «фабрики» для синтеза белков типа рестриктаз, но и получать с их помощью новые продукты, изменяя метаболизм бактериальных клеток введением в них чужеродных генов или модификацией уже существующих. Можно создавать рекомбинантные микроорганизмы, способные синтезировать самые разные низкомолекулярные соединения: L-аскорбиновую кислоту, краситель индиго, аминокислоты, антибиотики, мономерные единицы различных биополимеров. Общая стратегия при этом состоит во введении в организм хозяина специфических генов, клонированных в подходящем векторе, которые кодируют один или несколько ферментов, катализирующих не свойственные микроорганизму метаболические реакции или влияющих на осуществляемый им в норме биосинтез определенных соединений. По имеющимся данным, создание новых метаболических путей не является технически неосуществимым. Этот подход поможет создать необычные, более эффективные пути синтеза самых разных соединений.

