Скорость роста и урожайность растений в естественных условиях зависят от их генотипа, доступности питательных веществ, наличия в почве полезных микроорганизмов и отсутствия патогенных (так называемых фитопатогенов, от phyto – растение). Одни виды полезных природных почвенных бактерий и грибов оказывают прямое действие, другие опосредованное. Первые поставляют растениям соединения, стимулирующие их рост, вторые подавляют размножение патогенных почвенных микроорганизмов, предотвращая их негативное влияние на растение.
К основным механизмам стимуляции роста растений микроорганизмами «прямого действия» относятся:
1) фиксация атмосферного азота, который затем используется растением;
2) образование легкоусваиваемых форм железа и фосфора и/или поглощение из почвы и доставка этих полезных минеральных веществ в растения;
3) синтез фитогормонов, вызывающих пролиферацию растительных клеток.
Опосредованная стимуляция роста растения каким-либо штаммом полезного микроорганизма проявляется через предотвращение роста фитопатогенного почвенного микроорганизма, который мог бы отрицательно влиять на нормальный рост и развитие растения. Такое действие называется антибиозом и может заключаться либо в истощении полезным микроорганизмом лимитирующего субстрата, либо в синтезе и секреции соединения, препятствующего росту фитопатогена.
Последние генетические эксперименты по созданию штаммов микроорганизмов, способных более эффективно стимулировать рост растений, были направлены в основном на решение следующих четырех проблем.
- Молекулярные механизмы фиксации азота. Цель всех исследований состояла в том, что бы оценить возможности повышения уровня фиксации азота микроорганизмами и, следовательно, снизить количество вносимых в почву химических удобрений.
- Образование корневых клубеньков симбиотическими бактериями. Целью этих исследований было создание рекомбинантных бактерий, способных конкурировать с природными симбиотическими бактериями.
- Микробиологический синтез веществ, хелатирующих железо (сидерофоров). Есть надежда, что удастся получить штаммы микроорганизмов, подавляющие рост фитопатогенов.
- Микробиологический синтез фитогормонов. Эти исследования проводились для того, чтобы создать штаммы бактерий, синтезирующие и секретирующие определенные количества фитогормонов, которые ускоряли бы рост растений.
Исследования в этой области проводятся главным образом на бактериях, а не на грибах. Отчасти это обусловлено тем, что полезные грибы не удается вырастить в культуре, поэтому с ними трудно работать в лабораторных условиях, а кроме того, невозможно получить эти организмы в количестве, достаточном для инокуляции.
ФИКСАЦИЯ АЗОТА
Азот (N2) – газ, на долю которого приходится примерно 80% (по объему) воздуха, которым мы дышим. Растения или животные не могут использовать его непосредственно для синтеза необходимых им биологических азотсодержащих соединений типа аминокислот и нуклеотидов; предварительно азот должен быть включен в состав аммиака (фиксирован). Это требует больших энергетических затрат, поскольку тройная связь в молекуле N2 (N = N), которую необходимо предварительно разорвать, чрезвычайно прочная. Энергия для биологической фиксации азота высвобождается при гидролизе больших количеств аденозинтрифосфата (АТР). Для химического (промышленного) превращения N2 в аммиак используют высокие температуру и давление
Для удовлетворения потребностей пищевой промышленности в сельскохозяйственной продукции ежегодно требуется более 100 млн. т связанного азота. Примерно половину этого количества составляют синтетические (химически синтезированные) удобрения, а большую часть второй половины растения получают от азотфиксирующих (диазотрофных) бактерий типа Rhizobium, Frankia, Azospirillum, Azotobacter и цианобактерий. Ни один из эукариотических организмов не способен связывать азот.
Благодаря применению химических удобрении удалось значительно повысить урожайность сельскохозяйственных культур, однако их продолжительное использование приводит к загрязнению почвы и истощению запасов в ней питательных веществ. К тому же химические удобрения становятся все более дорогими. Все это стимулировало поиск альтернативных источников связанного азота, в частности создание штаммов диазотрофных микроорганизмов, которые могли бы служить «бактериальными удобрениями».
Способностью к фиксации азота обладают самые разные бактерии, и многие из них в принципе могут использоваться как удобрения. Однако до тех пор, пока не будет показано, что бактериальные удобрения столь же эффективны, как и химические, вряд ли удастся преодолеть консерватизм производителей сельскохозяйственной продукции и изменить используемые в настоящее время подходы. Например, вторая по экономической значимости и по занимаемым площадям сельскохозяйственная культура в США – соя – формирует симбиотические отношения с бактерией Bradyrhizobium japonicum. В результате такого симбиоза бактерии обеспечивают растение связанным азотом, а сами получают от него легко усваиваемые формы углерода, образующиеся при фотосинтезе. После инокуляции растений некоторыми штаммами В. japonicum конечный выход растительной биомассы может возрасти на 25–50% и никаких добавок химически связанного азота больше не потребуется. Примерно 50% сои выращивается в нескольких регионах США, при этом везде используется в общем сходная технология. Но лишь небольшую часть этой культуры в настоящее время обрабатывают В. japonicum. Фермеры до сих пор полагаются на природные штаммы В. japonicum и химические удобрения.
Репутация бактериальных удобрений весьма сомнительна. В 1950-х годах в СССР более 10 млн. га сельскохозяйственных угодий обрабатывались смесью диазотрофных бактерий, состоящей в основном из Azotobacter chroococcum и Bacillus megaterium. При этом примерно в 60% случаев урожайность различных зерновых повысилась на 10–20%. Однако эти полевые испытания оказались некорректными и невоспроизводимыми; многие исследователи выразили сомнения в правильности полученных результатов, и использование бактериальных инокулятов в качестве удобрений не получило развития. Однако проблемы экономического характера, необходимость предотвращения загрязнения окружающей среды, появление новых технологий привели к тому, что ученые вновь обратились к изучению возможности использования бактериальных удобрений.
Микроорганизмы, которые применяются в настоящее время в сельском хозяйстве, принадлежат в основном к двум родам: Rhizobium и Bradyrhizobium. Это грамотрицательные палочкообразные жгутиковые бактерии, находящиеся в симбиозе с бобовыми. Каждый вид Rhizobium и Bradyrhizobium специфичен в отношении лишь небольшого числа видов растений и не взаимодействует с растениями, не являющимися его природными хозяевами (табл. 14.1).
Таблица 14.1. Специфичность видов Rhizobium
и Bradyrhizobium в отношении разных растений

На определенной стадии жизненного цикла Rhizobium проникает в клетки корня растения и инициирует комплекс изменений, приводящих к формированию корневою клубенька. Бактерии внутри корневого клубенька быстро пролиферируют и находятся в форме, не имеющей клеточной стенки. Клубеньковые бактерии связывают атмосферный азот с помощью фермента нитрогеназы. Структурные и биохимические взаимодействия между симбионтами – Rhizobium и растением-хозяином – весьма сложны и взаимовыгодны. Внутри клубенька нитрогеназа защищена от токсического действия атмосферного кислорода двумя способами. Во-первых, кислород практически не проникает в клубенек. Во-вторых, содержание кислорода внутри клубенька регулируется белком леггемоглобином. Гемовый компонент этого кислородсвязывающего белка синтезируется бактерией, а глобиновая часть молекулы кодируется геномом растения. Растение обеспечивает бактерии необходимыми для роста связанными формами углерода, образующимися при фотосинтезе, а растение извлекает выгоду из этих симбиотических отношений, получая от бактерии связанный азот.
НИТРОГЕНАЗА
Интерес к диазатрофам как к биологическим удобрениям возродился после того, как были разработаны методы выделения и модификации генов, и это стимулировало изучение биохимических и молекулярно-биологических механизмов фиксации азота. Ученые надеялись, что благодаря этим исследованиям удастся создать более эффективные азотфиксирующие микроорганизмы, способствующие повышению урожайности сельскохозяйственных культур, а некоторые исследователи даже предполагали ввести бактериальные гены фиксации азота непосредственно в растения, чтобы такие растения могли сами фиксировать азот. И хотя эти чересчур смелые планы не удалось осуществить, процесс фиксации азота был детально изучен, так что возможность генноинженерного усовершенствования некоторых диазотрофов стала более реальной.
Компоненты
Все известные нитрогеназы содержат два кислородчувствительных компонента: 1 и П. Компонент I – это комплекс из двух а-субъединиц (массой примерно 50 000 Да каждая), двух β-субъединиц (примерно 60 000 Да каждая), 24 молекул железа, двух молекул молибдена и железомолибденового кофактора, обозначаемого FeMoCo (рис. 14.1). Компонент II состоит из двух а-субъединиц (примерно 32 000 Да каждая) и из неизвестного числа молекул железа, причем его а-субъединицы не аналогичны таковым в компоненте I. Для фиксации азота необходимы оба компонента, комплекс магния и АТР, а также источник восстановительных эквивалентов:
N2 + 8Н+ + 8е– + 16MgATP → 2NH3 + H2 ↑ + 16MgADP + 16Рi. (1)
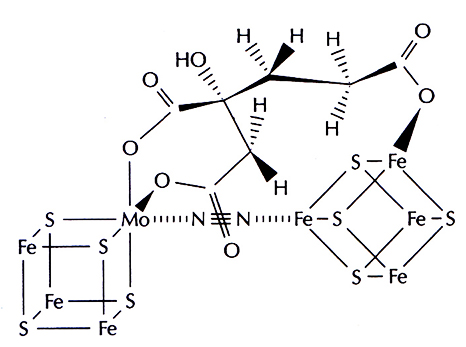
Рис. 14.1. Предполагаемая структура железомолибденового кофактора, связанного с молекулой азота (N2).
Помимо фиксации азота, нитрогеназа катализирует также восстановление газообразного ацетилена до этилена:
H–C=C–H + 2Н+ → Н2=С=С=Н2. (2)
Определяя с помощью газовой хроматографии количество синтезированного этилена, можно оценивать активность нитрогеназы. Определения можно проводить на целых клетках в растворе (рис. 14.2), на бактериях, ассоциированных с корнями растений, на грубых экстрактах клеток или на высокоочищенных препаратах фермента. Компонент I катализирует собственно восстановление N2, а компонент II служит донором электронов. Оба они чрезвычайно чувствительны к кислороду и при слишком высоких его концентрациях быстро и необратимо инактивируются. Функционирование нитрогеназы зависит также от 15–20 вспомогательных белков. Роль некоторых из них состоит в передаче электронов компоненту II, а также в биосинтезе железомолибденовото кофактора.
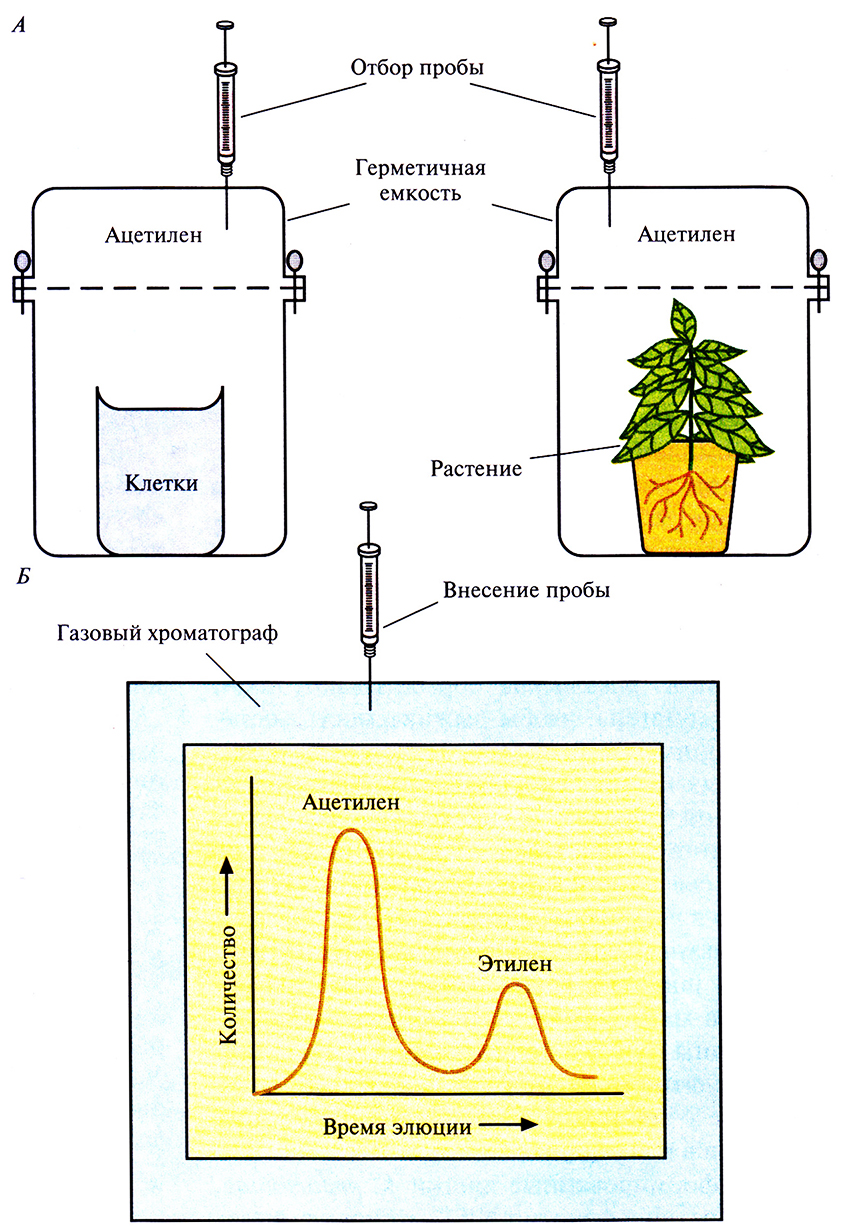
Рис. 14.2. Определение активности нитрогеназы по восстановлению ацетилена до этилена. А. Бактерии (в культуре или ассоциированные с корнями растения), синтезирующие нитрогеназу, либо препарат очищенного фермента (не показано) помещают в герметичную емкость в атмосферу ацетилена. Б. Из емкости периодически отбирают пробы и методом газовой хроматографии измеряют количество ацетилена и этилена. Активность нитрогеназы пропорциональна количеству образовавшегося этилена.
Генная инженерия кластера генов нитрогеназы
Фиксация азота – очень сложный процесс, требующий согласованного действия множества разных белков. Поэтому вряд ли можно было ожидать, что вся генетическая информация, необходимая для фиксации азота, будет содержаться в каком-то одном фрагменте ДНК и что этот фрагмент удастся вычленить из генома диазотрофного микроорганизма и перенести в недиазотрофный организм. Следует еще учесть, что физиологические условия в организме реципиента должны быть подходящими для функционирования активной нитрогеназы. Более приемлемый способ выделения генов азотфиксации (nif-генов) состоял в том, чтобы идентифицировать и охарактеризовать те клоны библиотеки ДНК дикого типа, которые восстанавливают способность различных мутантов данного микроорганизма фиксировать азот. Такой метод называется генетической комплементацией.
Первые nif-гены, идентифицированные методом комплементации, были выделены из банка клонов диазотрофной бактерии Klebsiella pneumoniae. Эта хорошо изученная энтеробактерия, которая обнаруживается в почве и воде, а также в кишечнике человека. Схема выделения состоит в следующем (рис. 14.3).
- Клетки К. pneumoniae обрабатывают такой дозой мутагена, чтобы выживаемость составила примерно 0,1–1,0%. Некоторые из мутантных клеток, способные расти на минимальной среде, содержащей источник связанного азота типа NH4C1, но не в отсутствие связанного азота, вероятно, несут мутацию в nif-гене; их обозначают Nif–
- Используя экспрессирующие плазмидные векторы с широким кругом хозяев, создают банк клонов хромосомной ДНК К. pneumoniae дикого типа (Nif+) и поддерживают его в Е. coli.
- Проводят конъюгацию Nif–-клеток К. pneumoniae с клетками Е. coli, несущими банк клонов в плазмидных векторах.
- Трансформированные клетки К. pneumoniae, приобретшие фенотип Nif+, отбирают, высевая их на минимальную среду, не содержащую источника связанного азота. В этих ус ловиях растут только Nif–-клетки К. pneumoniae с плазмидой, кодирующей белок, который отсутствует или не функционирует в Nif–-мутанте.
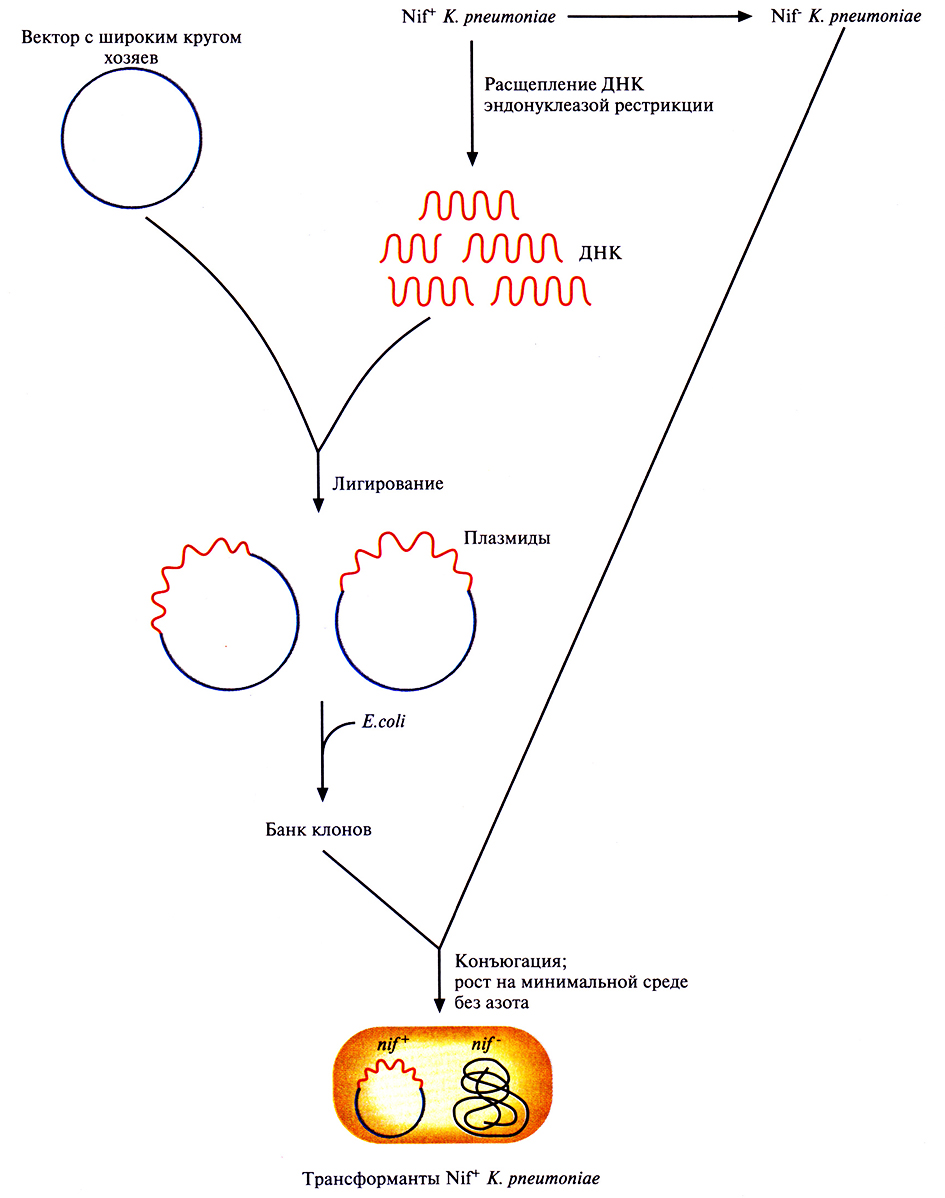
Рис. 14.3. Выделение nif-генов методом генетической комплементации. Для комплементации Nif–-штамма К. pneumoniae используется банк клонов ДНК Nif+-клеток. Трансформированные клетки отбирают по их способности расти на минимальной среде, не содержащей связанного азота.
Фрагмент ДНК в плазмиде, комплементирующий хромосомную мутацию Nif–, содержит nif-ген, который можно детально охарактеризовать и использовать для выделения других nif-генов.
Для выделения других генов, участвующих в фиксации азота, применяли два подхода. Во-первых, использовали банк клонов К. pneumoniae для комплементации независимо возникающих Nif–-мутантов, увеличивая тем самым вероятность того, что в каждом случае будет выделен другой nif-ген. Во-вторых, выделенные nif-гены использовали в качестве гибридизационных зондов для скрининга банка клонов хромосомной ДНК К. pneumoniae, несущих большие вставки (от 7 до 10 т. п. н.), исходя из того, что у прокариот гены одного пути биосинтеза обычно образуют кластеры.
В результате всесторонних исследований был идентифицирован и охарактеризован весь набор nif-генов К. pneumoniae. Эти гены организованы в один кластер длиной примерно 24 т. п. н. (рис. 14.4), который содержит семь отдельных оперонов, кодирующих в общей сложности 20 разных белков (табл. 14.2). Для того чтобы образовалась активная нитрогеназа, все nif-гены должны транскрибироваться и транслироваться одновременно (под регуляторным контролем nifA- и nifL-генов). Белок NifA – это активатор транскрипции всех nif-опсронов, кроме своего собственного. Он связывается со специфической последовательностью ДНК (5'-TGT-N10-ACA-3'), которая находится в каждом промоторе каждого nif-оперона. Сайт связывания белка NifA находится примерно в 80–150 нуклеотидах перед каждым сайтом инициации транскрипции. Перед началом транскрипции с nif-промотора связавшийся с ДНК белок NifA взаимодействует со специфическим белком инициации транскрипции σ54. Белок NifL – репрессор. В присутствии либо кислорода, либо связанного азота он действует как антагонист NifA и в результате ингибирует транскрипцию всех других nif-генов.
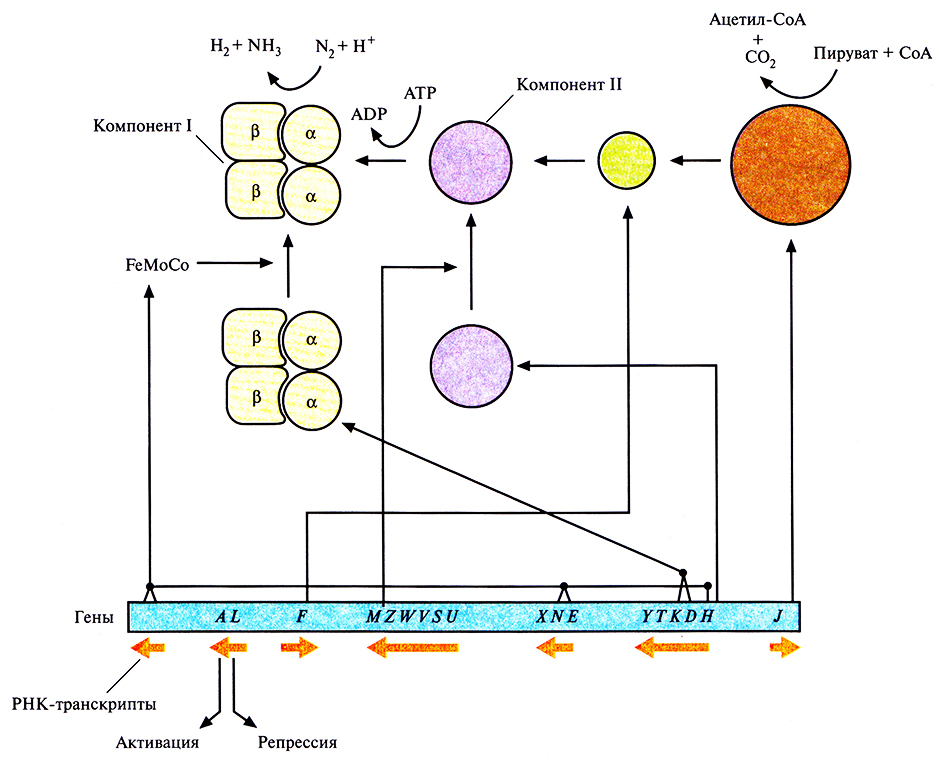
Рис. 14.4. Расположение nif-генов в кластере и некоторые кодируемые ими функции. Гены обозначены заглавными буквами: красная стрелка под каждой из групп этих букв обозначает специфический nif-оперон и указывает направление его транскрипции. Стрелки, отходящие от обозначений генов, показывают, какое участие в фиксации азота принимают продукты некоторых из этих генов. F – флаводоксин, FO – пируват: флаводоксин оксидоредуктаза.
Таблица 14.2. Гены К. pneumoniae, участвующие в фиксации азота,
и кодируемые ими белки (или функции)

Роль К. pneumoniae в общем биологическом процессе связывания азота не является основной. Поэтому в целях модификации процесса фиксации азота почвенными бактериями, представляющими большой интерес с точки зрения стимуляции роста растений, были клонированы и охарактеризованы nif-гены из других источников. При этом nif-гены К. pneumoniae использовались в качестве гибридизационных зондов для выделения соответствующих генов из банков клонов других диазотрофных микроорганизмов. Большинство диазотрофов имеет сходный набор генов, кодирующих аппарат фиксации азота, и последовательности ДНК этих генов у разных организмов мало различаются.
Принимая во внимание результаты молекулярно-генетических исследований, вероятно, можно повысить уровень фиксации азота диазотрофными бактериями, модифицируя nifА- и nifL-гены. После введения с помощью методов генной инженерии дополнительных копий nifA-гена в штамм Rhizobium meliloti растения люцерны, зараженные этим рекомбинантным штаммом, достигали больших размеров и давали больше биомассы, чем растения, обработанные нетрансформированным штаммом. По-видимому, аналогичным образом можно поступить с nifL-геном, так чтобы белок NifL (негативный регуляторный фактор) стал бы менее чувствительным к присутствию связанного азота. При таком нарушении регуляции микроорганизм поставлял бы больше азота своему симбиотическому партнеру. Однако имеющиеся данные указывают на то, что не все азотфиксирующие организмы синтезируют белок NifL (у некоторых из них существенные области NifL могут быть составной частью NifA), так что подобный подход не является универсальным. Кроме того, увеличение количества азота, которое может фиксировать микроорганизм, приводит к увеличению количества энергии (обычно в форме связанного углерода), необходимой для обеспечения метаболизма. Следовательно, рекомбинантный микроорганизм может оказаться неспособным стимулировать рост растения просто вследствие замедления своего роста.
Имея в виду всю сложность процесса фиксации азота микроорганизмами, можно сделать вывод, что простого введения в недиазотрофную клетку-реципиент одного или двух nif-генов недостаточно для того, чтобы она приобрела способность связывать азот. Более того, даже введение в геном растений полного кластера nif-генов длиной 24 т. п. н. не даст необходимого эффекта, поскольку при той концентрации кислорода, которая характерна для растительной клетки, нитрогеназа инактивируется. Если же концентрацию кислорода понизить, то растительная клетка вероятнее всего погибнет. Но в первую очередь попытки создания растительных клеток, способных связывать азот, требуют решения фундаментальных проблем транскрипции, трансляции и регуляции. Например, трудно представить, как будет осуществляться регуляция фиксации, поскольку у растений нет промоторов, с которыми связывался бы белок NifA. Следовательно, в таком трансгенном растении транскрипция nif-генов не будет инициироваться. Кроме того, чтобы реагировать на уровень связанного азота в клетке, все nif-гены должны находиться под контролем отдельных промоторов, поскольку растительные клетки неспособны процессировать мультигенные транскрипты. Учитывая все сказанное выше, приходится констатировать, что создание растений, способных фиксировать азот, вряд ли возможно.
ГИДРОГЕНАЗА
Нежелательная побочная реакция фиксации азота – восстановление нитрогеназой Н+ до Н2 (газообразный водород), в ходе которой энергия (в форме АТР) расходуется на образование водорода, который в конечном счете просто улетучивается. В результате только от 40 до 60% всего потока электронов, проходящих через нитрогеназный комплекс, передается на N2, что значительно уменьшает эффективность процесса фиксации азота. В принципе, если бы Н2 мог превратиться обратно в Н+, потери энергии были бы ниже, и процесс фиксации азота стал бы более эффективным. Устранить же эту побочную реакцию прямым путем невозможно, поскольку она обусловлена особенностями химического строения активного центра нитрогеназы, и если попытаться блокировать ее, изменив структуру фермента, то неизбежно произойдет и уменьшение активности нитрогеназы.
Метаболизм водорода
В середине 1970-х годов было показано, что некоторые штаммы Bradyrhizobium japonicum могут расти в микроаэрофильных условиях (при низкой концентрации кислорода), используя в качестве источника энергии водород. Для этого они синтезируют фермент гидрогеназу, способную превращать атмосферный Н2 в Н+ (рис. 14.5). Чтобы проверить, можно ли с помощью этих штаммов влиять на рост сои, растения инфицировали В. japonicum, синтезирующими гидрогеназу (Нuр+). Растения давали большую биомассу и усваивали больше азота, чем те, которые были заражены Hup– -штаммами, даже несмотря на более высокий уровень нитрогеназной активности последних (табл. 14.3). По результатам этого и аналогичных экспериментов был сделан вывод, что наличие системы ассимиляции водорода у симбиотических диазотрофов типа В. japonicum повышает их способность стимулировать рост растений, по-видимому, в результате связывания и рециркуляции газообразного водорода, образующегося в клубеньках при участии нитрогеназы (рис. 14.5).
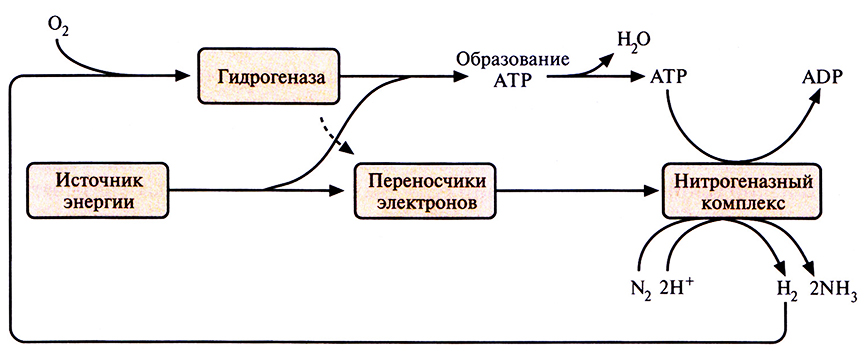
Рис. 14.5. Рециркуляция газообразного водорода – побочного продукта фиксации азота. Нитрогеназа катализирует образование водорода, используя энергию гидролиза АТР, а гидрогеназа катализирует его утилизацию.
Таблица 14.3. Относительная активность нитрогеназы и гидрогеназы и способность В. japonicum Hup+ (SR)
и трех Нuр–-мутантов (SR1, SR2 и SR3) стимулировать рост растений1), 2)

Несмотря на выгоды, которые получает растение от симбиоза с диазотрофным микроорганизмом, обладающим системой повторного использования водорода, в природных условиях такая система при участии штаммов Rhizobium встречается редко. Согласно результатам тестирования, представленным в табл. 14.4, большинство рассмотренных природных штаммов Rhizobium и Bradyrhizobium имеют фенотип Hup–. Было провереь о по несколько штаммов каждого из указанных видов, а для В japonicum их было более 1400. Ясно, что как только удастся достаточно подробно изучить генетическую природу гидрогеназной системы и идентифицировать соответствующие гены, коммерческие Hup -штаммы Rhizobium будут первыми кандидатами на превращение в штаммы с фенотипом Нuр+.
Таблица 14.4. Доля природных штаммов Rhizobium и Bradyrhizobium,
у которых есть система ассимиляции водорода (Hup+)1)

Модификация генов гидрогеназ
На изучение гидрогеназ как диазотрофных, так и недиазотрофных микроорганизмов в последние 20 лет было затрачено много усилий, и тем не менее строение и функции этих ферментов до конца не установлены. Многие микроорганизмы синтезируют более одной гидрогеназы, при этом часто они состоят больше чем из одной полипептидной цепи. Одни гидрогеназы только связывают атмосферный водород, в то время как другие при соответствующих условиях могут также синтезировать его. Из всего этого следует, что вряд ли для преобразования штамма Hup– Rhizobium в Нuр+ будет достаточно простого включения в его геном гена одной из гидрогеназ. Включенный ген(ы) должен кодировать все субъединицы фермента, который должен быть совместим с электронтранспортной системой организма-хозяина.
Наиболее распространенная стратегия выделения генов гидрогеназ – генетическая комплементация. Первый из таких генов, ген мембраносвязанной гидрогеназы Е. coli, был идентифицирован методом комплементации у мутантной Е. coli, неспособной синтезировать активную гидрогеназу, с использованием банка клонов ДНК Е. coli дикого типа, созданного с помощью плазмиды pBR322. Мутант, содержащий дефектную мембраносвязанную гидрогеназу, не рос на минимальной среде в присутствии формиата, при этом активность эндоплазматической гидрогеназы оставалась неизменной. Трансформированные клетки, способные расти на такой среде, проверяли на присутствие в них активной гидрогеназы. Трансформант, у которого активность гидрогеназы восстановилась до такого же уровня, как у штамма дикого типа, содержал плазмиду, кодирующую белок мол. массой примерно 60 000 Да, что соответствует мол. массе одной из субъединиц мембраносвязанной гидрогеназы Е. coli. Дальнейшие исследования показали, что в гидрогеназную систему Е. coli входит множество генов.
Затем были идентифицированы гидрогеназные гены (hup) В. Japonicum; для этого использовался банк клонов ДНК дикого типа, созданный с помощью космидного вектора pLAFRl с широким кругом хозяев, и мутанты Hup– В. japonicum. Присутствие гидрогеназы, связывающей атмосферный водород, в трансформированных мутантных клетках Hup– определяли по способности активного фермента восстанавливать метиленовый синий в атмосфере водорода. Более детальное исследование показало, что hup-гены В. japonicum образуют по крайней мере два, а возможно, и три оперона, охватывающих примерно 15 т.п.н., причем hup-гены Rhizobium leguminosarum аналогичны таковым В. japonicum как в отношении нуклеотидной последовательности, так и в том, что касается организации генов. Таким образом, идентифицированные hup-гены В. japonicum можо использовать в качестве гибридизационных зондов для поиска гомологичных генов из банка клонов R. leguminosarum.
После идентификации hup-генов R. leguminosarum, несмотря на всю сложность гидрогеназной системы, удалось «переместить» ее из Нuр+-штамма R. leguminosarum в штамм Нuр– (табл. 14.5). Растения бобов, на которых образовывали клубеньки бактерии рекомбинантного Нuр+-штамма R. leguminosarum, росли быстрее и содержали больше азота, чем растения, инокулированные Нuр–-штаммом (табл. 14.5).
Таблица 14.5. Рост растений и ассимиляция азота после введения генов hup в Hup– -штамм R. Leguminosarum1)

Работы по исследованию генов гидрогеназ не вызвали столь большого интереса, как исследования nif-генов, и тем не менее они убедительно продемонстрировали целесообразность применения методов генной инженерии для повышения способности диазотрофных микроорганизмов стимулировать рост растений. Теперь нужно проверить, приведет ли введение hup-генов в геномы других диазотрофных микроорганизмов (как несимбиотических, так и симбио тических) к такому же эффекту.
Гидрогеназная система может применяться не только для повышения эффективности фиксации азота. Так, очищенную гидрогеназу можно использовать для преобразования и запасания солнечной энергии; регенерации кофакторов, принимающих участие в промышленных ферментативных процессах; синтеза специфических химических соединений, требующего участия Н2 в качестве восстановителя; для удаления трития из воды, которая использовалась для охлаждения реакторов атомных электростанций; для синтеза Н2 из органических отходов; получения водород но-кислородных топливных ячеек. Однако, несмотря на то что уже идентифицировано и охарактеризовано более дюжины генов гидрогеназ, пока ни один из них не использовался для крупномасштабного синтеза этих ферментов.
ОБРАЗОВАНИЕ КЛУБЕНЬКОВ
Конкуренция среди организмов, образующих клубеньки
Одна из основных задач сельскохозяйственной биотехнологии – создание с помощью методов генной инженерии штаммов Rhizobium, которые повышали бы урожайность растений более эффективно, чем природные штаммы. Многие имеющиеся на рынке штаммы-инокуляты – превосходные азотфиксаторы – были созданы путем мутагенеза и последующего отбора, однако они в недостаточной степени стимулируют образование клубеньков на корнях растения-хозяина в условиях конкуренции с природными штаммами Rhizobium, уже присутствующими в почве. И наоборот, многие природные штаммы с успехом выдерживают конкуренцию с лабораторными штаммами, но малоэффективны в отношении фиксации азота. Таким образом, для того чтобы можно было реально использовать имеющиеся на рынке инокулирующие штаммы, необходимо либо повысить их способность образовывать клубеньки, либо устранить природные штаммы Rhizobium.
Были проведены исследования, направленные на определение генетической основы «конкурентоспособности» природных штаммов, с тем чтобы затем попытаться ввести соответствующие гены в штаммы-инокуляты.
Манипуляции с генами образования клубеньков
Для идентификации генов образования клубеньков (nod-генов) вновь использовали генетическую комплементацию. Не способный образовывать клубеньки (Nod–) мутантный штамм R. meliloti трансформировали банком клонов хромосомной ДНК R. meliloti дикого типа и выделяли колонии, приобретшие способность образовывать клубеньки на корнях люцерны (рис. 14.6). Стратегия заключалась в следующем.
1. С помощью частичного гидролиза ДНК R. meliloti рестриктазой EcoRI и встраивания фрагментов длиной до 40 т. п. н. в уникальный EcoRI-сайт космиды pLAFRl с широким кругом хозяев был создан банк клонов хромосомной ДНК R. meliloti дикого типа (Nod+).
2. Рекомбинантные плазмиды упаковали в частицы фага λ, ввели в Е. coli, а затем перенесли в клетки Nod–-штамма R. meliloti при помощи конъюгации. Вектор содержал ген устойчивости к тетрациклину, который можно было использовать как селективный маркер и в случае Е. coli, и в случае R. meliloti.
3. После конъюгации суспензии, содержащие от 200 до 300 трансформированных клеток R. meliloti, проверяли на способность инициировать образование клубеньков у стерильных растений люцерны. Ожидалось, что этой способностью будут обладать только трансформанты, которые несут и экспрессируют ген, комплементирующий дефект образования клубеньков в клетках R, meliloti.
4. Из клубеньков выделили бактерии, вызывающие образование клубеньков, а из бактерий – вектор, несущий комплементирующий ген. Содержащую этот ген большую вставку переклонировали и провели дальнейший анализ.
5. Идентифицированный ген образования клубеньков использовали в качестве зонда для обнаружения фланкирующих его участков хромосомной ДНК R. meliloti в геномной библиотеке.
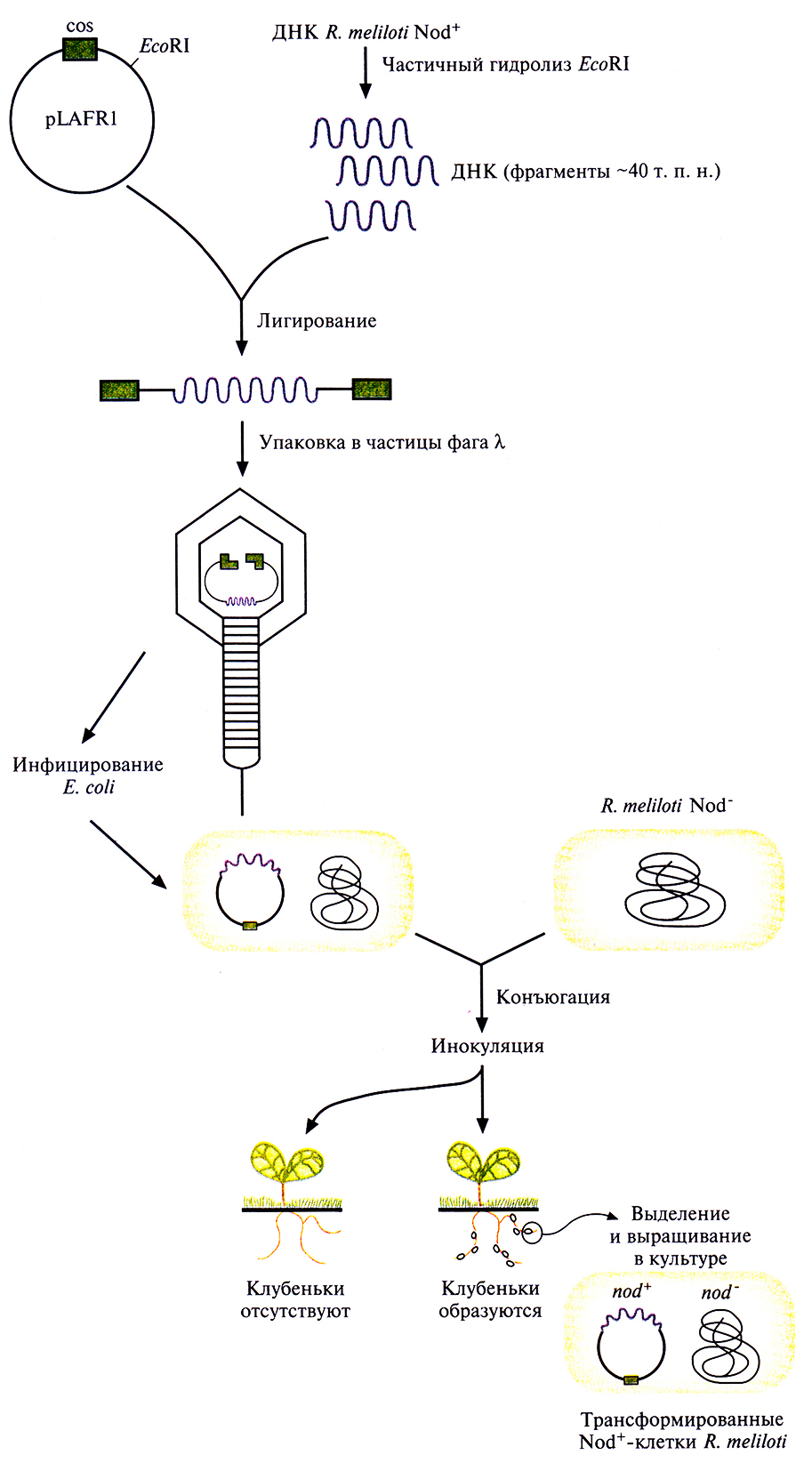
Рис. 14.6. Идентификация генов образования клубеньков R. meliloti. ДНК R. meliloti дикого типа встраивают в космиду pLAFRl с широким кругом хозяев, упаковывают в частицы фага А. и вводят в Е. coli. Банк клонов переносят из Е. coli в Nod– -штамм R. meliloti при помощи конъюгации. Растения люцерны инокулируют трансформированными R. meliloti Nod–; растения, образующие корневые клубеньки, инфицированы R. meliloti Nod+, клетки которых, по-видимому, несут комплементирующий ген образования клубеньков в составе космидного вектора. Из корневых клубеньков выделяют трансформированные Nod+-клетки R. meliloti.
В результате этих весьма трудоемких экспериментов удалось охарактеризовать весь набор генов образования клубеньков R. meliloti. Детальные биохимические и генетические исследования показали, что образование клубеньков и его регуляция – это сложные процессы, в которых задействованы продукты большого количества генов (примерно 20; табл. 14.6). Одни из этих генов высококонсервативны (одинаковы у всех микроорганизмов, образующих клубеньки), другие видоспецифичны. Их можно сгруппировать в три отдельных класса: консервативные, видоспецифичные и регуляторный ген nodD. Так, nodABC-тены одинаковы у всех видов Rhizobium и структурно взаимозаменяемы; у большинства видов они образуют один оперон.
Таблица 14.6. Некоторые белки, кодируемые генами образования клубеньков Rhizobium, и их возможные функции

Установлено, что процесс образования клубеньков включает несколько этапов. Сначала продукт конститутивно экспрессирующегося гена nodD связывается с молекулой флавоноида, секретируемого клетками корней растения-хозяина. Флавоноиды – это растительные фенольные соединения, структурную основу которых составляют два ароматических кольца, соединенных друг с другом трехуглеродным мостиком. Они выполняют в растениях разные функции, в частности отвечают за их пигментацию и участвуют в защите от грибов и насекомых. Связывание флавоноидов с белком NodD – один из ключевых моментов идентификации растения-хозяина, поскольку каждый вид Rhizobium узнает ограниченное число флавоноидных структур, а каждая разновидность растений синтезирует свой специфический набор этих молекул. Одни штаммы, например R. leguminosarum biovar (bv.) trifolii, имеют очень узкий круг хозяев, поскольку узнают только несколько видов флавоноидов, а у других штаммов, например у NGR234 Rhizobium sp., круг хозяев очень широк.
Присоединение молекул флавоноида активирует белковый продукт NodD, по-видимому, вызывая его конформационное изменение. Далее комплекс флавоноид–NodD связывается с промоторным участком генов образования клубеньков, называемым nod-блоком. Этот участок расположен перед всеми генами образования клубеньков, кроме гена nodD, и запускает их транскрипцию.
Гены nodABC кодируют белки, которые вызывают набухание и скручивание корневых волосков, что считается первым шагом инфицирования корня растения бактерией. Вместе растение и бактерии синтезируют некий олигосахаридный фактор, который модифицируется генным продуктом NodH, а возможно, и продуктами NodQ и NodP. Этот фактор, обозначаемый NodRm-1 (рис. 14.7), обусловливает специфический ответ растения-хозяина, в том числе скручивание и деформацию корня.
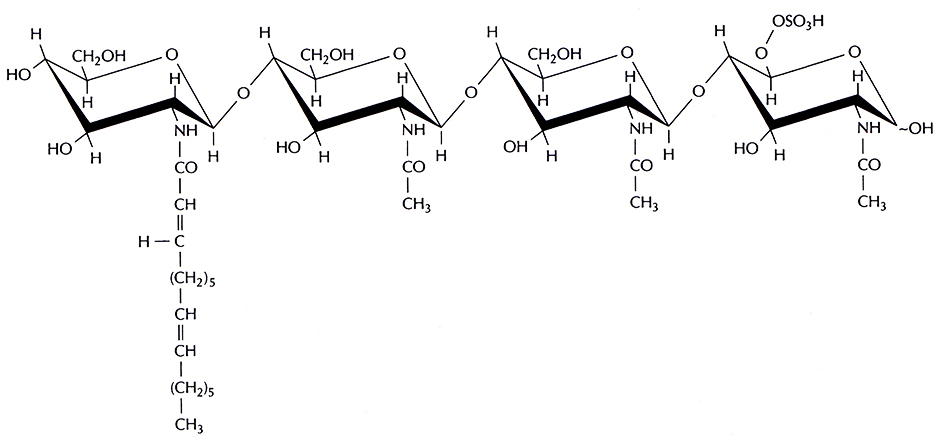
Рис. 14.7. Предполагаемая структура олигосахаридного фактора NodRm-1. Это соединение обусловливает специфический ответ растения-хозяина, в том числе скручивание и деформацию корня.
В зависимости от штамма Rhizobium или Bradyrhizobium, в конце концов синтезируется примерно 20 дополнительных продуктов nod-генов. Вместе с некоторыми белками, кодируемыми растениями, они участвуют в формировании клубенька.
Чтобы выяснить роль каждого из идентифицированных nod-генов, необходимо провести дополнительные исследования; кроме того, не исключено, что со временем обнаружатся новые nod-гены. Например, секвенирование ДНК и компьютерный анализ показали, что у медленнорастущей формы Bradyrhizobium sp. область ДНК между nodD- и nodАВС-генам и содержит открытую рамку считывания, а у быстрорастущей формы этой последовательности нет. Открытую рамку считывания обозначили nodK. При инокуляции растений штаммом Bradyrhizobium sp. с мутантным nodK-геном (NodK–) клубеньки на них начинают образовываться на 5 дней раньше, чем у растений, зараженных штаммом дикого типа; при этом число клубеньков удваивается, а урожайность растений увеличивается на 120%.
К настоящему времени не удалось разработать простых генетических подходов, которые позволяли бы использовать nod-гены для повышения конкурентоспособности инокулирующих штаммов Rhizobium. Впрочем, можно изменить видоспецифичность бактерий путем переноса nodD-гена из штамма Rhizobium с широкой специфичностью в один из штаммов с узкой специфичностью. Так или иначе, ясно, что образование клубеньков – весьма сложный процесс, и для дальнейшего увеличения конкурентоспособности штаммов Rhizobium потребуются всесторонние исследования с использованием методов генной инженерии.
ВАЖНАЯ ВЕХА
Идентификации генов образования клубеньков Rhizobium meliloti путем прямой комплементации Nоd_-мутантов
S. R. Long, W. J. Buikema, F. M. Ausubel Nature 298: 485-488, 1982
Идентификация гена в отсутствие гетерологичного зонда или какой-либо информации об этом гене – задача не из легких. В таких случаях часто приходится разрабатывать принципиально новую схему отбора. В ее основе может лежать иммунологическая идентификация искомого белка, определение его активности, ДНК-гибрилзация с олигонуклеотидным зондом, нуклеотидная последовательность которого была определена исходя из данных о частично секвенированной аминокислотной последовательности очищенного искомого белка, или комплементация мутантов. Очень часто после идентификации гена, кодирующего определенную функцию, можно выделить аналогичные гены из других организмов, используя первый выделенный ген в качестве гетерологичного зонда для ДНК-гибридизации. Результативность данного подхода зависит от близости нуклеотидных последовательностей зонда и искомого гена. Эта стратегия оправдывает себя в случае консервативных в эволюционном плане генов, например генов, кодирующих белки, которые участвуют в фиксации азота, но в большинстве случаев она малопригодна.
Когда Лонг и др. решили идентифицировать гены образования клубеньков из Rhizobium meliloti, ни одного подобного гена охарактеризовано не было. Практически ничего не было известно о том, каким образом множество генов участвуют в этом процессе или какие белки они кодируют. Прежде чем идентифицировать гены образования клубеньков, эти ученые выделили и охарактеризовали несколько мутантов R. meliloti, не способных образовывать клубеньки. Однако эти эксперименты не дали исследователям ключ к объяснению функций указанных генов. Поэтому они попытались отобрать гены образования клубеньков, способные комплементировать полученных ими мутантов R. meliloti. Работа осложнялась еще и тем, что в то время банки клонов почти всегда создавали и поддерживали в Е. coli. Для создания банка клонов R. meliloti и его дальнейшего переноса в мутантные штаммы R. meliloti, не способные образовывать клубеньки, исследователи для начала создали космидный вектор с широким кругом хозяев, в который можно было встраивать длинные фрагменты ДНК (примерно 23 т. п. н.), стабильно поддерживающиеся в некоторых грамотрицательных бактериях. Благодаря большому размеру вставки увеличивалась вероятность того, что другие гены, участвующие в образовании клубеньков, будут находиться в одном фрагменте с комплементирующей последовательностью ДНК. После переноса космид при помощи конъюгации в R. meliloti трансформированные бактерии проверяли на способность вызывать образование клубеньков у люцерны. Проведенные ранее эксперименты показали, что даже одна бактерия, способная образовывать клубеньки, на фоне 104 «дефектных» бактерий может вызвать образование клубеньков у растений люцерны. Бактерии с космидами, содержащими комплементирующую последовательность, выделяли непосредственно из клубеньков.
Так были впервые идентифицированы гены образования клубеньков и разработана четкая и эффективная схема отбора. Сконструированный Лонгом и др. космидный вектор с широким кругом хозяев в дальнейшем неоднократно использовался в других работах.
БИОКСНТРОЛЬ ПАТОГЕННЫХ МИКРООРГАНИЗМОВ
Бактерии, стимулирующие рост растений, могут оказывать свое действие прямо или косвенно. Прямая стимуляция обычно состоит в поставке растению какого-либо соединения, синтезируемого бактерией (это может быть, например, связанный азот), или растительного гормона. Кроме того, бактерии могут облегчать поглощение растением из окружающей среды некоторых веществ, например железа или фосфора. Косвенная стимуляция заключается в том, что бактерии уменьшают или предотвращают вредное влияние одного или нескольких фитопатогенных организмов – грибов или бактерий. Фитопатогены могут уменьшать урожайность сельскохозяйственных культур на 25–100%, что наносит огромный ушерб. Обычно для борьбы с ними используют химикаты. К сожалению, в большинстве случаев симптомы заболеваний у растений не проявляются достаточно долго, до тех пор, пока изменения в окружающей среде не вызовут пролиферацию бактерий и не приведут к быстрому развитию болезни и к уничтожению всего урожая. Контроль таких обширных эпидемий трудноосушествим и требует больших денежных затрат.
Многие химикаты, использующиеся для борьбы с фитопатогенами, представляют опасность для животных и человека; они накапливаются в природных экосистемах и долго сохраняются в них. Поэтому было бы целесообразно заменить химические способы подавления патогенных микроорганизмов биологическими, более «благоприятными» для среды. Один из биологических подходов к контролю фитопатогенов заключается в создании трансгенных растений, устойчивых к одному или нескольким патогенным микроорганизмам (этот подход обсуждается в гл. 18). Были также предприняты попытки использовать в качестве инструмента биоконтроля бактерии, стимулирующие рост растений. Такие бактерии синтезируют соединения, которые можно использовать для уменьшения ущерба, наносимого растениям фитопатогенами. В их числе – сидерофоры и антибиотики, а также различные ферменты. Впрочем, несмотря на всю перспективность этого подхода, почти все исследования пока проводились в лабораторных условиях, ростовых камерах или в оранжереях. Окончательный же вывод о пользе той или иной стратегии, основанной на использовании какого-то конкретного механизма, можно будет сделать только после полевых испытаний.
Сидерофоры
Железо – один из наиболее распространенных на Земле элементов, абсолютно необходимых живым организмам. Однако в той форме, в какой железо присутствует в почве, оно не может прямо использоваться микроорганизмами. Дело в том, что его преобладающей природной формой являются трехвалентные ионы. Их растворимость очень мала – при рН 7,4 она равна примерно 10–18 М, и этого количества абсолютно недостаточно для поддержания роста микроорганизмов. Чтобы выжить в таких условиях, почвенные микроорганизмы синтезируют и секретируют небольшие низкомолекулярные железосвязывающие соединения мол. массой примерно 400–1000 Да, известные под названием сидерофоров (рис. 14.8). Они эффективно связывают Fe(III) и транспортируют его к клеткам микроорганизмов, где оно связывается с клеточными рецепторами и попадает внутрь клеток. Здесь железо высвобождается и может использоваться микроорган измом.
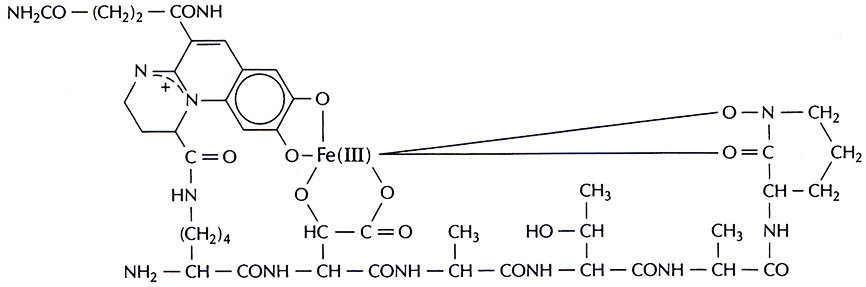
Рис. 14.8. Структура сидерофора псевдобактина, продуцируемого штаммом Pseudomonas В10. С одной молекулой сидерофора связан один ион Fe(III).
Бактерии, стимулирующие рост растений, подавляют пролиферацию фитопатогенных грибов, синтезируя сидерофоры, которые связывают большую часть Fe(III), находящегося в слое почвы, непосредственно прилегающем к корню растения (в ризосфере). Фитопатогенные грибы тоже синтезируют сидерофоры, но они обычно обладают более низким сродством к железу, чем сидерофоры, синтезируемые стимулирующими рост растений бактериями. Это позволяет последним одерживать верх в конкурентной борьбе с фитопатогенными грибами за имеющееся железо.
В отличие от фитопатогенных микроорганизмов, растения, как правило, не страдают от локального истощения железа в почве в результате поглощения его бактериями, стимулирующими рост растений. Большинство растений могут расти при значительно меньших концентрациях железа, чем микроорганизмы. Кроме того, есть данные, что железо, связанное бактериальными сидерофорами, может ассимилироваться растениями и использоваться ими для своих нужд.
Поскольку связывание железа бактериальными сидерофорами может одновременно приводить к подавлению пролиферации самыхразных фитопатогенных микроорганизмов, исследуется возможность использования их для создания более эффективных систем биоконтроля.
Многие стимулирующие рост растений флуоресцирующие псевдомонады секретируют сидерофор, представляющий собой линейный гексапептид, который состоит из чередующихся L- и D-аминокислот и связанного флуоресцентного хромофора (рис. 14.8). Один из таких сидерофоров, так называемый псевдобактин, обладает сродством к Fe(III) = 1025 л • моль–1. Сходные сидерофоры синтезируют все флуоресцирующие псевдомонады.
Предприняты также первые попытки исследовать синтез псевдобактина у стимулирующей рост растений бактерии Pseudomonas putida WCS358. С помощью мутагенеза были получены 28 мутантов этого микроорганизма, не способных синтезировать сидерофор. Их отбор осуществляли по: 1) отсутствию флуоресценции в УФ-свете; 2) неспособности к росту в присутствии дипиридила – вещества, связывающего большую часть железа в культуральной среде. При очень малых концентрациях ионов железа растут только те клетки, которые синтезируют сидерофоры. Был создан банк клонов ДНК P. putida WCS358 с помощью космидного вектора pLAFRl с широким кругом хозяев и путем конъюгации осуществлена трансформация всех 28 мутантных форм. Трансформанты были проверены на способность к флуоресценции в УФ-свете и/или способность к росту в присутствии дипиридила. Идентифицированы тринадцать разных комплементирующих космидных клонов со средним размером вставки 26 т. п. н. Детальные исследования показали, что эти клоны соответствуют по крайней мере пяти отдельным кластерам генов.
Один из этих кластеров был исследован более детально. Его минимальная длина составила примерно 33,5 т. п. н., он содержал пять оперонов по крайней мере с семью отдельными генами. Таким образом, как и фиксация азота и образование клубеньков, биосинтез сидерофоров – это сложный процесс. Поскольку каждый сидерофор кодируется несколькими генами, получение рекомбинантных бактерий, способных синтезировать модифицированный сидерофор, – задача не из легких. К счастью, есть другие способы повысить эффективность использования бактерий, стимулирующих рост растений, в качестве инструмента биоконтроля. Например, можно расширить круг узнаваемых одним бактериальным штаммом комплексов железо–сидерофор, так чтобы один рекомбинантный штамм мог узнавать и использовать сидерофоры, синтезируемые другими почвенными микроорганизмами, повышая тем самым свою конкурентоспособность. Для этого были клонированы гены рецепторов комплекса железо–сидерофор одной из бактерий, стимулирующих рост растений, и введены в другие штаммы.
Антибиотики
Один из наиболее эффективных механизмов, которые используют стимулирующие рост растений бактерии для подавления пролиферациифитопатогенов, – синтез антибиотиков. Так, псевдомонады, использующиеся для биоконтроля, синтезируют такие антибиотики, как агроцин 84, агроцин 434, 2,4-диацетилфлороглюцинол, гербиколин, оомицин, феназины, пиолутеорин и пирролнитрин.
Способность бактерий, стимулирующих рост растений, подавлять пролиферацию фитопатогенов можно повысить, если ввести в эти бактерии гены, кодирующие биосинтез антибиотиков, которые обычно синтезируются другими бактериями. Это позволит расширить спектр фитопатогенов, рост которых способна подавлять одна бактерия. Более того, ограничивая размножение других почвенных микроорганизмов, секретирующие антибиотик бактерии, стимулирующие рост растений, облегчают свою собственную пролиферацию, поскольку уменьшается число конкурентов за ограниченные пищевые ресурсы, а с помощью методов генной инженерии со временем удастся увеличить выход бактериальных антибиотиков.
Синтез большинства противогрибковых метаболитов, продуцируемых псевдомонадами, по-видимому, контролируется белком, который действует как общий регулятор транскрипции; следовательно, уровень синтеза антибиотика можно повысить изменением общей регуляции. Например, в случае Pseudomonas fluorescens СНАО его удалось повысить с помощью трансформации микроорганизма вектором, несущим ген «домашнего хозяйства» rpoD, который кодирует о70-субъединицу РНК-полимеразы. Рекомбинантный штамм лучше защищал корни растений огурца от повреждений, вызываемых грибом Pythlum ultimum (табл. 14.7). В другом исследовании синтез антибиотика пиолутеорина тем же микроорганизмом стимулировали инактивацией генов pqq, участвующих в биосинтезе пирролхинолинхинона – кофактора различных гидрогеназ. Механизм такой стимуляции до конца не установлен; возможно, в результате мутации поток метаболитов от других реакций биосинтеза переключается на биосинтез пиолутеорина.
Таблица 14.7. Влияние дополнительных копий rpoD-гена Pseudomonas fluorescens СНА0
на способность этой бактерии защищать корни растений огурца
от повреждений, вызываемых патогенным грибом Pythium ultimum 1)

В настоящее время на рынке имеется только один рекомбинантный микроорганизм, использующийся для биоконтроля: Agrobacterium radiobacter К84. Этот штамм продается в Австралии начиная с 1989 г. как средство борьбы с корончатым галлом – болезнью, которую вызывает Agrobacterium tumefaciens. Заболеванию подвержены миндаль и косточковые плодовые деревья, такие как персики. A. radiobacter синтезирует антибиотик агроцин 84, токсичный для A. tumefaciens. Однако при случайном попадании в него плазмиды от A. radiobacter, содержащей гены биосинтеза агроцина 84, могут возникнуть агроцинустойчивые штаммы A. tumefaciens. Чтобы избежать этого, из плазмиды pAgK84, несущей гены биосинтеза агроцина 84, был удален участок, ответственный за перенос плазмиды (рис. 14.9). В результате штамм A. radiobacter больше не мог передавать рекомбинантную агроциновую плазмиду патогенным агробактериям, но сохранял способность к биоконтролю.
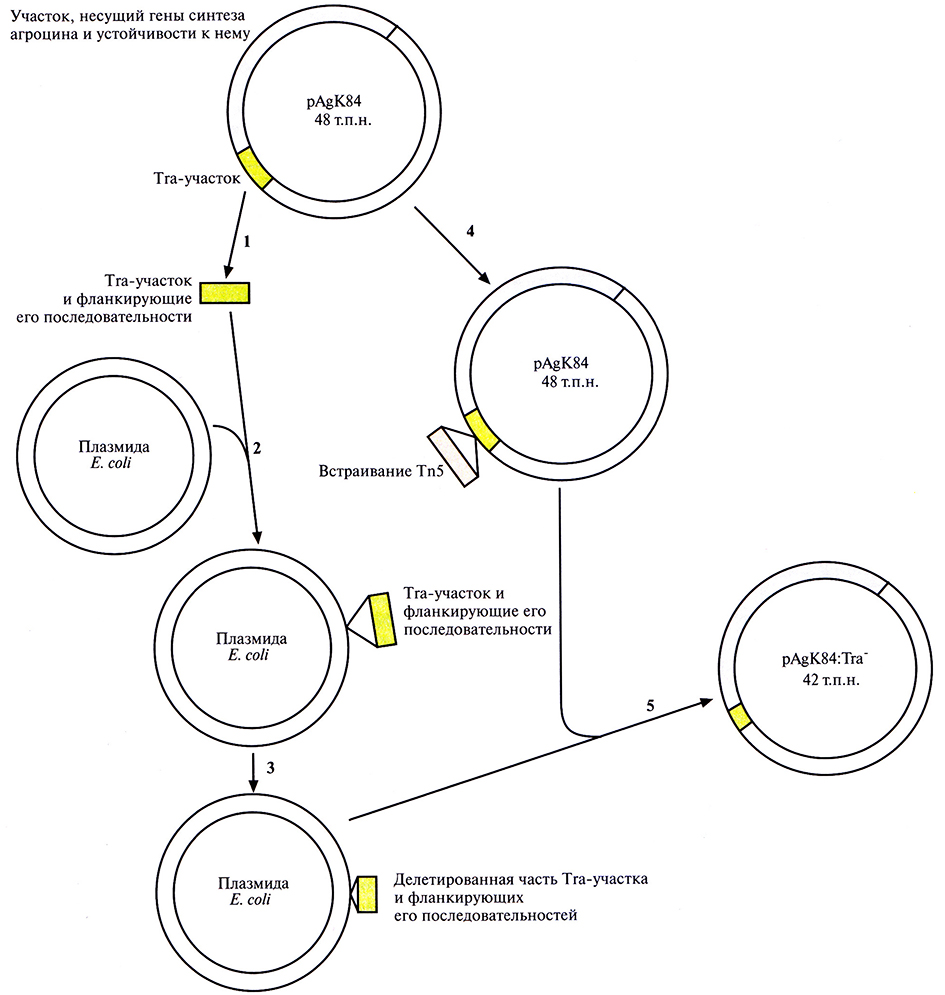
Рис. 14.9. Конструирование неспособной к переносу (Тra–) модификации плазмиды pAgK84 A. radiobacter, кодирующей гены биосинтеза агроцина 84 и гены устойчивости к нему. Используя рестрикционную карту pAgK84, из плазмиды вырезали (1) фрагмент, который содержал участок Тга, ответственный за перенос, вместе с фланкирующими его последовательностями, и встроили его в плазмиду Е. coli (2). С помошью рестриктазной обработки из клонированного фрагмента удалили примерно 80% Тга-участка и часть фланкирующих его последовательностей (в сумме примерно 6 т.п.н.) (3). Осуществили гомологичную рекомбинацию между плазмидой Е. coli, содержащей «урезанный» Тrа-участок, и плазмидой pAgK84, которая содержала встроенный в Тга-участок транспозон Тп5 с геном устойчивости к канамицину (4). Получили несколько производных плазмиды pAgK84 с частично удаленным Тга-участком (5). Тrа–-плазмида pAgK84 больше не могла передаваться другой агробактерии в ходе конъюгации, но все еще была способна детерминировать синтез агроцина 84 и обеспечивать устойчивость к нему. Рисунок выполнен без соблюдения масштаба.
Ферменты
Некоторые бактерии, стимулирующие рост растений, синтезируют такие ферменты, как хитиназа, β-1,3-глюканаза, протеаза и липаза, которые разрушают клеточную стенку грибов. В одном из экспериментов удалось снизить частоту возникновения болезней, вызываемых фитопатогенными грибами Rhizoctonia solani, Sclerotium rolfsii и Pythium ultimum, с помощью штамма Pseudomonas cepacia, синтезирующего фермент β-1,3-глюканазу, который разрушал грибной мицелий. В ходе других исследований было показано, что противогрибковая активность трех штаммов Enterobacter agglomerans, стимулирующих рост растений, обусловлена наличием у них комплекса из четырех разных полипептидов, которые, действуя совместно, расщепляют хитин клеточной стенки грибов. Эти бактерии хорошо защищали растения хлопчатника от заражения Rhizoctonia solani. В то же время Тn5-мутанты Е. agglomerans, не продуцирующие активной хитиназы, не были способны защитить растения от патогенных грибов.
Многие бактериальные ферменты, разрушающие клеточную стенку грибов, в том числе хитиназа и β-глюканаза, кодируются одним геном. Было бы разумно выделить эти гены и ввести их бактериям, стимулирующим рост растений, с тем чтобы получить штаммы, синтезирующие, например, и антибиотики, и ферменты, разрушающие клеточную стенку грибов. Были проведены эксперименты, в которых ген хитиназы, выделенный из бактерии Serratia marcescens, был перенесен в клетки Trichoderma harzianum и R. meliloti. Оба трансформированных микроорганизма синтезировали хитиназу и обладали повышенной противогрибковой активностью. При введении гена хитиназы S. marcescens в штамм P. fluorescens, стимулирующий рост растений, был получен трансформант, стабильно секретирующий хитиназу и эффективно подавляющий размножение фитопатогенного гриба Rhizoctonia solani.
Образование кристаллов льда и антифризные белки
Некоторые патогенные поражаюшие листья бактерии типа Pseudomonas syringae синтезируют при низких температурах специфические белки, служащие центрами образования кристаллов льда на поверхности листа при температурах ниже нуля. По мере своего роста кристаллы прокалывают растительные клетки и необратимо повреждают растение, а бактерии получают в свое распоряжение питательные вещества, высвободившиеся из разрушенных растительных клеток. Если белки – центры кристаллизации на поверхности листа – отсутствуют, то непродолжительные ночные заморозки могут и не принести вреда растению, поскольку образование кристаллов льда в цитоплазме растительной клетки обычно начинается при температуре на несколько градусов ниже точки замерзания (т.е. происходит ее переохлаждение). Чтобы предотвратить кристаллизацию на листьях таких культур, как земляника, можно еше до заморозков распылить над растениями мутантные бактерии P. syringae, не способные синтезировать белки – центры кристаллизации. Такие мутантные формы могут быть созданы с помощью технологнии рекомбинантных ДНК или обычного мутагенеза с последующим отбором, и они при достаточной концентрации вытеснят бактерии дикого типа.
Одним из важных условий эффективности биоконтроля патогенных микроорганизмов с помощью бактерий, стимулирующих рост растений, является способность этих бактерий к распространению в естественных условиях. В Канаде, скандинавских странах и на севере США они должны сохранять жизнеспособность в условиях долгих холодных зим, а весной размножаться при относительно низких температурах почвы (~5–10 °С). Поскольку микроорганизмы используют разные адаптивные стратегии выживания в неблагоприятных условиях, можно попытаться сконструировать с помощью генной инженерии рекомбинантные бактерии, оптимально приспособленные к низким температурам. Недавно было показано, что некоторые почвенные бактерии (а среди них встречаются и такие, которые стимулируют рост растений) могут размножаться при 5 °С и секретировать в окружающую среду антифризные белки при низких температурах. Такие белки регулируют образование кристаллов льда внутри бактериальной клетки. Хотя в их присутствии кристаллы все же формируются, они не достигают больших размеров и не разрушают клетки. Как только будут идентифицированы гены бактериальных антифризных белков, их можно будет перенести в клетки бактерий, стимулирующих рост растений, с тем чтобы получить трансформированные бактерии, устойчивые к низким температурам. Пока нет никаких данных о наличии связи между антифризной активностью бактерий и механизмом, обеспечивающим их выживание при низких температурах. Очень интересно проверить, является ли синтез антифризного белка частью адаптивной стратегии, используемой некоторыми бактериями для обеспечения устойчивости к холоду.
СТИМУЛЯЦИЯ РОСТА РАСТЕНИЙ
СВОБОДНОЖИВУЩИМИ БАКТЕРИЯМИ
Бактерии, стимулирующие рост растений, оказывают свое действие несколькими способами:
1) фиксируют атмосферный азот, который затем используется растением;
2) синтезируют сидерофоры, которые солюбилизируют и связывают железо из почвы и обеспечивают им растительные клетки;
3) синтезируют фитогормоны, ускоряющие разные стадии роста;
4) солюбилизируют минеральные вещества (такие, как фосфор), которые затем используются растением;
5) синтезируют ферменты, способные регулировать уровень растительных гормонов.
Каждая бактерия, стимулирующая рост растений, может использовать один или несколько из этих механизмов.
Фиксация азота вносит совсем небольшой вклад в тот положительный эффект, который дают бактерии, стимулирующие рост растений. Не все такие бактерии являются диазотрофами, а многие из них усваивают лишь ограниченное количество азота.
Для поглощения железа из почвы некоторые растения используют бактериальные комплексы железо–сидерофор; без этого их рост в большинстве случаев был бы сильно замедлен. Однако, несмотря на то что бактериальные сидерофоры несомненно вносят вклад в питание растений и, следовательно, в их рост, этот эффект, как правило, не очень велик.
Как именно бактерии, стимулирующие рост растений, способствуют поглощению растением таких минеральных веществ, как фосфор, до конца не установлено. Высказывалось предположение, что у растений, обработанных стимулирующими их рост бактериями, лучше развивается корневая система, а потому они более эффективно поглощают из почвы нужные им вещества, т. е. влияние бактерий носит опосредованный характер. Однако эксперименты с Azospirillum показали, что этот организм увеличивает поглощение именно минеральных веществ, возможно, синтезируя и секретируя органические кислоты, которые растворяют и связывают некоторые из этих веществ.
Очень часто различные эффекты бактерий, стимулирующих рост растений, объясняют способностью их к синтезу фитогормонов. Большинство исследований в этой области относится к выяснению роли одного из классов фитогормонов – ауксинов. Наиболее распространенный и лучше всего охарактеризованный ауксин – это индолил-3-уксусная кислота (ИУК). Она стимулирует как быстрые ответы (например, удлинение растительных клеток), так и длительные (ускорение деления и дифференцировки). Растения тоже могут синтезировать ауксин. Часто это не позволяет определить, какой именно ауксин дает необходимый эффект: бактериальный или растительный. Тем не менее можно утверждать, что бактерии, стимулирующие рост растений, оказывают свое действие именно через изменение гормонального баланса в растениях.
Недавно обнаружилось, что многие бактерии, стимулирующие рост растений, синтезируют фермент, способный регулировать уровень растительного гормона этилена. Этот фермент, 1-аминоциклопропан-1-карбоксилат(АЦК)–дезаминаза, гидролизует АЦК, который является непосредственным предшественником этилена при биосинтезе в растениях. Одно из объяснений роли этого фермента состоит в следующем. Бактерия связывается с оболочкой семени или с корнями растения, а затем поглощает и гидролизует АЦК, понижая концентрацию этилена в тканях растения. Во многих растениях этилен стимулирует прорастание семян и выводит их из состояния покоя; однако, если после прорастания уровень этилена оказывается слишком высоким, удлинение корней замедляется. Таким образом, бактериальная АЦК–дезаминаза предотвращает уменьшение скорости роста корней, и растение развивается быстрее. Кроме того, многие бактерии, стимулирующие рост растений, синтезируют ИУК, а избыток ИУК, не израсходованный на стимуляцию удлинения растительных клеток или ускорение деления, активирует АЦК–синтазу, что приводит к повышению концентрации этилена. Присутствие активной АЦК–дезаминазы препятствует накоплению АЦК даже при высоких концентрациях ИУК, так что концентрация этилена не повышается до уровня, при котором замедляется рост растения (рис. 14.10). После детального изучения механизмов, с помощью которых бактерии, стимулирующие рост растений, оказывают свое действие, появится возможность создавать рекомбинантные микроорганизмы, способные стимулировать рост самых разных растений в различных условиях.
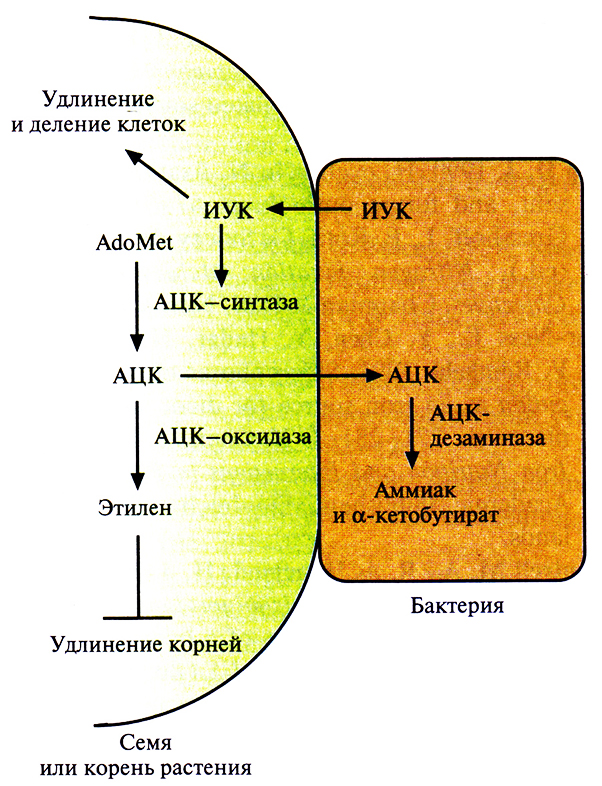
Рис. 14.10. Схематическое изображение механизма, с помощью которого бактерии, стимулирующие рост растений, снижают концентрацию этилена в растительных тканях и тем самьш предотвращают ингибирование роста корней. Бактериальная клетка, прикрепившаяся к поверхности семени или корня развивающегося растения, синтезирует и секретирует индолил-3-уксусную кислоту (ИУК), стимулирующую рост растения. Попадая в растение, бактериальная ИУК (вместе с ИУК, синтезируемой самим растением) стимулирует либо деление растительной клетки и ее удлинение, либо фермент АЦК-синтазу, который катализирует превращение S-аденозилметионина (AdoMet) в АЦК. Значительная часть АЦК вместе с другими малыми молекулами, обычно содержащимися в семенном или корневом эксудате, экскретируется корнями растения или семенами, поглощается бактерией и гидролизуется АЦК-дезаминазой до аммиака и а-кетобутирата. В результате количество АЦК вне растения снижается. Чтобы сохранить равновесие между АЦК внутри и снаружи, растение секретирует его больше. Соответственно его концентрация, а следовательно, и концентрация этилена в рас ительных тканях уменьшается. (Из работы Glick et al., J Theor. Biol, in press.)
ЗАКЛЮЧЕНИЕ
Многие почвенные микроорганизмы обладают способностью стимулировать рост растений. Были исследованы молекулярные механизмы, лежащие в основе этой стимуляции, с тем чтобы выяснить, можно ли использовать полезные почвенные бактерии вместо химических удобрений. Полезные бактерии могут оказывать свое влияние непосредственно, поставляя растениям фиксированный азот, хелатированное железо, фитогормоны или облегчая поглощение ими фосфора. Но влияние может быть и опосредованным, через подавление роста фитопатогенных микроорганизмов.
Из всех бактерий, стимулирующих рост растений и уже использующихся в сельском хозяйстве, наиболее детально изучены члены семейства Rhizobium и Bradyrhizobium. Эти микроорганизмы вступают в сложные облигатные симбиотические отношения со строго определенными растениями.
Молекулярные основы фиксации азота всесторонне исследовались на К. pneumoniae, которая может служить модельной системой для изучения симбиотических бактерий семейств Rhizobium и Bradyrhizobium. Детально охарактеризована нитрогеназа, азотфиксирующий фермент. Молекулярно-генетические исследования показали, что фиксация азота бактериями – это сложный процесс; в нем участвует семь координирование регулируемых оперонов, кодирующих в общей сложности 20 разных белков. Это делает пока невозможным создание с помощью методов генной инженерии растений, которые могли бы сами усваивать азот, и других азотфиксирующих бактерий.
Азотфиксирующий фермент нитрогеназа, используя энергию гидролиза АТР, катализирует образование газообразного водорода (Н2). Некоторые штаммы Rhizobium синтезируют фермент гидрогеназу. Он катализирует превращение in vivo Н2 в Н+, что увеличивает эффективность фиксации азота. Если ппамм содержит неактивную гидрогеназу, его способность фиксировать азот и стимулировать рост растения уменьшается. С учетом всего сказанного выше были предприняты попытки ввести клонированные гены гидрогеназ в штаммы Rhizobium, вступающие в симбиотические отношения с сельскохозяйственными культурами. По предварительным данным, проводя генноинженерные модификации генов гидрогеназ, можно создать штаммы Rhizobium, обладающие более высокой способностью стимулировать рост растений.
Вступая в симбиотические отношения с растениями, штаммы Rhizobium стимулируют образование на их корнях клубеньков, где и происходит размножение этих бактерий и фиксация азота. Разумно было предположить, что, если с помощью методов генной инженерии удастся создать бактерии, способствующие образованию большего количества клубеньков, конкурентоспособность инокулирующих штаммов Rhizobium в борьбе за место на корнях растений-симбионтов повысится по сравнению со штаммами дикого типа. К сожалению, обнаружилось, что в образовании клубеньков участвует множество разных генов, и эта сложность затрудняет проведение соответствующих молекулярно-генетических экспериментов.
Опосредованная стимуляция роста растений бактериями состоит в защите растений от повреждений, вызываемых фитопатогенными грибами или бактериями. Такая защита осуществляется при участии специфических соединений, синтезируемых бактериями, которые стимулируют рост растений: сидерофоров, антибиотиков, других малых молекул и различных ферментов. Некоторые другие продукты синтеза, в частности фитогормоны и АЦК–дезаминаза, влияют на рост растений непосредственно. Есть надежда, что когда-нибудь гены биосинтеза всех перечисленных соединений можно будет использовать для создания бактерий – более эффективных стимуляторов роста растений.

