Для получения коммерческих продуктов с помощью рекомбинантных микроорганизмов необходимо сотрудничество специалистов в двух областях: молекулярных биологов и биотехнологов. Задача молекулярных биологов заключается в идентификации, изучении свойств, модификации нужных генов и создании эффективных систем их экспрессии в клетках микроорганизмов, которые можно будет использовать для промышленного синтеза соответствующего продукта, а задача биотехнологов – в обеспечении условий оптимального роста нужного рекомбинантного микроорганизма с целью получения продукта с наибольшим выходом. На заре развития молекулярной биотехнологии ученые наивно полагали, что переход от лабораторного синтеза к промышленному – это вопрос простого увеличения масштаба, т. е. условия, оптимальные для малых объемов, будут оптимальными и для больших, так что достаточно просто взять больший реактор и соответственно больший объем культуральной среды.
Такое упрощенное представление не соответствует действительности. Например, аэробные микроорганизмы хорошо растут в обычной колбе на 200 мл при аэрации ее содержимого с помощью мешалки мощностью 300 Вт. Если просто увеличить объем «колбы» до 10 000 литров, то потребуется мешалка мощностью 15 МВт. Ее мотор будет размером с дом, а при перемешивании выделится столько тепла, что микроорганизмы попросту сварятся. Этот простой пример может не во всем убедить биотехнологов, однако они точно знают, что проблема промышленного культивирования микроорганизмов не сводится к пропорциональному увеличению масштаба лабораторного эксперимента. Конечно, увеличить размер реактора (биореактора, ферментера) совершенно необходимо, поскольку для получения 10 000 л клеточной суспензии не имеет смысла использовать 50 000 отдельных колб на 200 мл. Однако помимо этого для получения максимального выхода как в малых (от 1 до 10 л), так и в больших (>1000 л) биореакторах необходимо оптимизировать множество параметров: температуру, рН, интенсивность и способ перемешивания культуры и – в случае аэробных организмов – концентрацию кислорода. При этом надо иметь в виду, что как правило оптимальные условия изменяются при каждом десятикратном увеличении объема биореактора.
Есть и другие очень важные соображения. В реакторе должен поддерживаться достаточный уровень стерильности и, кроме того, необходимо создать условия, предотвращающие утечку генетически измененных микроорганизмов. Чтобы иметь возможность быстро и легко изменять условия в ходе ферментации, реактор должен быть снабжен контрольно-измерительной аппаратурой, позволяющей непрерывно отслеживать значения как можно большего числа параметров. Поскольку при стерилизации может изменяться состав среды (например, могут разрушаться витамины), важно убедиться в том, что он остался оптимальным для роста нужных микроорганизмов.
Как правило, промышленная ферментация и очистка продукта – процессы многоступенчатые (рис. 16.1). Обычно процедура начинается с приготовления и стерилизации культуральной среды и оборудования. Сначала выращивают исходную культуру (5–10 мл), затем инкубируют ее во встряхиваемой колбе (200–1000 мл), после чего переносят в ферментер для посевного материала (10–100 л) и, наконец, в промышленный ферментер (1000–100 000 л). По завершении ферментации клетки выделяют из культуральной среды центрифугированием или фильтрацией. Если продукт локализован внутри клеток, последние разрушают, удаляют клеточные осколки и выделяют продукт из осветленной среды. Секретируемый продукт выделяют непосредственно из среды.
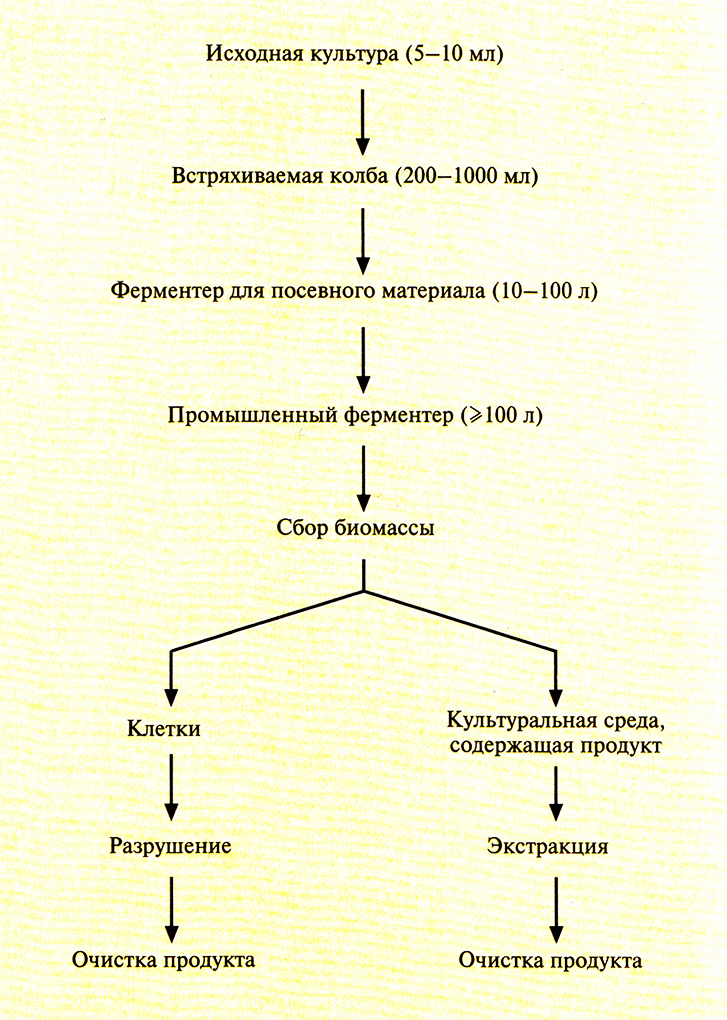
Рис. 16.1. Обобщенная схема процесса промышленной ферментации. Выделяемый продукт находится либо в клетках, либо в культуральной среде, но не в обеих фракциях одновременно, так что дальнейшие манипуляции проводят с одной из этих фракций.
РОСТ МИКРООРГАНИЗМОВ
Микроорганизмы можно выращивать в ферментере периодического действия, в ферментере периодического действия с добавлением субстрата или в непрерывной культуре (рис. 16.2). В первом случае микроорганизмы выращивают в стерильных условиях без добавления в ходе ферментации свежей культуральной среды. Во втором случае по ходу ферментации к культуре периодически добавляют увеличивающиеся количества питательных веществ, при этом культуральную среду не удаляют до окончания процесса. При непрерывной ферментации свежая культуральная среда поступает в ферментер непрерывно, и параллельно отводится такой же объем клеточной суспензии. Во всех случаях через среду при необходимости продувают кислород (обычно в виде стерильного воздуха), добавляют пеногаситель и (если это нужно) кислоту или основание.
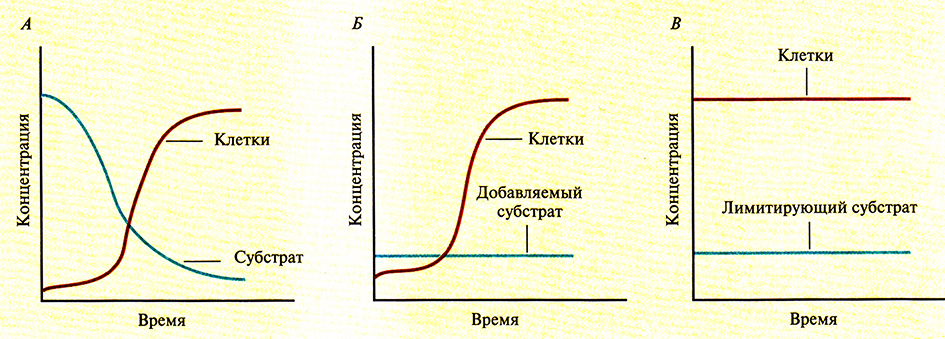
Рис. 16.2. Изменение во времени концентрации клеток и субстрата в периодической культуре (А), периодической культуре с добавлением субстрата (Б) и в непрерывной культуре (В).
Периодическая культура
В ходе периодической ферментации состав культуральной среды, концентрация микроорганизмов (концентрация биомассы), химический состав клеток и количество белкового продукта или метаболита зависят от фазы роста, клеточного метаболизма и наличия питательных веществ. Различают шесть основных фаз роста: лаг-фазу, фазу ускорения, логарифмическую (log), или экспоненциальную фазу, фазу замедления, стационарную фазу и фазу отмирания (рис. 16.3).
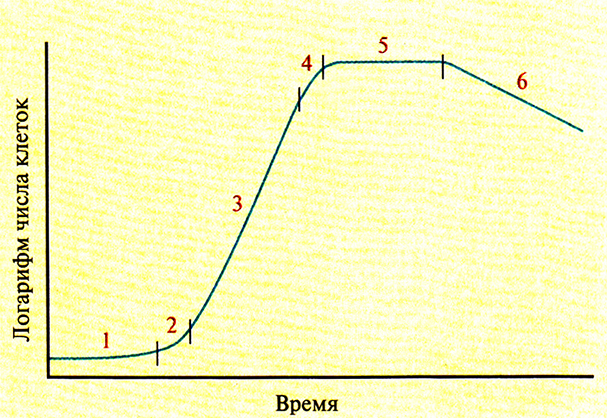
Рис. 16.3. Кривая роста бактериальной культуры при периодической ферментации. 1 – лаг-фаза, 2 – фаза ускорения, 3 – экспоненциальная фаза, 4 – фаза замедления, 5 – стационарная фаза, 6 – фаза отмирания.
Обычно после инокуляции стерильной культуральной среды мгновенного увеличения числа клеток не наблюдается. В течение какого-то периода времени, называемого лаг-фазой, клетки адаптируются к новым условиям: другим рН или концентрации питательных веществ. В ходе такой адаптации может произойти включение каких-то новых, ранее не проявившихся путей метаболизма. Лаг-фаза наблюдается всякий раз, когда посевной материал получен из культуры, рост которой прекратился в результате исчерпания субстрата или ингибирования продуктом (т. е. культуры в стационарной фазе). Продолжительность лаг-фазы зависит от времени, в течение которого клетки посевного материала находились в стационарной фазе, и от того, как сильно различались среда, в которой росла культура, и новая, свежая культуральная среда. Если же посевным материалом служит культура, находящаяся в экспоненциальной фазе, то выраженная лаг-фаза может отсутствовать и рост начнется немедленно после инокуляции. Между лаг- и экспоненциальной фазами есть короткий период, так называемая фаза ускорения, когда скорость роста клеток увеличивается до достижения постоянной величины.
Во время экспоненциальной фазы клетки претерпевают несколько делений, а удельная скорость роста остается постоянной. При избытке субстрата (питательных веществ) и в отсутствие ингибирования роста каким-либо соединением, присутствующим в культуральной среде, удельная скорость роста не зависит от концентрации субстрата. Кривую роста при таких условиях можно описать математически, что позволяет биотехнологам моделировать процесс, а затем провести его масштабирование. Прирост клеточной массы во времени dX/dt равен произведению удельной скорости роста µ на биомассу X:
dX/dt = µX.
Аналогично, прирост числа клеток dN/dt равен произведению удельной скорости ц на число клеток N:
dN/dt = µN.
Удельная скорость µ зависит от концентрации лимитирующего субстрата (источника углерода или азота) S, максимальной удельной скорости роста µmах и субстратспецифичной константы Кs.
µ = µmaxS/(Ks+S).
И S, и Ks имеют размерность концентрации (г/л или М).
Иногда вместо удельной скорости роста используют время удвоения, или время генерации td = lп2/µ. Это время, а которое в определенных условиях число клеток или биомасса удваивается. Для одноклеточных микроорганизмов величина µmax обычно находится в диапазоне от 2,1 до 0,086–1, что соответствует времени удвоения примерно от 20 мин до 8 ч.
Когда субстрат присутствует в избытке (т. е. при S>> Ks), µ = µmах и достигается максимальная скорость роста культуры в экспоненциальной фазе. Как правило, величина Ks настолько мала, что концентрация субстрата редко становится сравнимой с в Ks о время экспоненциальной фазы. Например, в случае Escherichia coli Ks для глюкозы равна примерно 1 мг/л, а начальная концентрация глюкозы в среде обычно составляет около 10 000 мг/л. Однако в конце экспоненциальной фазы субстрата остается мало, и S может стать ниже Ks. При S< Ks быстро наступает фаза замедления. Она может быть очень кратковременной или даже практически незаметной, поскольку из-за большого числа клеток в конце экспоненциальной фазы субстрат может быть израсходован очень быстро.
В результате истощения лимитирующего субстрата (например, источника углерода) или накопления продуктов метаболизма, замедляющих рост, увеличение числа клеток постепенно прекращается и культура переходит в стационарную фазу. В это время биомасса остается постоянной, однако метаболизм часто претерпевает кардинальные изменения. Именно в этот период нередко синтезируются соединения (вторичные метаболиты), представляющие коммерческий интерес, например антибиотики. Продолжительность стационарной фазы зависит от конкретного организма и условий роста.
В фазе отмирания энергетические запасы клеток оказываются исчерпанными, и метаболизм прекращается. В большинстве промышленных процессов ферментацию останавливают и клетки собирают еще до наступления фазы отмирания.
Периодическая культура с добавлением субстрата
В этом случае в ферментер периодически добавляют субстрат, а конечный продукт собирают только по завершении процесса. Добавление субстрата приводит к удлинению экспоненциальной и стационарной фаз и к увеличению биомассы и количества метаболитов, синтезируемых во время стационарной фазы (например, антибиотиков). Однако в стационарной фазе микроорганизмы часто синтезируют протеолитические ферменты (протеиназы), разрушающие все производимые ими белки. Поэтому, если целью ферментации является получение белковых продуктов, нужно остановить процесс до его перехода в эту фазу. Прямое измерение концентрации субстрата в ходе ферментации часто бывает затруднено, и чтобы определить, в какой момент нужно добавить следующую порцию субстрата, приходится использовать другие показатели, коррелирующие с его расходованием, например количество синтезированных органических кислот, значение рН или количество образовавшегося С02. Вообще говоря, ферментеры периодического действия с добавлением субстрата требуют постоянного и более тщательного контроля, чем простые ферментеры периодического действия, и поэтому используются реже. Но они имеют ряд преимуществ, если говорить о разработке систем получения белков с помощью рекомбинантных микроорганизмов, а потому становятся все более популярными.
Периодическое добавление субстрата к растущей культуре рекомбинантных микроорганизмов продлевает экспоненциальную фазу и отсрочивает наступление стационарной фазы, во время которой инициируются клеточные ответы на стрессовые воздействия, происходит синтез протеиназ и другие изменения метаболизма, уменьшающие выход рекомбинантного белка. Для поддержания метаболизма клетки-хозяина количество добавляемого субстрата необходимо постоянно увеличивать. Чтобы обеспечить непрерывный синтез рекомбинантного белка и его стабильность, нужно тщательно контролировать процесс и добавлять субстрат (источник углерода и азота вместе с микроэлементами) сразу, как только в этом возникнет необходмость В зависимости от генотипа микроорганизма и природы рекомбинантного белка при периодической ферментации с добавлением субстрата выход продукта может возрасти на 25–1000 % по сравнению с простой периодической ферментацией.
Периодическую ферментацию с добавлением субстрата можно использовать для культивирования не только микроорганизмов, но и клеток млекопитающих и насекомых. Это очень важно, поскольку: 1) такие культуры все шире применяются для получения белковых продуктов, имеющих медицинское значение; 2) без периодического добавления субстрата животные клетки не очень эффективно синтезируют чужеродные белки.
Непрерывная культура
При непрерывной ферментации стационарные условия, т. е. условия, при которых dX/dt = 0, обеспечиваются тем, что при постоянном объеме биореактора убыль числа клеток (удаление продукта) в точности уравновешивается их увеличением в результате деления. Говоря более формальным языком, для непрерывного процесса в стационарном состоянии скорость разведения D, определяемая как скорость притока среды F, деленная на постоянный объем среды V в биореакторе,
D= F/V,
равна удельной скорости роста µ:
D=(dX/dt)(1/X) = µ.
Чтобы получить непрерывную культуру с постоянными гидродинамическими характеристиками, нужно создать условия, при которых удельная скорость роста была бы ниже максимальной величины µmax. Для этого нужно так отрегулировать насос, который контролирует скорость притока F, чтобы объем культуры в биореакторе V поддерживался постоянным.
Важнейшей задачей промышленной ферментации является получение максимального количества продукта при минимуме затрат. Эту задачу можно решить, если для каждого конкретного процесса разрабатывать свою, наиболее эффективную конструкцию ферментера. Вообще говоря, непрерывная ферментация применяется в промышленных целях не так уж часто, прежде всего потому, что ученые накопили наибольший опыт в работе с периодическими культурами. При этом стоимость получения данного количества биомассы в ферментере непрерывного действия гораздо ниже, чем в ферментере, работающем в периодическом режиме. Такое удешевление обусловливается следующими факторами.
- Для получения данного количества продукта с помощью непрерывной ферментации нужны меньшие биореакторы, чем с помощью периодической.
- При периодической ферментации для сбора клеток, их разрушения и последующей очистки белкового продукта или метаболита, синтезированного микроорганизмом, необходимо крупногабаритное оборудование. В то же время в ферментере непрерывного действия синтез идет постепенно, так что и оборудование может быть не столь громоздким.
- Ферментер, работающий в непрерывном режиме, не простаивает, как ферментер, периодического действия, который нужно время от времени разгружать и подготавливать к повторному использованию. Простой биореактора в связи с ремонтом, чисткой или стерилизацией – основная причина снижения эффективности процесса. При непрерывной ферментации этот простой гораздо меньше.
- Физиологический статус большинства клеток при непрерывной ферментации одинаков, поэтому синтез происходит более согласованно. При периодической же ферментации небольшие различия во времени сбора клеток, который проводят начиная с середины экспоненциальной фазы и заканчивая ее поздним этапом, могут приводить к значительной рассогласованности.
Непрерывную ферментацию уже использовали для промышленного получения белков одноклеточных микроорганизмов, антибиотиков и органических растворителей.
Впрочем, этот способ имеет и свои недостатки.
- Время ферментации в непрерывном режиме иногда составляет 500–1000 ч, при этом некоторые клетки могут потерять рекомбинантные плазмиды. Клетки, не несущие плазмид, обычно расходуют меньше энергии и делятся быстрее, чем те, которые содержат плазмиду, поэтому со временем выход продукта может снижаться из-за уменьшения числа клеток, способных его синтезировать. Эту проблему можно было бы решить, интегрировав клонированный ген в геном организма хозяина.
- Очень трудно поддерживать стерильные условия в промышленных установках в течение долгого времени. Кроме того, для непрерывных процессов необходимо стерильное резервное оборудование, что значительно увеличивает основные затраты.
- К качеству компонентов культуральной среды, используемой при крупномасштабной ферментации, не предъявляются столь высокие требования, как к компонентам среды при ферментации в лабораторных условиях; они могут изменяться от одного процесса к другому, что может приводить к изменению физиологии клеток и снижению производительности.
Репутация периодической ферментации как весьма надежной системы сдерживает переход к jпобому другому типу ферментации, даже при том что непрерывный режим работы более эффективен. И все-таки недавно было создано сразу несколько установок, лабораторных (до 10 л) и пилотных (до 1000 л), для непрерывной и периодической ферментации с добавлением субстрата – с целью получения белков с помощью рекомбинантных микроорганизмов. Это говорит о том, что более широкое применение непрерывных ферментеров и периодических ферментеров с добавлением субстрата в промышленности – это только вопрос времени.
ПОВЫШЕНИЕ ЭФФЕКТИВНОСТИ ФЕРМЕНТАЦИИ
Независимо от типа биореактора в ходе ферментации необходимо строго контролировать такие параметры, как концентрация растворенного кислорода, рН, температура и интенсивность перемешивания. Слишком сильное изменение любого из них может существенно снизить скорость роста клеток и стабильность белкового продукта.
Для оптимального роста Е. coli и многих других микроорганизмов, используемых в качестве инструмента экспрессии рекомбинантных белков, обычно нужна хорошо аэрируемая культуральная среда. Максимальная скорость утилизации кислорода при ферментации Qmax зависит от массы клеток X, максимальной удельной скорости роста µmах и скорости роста, зависящей от количества потребленного кислорода Yo2. Эта зависимость выражается следующей формулой:
Qmax = Xµmax/Yo2.
Поскольку кислород плохо растворим в воде (0,0084 г/л при 25 °С), он должен подаваться в среду непрерывно. Обычно для аэрации через ферментер продували стерилизованный воздух. Однако при этом в среде образуются пузырьки, и если они слишком велики, то скорость переноса кислорода к клеткам недостаточна для поддержания их роста. Таким образом, в ходе ферментации необходимо с помощью специального датчика контролировать содержание растворенного кислорода в среде, следить за его равномерным распределением по всему объему и тщательным перемешиванием культуры, обеспечивающим эффективное диспергирование пузырьков.
Большинство микроорганизмов растут лучше всего при рН от 5,5 до 8,5. Следует иметь в виду, однако, что клеточные метаболиты, поступая в культуральную среду, могут изменять ее рН. Таким образом, необходимо тщательно контролировать рН в ходе ферментации и при необходимости добавлять в ферментер кислоту или щелочь. При этом последние должны быть хорошо перемешаны со средой и равномерно распределены по всему объему.
Еще один параметр, от которого зависит успех ферментации, – температура. Если она ниже оптимально», то рост микроорганизмов замедляется и интенсивность метаболизма снижается. Если же, напротив, температура слишком высока, то может произойти преждевременная индукция синтеза белка, если он находится под контролем температурочувствительного репрессора, или индукция белков теплового шока, что активизирует клеточные протеиназы и снизит выход белкового продукта.
Тщательное перемешивание культуры необходимо, во-первых, для равномерной доставки питательных веществ к клеткам и, во-вторых, для предотвращения накопления токсичных побочных продуктов метаболизма в каком-нибудь небольшом отсеке биореактора. Эффективное перемешивание относительно легко обеспечить при культивировании в небольших объемах, при крупномасштабном же культивировании поддержание гомогенности культуральной среды становится одной из главных проблем.
Перемешивание культуральной среды влияет и на другие параметры: скорость переноса кислорода из пузырьков газа в жидкую среду, а затем из среды в клетки; эффективность теплопередачи; точность измерения концентрации метаболитов в культуральной жидкости; эффективность диспергирования добавляемых реагентов (кислот, оснований, питательных веществ и т.д.). Исходя из всего этого, можно было бы предположить, что чем интенсивнее культура перемешивается, тем лучше она растет. Однако при чрезмерном перемешивании среды в ней могут возникнуть гидромеханические эффекты, губительные для бактериальных клеток и клеток млекопитающих, или произойти повышение температуры, которое также скажется на их жизнеспособности. Таким образом, как всегда, нужно соблюдать баланс между необходимостью тщательно перемешивать среду и стремлением сохранить целостность клеток.
Есть еще один аспект, касающийся крупномасштабной ферментации, который не имеет отношения к технической стороне процесса, а касается того, используются ли при этом рекомбинантные микроорганизмы. В большинстве стран крупномасштабное культивирование рекомбинантных микроорганизмов сопряжено с необходимостью соблюдения определенных правил и инструкций. Хотя большинство рекомбинантных микроорганизмов не представляют никакой опасности, важно не допустить их случайного попадания в среду. Для этого используются надежные системы, предотвращающие утечку живых рекомбинантных организмов или ограничивающие их распространение, если утечка все же произошла. Кроме того, перед окончательным удалением из установки все рекомбинантные микроорганизмы должны быть инактивированы в соответствии с определенными инструкциями. Использованную культуральную среду тоже необходимо проверять на наличие в ней жизнеспособных микроорганизмов, чтобы исключить их попадание в окружающую среду.
ВАЖНАЯ ВЕХА
Экспрессия гена гемоглобина стимулирует синтез белка в Е. coli в условиях недостатка кислорода
С. Khosla, J.E. Curtis, J. DeModena, U.Rinas, J.E. Bailey Bio/Technology 8:849–853, 1990
Поскольку кислород плохо растворим в воде, рост аэробных бактерий часто лимитируется количеством растворенного в культуральной среде кислорода. Эта проблема особенно актуальна при большой плотности культуры или при крупномасштабной ферментации. Чтобы решить ее, биотехнологи попытались увеличить количество кислорода, поступающего в жидкую культуральную среду. Предложенные подходы состояли в следующем: 1) подача в культуральную среду чистого кислорода вместо воздуха; 2) подача воздуха (или кислорода) под давлением; 3) добавление к культуральной среде химических соединений, таких как перфторуглероды, повышающие растворимость кислорода; 4) модификация конструкции ферментера таким образом, чтобы обеспечивались оптимальная аэрация и перемешивание культуральной среды. Все эти подходы решают «кислородную проблему» лишь частично. Для каждого из них существует свой порог, по достижении которого выход продукта уже нельзя повысить дальнейшим добавлением кислорода.
В качестве альтернативы Бей ли и др. предложили модифицировать микроорганизм, использующийся для культивирования, таким образом, чтобы он мог более эффективно использовать тот кислород, который присутствует в культуральной среде. Они перенесли ген, кодирующий гемоглобиноподобное соединение, из грамотрицательной бактерии Vitreoscilla sp. в несколько рекомбинантных бактерий. Бактериальный гемоглобин связывал кислород среды и поддерживал высокую концентрацию его в клетках, что стимулировало рост и экспрессию чужеродного белка. Этот подход проиллюстрировал возможность весьма неожиданного биологического решения трудной технической задачи.
Культуры с высокой плотностью
Вообще говоря, при получении чужеродных белков с помощью рекомбинантных Е. coli руководствуются тем, что при максимальной конечной плотности культуры получается и максимальное количество продукта. В ферментерах периодического действия с добавлением субстрата концентрация рекомбинантных клеток Е. coli достигает 50 грамм сухого вещества на 1 л среды (а в некоторых случаях >100 г/л). (Вес сухого вещества клеток Е. coli составляет примерно 20–25% веса влажного вещества.)
Один из способов повышения плотности культуры состоит в оптимизации культуральной среды. Следует иметь в виду, что некоторые питательные вещества, в том числе источники углерода и азота, при слишком больших концентрациях замедляют рост клеток. Глюкоза подавляет рост при концентрации >50 г/л, аммиак – при концентрации >3 г/л, железо – >1,15 г/л, магний – >8,7 г/л, фосфор – >10 г/л, цинк – >0,038 г/л. Таким образом, простое увеличение содержания питательных веществ в культуральной среде при периодической ферментации не даст желаемого результата. Кроме того, поскольку состав сложных сред типа пептона или дрожжевого экстракта может немного различаться от раза к разу, ферментация в них не всегда бывает воспроизводимой.
Ацетат, который может подавлять рост клеток, продуцируется Е. coli при росте в условиях недостатка кислорода, но избытка глюкозы. Проблему его образования можно решить, если использовать в качестве источника углерода глицерин вместо глюкозы, понизить температуру или использовать рекомбинантный штамм Е. coli, способный преврашать ацетат в менее токсичные вещества (см. гл. 6).
В культурах с высокой плотностью может также возникнуть недостаток кислорода. Чтобы избежать этого, увеличивают количество поступающего воздуха (разбрызгивание) либо скорость перемешивания или делают и то, и другое. Кроме того, можно подавать в культуру чистый кислород, а не воздух, в котором содержится только 20% кислорода, или выращивать клетки под давлением, чтобы увеличить растворимость кислорода. В качестве альтернативы предлагалось экспрессировать в хозяйских клетках Е. coli ген гемоглобина Vitreoscilla, что значительно увеличило бы поглощение кислорода растущими клетками.
Высокой плотности чаще всего удается достичь при росте в периодическом режиме с добавлением субстрата. Режим подачи питательных веществ может быть разным: непрерывным, ступенчатым или экспоненциальным. При непрерывном режиме в среду в течение всей ферментации вносят одинаковые количества питательных веществ. Однако в этих условиях удельная скорость роста непрерывно снижается. При ступенчатом режиме питательные вещества добавляют по мере увеличения концентрации клеток во все большем количестве, так что снижение удельной скорости роста в значительной мере компенсируется. При экспоненциальном режиме питательные вещества добавляют в количестве, обеспечивающем постоянную скорость роста клеток. Периодическую подачу питательных веществ можно автоматизировать, основываясь на результатах измерения концентрации лимитирующего субстрата (например, глюкозы) в среде в ходе ферментации.
БИОРЕАКТОРЫ
При беглом просмотре литературы по биотехнологии создается впечатление, что число типов биореакторов безгранично. Однако на самом деле все биореакторы можно подразделить на три основных группы:
- реакторы с механическим перемешиванием (рис. 16.4, А)
- барботажные колонны, через которые для перемешивания содержимого пропускается воздух или другой газ (рис. 16.4, Б)
- эрлифтные реакторы с внутренней (рис. 16.4, В) или внешней (рис. 16.4, Г) рециркуляцией; перемешивание и циркуляция культуральной среды в них обеспечивается потоком газа (обычно воздуха), за счет которого между верхним и нижним слоями культуральной среды возникает градиент плотности.
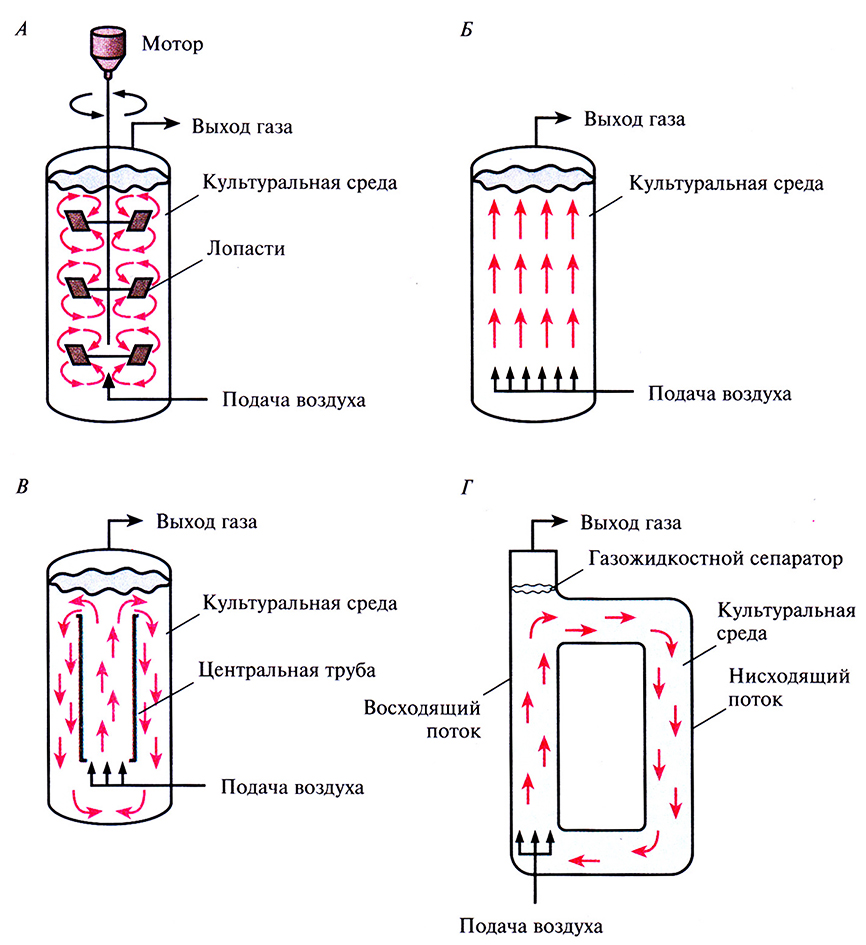
Рис. 16.4. Разные типы биореакторов (упрощенная схема). А. Реактор с механическим перемешиванием. Б. Барботажная колонна. В. Эрлифтный реактор с внутренней рециркуляцией. Г. Эрлифтный реактор с внешней системой рециркуляции. Стрелки – направление потока культуральной среды.
Чаще всего используются биореакторы первого типа. Они обладают следующими преимуществами:
- позволяют легко менять технологические условия
- всегда есть в продаже
- обеспечивают эффективную доставку газа к растущим клеткам (если говорить на инжеpнерном языке, обладают высоким объемным коэффициентом массообмена, kLa)
- уже давно используются для выращивания различных микроорганизмов.
В реакторах с механическим перемешиванием газ (как правило, воздух) подают в культуральную среду под давлением через разбрызгиватель – кольцо с множеством маленьких отверстий либо трубку с одним отверстием. В первом случае образуются мелкие пузырьки воздуха и обеспечивается их более равномерное распределение, однако разбрызгиватели в виде трубок используются чаще, поскольку они реже закупориваются. Для равномерного распределения газа по всему объему биореактора используются мешалки – одна или несколько. Они разбивают крупные пузырьки воздуха, разносят их по всему реактору и увеличивают время пребывания в культуральной среде. При сильном перемешивании средний размер пузырьков в больших биореакторах практически не зависит от размера отверстий в разбрызгивателе. Эффективность распределения газа зависит прежде всего от типа мешалки, числа оборотов и физико-химических свойств среды. Если размер биореактора слишком велик, а газ, поступающий из разбрызгивателя, распределяется по объему неравномерно, то даже при энергичном перемешивании гомогенизировать среду не удается.
Многие культуральные среды весьма агрессивны, и во избежание коррозийного или механического повреждения стенок биореактора его обычно изготавливают из нержавеющей стали или стекла. Стеклянные части чаще используют только в лабораторных биореакторах емкостью меньше 50 л.
Размер биореактора лимитируется его способностью эффективно отдавать тепло, выделяемое микроорганизмами в ходе метаболизма и высвобождаемое в результате перемешивания. Если теплоотдача недостаточна, температура среды может превысить критическую, что уменьшит выход продукта. Для отвода тепла используют охлаждающую рубашку или змеевики, помещаемые внутрь реактора. Внутреннее охлаждение более эффективно, однако змеевики часто покрываются слоем растущих клеток, что затрудняет охлаждение, а иногда мешает интенсивному перемешиванию культуральной среды
Большую опасность представляет загрязнение ферментера грибами или бактериями. Поэтому биореакторы конструируют таким образом, чтобы их можно было стерилизовать; обычно для этого используют пар под давлением. Внутри реактора не должно быть «мертвых зон», недоступных для пара во время стерилизации. Обработке подлежат все клапаны, датчики, входные и выходные отверстия. При конструировании перед инженерами зачастую возникает проблема: использовать максимальное число датчиков для полного контроля за процессом ферментации или ограничиться их минимальным набором, чтобы легче было поддерживать стерильность.
При интенсивном перемешивании культуральной среды в процессе ферментации часто происходит ее вспенивание. Это может привести к переувлажнению фильтра в отверстии, через которое воздух выходит из биореактора, и уменьшению его потока, а также к попаданию в реактор посторонних микроорганизмов. Для контроля пенообразования используют химические пеногасители или механические сбиватели пены. Однако в присутствии химических реагентов может ухудшаться перенос кислорода, а иногда происходить ингибирование клеточных ферментов, что уменьшает скорость роста микроорганизмов. Кроме того, если пеногасители не удалять, они могут загрязнять конечный продукт. Проблему вспенивания можно решить, если оставить в верхней части биореактора достаточно большое пустое пространство, в котором лопались бы пузырьки воздуха. Правда, в этом случае рабочий объем реактора уменьшится примерно на 25%.
Все эти соображения относятся и к «пневматическим» реакторам типа барботажных колонн и эрлифтных биореакторов. Таким образом, обеспечение стерильности, постоянства рН и температуры – ключевые требования при любом способе культивирования независимо от конструкции биореактора.
Конструкционные особенности барботажных колонн и эрлифтных биореакторов дают им некоторые преимущества перед реакторами с механическим перемешиванием. «Пневматические» реакторы более экономичны, поскольку перемешивание в них происходит с помощью восходящего потока воздуха (или другого газа в случае анаэробных микроорганизмов), а не механической мешалки, потребляющей много энергии. Кроме того, в отсутствие механической мешалки исключается и один из путей проникновения в биореактор посторонних микроорганизмов. В пневматических биореакторах в культуральной среде не возникает столь сильных гидродинамических возмущений (сдвига слоев жидкости друг относительно друга), при этом в эрлифтных биореакторах перемешивание происходит более равномерно по всему объему. Уменьшение сдвиговых эффектов очень важно по следующим причинам:
- клетки рекомбинантных микроорганизмов более хрупки, чем трансформированные клетки, поскольку часть их энергетических ресурсов расходуется на синтез чужеродных белков и в результате образуется менее прочная клеточная стенка
- самый распространенный ответ клетки на внешнее воздействие – уменьшение количества всех синтезируемых белков, в том числе и рекомбинантных
- под действием сдвиговых эффектов могут изменяться физические и химические свойства клеток, что затруднит дальнейшую работу с ними. Например, может увеличиться количество полисахаридов на поверхности клеток, что приведет к ухудшению условий их выделения и лизиса, а также затруднит очистку рекомбинантного белка.
В барботажных колоннах воздух подается под высоким давлением в нижнюю часть биореактора; по мере подъема маленькие пузырьки воздуха объединяются, что приводит к неравномерному его распределению. Кроме того, подача воздуха под высоким давлением может привести к слишком сильному пенообразованию. Все это ограничивает универсальность данных конструкций и сужает диапазон реализуемых технологических условий, а также уменьшает возможный размер барботажных колонн.
Эрлифтные биореакторы могут использоваться как в экспериментальных установках, так и в целях промышленной ферментации. Газ в них подается в нижнюю часть вертикального канала. Поднимаясь, он увлекает за собой жидкость к верхней части канала – газожидкостному сепаратору, и здесь частично выходит в воздух. Более плотная деаэрированная жидкость опускается по другому вертикальному каналу ко дну реактора, и процесс повторяется. Таким образом, культуральная среда вместе с клетками непрерывно циркулирует в биореакторе.
Эрлифтные биореакторы бывают двух основных типов. В первом случае реактор представляет собой одну емкость с центральной трубкой, которая обеспечивает циркуляцию жидкости (реакторы с внутренней рециркуляцией) (рис. 16.4, В). Во втором культуральная среда проходит через отдельные, независимые каналы (реактор с внешней рециркуляцией) (рис. 16.4, Г). Конструкция эрлифтных реакторов с внутренней рециркуляцией проще, но если уж реактор построен, его объем и скорость циркуляции остаются неизменными. Напротив, биореактор с внешней рециркуляцией можно модифицировать и создавать разные условия ферментации.
Эрлифтные биореакторы, вообще говоря, более эффективны, чем барботажные колонны, особенно в случае суспензий микроорганизмов с большой плотностью или вязкостью. Перемешивание в них более эффективно и проблема слипания пузырьков не столь велика. В особенно больших эрлифтных ферментерах, таких как ферментер на 1 500 000 л фирмы IСI (Англия), сконструированный для получения белков одноклеточных микроорганизмов, для прохождения клетками полного цикла в реакторе требуется весьма значительное время. Чтобы обеспечить их субстратами на все время их перемещения с током жидкости, субстраты вводились по всей длине реактора сразу во многих точках.
ТИПИЧНЫЕ КРУПНОМАСШТАБНЫЕ
СИСТЕМЫ ФЕРМЕНТАЦИИ
Рекомбинантные микроорганизмы широко используются для получения разнообразных белковых продуктов, применяющихся в медицине (например, инсулина), а также в качестве своего рода «фабрик» по производству имеющих коммерческую ценность метаболитов (например, антибиотиков). Белки синтезируются наиболее интенсивно в период от середины экспоненциальной фазы до ее завершения, а метаболиты – в период замедления роста и в стационарной фазе. Все это должно учитываться при выборе параметров крупномасшабных процессов ферментации.
Оптимизация синтеза необходимого продукта – серьезная научная проблема. Если речь идет о белках, то для ее решения обычно используют клонированные гены, находящиеся под контролем сильных регулируемых промоторов. Вначале полагали, что для получения нужного количества продукта будет достаточно конститутивной экспрессии клонированного гена. Однако опыт показал, что при непрерывной транскрипции и трансляции клонированного гена истощаются все энергетические ресурсы клетки и ее рост замедляется. Чтобы приурочить экспрессию клонированного гена к определенной фазе роста, можно использовать механизм индукции. Для этого вначале выращивают клетки в оптимальных условиях до относительно высокой плотности, а затем индуцируют транскрипцию, либо изменяя температуру, либо добавляя в среду тот или иной химический индуктор в зависимости от природы промотора (например, изопропил-β-тиогалактопиранозид).
Двухступенчатая ферментация в большом биореакторе (>100 л) встречается с определенными трудностями, поскольку технически очень сложно быстро повысить температуру (обычно с 30 до 42 °С) в большом объеме или обеспечить быстрое и равномерное распределение химического индуктора. Эту проблему можно решить, если использовать два сообщающихся биореактора (двухступенчатая ферментация): клетки выращивают в одном из них, а индукцию осуществляют в другом. Это позволяет оптимизировать процессы роста и индукции по отдельности и увеличить количество продукта, синтезируемого за единицу времени.
Двухступенчатая ферментация в тандемных эрлифтных биореакторах
Штамм Е. coli NM989, несущий ген ДНК-лигазы Т4 под транскрипционным контролем промотора pL и температурочувствительного репрессора cl, выращивали и индуцировали в двухступенчатом эрлифтном биореакторе (рис. 16.5). Ген ДНК-лигазы был встроен в хромосомную ДНК, что снимало все проблемы, связанные с нестабильностью плазмид в ходе длительной ферментации. Клетки выращивали при 30 °С в эрлифтном биореакторе с внешней рециркуляцией и рабочим объемом 10 л. В этих условиях ген ДНК-лигазы не экспрессировался. Для индукции при 42 °С использовали эрлифтный биореактор с внешней рециркуляцией и рабочим объемом около 5 л. Биореакторы были соединены трубкой с насосом, который обеспечивал непрерывность подачи суспензии из первого биореактора во второй. Клеточную суспензию, достигшую определенной плотности, удаляли из биореактора, где проходила индукция, и подвергали дальнейшей обработке.
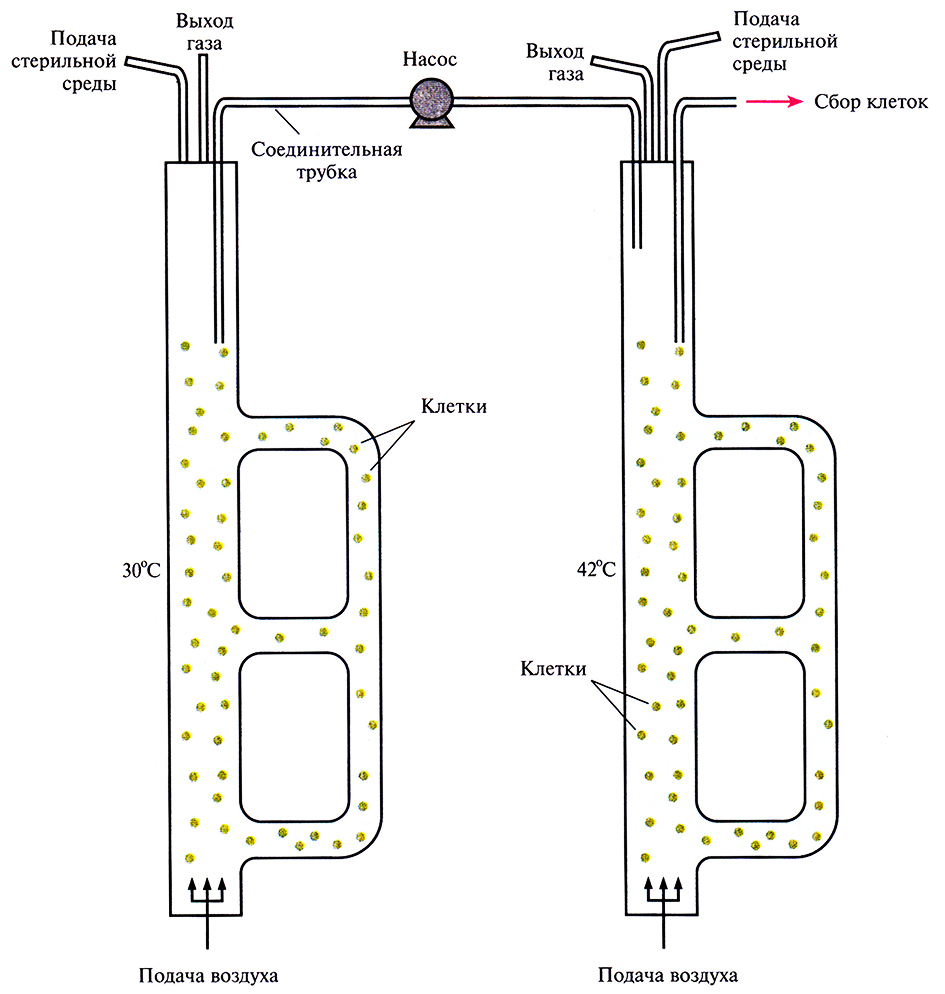
Рис. 16.5. Система из двух эрлифтных биореакторов, использующаяся для температурной индукции синтеза белкового продукта. Из ферментера, в котором осуществляется культивирование при 30 °С (слева), клетки поступают в ферментер с температурой 42 °С (справа), где происхоит индукция. У обоих биореакторов имеется двойное внешнее рециркуляционное устройство, оснащенное задвижками. Изменяя положение задвижек, можно создавать рабочий объем, оптимальный для данных условий.
Максимальная удельная скорость роста культуры (µmах) составляла примерно 0,66 ч–1 в первом биореакторе и 0,54 ч–1 во втором, что соответствовало времени удвоения 63 и 77 мин. Свежую среду непрерывно добавляли в ферментер, где росли клетки, со скоростью 2 л/ч, а из ферментера, где происходила индукция, отбирали такой же объем суспензии. Поскольку рабочие объемы биореакторов различались, клетки находились примерно 5 ч в биореакторе, где происходил рост, и 2 ч в биореакторе, где осуществлялась индукция. Различие во времени пребывания клеток в биореакторах было необходимо для оптимизации числа клеток, выхода продукции и стабильности ДНК-лигазы. Само время пребывания клеток в разных реакторах можно варьировать изменением их относительного рабочего объема и объема поступающих в первый биореактор питательных веществ.
Использованный в этой работе эрлифтный ферментер с двойной наружной рециркуляцией (рис. 16.5) позволил упростить регуляцию относительных рабочих объемов ферментеров, а также повысить гибкость системы (обеспечивать разные условия роста для разных популяций рекомбинантных клеток). При синтезе ДНК-лигазы наилучшие результаты были получены при ежеминутном поступлении примерно 33 мл клеточной суспензии из первого биореактора во второй. Это эквивалентно всего 0,67% объема биореактора, где осуществлялась индукция, что обеспечивало практически мгновенный подъем температуры всей поступающей суспензии с 30 до 42 °С. Для поддержания роста клеток, находящихся во втором биореакторе, в экспоненциальной фазе в него непрерывно добавлялось нужное количество питательных веществ в концентрированной форме. Это предотвращало расщепление ДНК-лигазы протеолитическими ферментами, которые обычно синтезируются клетками в фазе замедления и в стационарной фазе.
При росте в таком двухступенчатом биореакторе непрерывного действия культура штамма Е. coli NM989 может достигать плотности 4 г (сухого вещества) на L л, а на долю ДНК-лигазы Т4 может приходиться до 4% суммарного белка в клетке, что соответствует примерно 25 000 ЕД ферментативной активности на 1 г (сухого вещества). Вообще же с помощью описанного подхода можно синтезировать примерно 100 000 ЕД ферментативной активности на 1 л культуры, т. е. до 4 800 000 ЕД в сутки. С учетом того что после очистки фермента уровень активности уменьшается до 20% и что стоимость единицы активности равна примерно 0,25 долларов, получаем, что ежедневно можно синтезировать количество фермента на сумму 240 000 долларов. Мы не учли всех затрат на само производство белка, однако ясно и так, что прибыль от реализации ценных продуктов, полученных при непрерывной ферментации в биореакторах малого или среднего размера, значительно превышает затраты.
Двухступенчатая ферментация в одном реакторе
с механическим перемешиванием
Трехкомпонентный рекомбинантный белок AGPgal, использующийся при проведении иммунологических тестов, синтезировали в промышленных масштабах в одном биореакторе с механическим перемешиванием. Ген этого белка был сконструирован методами генной инженерии и содержал сегменты, кодирующие пять сайтов связывания иммуноглобулина G (IgG) А-белка Staphylococcus aureus, два сайта связывания IgG G-белка штамма G148 Streptococcus и β-галактозидазу Е. coli. Он находился под контролем промотора pR бактериофага λ, регуляция которого осуществляется так же, как регуляция pL-промотора, и был встроен в плазмиду, несущую ген устойчивости к ампициллину; этой конструкцией трансформировали клетки Е. coli. Штамм с плазмидой, несущей ДНК AGβgal, содержал вторую плазмиду, несущую ген температурочувствительного белка-репрессора cl и ген устойчивости к канамицину.
Культуру в объеме 5 л выращивали при 30 °С в присутствии ампициллина и канамицина, с тем чтобы обеспечить условия для сохранения обеих плазмид, а затем использовали в качестве посевного материала для инициации роста культуры без антибиотиков при 30 °С в реакторе с рабочим объемом 45 л. Суспензия клеток из 45-литрового ферментера в свою очередь служила посевным материалом для культивирования в биореакторе на 600 л, в котором клетки продолжали выращивать при 30 °С без антибиотиков (рис. 16.6). (Вообще говоря, для уменьшения стоимости процесса антибиотики при крупномасштабном культивировании в среду не добавляют.) Как только плотность культуры в биореакторе на 600 л достигала примерно 4 г/л, температуру повышали с 30 до 40 °С, чтобы индуцировать экспрессию гена белка AGβgal. На повышение температуры в этих условиях уходило около часа. Индукцию проводили при 40, а не при 42 °С, поскольку при более низкой температуре синтезировалось такое же количество белка AGβgal, но клетки могли расти в течение более длительного периода. Иными словами, при более низкой температуре индукции (40 °С) выход белкового продукта был больше.
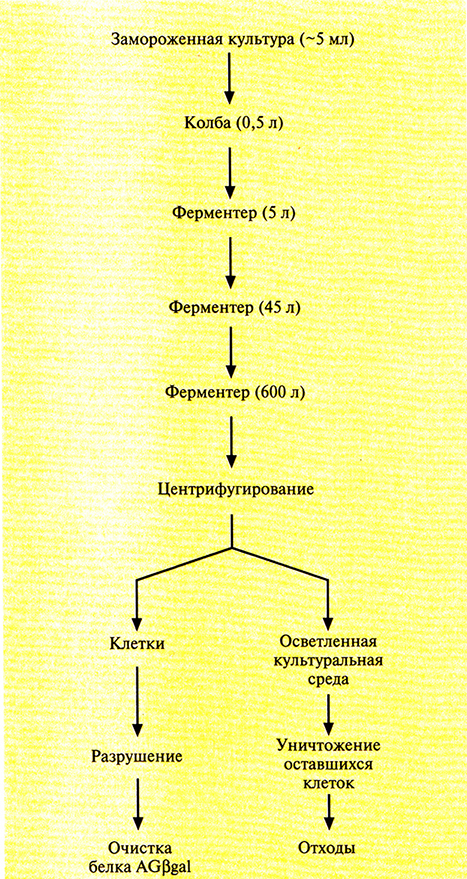
Рис. 16.6. Схематическое представление промышленного синтеза белка AGβgal. В скобках указан объем культуральной среды на каждом этапе. На ее долю приходится от 60 до 75% объема соответствующих биореакторов (ферментеров).
Удельная активность белка AGβgal в течение 2 ч после начала индукции повышалась, а затем снижалась. Возможно, это было связано с синтезом протеаз клетками, перешедшими в фазу замедленного роста или в стационарную фазу. Кроме того, примерно 50% клеток, росших в течение 4 ч при 40 С, утратили плазмиду. Но даже при этом после 4-часового культивирования при 40 °С на долю AGβgal-белка приходилось примерно 20% всей массы сухого вещества. Учитывая все это, можно не интегрировать гены белка AGβgal и репрессора сI в хромосомную ДНК хозяйской клетки Е. coli с целью увеличения выхода продуктов.
Периодическая ферментация и периодическая
ферментация с добавлением субстрата
В некоторых случаях для достижения высокой плотности культуры и получения больших количеств продукта достаточно проводить ферментацию в обычном периодическом режиме. В одном из экспериментов плазмиду, несущую ген гибридного белка, одним из компонентов которого был пептид инсулина В, помещали под контроль trp-промотора Е. coli и вводили в trp–-штамм Е. coli; трансформированные клетки культивировали в среде с разным содержанием триптофана. При высоких концентрациях последнего гибридный белок не синтезировался; последующее поглощение триптофана из среды растущими клетками приводило к индукции синтеза необходимого белка. Добавление триптофана в среду приводило к увеличению количества как биомассы, так и синтезируемого белка, а использование периодических ферментеров с добавлением постоянного количества субстрата еще более усиливало этот эффект (табл. 16.1).
Таблица 16.1. Синтез рекомбинантного белка одним из компонентов которого является пептид инсулина В,
при периодической ферментации и при периодической ферментации с добавлением субстрата1,2)

СБОР КЛЕТОК
Чтобы очистить продукт ферментации, нужно прежде всего отделить клетки от культуральной среды. Сбор генетически модифицированных и исходных, нетрансформированных клеток можно проводить одними и теми же методами. Однако трансформированные клетки часто обладают другими физиологическими свойствами (они имеют другой размер или синтезируют внеклеточные полисахариды), и в результате условия, оптимальные для сбора нетрансформированных клеток, могут не подходить для клеток, синтезирующих чужеродный белок.
Для выделения клеток из больших объемов культуральной среды часто используют высокоскоростное центрифугирование. Для этого сконструированы специальные высокоскоростные центрифуги полунепрерывного действия. Суспензию клеток непрерывно подают в барабан работающей центрифуги, клетки концентрируются в нем, а осветленная среда удаляется. Когда барабан заполняется осажденными клетками, центрифугу останавливают и клетки собирают. Основное неудобство данного способа – необходимость останавливать процесс, а затем снова начинать его. Кроме того, недостатками являются высокая стоимость оборудования и потребляемой им энергии, вероятность утечки микроорганизмов в окружающую среду, невозможность полного удаления клеток из среды.
Альтернативный метод выделения клеток из культуральной среды – фильтрация через мембрану. К сожалению, при обычной фильтрации клетки со временем забивают поры мембранного фильтра, накапливаются на его поверхности, и в результате скорость процесса быстро снижается (рис. 16.7, А). Фильтрацию можно ускорить, проводя ее под давлением, но это лишь временный эффект; клетки все равно будут накапливаться на поверхности мембраны, а кроме того, под давлением они образуют более плотный и менее проницаемый слой.
Чтобы решить эту проблему, клеточную суспензию пропускают с высокой скоростью параллельно поверхности мембраны (рис. 16.7, Б), так что через мембрану за один раунд проходит только небольшая часть циркулирующей жидкости. Остальная ее часть очищает мембрану от накопившихся клеток (см. рисунок), и в результате скорость фильтрации падает не так быстро, как при необратимом забивании фильтра. После многочисленных раундов фильтрации через мембрану проходит почти вся культуральная среда. Этот метод используется пока только в лаборатории; в промышленных процессах для сбора клеток применяют центрифугирование.
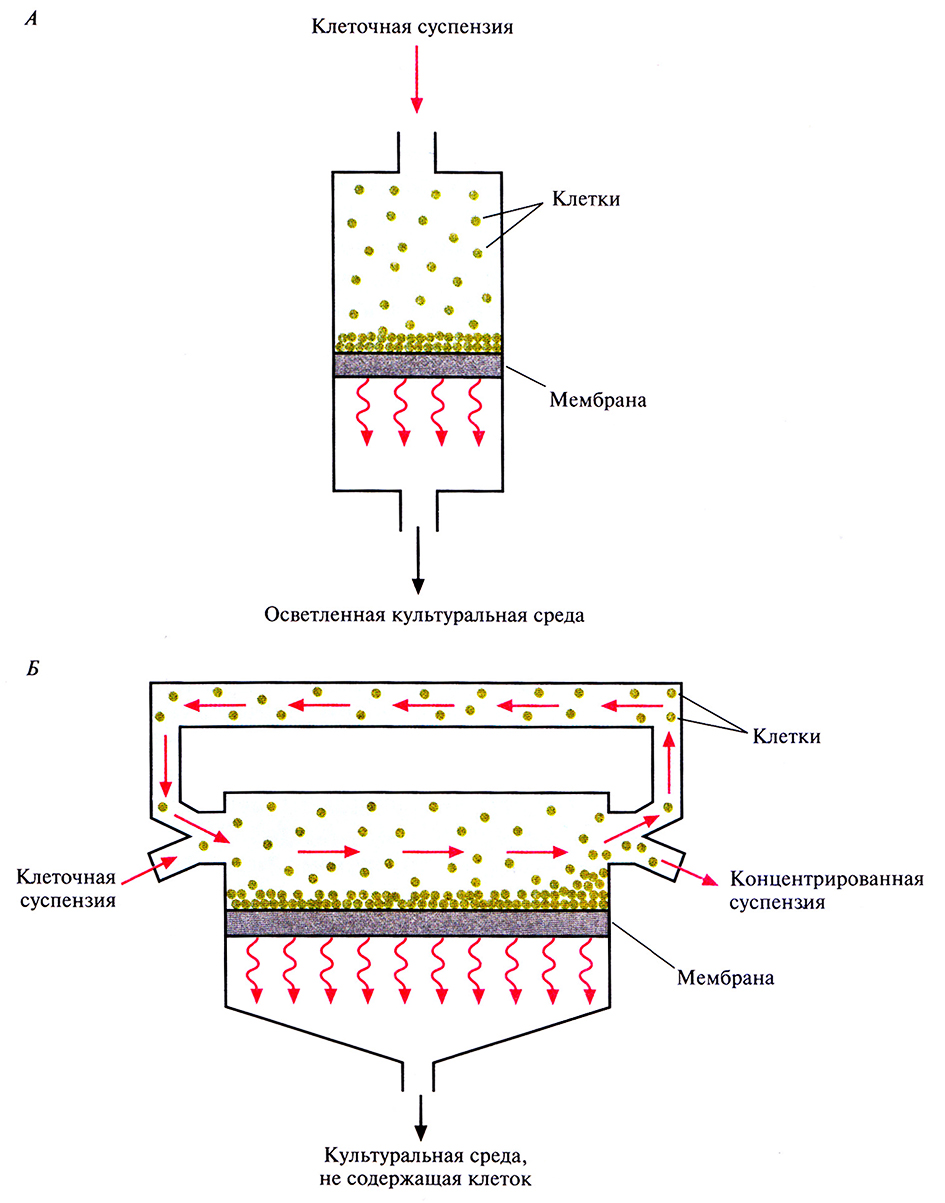
Рис. 16.7. Способы фильтрации, применяющиеся для сбора клеток. А. Фильтрация с необратимым забиванием фильтра. Б. Фильтрация с параллельным потоком клеточной суспензии. Стрелки – направление потока.
Дальнейшие действия зависят от природы и локализации продукта. Если продукт представляет собой белок, находящийся в культуральной среде, то среду концентрируют, а белок очищают хромотографическими или другими методами. Если продукт – это низкомолекулярное соединение, находящееся в культуральной среде, то используют соответствующие методы экстракции. Наконец, если продукт имеет внутриклеточную локализацию, то прежде чем очищать его, клетки разрушают.
РАЗРУШЕНИЕ КЛЕТОК
Для разрушения клеток используют разнообразные химические, биологические и физические методы. Все процедуры должны быть достаточно жесткими, чтобы разрушить клеточную стенку, и в тоже время достаточно мягкими, чтобы исключить денатурацию белка. А поскольку клеточные стенки у разных микроорганизмов состоят из разных полимеров, никакого универсального метода их разрушения не существует.
- У грамположительных бактерий клеточная стенка состоит из толстого пептидогликанового слоя N-ацетил глюкозам и на и остатков N-ацетилмурамовой кислоты, соединенных пептидными мостиками.
- У грамотрицательных бактерий клеточная стенка тоньше и покрыта снаружи слоем липидов.
- Стенка дрожжевых клеток состоит из плотного слоя частично фосфорилированных маннанов и β-глюканов.
- Низшие грибы имеют многослойные клеточные стенки, состоящие из α- и β-глюканов, гликопротеидов и хитина.
Состав и прочность клеточной стенки зависят от условий культивирования, скорости роста клеток, фазы, на которой они собираются, условий хранения сконцентрированных клеток и от того, экспрессировал ли выделенный микроорганизм клонированный ген.
Химические методы разрушения клеточных стенок включают обработку щелочью, органическими растворителями или детергентами. Если белковый продукт не разрушается при рН от 10,5 до 12,5, то можно без труда и дешево лизировать большие количества бактериальных клеток. Например, рекомбинантный гормон роста человека очень просто выделить из клеток Е. coli обработкой гидроксидом натрия при рН 11. После обработки щелочью не остается практически ни одной жизнеспособной клетки, что автоматически решает проблему утечки рекомбинантных микроорганизмов. Обработка органическими растворителями – это простой и недорогой способ разрушения клеток, который используется для выделения ферментов из дрожжей. Однако, чтобы убедиться в том, что в подобранных условиях белковый продукт не денатурирует, необходимо провести предварительное тестирование. Под действием детергентов в мембранах бактериальных клеток образуются поры, через которые белки и другие молекулы выходят из клетки. К сожалению, детергенты дороги, в большинстве случаев в их присутствии белки денатурируют, а кроме того, они могут загрязнять конечный продукт.
Основным биологическим методом разрушения клеток микроорганизмов является лизис с помошью ферментов. Так, лизопим яичного белка легко гидролизует клеточные стенки грамположительных бактерий. Для разрушения клеточных стенок грамотрицательных бактерий используют лизоцим и этилендиаминтетрауксусную кислоту (ЭДТА), а клеточные стенки дрожжей гидролизуют с помощью одного или нескольких ферментов: β-1,3-глюканазы, β-1,6-глкжаназы, манназы и хитиназы. Ферментативная обработка высокоспецифична, а лизис проходит в мягких условиях. Пока использование ферментов для лизиса клеток сдерживается их высокой стоимостью, но с применением рекомбинантных микроорганизмов для промышленного синтеза ферментов, разрушающих клеточные стенки, эта проблема будет решена.
Клетки можно разрушить и физическими методами: немеханическими (например, с помощью осмотического шока или быстрого многократного замораживания и оттаивания) или механическими (обработкой ультразвуком, с помощью шаровой мельницы, гомогенизации под давлением, соударения). Обычно после обработки немеханическими методами многие клетки остаются неповрежденными. Напротив, механическое разрушение высокоэффективно, что делает его более привлекательным. Особенно часто ультразвуковые излучатели, генерирующие высокочастотные звуковые волны, используют для обработки малых объемов. Клетки разрушаются при этом под действием гидродинамических сил (сдвига слоев жидкости друг относительно друга, кавитации и т.д.).
Для разрушения большого количества клеток обычно используют шаровые мельницы. Концентрированную клеточную суспензию заливают в камеру высокоскоростной шаровой мельницы, заполненную инертным абразивным материалом (например, стеклянными шариками диаметром <1 мм). Содержимое быстро перемешивают с помощью лопастей, насаженных на ось. Большинство клеток разрушается под действием сдвиговых напряжений, возникающих в результате быстрого движения шариков. Условия оптимального разрушения клеток можно подобрать, варьируя число и форму лопастей, скорость перемешивания, размер шариков, их число, концентрацию клеток, геометрию камеры и температуру. Приборы такого типа успешно использовались для разрушения клеток самых разных микроорганизмов. С их помощью можно легко разрушать клетки как нерекомбинантных, так и рекомбинантных микроорганизмов.
При гомогенизации под высоким давлением концентрированную клеточную суспензию продавливают через небольшое отверстие под высоким давлением, а затем давление резко сбрасывают, что и вызывает лизис. Условия обработки можно оптимизировать применительно к разным микроорганизмам. Для этого изменяют рабочее давление, размер и форму отверстия, температуру клеточной суспензии, число продавливаний.
Еще один механический метод разрушения клеток – соударение. Клеточную суспензию большой вязкости направляют под давлением на неподвижную поверхность или навстречу потоку другой суспензии. В месте соприкосновения выделяется большое количество энергии, разрушающей клетки. Таким способом с помощью устройства под названием Microfluidizer за один прием была разрушена большая часть клеток Е. coli в двух встречных потоках суспензии. Однако для разрушения клеток других микроорганизмов может понадобиться большее число раундов. В отличие от гомогенизаторов под высоким давлением и высокоскоростных шаровых мельниц, в которых, как правило, используются концентрированные клеточные суспензии, данное устройство пригодно для обработки любых суспензий. Как показали предварительные исследования, активность клеточных белков уменьшается при разрушении клеток по этой методике лишь незначительно. А если обработать суспензию клеток небольшим количеством лизоцима, а затем использовать устройство Microfluidizer в режиме пониженного по сравнению с обычным давления и при небольшой вязкости, то сохранится активность некоторых лабильных белков, инактивирующихся при высоком давлении.
ДАЛЬНЕЙШАЯ ОБРАБОТКА
После разрушения клеток их осколки удаляют либо низкоскоростным центрифугированием больших объемов, либо микрофильтрацией через мембрану. Белковый продукт осаждают из грубого или осветленного лизата органическими растворителями (спиртом или ацетоном) или сульфатом аммония. Достигаемое при этом обогащение – 2–5 раз. К сожалению, дороговизна агентов, использующихся для осаждения, может значительно увеличить стоимость процесса. В качестве альтернативы для концентрирования и выделения суммарных белков можно использовать ультрафильтрацию с параллельным потоком через мембраны с меньшим средним размером пор, чем у мембран, применяющихся для концентрации клеток или удаления их осколков (рис. 16.7, Б). Этот подход пока находится в стадии разработки, однако уже ясно, что он пригоден для работы с объемами от одного до нескольких тысяч литров, процесс может идти непрерывно (что позволяет уменьшить размеры установки) и обеспечивать 10–100-кратное обогащение (в зависимости от размеров и свойств выделяемого белка).
Необходимая степень очистки белкового продукта зависит от того, где его намереваются использовать. В одних случаях это может быть довольно грубый препарат, в других (например, если речь идет о белках, использующихся в медицине) – препарат высокой степени чистоты.
Некоторые белки, синтезирующиеся в клетках в избыточном количестве, образуют нерастворимые частицы (тельца включения). После разрушения клеток их легко можно отделить от большинства других клеточных компонентов. Вначале исследователям не удавалось дезагрегировать выделенные тельца включения так, чтобы при этом не произошла необратимая денатурация белков, но позже были разработаны методы, позволяющие ренатурировать рекомбинантный белок и восстановить его активность. Ясно, что все эти дополнительные процедуры увеличивают стоимость процесса очистки.
Солюбилизация белков
В некоторых случаях при гиперпродукции рекомбинантных белков образуются как растворимые, так и нерастворимые продукты, что усложняет процедуру очистки. Например, при экспрессии в клетках Е. coli гена инсулиноподобного фактора роста I (IGF-I) человека мол. массой 7,6 кДа примерно 90% рекомбинантных молекул локализуется в периплазме, а 10% секретируется. Чтобы выделить растворимую и нерастворимую формы IGF-I из периплазмы, для солюбилизации нерастворимой формы in situ добавляли мочевину и дитиогрентол до высоких концентраций при щелочном рН. При этом клетки погибали, но не разрушались, так что цитоплазматические белки оставались внутри клеток. В результате образовывался очень вязкий раствор, что затрудняло осаждение клеток и их осколков центрифугированием. Чтобы решить эту проблему, разработали процедуру двухфазной жидкостной экстракции, позволяющую разделять растворимые и нерастворимые продукты. И солюбилизация in situ, и двухфазная жидкостная экстракция высокоэффективны; с их помощью можно выделить от 80 до 95% IGF-I из культуры объемом от 10 до 1000 л.
ЗАКЛЮЧЕНИЕ
Для крупномасштабного культивирования рекомбинантных микроорганизмов в промышленных биореакторах (>1000 л) недостаточно просто экстраполировать условия роста в лабораторных ферментерах (0,1–1,0 л). При конструировании промышленных биореакторов необходимо учитывать такие параметры, как температура, рН, скорость и характер перемешивания, потребность аэробных организмов в кислороде, количество питательных веществ.
Ферментацию можно проводить по-разному. При периодической ферментации посевной материал вводят в свежую культуральную среду и проводят культивирование, не добавляя субстрат до тех пор, пока количество нужного продукта не достигнет максимума. В этих условиях рост культуры проходит шесть этапов: латентную фазу, фазу ускорения, логарифмическую (log) фазу, фазу замедления, стационарную фазу и фазу отмирания Больше всего белков синтезируется во время логарифмической фазы, а многие низкомолекулярные продукты – во время стационарной. При таком способе ферментации необходимо тщательно следить за тем, чтобы клетки были собраны в нужное время. При периодической ферментации с добавлением субстрата в биореактор добавляют свежую культуральную среду через разные интервалы времени, как правило для того, чтобы продлить логарифмическую фазу. Непрерывная ферментация предполагает добавление свежей среды в течение всего процесса и одновременное удаление клеток и отработанной среды.
Каждая из этих систем ферментации имеет свои недостатки и достоинства, которые нужно учитывать, применяя ее для промышленного синтеза рекомбинантных продуктов. Несмотря на то что непрерывная ферментация применяется в промышленном масштабе не очень широко, этот способ имеет ряд преимуществ и в будущем, по-видимому, получит большее распространение.
Один из подходов к увеличению количества рекомбинантного белкового продукта состоит в максимальном увеличении плотности культуры трансформированных клеток, синтезирующих данный продукт. Для достижения этой цели лучше всего использовать режим периодической ферментации с добавлением субстрата.
Все биореакторы можно отнести к одному из трех основных типов: реакторы с механическим перемешиванием, барботажные колонны, эрлифтные реакторы. В настоящее время в промышленности чаще всего используются биореакторы первого типа, но появляется интерес и к эрлифтным биореакторам. Механическое перемешивание обеспечивается с помощью механической мешалки, а в эрлифтных биореакторах для аэрации и перемешивания используют газ (обычно воздух), который подается под давлением через разбрызгиватель в дне сосуда. При этом во всем объеме происходит непрерывная циркуляция жидкой среды. Барботажные колонны сходны с эрлифтными реакторами, но их недостатком является отсутствие циркуляции культуральной среды. Для обеспечения стерильности, постоянства рН, температуры и других параметров используют разные способы в зависимости от дизайна биореактора. Для синтеза рекомбинантных белков применяют двухступенчатые процессы ферментации, осуществляемые в тандемных эрлифтных биореакторах или в одном реакторе с механическим перемешиванием.
Если синтезированный продукт накапливается в клетках, то их осаждают из культуральной среды центрифугированием или фильтрацией, затем разрушают ферментативными, химическими или механическими методами и выделяют нужный продукт. Если синтезируемый продукт секретируется в культуральную среду, то процедура его выделения и очистки значительно упрощается.

