Одной из основных задач селекционеров было получение высокоурожайных сортов растений с повышенной пищевой ценностью. Наибольшее внимание уделялось при этом таким зерновым культурам, как кукуруза, пшеница и рис, однако были осуществлены программы и по скрещиванию других сельскохозяйственных и садовых культур. В качестве важного инструмента прямого генетического воздействия на растения применяется технология рекомбинантных ДНК, широко использующаяся в микробиологических системах. К настоящему времени разработано несколько эффективных систем переноса ДНК и экспрессирующих векторов, которые работают в ряде растительных клеток. Одним из достоинств последних является их тотипотентность: из одной клетки может быть регенерировано целое растение, так что из клеток, сконструированных генноинженерными методами, можно получить фертильные растения, все клетки которых несут чужеродный(е) ген(ы) (трансгенные растения). Если такое растение цветет и дает жизнеспособные семена, то желаемый признак передается последующим поколениям.
Можно привести три основных аргумента в пользу получения трансгенных растений. Во-первых, введение гена (генов) часто приводит к повышению сельскохозяйственной ценности и декоративных качеств культурных растений. Во-вторых, трансгенные растения могут служить живыми биореакторами при малозатратном производстве экономически важных белков или метаболитов. В-третьих, генетическая трансформация растений (трансгеноз) позволяет изучать действие генов в ходе развития растения и других биологических процессов.
Некоторые генетически обусловленные признаки – такие как инсектицидная активность, устойчивость к вирусным заболеваниям и гербицидам, замедление старения, устойчивость к неблагоприятным условиям окружающей среды, измененная окраска цветков, повышенная пищевая ценность семян и самонесовместимость – могут быть приобретены растением при введении в него одного или нескольких генов. На сегодняшний день уже получены многочисленные трансгенные растения на основе как культурных, так и диких видов. Биотехнология несомненно внесет коррективы в традиционные программы разведения растений, в рамках которых для выведения нового сорта требуется от 10 до 15 лет. А в будущем с ее помощью можно будет создавать растения с совершенно новыми характеристиками.
ТРАНСФОРМАЦИЯ РАСТЕНИЙ TI-ПЛАЗМИДОЙ
ИЗ AGROBACTERIUM TUMEFACIENS
Грамотрицательная почвенная бактерия Agrobacterium tumefaciens – фитопатоген, который в процессе своего жизненного цикла трансформирует клетки растений. Эта трансформация приводит к образованию корончатого галла – опухоли, нарушающей нормальный рост растения (рис. 17.1). Этой болезни, имеющей серьезные агрономические последствия, подвержены только двудольные растения, в частности виноград, косточковые фруктовые деревья, розы.
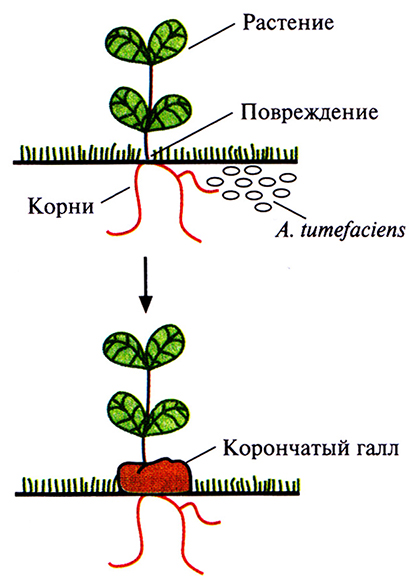
Рис. 17.1. Инфицирование растений A. tumefaciens и образование корончатого галла.
Образование корончатого галла начинается с проникновения, интеграции в геном растительных клеток и экспрессии специфического сегмента бактериальной плазмидной ДНК – так называемой Т-ДНК (от англ. transferred DNA). Т-ДНК – это часть плазмиды, индуцирующей развитие опухоли (tumor-inducing plasmid, Ti-плазмиды); ее несут большинство штаммов A. tumefaciens.
Длина Т-ДНК варьирует от 12 до 24 т. п. н. в зависимости от штамма. Штаммы A. tumefaciens, не содержащие Ti-илазмиды, не способны индуцировать развитие корончатого галла.
Инфекционный процесс начинается с прикрепления А. tumefaciens к клеткам растения в месте повреждения, часто у основания стебля (у корневой шейки). Ранее предполагалось, что A. tumefaciens заражает именно поврежденные растения вследствие разрушения клеточной стенки и устранения физического барьера, затрудняющего проникновение бактерий в клетку. Однако сейчас считается, что все дело в специфических фенольных соединениях, ацетосирингоне и гидроксиацетосирингоне (рис. 17.2), которые выделяет поврежденное растение. Эти соединения сходны с некоторыми продуктами основного пути синтеза у растений вторичных метаболитов, таких как лигнины и флавоноиды. Ацетосирингон и гидроксиацетосирингон активируют гены вирулентности (vir), которые локализованы в участке Ti-плазмиды длиной 35 т. п. н., находящемся за пределами Т-ДНК. Продукты vir-генов необходимы для транспорта и интеграции Т-ДНК (рис. 17.3) в геном растительной клетки. Существуют по меньшей мере семь разных vir-генов.
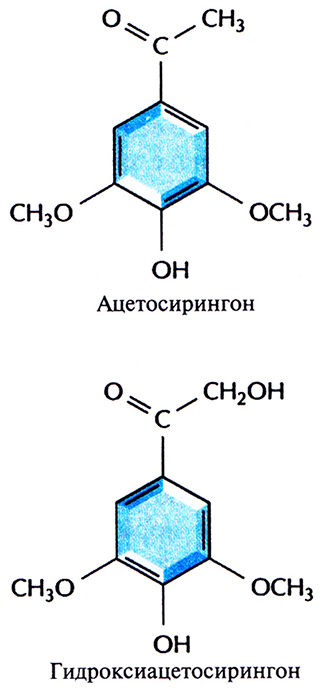
Рис. 17.2. Структурные формулы ацетосирингона и гидроксиацетосирингона. Эти соединения выделяются растением в ответ на повреждение и активируют vir-гены Ti-плазмиды.
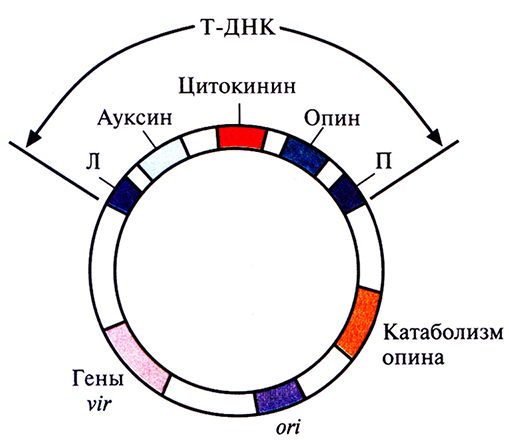
Рис. 17.3. Генетическая карта Ti-плазмиды (масштаб не соблюден). Т-ДНК содержит гены ауксина, цитокинина и опина, которые транскрибируются и транслируются только в растительных клетках. За пределами Т-ДНК находится кластер ил-генов, ген(ы), кодирующий(е) ферменты) катаболизма опина, и сайт инициации репликации (on), который обеспечивает стабильное поддержание плазмиды в A. tumefaciens. Л и П – левая и правая фланкирующие последовательности соответственно.
После присоединения A. tumefaciens, несущей Ti-плазмиду, к растительной клетке и активации vir-генов Т-ДНК транспортируется в клетку, по-видимому, с помощью механизма, аналогичного механизму переноса плазмидной ДНК из донорной клетки в реципиентную в процессе конъюгации. При этом Т-ДНК находится в одноцепочечной форме, и именно в такой форме она встраивается в хромосомную ДНК растения.
Переход Т-ДНК в одноцепочечную форму начинается с внесения в нее разрывов по обеим фланкирующим ее последовательностям. При этом правая фланкирующая последовательность оказывается на 5'-конце одноиепочечной Т-ДНК, а левая – на 3'-конце. Предполагается, что интеграция Т-ДНК в геном растения зависит от специфических последовательностей, локализованных в правой фланкирующей последовательности, которая содержит повтор длиной 25 п. н. Аналогичный повтор присутствует и в левой последовательности, однако, как показывает делеционный мутагенез, она не принимает участия в интеграции.
Большинство генов Т-ДНК активируются только после ее встраивания в геном растения. Их продукты и вызывают образование корончатого галла. Гены iaaM и iaaH, известные также как tms1 и tms2 соответственно, кодируют ферменты, принимающие участие в синтезе растительного гормона ауксина (индолилуксусной кислоты). Гены iaaM кодирует фермент триптофан-2-монооксигеназу, которая катализирует превращение триптофана в индолил-3-ацетамид, а ген iaaH – фермент индолил-3-ацетамидгидролазу, катализирующую образование индолилуксусной кислоты из индолил-3-ацетамида (рис. 17.4, А). Кроме того, Т-ДНК несет ген tmr (известный также как ген itp), кодирующий изопентилтрансферазу – фермент, который катализирует присоединение к 5'-AMP изопреноидной боковой цепи с образованием цитокининов изопентениладенина и изопентениладенозинмонофосфата (рис. 17.4, Б). При гидроксилировании этих соединений растительными ферментами образуются цитокинины трансзеатин и трансрибозилзеатин соответственно. И ауксин, и цитокинины регулируют рост и развитие растительной клетки, но, присутствуя в избытке, могут вызывать у растений образование опухолей, таких как корончатый галл.
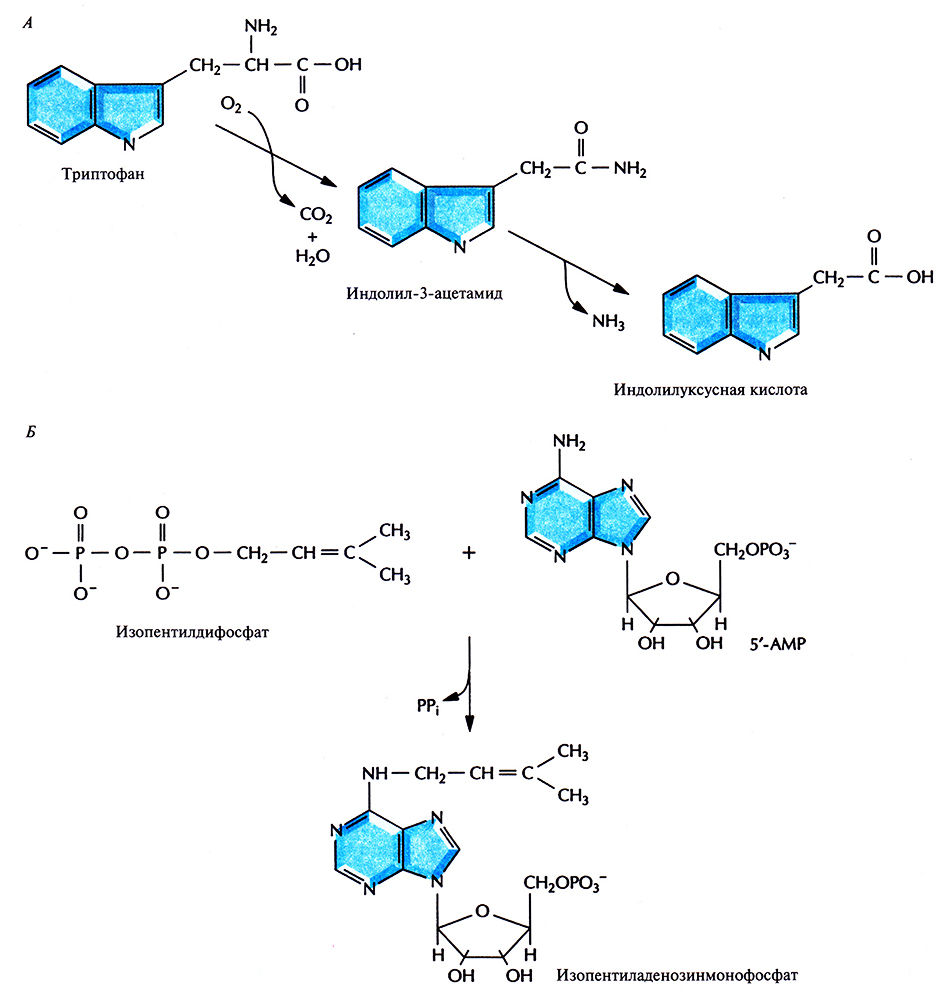
Рис. 17.4. Биосинтез ауксина и цитокинина при участии ферментов, кодируемых генами Т-ДНК Ti-плазмиды A. tumefaciens. А. Синтез ауксина начинается с превращения триптофана в индолил-3-ацетамид, катализируемого триптофанмонооксигеназой. Затем происходит превращение индолил-3-ацетамида в индолилуксусную кислоту ферментом индолил-3-ацетамидгидролазой. Б. Синтез цитокинина включает присоединение изопентенильной группы изопентенилдифосфата к 5'-АМР при участии фермента изопентенилтрансферазы с образованием изопентениладенозинмонофосфата.
Кроме генов ауксина и цитокинина, Т-ДНК каждой специфической Ti-плазмиды содержит ген, детерминирующий синтез соединения из класса опинов. Опины – это уникальные продукты конденсации амино- и кетокислот или аминокислот и Сахаров. Например, при конденсации аргинина и пировиноградной кислоты образуется октопин, аргинина и а-кетоглутаральдегида – нопалин, а бициклического производного глутаминовой кислоты и сахара – агропин (рис. 17.5). Опины синтезируются в корончатом галле, а затем секретируются. Они могут использоваться как источник углерода (а иногда и как источник азота) любой A. tumefaciens, которая несет в Ti-плазмиде ген(ы) катаболизма соответствующего опина (рис. 17.3), локализованные вне Т-ДНК. Большинство других исследованных почвенных микроорганизмов не способны использовать опины как источник углерода. Таким образом, в процессе эволюции выработался уникальный набор механизмов, посредством которых каждый штамм A. tumefaciens генетически трансформирует растительные клетки в «биологические фабрики» по производству соединений углерода, использовать которые могут только сами эти бактерии.
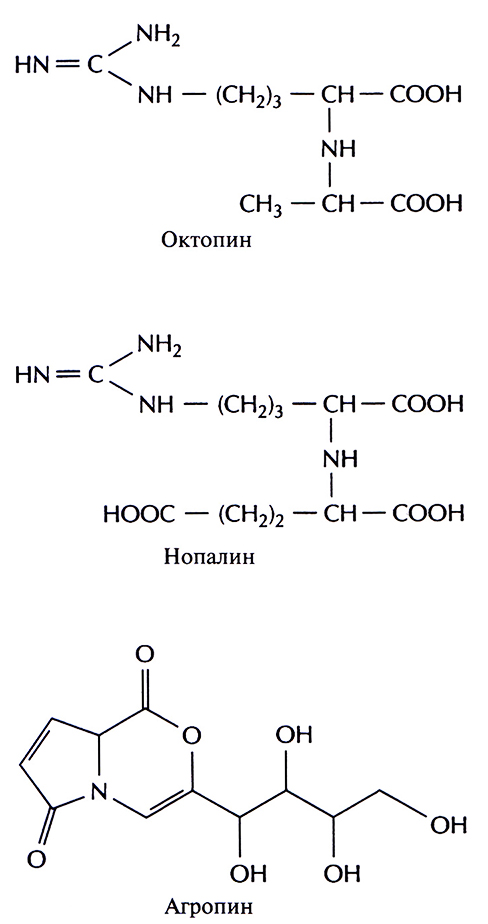
Рис. 17.5. Структурные формулы трех опинов: октопина, нопалина и атропина.
ВЕКТОРНЫЕ СИСТЕМЫ НА ОСНОВЕ TI-ПЛАЗМИД
Самый простой способ использования природной способности Ti-плазмид к генетической трансформации растений предполагает встраивание интересующей исследователя нуклеотидной последовательности в Т-ДНК, а затем использование Ti-плазмид и A. tumefaciens для доставки и встраивания клонированного гена (генов) в геном компетентной растительной клетки. Однако, несмотря на то что Ti-плазмиды являются эффективными природными векторами, имеется ряд серьезных ограничений на их использование в качестве векторов для клонирования.
- Фитогормоны, синтезируемые трансформированными клетками в культуре, подавляют регенерацию из этих клеток зрелого растения, поэтому при конструировании векторов на основе Ti-плазмиды гены ауксина и цитокинина должны быть удалены.
- Ген опина несуществен для трансгенных растений, но при его наличии может снижаться конечный выход биомассы, поскольку часть ресурсов расходуется на синтез опина. Следовательно, при создании векторов ген опина также должен быть удален.
- Ti-плазмиды имеют очень большой размер (от 200 до 800 т. п. н.), а для экспериментов с рекомбинантными ДНК нужны векторы меньшего размера, поэтому участки ДНК, несущественные для клонирующего вектора, должны быть удалены.
- Ti-плазмиды не реплицируются в Escherichia coli, что исключает работу с рекомбинантными Ti-плазмидами в этих бактериях. Следовательно, при конструировании векторов на основе Ti-плазмид необходимо ввести в них сайт инициации репликации, обеспечивающий их поддержание в Е. coli.
Несмотря на все эти сложности было сконструировано несколько векторов для растительных клеток. Все векторы на основе Ti-плазмид организованы сходным образом и имеют следующие элементы.
- Селективный маркерный ген, например ген неомицинфосфотрансферазы, который обеспечивает устойчивость трансформированных растительных клеток к канамицину. Поскольку этот ген (как и многие другие маркерные гены, используемые при трансформации растений) по своей природе прокариотический, необходимо поставить его под контроль растительных (эукариотических) сигналов регуляции транскрипции, в том числе промотора и сигнала терминации-полиаденилирования. Это обеспечит эффективную экспрессию гена в трансформированных растительных клетках.
- Сайт инициации репликации, который позволяет плазмиде реплицироваться в Е. coli. Некоторые векторы содержат также и сайт инициации репликации tumefaciens.
- Правая фланкирующая последовательность Т-ДНК. Этот элемент абсолютно необходим для интеграции Т-ДНК в клеточную ДНК растений. Большинство же векторов содержат как правую, так и левую фланкирующие последовательности.
- Полилинкер (множественный сайт клонирования) для встраивания гена в участок между границами Т-ДНК.
Поскольку клонирующие векторы не содержат генов vir, они сами не способны обеспечивать транспорт и интеграцию Т-ДНК в клетки растения-хозяина. Чтобы решить эту проблему, было разработано два подхода. В первом случае используют бинарную векторную систему (рис. 17.6, А). Бинарный клонирующий вектор содержит сайты инициации репликации и для Е. coli, и для A. tumefaciens, но не несет генов vir, т.е. это практически челночный вектор Е. coli – A. tumefaciens. Все стадии клонирования проводят в Е. coli, а затем вектор вводят в A. tumefaciens. Штамм-реципиент A. tumefaciens несет модифицированную неонкогенную («разоруженную») Ti-плазмиду; она содержит полный набор vir-генов, но из нее удалена часть (или вся) Т-ДНК (так что Т-ДНК не может быть транспортирована). В этой системе на неонкогенной Ti-плазмиде синтезируются продукты vir-генов, которые мобилизуют участок Т-ДНК бинарного клонирующего вектора. Продуцируя белки, кодируемые v/r-генами, неонкогенная Ti-плазмида выступает в роли помощника, способствуя встраиванию Т-ДНК из бинарного клонирующего вектора в хромосомную ДНК растения.
Во втором случае используют коинтегративную векторную систему. Векторная ДНК рекомбинирует в A. tumefaciens с «разоруженной» Ti-плазмидой, Т-ДНК которой не несет опухолеродных генов, таким образом, что весь клонирующий вектор встраивается в неонкогенную Ti-плазмиду (рис. 17.6, Б). Коинтегративный вектор и неонкогенная Ti-плазмида-помощник содержат гомологичные последовательности, которые образуют сайт для гомологичной рекомбинации in vivo. Обычно эти последовательности расположены в Т-ДНК. После рекомбинации клонирующий вектор становится частью неонкогенной Ti-плазмиды, которая содержит vir-гены, необходимые для переноса Т-ДНК в растительную хозяйскую клетку. Единственный способ поддержания клонирующего вектора в A. tumefaciens – это использование такой коинтегративной структуры. В данной конфигурации генетически сконструированный участок Т-ДНК может быть перенесен в растительные клетки.
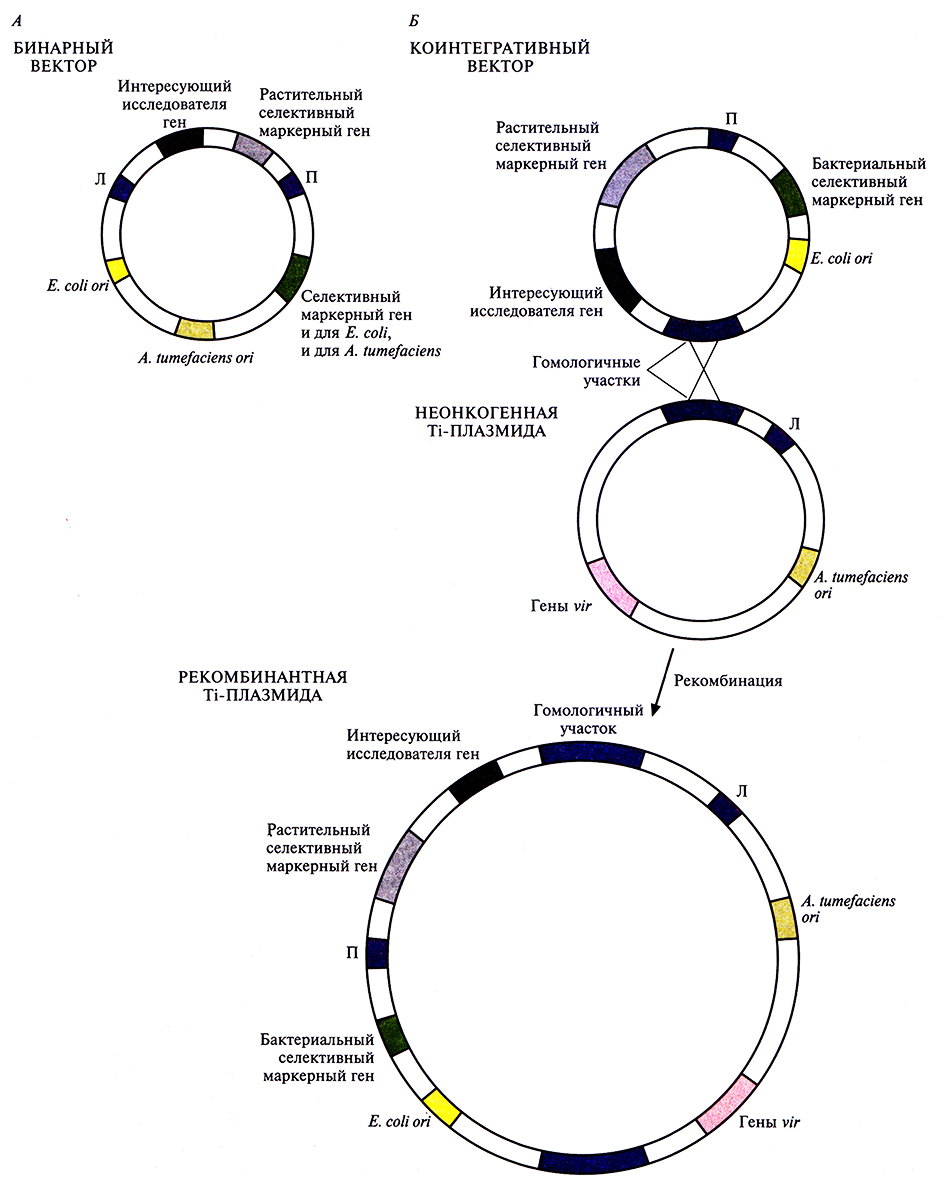
Рис. 17.6. Две векторные системы на основе Ti-плазмид. А. Бинарный клонирующий вектор содержит сайты инициации репликации (ori) и для Е. coli. и для A. tumefaciens (либо сайт инициации репликации для широкого круга хозяев), селективный маркерный ген, который может быть использован либо в Е. coli, либо в A. tumefaciens, а также интересующий исследователя ген и растительный селективный маркерный ген, встроенные в Т-ДНК. Б. Коинтегративный клонирующий вектор (вверху) содержит сайт инициации репликации только для Е. coli и не может автономно существовать в A. tumefaciens. Он также несет селективный маркерный ген, который используется либо в Е. coli, либо в A. tumefaciens. правую фланкирующую последовательность Т-ДНК (П), растительный селективный маркерный ген, ген, который нужно ввести в геном, и фрагмент Ti-плазмиды, гомологичный участку ДНК неонкогенной («разоруженной») Ti-плазмиды. Неонкогенная Ti-плазмида (в середине) содержит левую фланкирующую последовательность Т-ДНК (Л), кластер vir-reнов и сайт инициации репликации A. tumefaciens (ori). Гомологичная рекомбинация коинтегративного клонирующего вектора с неонкогенной Ti-плазмидой дает рекомбинантную плазмиду (внизу), которая несет клонированный ген и растительный репортерный ген, фланкированные правой и левой концевыми последовательностями Т-ДНК.
ФИЗИЧЕСКИЕ МЕТОДЫ ПЕРЕНОСА ГЕНОВ
В РАСТИТЕЛЬНЫЕ КЛЕТКИ
Системы переноса генов с помощью A. tumefaciens эффективно работают только в случае некоторых видов растений. В частности, однодольные растения, включая основные зерновые культуры (рис, пшеницу и кукурузу), практически не трансформируются A. tumefaciens. Тем не менее, модифицировав методики и тщательно контролируя условия, удалось трансформировать кукурузу и рис агробактериями A. tumefaciens, несущими векторы – производные Ti-плазмид. Так, например, незрелые зародыши кукурузы помещали на несколько минут в суспензию клеток A. tumefaciens, а затем инкубировали несколько дней в отсутствие селективного давления. После этого зародыши переносили в среду с антибиотиками, в которой могли расти только трансформированные растительные клетки. Эти клетки выдерживали в темноте в течение нескольких недель, затем переносили массу трансформированных растительных клеток на другую питательную среду и инкубировали на свету, чтобы произошла регенерация целого трансгенного растения.
В табл. 17.1 перечислен ряд методов трансформации однодольных растений. Некоторые из этих методов требуют удаления клеточной стенки с образованием протопластов. Последние поддерживают в культуре как независимо растущие клетки или в специальной питательной среде, где они образуют клеточные стенки; из таких клеток может быть регенерировано целое растение. Кроме того, разработаны методы трансформации, позволяющие вводить клонированный ген в небольшое число клеток растительной ткани, из которой можно регенерировать целое растение, обходясь без регенерации из протопластов. В настоящее время для доставки ДНК в клетки растений предпочитают использовать либо векторы на основе Ti-плазмид, либо бомбардировку микрочастицами (табл. 17.1). Таким способом было генетически трансформировано более 50 различных видов растений (табл. 17.2).
Таблица 17.1. Методы введения ДНК в клетки растений

Таблица 17.2. Генетически трансформированные растения

БОМБАРДИРОВКА МИКРОЧАСТИЦАМИ
Бомбардировка микрочастицами, или биолистика, – наиболее многообещающий метод введения ДНК в растительные клетки. Золотые или вольфрамовые сферические частицы диаметром 0,4–1,2 мкм покрывают ДНК, осажденной СаС12, спермидином или полиэтиленгликолем, и «выстреливают» ими в клетки из специального «ружья», приводимого в действие газами, образующимися при сгорании пороха, сжатым воздухом или гелием. Частицы разгоняются до скорости 300–600 м/с и пробивают клеточную стенку и мембраны растительной клетки. При этом их плотность такова, что клетки практически не повреждаются.
Попав в клетку, ДНК, покрывающая частицы, каким-то неизвестным способом интегрируется в растительную ДНК. Метод бомбардировки микрочастицами позволяет трансформировать растения самых разных видов, в том числе однодольные и хвойные, в которые не удается ввести ДНК с помощью Agrobacterium.
Бамбардировку микрочастицами можно использовать также для введения чужеродной ДНК в суспензию растительных клеток, культуры клеток, меристематические ткани, незрелые зародыши, протокормы, колеоптили и пыльцу широкого круга растений (табл. 17.3). Кроме того, с помощью этого метода были транспортированы гены в хлоропласта и митохондрии. На поверхность микрочастиц можно осадить плазмидную ДНК, растворенную в буфере. Это позволяет повысить частоту трансформации путем увеличения количества плазмидной ДНК; однако следует иметь в виду, что слишком большие ее количества могут оказаться губительными для клетки.
Таблица 17.3. Трансгенные растения, полученные бомбардировкой
различных растительных клеток микрочастицами1)

В трансформированных таким способом клетках, идентифицируемых по экспрессии маркерного гена, введенная ДНК зачастую экспрессируется лишь кратковременно. Пока чужеродная ДНК не встроится в геном растения, она с большой вероятностью утрачивается при делении трансформированных клеток.
Как интеграция, так и экспрессия чужеродных генов может зависеть от конфигурации вектора, используемого для их введения. Например, частота трансформации повышается, если используется линейная, а не кольцевая ДНК. Кроме того, при бомбардировке микрочастицами высокомолекулярные плазмиды (>10 т. п. н.) могут фрагментироваться, поэтому уровень экспрессии чужеродных генов окажется ниже, чем в случае плазм ид меньшего размера.
ПРИМЕНЕНИЕ РЕПОРТЕРНЫХ ГЕНОВ
ПРИ ТРАНСФОРМАЦИИ КЛЕТОК РАСТЕНИЙ
Для идентификации трансформированных клеток необходимо уметь обнаруживать чужеродную ДНК, интегрировавшую в геномную ДНК растения. Более того, при исследовании сигналов регуляции транскрипции и их функций в специфических растительных тканях (листьях, корнях или цветках) зачастую важно уметь количественно оценивать уровень экспрессии гена, кодирующего легко идентифицируемый продукт. Все это требует применения репортерных генов, которые позволяют либо проводить отбор трансформированных клеток, либо оценивать активность кодируемого ими фермента. Было протестировано несколько разных генов, которые можно использовать как доминантные селективные маркеры, и генов, чей белковый продукт можно обнаружить с помощью специфических методов (табл. 17.4). Поскольку многие из репортерных генов имеют бактериальное происхождение, они были снабжены регуляторными последовательностями, обеспечивающими их экспрессию в растительных клетках. Проводя отбор по доминантному маркеру, можно получить культуру, содержащую только трансформированные клетки. Так, в присутствии канамииина выживают только клетки растений, синтезирующих активную неомицинфосфотрансферазу.
Таблица 17.4. Системы репортерных и селективных маркерных генов растительных клеток

Выбор того или иного репортерного гена диктуется характером конкретного эксперимента. Если экспрессия гена мешает нормальному росту растения, то его нельзя использовать как репортерный. Кроме того, по мнению экспертов-биотехнологов, присутствие некоторых генов и их продуктов может приводить к загрязнению коммерческого продукта. В связи с этим лучше не вводить гены устойчивости к антибиотикам в сельскохозяйственные растения.
Некоторые продукты репортерных генов (например, β-D-глюкуронидазу, а также люциферазу, синтезируемую бактериями и светляками) можно обнаружить в интактных растительных тканях. В системах трансформации чаще всего используется ген β-D-глюкуронидазы Е. coli (GUS-ген). Он кодирует стабильный фермент, обычно отсутствующий в растениях, который катализирует расщепление β-D-глюкуронидов. Его активность в трансформированных растительных тканях можно обнаружить по появлению синей окраски в результате гидролиза неокрашенного субстрата, 5-бром-4-хлор-3-индолил-β-D-глюкуроновой кислоты. Альтернативный, более чувствительный метод количественной оценки активности GUS-генов в растительных экстрактах основан на определении интенсивности флуоресценции продукта гидролиза 4-метилумбелли-ферил-β-D-глюкуронида.
ЭКСПЕРИМЕНТЫ ПО ЭКСПРЕССИИ
ЧУЖЕРОДНЫХ ГЕНОВ В РАСТЕНИЯХ
После того как методика трансформации растений была полностью отработана, исследователи стали пытаться вводить различные растительные и бактериальные гены в клетки самых разных растений. Трансформированные растения проверяли на способность к синтезу чужеродного белка, проводили физиологические исследования, чтобы определить, как присутствие этого белка сказывается на всем растении. Во многих ранних экспериментах использовали промоторы, контролирующие конститутивную экспрессию в ряде растительных клеток. Не так давно были выделены и охарактеризованы растительные промоторы, контролирующие экспрессию чужеродных белков в специфических клетках на определенных стадиях роста и развития растения. Например, вместо сильного конститутивного 358-промотора вируса мозаики цветной капусты, функционирующего во всех растительных тканях в течение всей жизни растения, использовали промотор гена малой субъединицы фотосинтетического фермента рибулозобис-фосфат-карбоксилазы, работающего только в фотосинтезирующих тканях, например в листьях. Аналогично для контроля экспрессии некоторых чужеродных генов использовали растительные промоторы, функционирующие только в специфических тканях или только при неблагоприятных условиях.
Подавляющее большинство генов растений локализованы в ядерной ДНК, однако хлоропласта и митохондрии тоже содержат гены, кодирующие ряд важных и уникальных функций. При этом не все белки, присутствующие в этих органеллах, закодированы в их ДНК. Некоторые из них кодируются ядерной ДНК, синтезируются в цитоплазме, а затем с помощью специального механизма импортируются в соответствующую органеллу. Есть два способа введения специфического чужеродного белка в митохондрии или хлоропласты. Один способ – это слияние гена, кодирующего чужеродный белок, и последовательности сигнального пептида, направляющего белки в органеллы. Такая конструкция может быть встроена в хромосомную ДНК, и ре комбинантный белок будет импортироваться в соответствующую органеллу. Второй способ предполагает встраивание гена, кодирующего чужеродный белок, непосредственно в хлоропластную или митохондриальную ДНК.
ВАЖНАЯ ВЕХА
Регенерация жизнеспособных фертильных растений, синтезирующих октопинсинтазу, из корончатого галла табака после делеции генов, контролирующих образование опухоли
Н. De Grcve, J. Leemans, J. P. Hernalsteens, L. Thia-Toong, M. De Beuckeleer, L. Willmitzer, L. Otten, M. Van Montagu, J. Schell Nature 300: 752–755, 1982
Для получения трансгенных растений необходима эффективная векторная система. Первые попытки создания таких систем основывались на использовании Ti-плазмиды почвенной бактерии A. tumefaciens, поскольку после инфицирования чувствительных двудольных растений часть Ti-плазмиды (Т-ДНК) встраивается непосредственно в хромосомную ДНК клетки растения-реципиента. Однако при инфицировании растений Ti-плазмидой на трансформированных растениях образуется корончатый галл – опухоль, препятствующая нормальному росту растения. Поэтому прежде чем использовать Ti-плазмиду в качестве вектора для трансформации растений, необходимо предотвратить образование опухоли.
Изучая мРНК, транскрибируемые с интактных и модифицированных Т-ДНК, Шелл и др. показали, что гены, ответственные за развитие корончатого галла, локализованы в Т-ДНК. Это означало, что можно удалить из Т-ДНК эти гены и ввести ее с помощью гомологичной рекомбинации в Ti-плазмиду, а последнюю – в растительные клетки. Ti-плазмида, включившись в хромосомную ДНК обычным способом, перенесет и свою Т-ДНК, которая теперь не несет генов корончатого галла. Следующим логическим шагом в развитии этой системы стало клонирование чужеродного маркерного гена и гена, интересующего исследователя, в Т-ДНК, чтобы их можно было транспортировать в хромосомную ДНК растения-хозяина. Векторная система на основе Ti-плазмид нашла широкое применение во всем мире. Ее используют для создания трансгенных растений в тысячах лабораторий.
Выделение различных промоторов и их использование
Для выделения растительных промоторов из некоторых видов растений использовали специализированные так называемые «промотор-направленные» векторы и систему трансформации на основе Ti-плазмид Agrobacterium. Суть подхода состоит в следующем. Репортерный ген без промотора встраивают сразу за правой фланкирующей последовательностью вектора на основе Ti-плазмиды, и после переноса Т-ДНК в хромосому растения он оказывается в окружении растительной ДНК. Если Т-ДНК встроится в промоторный участок функционального гена, то произойдет транскрипция репортерного гена. Для идентификации растительных промоторов в качестве репортерного гена можно использовать ген неомицинфосфотрансферазы (npt). При этом экспрессию данного гена можно проконтролировать отбором канамицинустойчивых трансформантов. Однако таким способом трудно идентифицировать промоторы, функционирующие лишь на определенной стадии развития растения или индуцируемые специфическим фактором окружающей среды. Чтобы быть уверенным в отборе именно трансформированных клеток, в Т-ДНК следом за репортерным геном без промотора встраивают ген устойчивости к гигромицину, находящийся под контролем конститутивного промотора. Сначала отбирают гигромицинустойчивые клетки, а затем проверяют ферментативную активность трансформантов в условиях, обеспечивающих экспрессию репортерного гена. В результате обнаруживается, что от 5 до 30% трансформированных растительных клеток несут репортерный ген, находящийся под контролем активного промотора.
35S-промотор вируса мозаики цветной капусты часто используют в растительных системах как сильный промотор, хотя уровень экспрессии контролируемого им гена, кодирующего чужеродный белок, часто оказывается ниже, чем хотелось бы. Чтобы решить эту проблему и найти наиболее эффективный промотор, необходимо протестировать в растениях различные конструкции «промотор–ген». Кроме промотора, экспрессию чужеродных генов могут усиливать некоторые другие элементы, в частности энхансерные последовательности, расположенные на расстоянии от одной до нескольких сотен нуклеотидов до промотора, интроны, стабилизирующие мРНК, и сигналы терминации транскрипции.
Были протестированы ДНК-конструкции, содержащие все или некоторые из следующих элементов: 358-промотор; сигнал терминации транскрипции гена нопалинсинтазы; от одного до семи тандемных повторов энхансерных элементов; так называемая Ω-последовательность, которая предположительно усиливает экспрессию гена на уровне трансляции. Наиболее эффективная конструкция содержала семь энхансерных элементов, при этом уровень экспрессии чужеродного гена в трансгенных растениях табака и риса был намного выше, чем в случае одного 358-промотора (табл. 17.5). Протестированные промоторные конструкции контролировали экспрессию в трансгенных растениях широкого круга чужеродных генов. Такое разнообразие, вероятно, объясняется тем, что Т-ДНК встраивалась в разные сайты в геноме растения. Используя этот подход, можно создавать сильные тканеспецифичные промоторы, регулируемые в процессе развития.
Таблица 17.5. Тестирование промоторных конструкций в трансгенных растениях1,2)

Введение чужеродных генов в хлоропластную ДНК
У большинства высших растений в каждой клетке листа присутствует примерно 100 хлоропластов и каждый хлоропласт содержит примерно 100 копий хлоропластной ДНК. Для стабильной генетической трансформации хлоропластов с целью изменения их функциональных характеристик необходимо вводить чужеродные гены в хлоропластную, а не в хромосомную ДНК, длина которой примерно в 104–105 раз больше. Кроме того, необходимо, чтобы чужеродные гены присутствовали во всех из примерно 104 молекул хлоропластной ДНК, содержащихся в одной клетке.
Вначале чужеродные гены вводили в ДНК хлоропласте в составе плазмидного вектора, несущего неселективную чужеродную ДНК и селективный маркер, например ген устойчивости к антибиотику, фланкированные специфическими последовательностями хлоропластной ДНК (рис. 17.7). Такая стратегия была весьма эффективной, однако нередко селективный маркер мешал экспрессии фланкирующих хлоропластных генов. Чтобы решить эту проблему, разработали стратегию, в которой селективный маркер и чужеродный ген не были физически связаны друг с другом. Для этого растения табака трансформировали смесью одинаковых количеств двух разных плазмид: одна содержала селективный маркер (ген устойчивости к спектиномицину), фланкированный ДНК из одного участка хлоропластной ДНК, а вторая – чужеродный ген (ген устойчивости к канамицину), фланкированный последовательностями из другого участка хлоропластной ДНК (рис. 17.8). Оба гена имели прокариотические сигналы транскрипции, что обеспечивало их транскрипцию в хлоропластах, но не в ядре. Последовательности хлоропластной ДНК в плазмиде были организованы таким образом, что рекомбинация или встраивание в геном хлоропластов не приводила к нарушению работы какого-либо хлоропластного гена. Плазмиды вводили методом бомбардировки микрочастицами, а затем отбирали трансформированные растения табака на среде со спектиномицином. Хлоропласта из отобранных трансформантов проверяли на наличие продукта, детерминируемого геном устойчивости к канамицину (неселективным чужеродным геном). Удивительно, что примерно 30% спектиномицинустойчивых трансформантов экспрессировали также ген устойчивости к канамицину, что указывает на применимость котрансформации для введения чужеродных генов в хлоропластную ДНК.
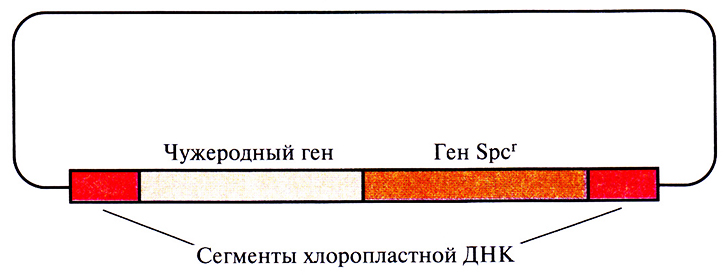
Рис. 17.7. Плазмидные векторы, используемые для введения тандемных генов в хлоропластную ДНК. Spcr – ген устойчивости к спектиномицину.

Рис. 17.8. Плазмидные векторы, используемые для встраивания в хлоропластную ДНК двух генов – селективного и неселективного. Spcr – ген устойчивости к спектиномицину.
ПОЛУЧЕНИЕ ТРАНСГЕННЫХ РАСТЕНИЙ,
НЕ СОДЕРЖАЩИХ МАРКЕРНЫХ ГЕНОВ
Обычно при введении чужеродного гена в растение одновременно вводится и селективный маркерный ген. Хотя до сих пор не было никаких указаний на то, что какой-либо из этих генов оказывает неблагоприятное воздействие на человека, животных или окружающую среду, последствия, к которым в принципе может привести включение в растения селективных маркерных генов, вызвали беспокойство общественности. Например, продукты некоторых маркерных генов могут оказаться аллергенами или токсичными веществами, а гены устойчивости к антибиотикам могут попасть в патогенные почвенные микроорганизмы. Кроме того, присутствие селективных маркеров технически затрудняет трансформацию трансгенных растений дополнительными генами, поскольку один селективный маркер не может использоваться дважды. Чтобы успокоить общественность, были разработаны методы получения трансгенных растений без каких-либо маркерных генов.
Один из экспериментальных подходов к получению безмаркерных трансгенных растений включает котрансформацию растений двумя разными ДНК, одна из которых несет маркерный ген, а другая – интересующий исследователя чужеродный ген. В этом случае от 30 до 80% растений содержат оба гена, которые, однако, интегрированы в разные сайты хромосомной ДНК. После отбора трансформантов маркерный ген можно удалить из трансгенного растения с помощью обычного скрещивания.
В рамках другого подхода селективный маркерный ген встраивают между растительными мобильными элементами (Ds-элементами) и такую конструкцию вводят в Т-ДНК вместе с геном транспозазы, которая вырезает участок ДНК между Ds-элементами и перемещает его в другой хромосомный сайт (рис. 17.9). В процессе встраивания Т-ДНК в ДНК растения-хозяина в 90% случаев селективный маркер, находящийся между двумя Ds-элементами, оказывается в другом сайте хромосомной ДНК, при этом с вероятностью 50% этот сайт находится далеко от исходного. Таким образом, селективный маркерный ген может использоваться для идентификации трансформированных растений, а затем удаляться при скрещивании.

Рис. 17.9. Схематическое представление Т-ДНК, входящей в состав вектора. После интеграции Т-ДНК в хромосомную ДНК растения транспозаза может вырезать селективный маркерный ген и встроить его в другой хромосомный сайт. Обозначения: Л и П – левая и правая фланкирующие последовательности, Ds – мобильный элемент. Промоторы и сигналы терминации транскрипции гена транспозазы, гена, интересующего исследователя, и селективного маркерного гена не показаны.
ЗАКЛЮЧЕНИЕ
С помощью генной инженерии можно вводить чужеродные гены в растительные клетки в культуре с последующей регенерацией целых фертильных растений из отобранных трансформированных клеток. Естественным путем трансформация растений осуществляется с помощью почвенных бактерий Agrobacterium tumefaciens. При поражении растения в нем начинает синтезироваться специфическое вещество. В ответ на этот химический сигнал A. tumefaciens прикрепляется к мембране растительной клетки, после чего происходит перенос части (Т-ДНК) бактериальной плазмиды (Ti-плазмиды) в ядро растительной клетки. Т-ДНК встраивается в растительный геном и экспрессируется. Т-ДНК содержит гены, кодирующие ферменты синтеза фитогормонов, которые вызывают увеличение размеров растительных клеток и их пролиферацию. Кроме того, растительные клетки начинают синтезировать опин, кодируемый Т-ДНК, который может использоваться только A. tumefaciens. Таким образом, в процессе эволюции сформировался механизм превращения растительной клетки в «фабрику» по производству вещества – источника углерода и азота (опина) исключительно для нужд A. tumefaciens.
Чтобы использовать природную способность A. tumefaciens проникать в растительные клетки для доставки в них клонированных генов, были созданы модифицированные Ti-плазмиды. Из Т-ДНК удаляли гены фитогормонов и гены метаболизма опина и встраивали такую измененную Т-ДНК в плазмиду, способную стабильно существовать в Е. coli. Встроенный в Т-ДНК ген-мишень попадал вместе с ней в ядро растительной клетки-реципиента. В случае бинарной системы челночный вектор с клонированным в Т-ДНК геном вводят в штамм A. tumefaciens, несущий модифицированную плазмиду с генами, необходимыми для переноса Т-ДНК в клетку растения (vir-генами). Кроме того, разработана коинтегративная система, которая предполагает введение челночного вектора в Л. tumefaciens, где он рекомбинирует с неонкогенной Ti-плазмидой, несущей vir-гены, с образованием одной плазмиды, в которой есть и функционирующие vir-гены, и Т-ДНК с клонированным геном. Участок Т-ДНК A. tumefaciens использовали для введения генов в различные растения. К сожалению, эта система применима не для всех видов растений. Эффективным методом доставки ДНК в различные растительные клетки являетcя также бомбардировка микрочастицами (биолистика).
Для обеспечения экспрессии чужеродных генов, введенных в растительные клетки, использовали растительные промоторы. Различные промоторы, функционирующие только в определенных растительных тканях или на определенной стадии развития растения, идентифицировали по экспрессии репортерного гена без промотора после его интеграции в хромосомную ДНК растения. Были разработаны методы встраивания чужеродных генов непосредственно в хлоропластную или митохондриальную ДНК так, чтобы кодируемый белок синтезировался прямо в этих органеллах. И наконец, для того чтобы успокоить общественность, были разработаны методы удаления маркерных генов из трансгенных растений.

