Любое микробиологическое производство можно представить в виде последовательно выполняемых технологических стадий или этапов. Общими для всех производств являются стадии подготовки питательной среды, получения посевного материала (маточной культуры), выращивания производственной культуры в поверхностных или глубинных условиях и выделения конечного продукта. В каждом конкретном микробиологическом производстве есть свои отличительные особенности. Они выражаются в составе используемых питательных сред и способах их приготовления, условиях культивирования производственной культуры и методах выделения конечного продукта. Однако эти особенности не меняют общую схему микробиологического производства.
Для получения биологически активных веществ, синтезируемых нерастущими, частично или полностью дифференцированными клетками растений, используют культивирование с разделением стадий роста и синтеза продукта: многостадийное периодическое и непрерывное культивирование.
3.1. ЗНАЧЕНИЕ АСЕПТИКИ В БИОТЕХНОЛОГИЧЕСКИХ ПРОЦЕССАХ
Требование надежной защиты среды, в которой культивируется производственный штамм микроорганизма-продуцента, от посторонней микрофлоры является одним из основных в биотехнологии. Асептика имеет особенно важное значение для производств тонкого микробиологического синтеза. Под асептическими условиями культивирования понимается возможность проведения этого процесса без попадания посторонней микрофлоры. Обеспечение асептических условий в масштабах крупного промышленного производства – весьма сложная инженерная проблема. В целом она решается двумя путями.
Первый путь заключается в обеспечении технологической гигиены производства. Сюда относится комплекс приемов и средств, обеспечивающих снижение загрязненности производственной среды посторонней микрофлорой и препятствующих распространению микроорганизмов-продуцентов по производственным помещениям и попаданию во внешнюю среду. Второй путь объединяет комплекс технических решений и методов, имеющих непосредственное отношение к технологии, и заключается в использовании специального технологического оборудования (фильтры, стерилизаторы) или реализации специфических требований асептики при создании основного технологического оборудования (культиваторы), контрольно-измерительных приборов, обвязок аппаратов и разводок трубопроводов. Конечной целью процессов, которые осуществляются с помощью этого оборудования, является стерилизация, т. е. полное освобождение от всего живого, всех видов материальных потоков, вводимых в культиватор (аэрирующий воздух, питательная среда, пеногасители и др.), и его внутренних полостей.
Обеспечение стерилизуемости и герметичности аппаратов и трубопроводов
Наиболее распространенный метод стерилизации аппаратов и трубопроводов – тепловая обработка насыщенным водяным паром. Этот метод надежнее, экономичнее и удобнее в производственных условиях, чем обработка химическими средствами. В некоторых случаях, когда обрабатываемые аппараты, их отдельные узлы или приборы не выдерживают нагрева до требуемых температур, применяют стерилизацию химическими средствами.
При тепловом методе обработки насыщенным водяным паром под стерилизуемостью аппаратов и трубопроводов понимается возможность создания во всех точках внутренних полостей необходимой температуры и поддержания ее в течение заданного времени. При этом предполагается, что минимально допустимая температура в наименее выгодном с точки зрения стерилизации месте аппарата должна быть выше летальной температуры наиболее термостойких споровых форм микроорганизмов при приемлемой продолжительности выдержки. Обычно эта температура лежит в пределах 115...120 °С при выдержке в течение 1 ч. В качестве тест-объекта можно использовать, например, Bacillus stearothermophilus.
После того как решена проблема герметизации основного оборудования стадии культивирования, обеспечение асептических условий зависит главным образом от эффективности уничтожения посторонней микрофлоры как внутри аппаратов (до начала процесса), так и во вводимых в ходе культивирования материальных потоках (питательная среда, различные добавки, пеногаситель, аэрирующий воздух).
Стерилизация питательных сред
Кроме жидких питательных сред, исходная бактериальная загрязненность которых достигает 104–106 клеток/см3, на стадии культивирования приходится периодически или непрерывно стерилизовать и вводить в культиватор (ферментер) жидкие пеногасители и различные растворы для подпитки (соли, глюкоза) или корректировки рН.
По различным причинам (экономичность, надежность, удобство в работе, сохранение качества) в микробиологических производствах в подавляющем большинстве случаев применяют тепловую стерилизацию водяным паром. Реже используют электронагрев и лишь для особо термолабильных сред применяют стерилизующую фильтрацию.
Тепловую стерилизацию жидких питательных сред осуществляют циклическим или непрерывным методами. Циклическую тепловую обработку обычно производят непосредственно в культиваторе, но возможно и применение специальной емкости. При циклическом методе одновременно нагревают весь объем среды. После этого среду выдерживают в течение определенного времени, а затем охлаждают до температуры культивирования.
При циклическом методе стерилизация происходит во время нагревания и охлаждения, поэтому возможен перегрев отдельных порций среды и трудно выдерживать и масштабировать режим стерилизации. При стерилизации больших количеств жидкостей цикл обработки длителен, а в объеме аппарата имеют место значительные градиенты температур. Поэтому в настоящее время периодическую тепловую стерилизацию применяют в основном для небольших емкостей (колбы, бутыли, аппараты вместимостью до 100 –200 дм3). В промышленных масштабах, как правило, применяют непрерывную стерилизацию в специальных установках, включающих нагреватель, выдерживатель и теплообменник-охладитель.
Непрерывный процесс тепловой обработки питательных сред позволяет регулировать режим стерилизации (температура и длительность выдержки) с высокой точностью и рекуперировать тепло. В результате непрерывный способ надежнее и экономичнее, чем периодический способ тепловой стерилизации. Одно из важнейших преимуществ непрерывного метода стерилизации – более широкая возможность влияния на качество обрабатываемых сред.
Очистка и стерилизация воздуха. Атмосферный воздух всегда содержит мельчайшие твердые или жидкие частицы, несущие различные микроорганизмы. Размеры этих частиц могут колебаться от десятых долей микрометра до десятков микрометров, а соотношение между различными фракциями зависит от местных условий. В любом случае атмосферный воздух является полидисперсным аэрозолем.
Спектр воздушной микрофлоры весьма разнообразен и также меняется в зависимости от местных условий, но во всех случаях в воздухе преимущественно сохраняются микроорганизмы, обладающие значительной устойчивостью к высыханию и действию солнечной радиации. Средняя общая исходная концентрация микроорганизмов в атмосферном воздухе может быть принята равной 2 • 103 клеток/м3.
Необходимость тонкой очистки и стерилизации воздуха возникает в микробиологических производствах не только при обеспечении аэрации, но и в некоторых других случаях, например при очистке воздушных выбросов из технологического оборудования и производственных помещений, вентиляции стерильных лабораторных помещений, боксов и производственных помещений, в которых необходимо поддерживать повышенный уровень чистоты для проведения технологических процессов в асептических условиях.
Основным требованием, предъявляемым к аэрирующему воздуху при культивировании, является стерильность, под которой понимается полное отсутствие микрофлоры. На практике, и особенно в промышленных условиях, обеспечить так называемую абсолютную стерильность (вероятность проникновения микрофлоры равна нулю), как правило, не удается. Поскольку проникновение даже единичного представителя посторонней микрофлоры в культиватор может привести к браку, допустимая вероятность проскока, которая устанавливается опытным путем, обычно невелика и составляет 10-3–10-6, т. е. проскок одного микроорганизма на 103–106 циклов аппарата-культиватора.
Для обеспечения приведенной выше вероятности проникновения посторонней микрофлоры системы очистки воздуха значение коэффициента проскока (отношение концентрации микроорганизмов в воздухе после системы очистки к их концентрации в воздухе до очистки, выраженное в процентах) должно лежать в пределах 10-8–10-11 %.
Стерильность воздуха может быть достигнута либо удалением взвешенных частиц из воздуха методами газовой очистки (механическими или электрическими), либо уничтожением микроорганизмов без удаления их из воздуха.
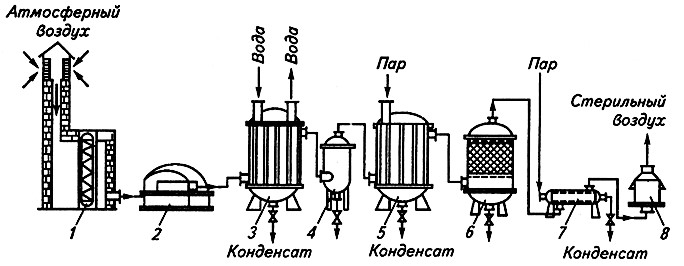
Рис. 3.1. Схема получения, очистки и стерилизации аэрирующего воздуха:
1 – предфильтр грубой очистки; 2 – компрессор; 3 – теплообменник-холодильник; 4– влагоотделитель;
5 – теплообменник-подогреватель; 6 – головной фильтр; 7 – теплообменник- подогреватель;
8 – индивидуальный фильтр тонкой очистки воздуха
В настоящее время наиболее эффективным, экономичным и универсальным способом тонкой очистки и стерилизации технологического или вентиляционного воздуха является фильтрация через слои насыпного пористого или волокнистого материалов. Обычно применяемые фильтры тонкой очистки имеют коэффициенты проскока в пределах до 10-4–106 %, что считается приемлемым для условий промышленного производства.
Для нужд технологии (главным образом аэрации при культивировании) на современных заводах тонкого микробиологического синтеза необходимо получать сотни тысяч кубических метров в час стерильного воздуха с коэффициентом проскока порядка 10-8–10-11 %, с избыточным давлением около 0,2 МПа, температурой 20...40°С и влажностью не более 80 %. Последнее требование связано с использованием на заключительной стадии в качестве основных аппаратов фильтров тонкой очистки.
Существующий уровень развития техники не позволяет получать в одном аппарате большие массы стерильного аэрирующего воздуха, отвечающего перечисленным требованиям. Поэтому используют системы из нескольких аппаратов (рис. 3.1).
3.2. КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ
3.2.1. ПОЛУЧЕНИЕ ПОСЕВНОГО МАТЕРИАЛА
Для производства посевного материала (маточной культуры) используют исходный штамм продуцента, получаемый из лаборатории чистых культур. Для приготовления необходимого количества посевного материала на предприятии организуют отделение чистой культуры, которое ведет постадийное выращивание посевного материала в асептических условиях, гарантирующих развитие только продуцента и полное отсутствие других микроорганизмов.
В зависимости от вида продуцента, его физиолого-биохимических особенностей приготовление посевного материала (до стадии производственной ферментации) проходит в несколько этапов: исходная культура → выращивание на скошенной агаризованной среде пересев и выращивание на качалке в колбах на жидкой питательной среде (одна-две стадии) → пересев и выращивание в посевных аппаратах (одна–несколько стадий) → засев производственной питательной среды и производственная ферментация.
Исходную культуру при оптимальных температурах выращивают в пробирках (рис. 3.2) на скошенной агаризованной питательной среде. Для микроскопических грибов выращивание длится до наступления обильного спорообразования (72–120 ч), для бактериальных и дрожжевых культур наиболее благоприятный возраст устанавливают экспериментально (в среднем 24–48 ч).
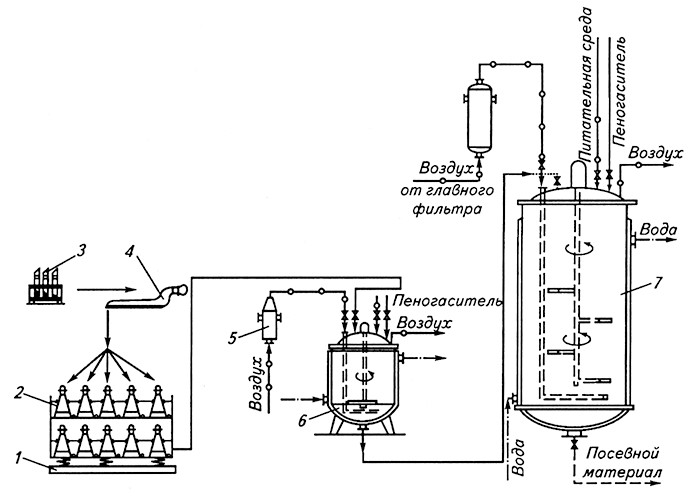
Рис. 3.2. Аппаратурио-технологическая схема получения глубинного посевного материала:
1 – качалка; 2 – колбы Эрленмейера; 3 – пробирки с исходной культурой; 4 – матрацы для исходного продуцента;
5 – фильтр; 6– малый инокулятор; 7– большой инокулятор
Исходный продуцент из пробирки пересевают на матрацы с большим количеством агаризованной среды.
Выращенную культуру (1–5 % к объему) стерильно смывают с поверхности агаризованной среды водой и переносят в колбы Эрленмейера вместимостью 750 см3, содержащие 50–100 см3 жидкой питательной среды. Колбы с засеянной питательной средой помещают на качалку (120–240 мин-1) при температуре 28... 30 °С и выдерживают в течение 18–144 ч. Выращивание микроорганизмов при перемешивании (встряхивании) увеличивает скорость роста культуры, что связано с интенсификацией массообмена. Эту стадию выращивания контролируют по морфологическим показателям микроорганизма. Наилучшие результаты дает культура, которая находится в стадии физиологической зрелости в конце логарифмической фазы роста. Для повышения титра клеток в инокуляте и увеличения количества посевного материала культуру выращивают в несколько стадий.
Готовую культуру стерильно переносят в посевной аппарат (малый инокулятор) с предварительно простерилизованной питательной средой. Посевной аппарат оснащен мешалкой, аэрирующим устройством, а также контрольно-измерительной аппаратурой для регулирования температуры, рН среды, уровня пенообразования и т.д. Стерильный воздух подается в инокулятор через индивидуальный фильтр. Готовую культуру из малого инокулятора передавливают стерильным воздухом в большой инокулятор на свежую питательную среду. Вместимость посевного аппарата может быть различной (0,1–10 м3), длительность культивирования зависит от физиологических особенностей микроорганизма-продуцента, а количество стадий выращивания определяется объемом производства и нормой расхода посевного материала для каждого продуцента.
3.2.2. ПОВЕРХНОСТНОЕ И ГЛУБИННОЕ КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ
В биотехнологии для культивирования микроорганизмов применяют поверхностный и глубинный способы.
При поверхностном способе микроорганизмы культивируют на твердых средах (увлажненные отруби) или на поверхности жидких питательных сред. Твердые (сыпучие) среды распределяют слоем 18–20 см в специальных кюветах. Процесс культивирования начинается с засева питательной среды чистой культурой продуцента. Засеянная среда выдерживается в растильных камерах при определенной температуре и аэрации. Процесс заканчивается накоплением максимального количества продукта (рис. 3.3). Поверхностный метод выращивания применим только для аэробных культур.
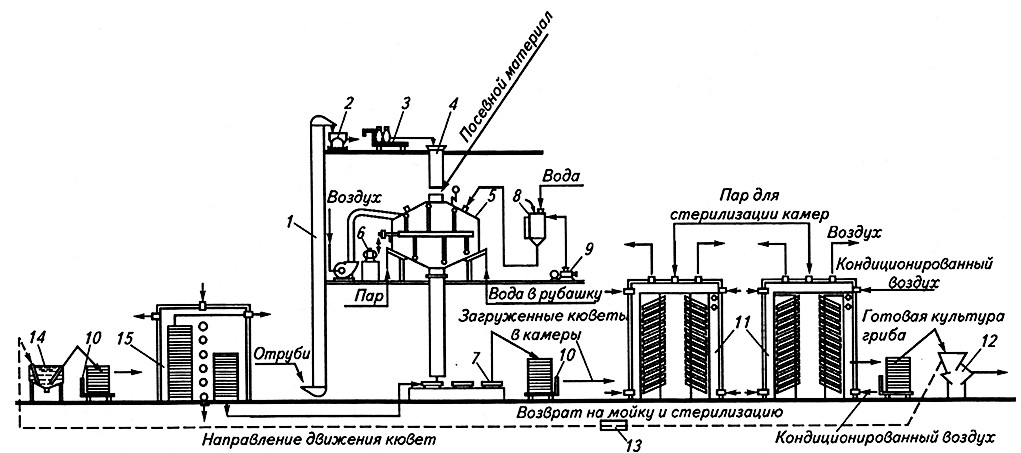
Рис. 3.3. Аппаратурно-технологическая схема выращивания культур
микроорганизмов поверхностным методом (на кюветах):
1 – нория; 2 – компрессор; 3 – весы; 4 – труба для подачи отрубей в стерилизатор; 5 – стерилизатор для отрубей;
6 – электродвигатель привода стерилизатора; 7 – кюветы; 8 – мерник стерильной воды; 9 – компрессор;
10 – тележка с кюветами; 11 – растильные камеры; 12 – дробилка готовой культуры; 13 – грязная кювета;
14 – ванна для мойки кювет; 15 – камера для стерилизации кювет
Глубинный способ выращивания применим как для аэробных, так и для анаэробных микроорганизмов. Культуры при этом развиваются во всей толще жидкой питательной среды в ферментере (рис. 3.4).
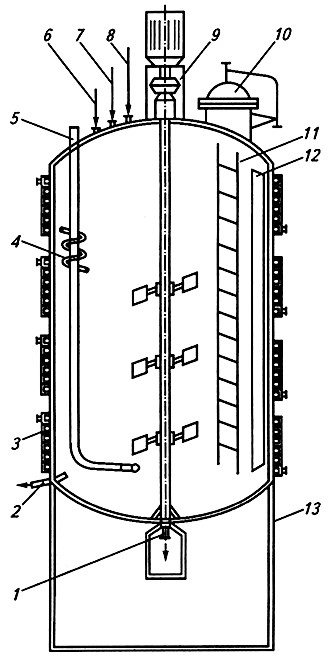
Рис. 3.4. Схема ферментера:
1 – штуцер для слива; 2 – штуцер для отбора проб; 3 – рубашка; 4 – змеевик;
5 – барботер; 6 – линия подачи титрующего раствора; 7 – линия подачи пеногасителя; 8 – линия загрузки;
9 – мешалка с приводом; 10 – люк-лаз; 11 – лестница; 12 – отбойник; 13 – опорная царга («юбка»)
Глубинный метод выращивания микроорганизмов может быть периодическим и непрерывным (проточным).
Ферментер (см. рис. 3.4) представляет собой герметичную емкость со сферическими крышкой и днищем. Вместимость аппарата может составлять от 0,01 до 100 м3. Высота ферментера в 2–2,5 раза превышает его диаметр. Ферментер снабжен термостатирующим, перемешивающим, аэрирующим и регулирующим рН среды устройствами, оборудован системой подачи питательной среды, пеногасителя, воды, пара и т.д. Тепло, выделяемое в период роста микроорганизмов, отводится с помощью различных теплообменных конструкций: рубашек и змеевиков.
Производственное культивирование проводят в стерильных условиях. Перед заполнением ферментера питательной средой его моют, проверяют на герметичность, стерилизуют. Одновременно с ферментером паром стерилизуют также всю систему трубопроводов. В ферментер, заполненный стерильной питательной средой (объем обычно не превышает 70 % общего объема аппарата), вводят посевной материал. Предварительно температуру и рН питательной среды доводят до оптимальных для данного микроорганизма-продуцента значений.
Стадия производственного культивирования для большинства микроорганизмов длится 48–72 ч. Однако имеются бактериальные культуры, длительность выращивания которых не превышает 24 ч; культивирование некоторых актиномицетов и микроскопических грибов длится до 12 сут. На протяжении всего этого периода растущую глубинную культуру необходимо снабжать кислородом. Микроорганизмы могут использовать только растворенный кислород. Насыщение питательной среды кислородом воздуха осуществляют путем аэрации, обеспечивающей контакт между воздушной и жидкой фазами. Наибольшее распространение в микробиологической промышленности получили аэрирующие устройства барботажного типа.
Для успешного выращивания производственных культур большое значение имеет предотвращение пенообразования. Все ферментеры снабжены устройствами для введения пеногасителя и контроля высоты пены в аппарате. Для снижения пенообразования используют химические (растительные и животные масла, различные силиконы) и механические (циклоны, вращающиеся в верхней части ферментера лопасти) средства пеногашения (рис. 3.5).
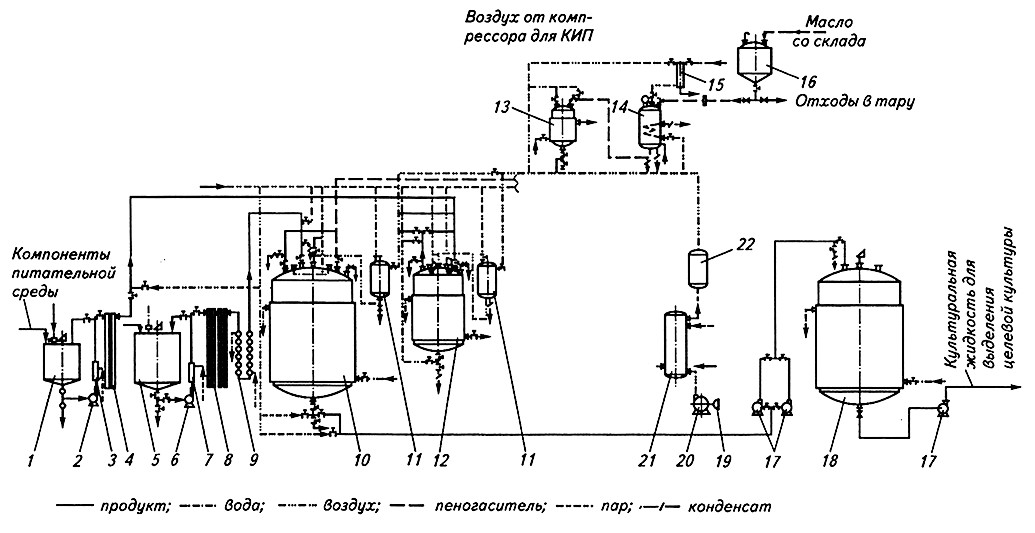
Рис. 3.5. Аппаратурно-технологическая схема выращивания культур микроорганизмов глубинным способом:
1 – смеситель для среды, предназначенной для выращивания маточной культуры; 2 – вихревой насос;
3 – подогреватель среды для маточной культуры;4 – выдерживатель нагретой среды для маточной культуры;
5– смеситель для среды, направляемой в ферментер; 6 – насос; 7– подогреватель среды для производственной культуры;
8 – выдержи ватель; 9 – теплообменник для охлаждения среды; 10– ферментер; 11 – фильтры для воздуха (индивидуальные);
12 – маточник; 13 – дозатор для пеногасителя; 14 – стерилизатор для пеногасителя;
15 – воздушный фильтр со стеклянной ватой; 16 – сборник для пеногасителя; 17 – насосы;
18 – промежуточная емкость для готовой культуры; 19 – воздушный фильтр масляный ячейковый;
20 – воздуходувка; 21 – охладитель для воздуха; 22 – общий фильтр для воздуха
В процессе культивирования ведут постоянный контроль за состоянием культуры и накоплением продуктов биосинтеза, фиксируют потребление основных компонентов среды (источников углерода, азота, фосфора), контролируют рН культуральной жидкости.
При периодическом процессе изменяются скорость роста, физиолого-биохимические и морфологические показатели культуры. Развитие культуры при периодическом способе выращивания начинается с лагфазы и заканчивается стационарной фазой или фазой отмирания.
При непрерывном (проточном) культивировании создаются условия развития культуры, различающиеся по способу поддержания культуры в динамическом равновесии.
Используют открытые и замкнутые системы непрерывного культивирования.
В открытых системах клетки микроорганизмов постоянно удаляются с культуральной жидкостью со скоростью образования в системе новых клеток для достижения их устойчивой концентрации.
В замкнутых системах клетки в течение определенного времени задерживаются в системе и их количество возрастает. В этих условиях большая часть клеток отмирает под действием лимитирующих факторов, и в такой системе невозможно достигнуть динамического равновесия. Замкнутые системы значительно менее эффективны для осуществления точного регулирования всех условий культивирования, управления ими и автоматизации процесса, чем открытые.
Непрерывный процесс может быть гомогенно- и гетерогенно-непрерывным. При гомогенно-непрерывном процессе в ферментере с интенсивным перемешиванием все параметры (концентрация питательных веществ, скорость роста микроорганизмов) постоянны во времени. При гетерогенно-непрерывном процессе несколько ферментеров соединяют в батарею. При этом не обеспечиваются постоянные условия роста клеток, так как в каждом ферментере поддерживаются свои постоянные условия культивирования, отличающиеся от условий в других ферментерах.
Метод проточного культивирования может быть организован как процесс полного вытеснения и как процесс полного смешения.
В процессе полного вытеснения ферментер для выращивания микроорганизмов представляет собой цилиндрическую емкость, в которую с одной стороны подаются питательная среда и посевной материал, а с другой вытекает культуральная жидкость (рис. 3.6). Перемешивание культуры не производится. Этот процесс применим для культивирования анаэробных микроорганизмов.
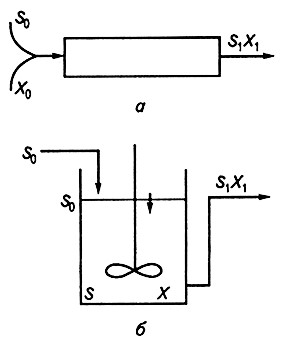
Рис. 3.6. Схема процессов непрерывного культивирования:
а – тубулярный ферментер полного вытеснения; б – ферментер полного смешения;
S0 – концентрация субстрата в поступающей среде; S – концентрация субстрата в ферментере;
S1 – концентрация субстрата в вытекающей среде; X0 – плотность подаваемой популяции;
X – плотность популяции в ферментере; Х1 – плотность популяции в вытекающей культуре
По ходу тубулярного ферментера происходит развитие культуры, выражающееся в использовании субстрата, накоплении биомассы и продуктов метаболизма, и перед вытеканием культура находится в состоянии, аналогичном стационарной фазе роста периодической культуры, т.е. воспроизводится полная кривая роста, но не во времени, а в пространстве. Подобная картина наблюдается и в батарее проточных ферментеров.
В процессе полного смешения рост культуры происходит в емкости-ферментере при интенсивном перемешивании, достигаемом продуванием воздуха и работой мешалки. Во всей массе культуры создаются одинаковые условия выращивания (гомогенно-непрерывный процесс).
При гомогенно-непрерывном процессе в ферментере могут быть созданы условия, соответствующие любой точке кривой роста культуры, выращиваемой периодическим способом. В установившемся режиме удельная скорость протока среды равна удельной скорости роста культуры. При этом культура находится в состоянии динамического равновесия и обладает способностью быстро реагировать на изменение условий.
Хорошо отработанный непрерывный процесс выращивания экономически выгодно воспроизводить проточным методом культивирования, так как культура непрерывно находится в состоянии максимальной активности и не тратится время на подготовку ферментера, его заполнение, слив и на лаг-фазу.
При гомогенно-непрерывном культивировании можно осуществить недоступное при периодическом культивировании ограничение роста культуры одним элементом питания при нелимитирусмых количествах остальных элементов. При медленном протоке ограничение роста будет сильным, при быстром – слабым. Такое непрерывное культивирование называется хемостатным (или хемостат), так как рост микроорганизмов регулируют химические факторы среды.
Хемостатный метод имеет большое число вариантов. Применение одностадийного культивирования позволяет воспроизвести любую скорость роста, кроме максимальной. Двухстадийное культивирование в двух последовательно соединенных ферментерах позволяет достичь максимальной скорости роста и даже превзойти ее. Для этого в первом ферментере батареи ведется нормальное культивирование при скорости протока, меньшей максимально возможной скорости роста в одном аппарате, а во второй подается культура из первого и свежая питательная среда (рис. 3.7, а).
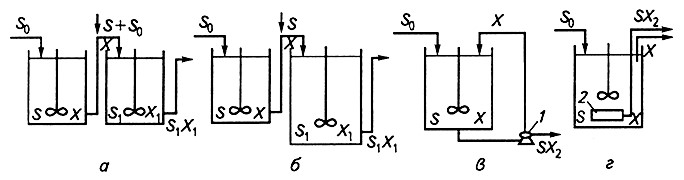
Рис. 3.7. Варианты хемостатного культивирования:
а, б – батареи из двух ферментеров; в – ферментер с возвратом микробной массы;
г – ферментер с фильтрующим устройством; 1 – сепаратор; 2 – фильтр;
S0 – концентрация субстрата в поступающей среде; S – концентрация субстрата в ферментере;
S1 – концентрация субстрата во втором ферментере; X– плотность популяции в первом ферментере;
Х1 – плотность популяции во втором ферментере; X2 – плотность популяции в вытекающей среде
Максимальная скорость роста культуры может быть достигнута при турбидостатном культивировании (в режиме турбидостата), при котором контроль за процессом осуществляется с помощью измерения концентрации микроорганизмов на выходе из аппарата и она поддерживается на постоянном уровне за счет изменения скорости протока питательной среды.
В двухстадийном культивировании можно повысить синтез вторичных метаболитов (ферментов и др.) по сравнению с одностадийным хемостатным. В первом ферментере ведется выращивание культуры при большой скорости роста, что соответствует логарифмической фазе периодической культуры. Второй используемый ферментер большего объема (рис. 3.7, б), поэтому культура, поступающая из первого аппарата, оказывается в условиях замедленного роста: скорость роста культуры снижается во столько раз, во сколько второй аппарат содержит больше среды, чем первый. Это соответствует условиям стационарной фазы.
При низких концентрациях субстрата и невысокой плотности популяции можно возвратить в ферментер часть клеток вместе с вытекающей из него культуральной жидкостью, чтобы повысить концентрацию клеток и ускорить процесс. Существует два варианта возврата: 1) путем сепарирования вытекающей культуры и подачи в ферментер сгущенной части культуральной жидкости (рис. 3.7, в); 2) путем установки в ферментере или после него фильтрующего устройства, задерживающего клетки, но позволяющего удалять культуральную жидкость (рис. 3.7, г). Существуют методы культивирования, занимающие промежуточное положение между непрерывными и периодическими:
- отъемно-доливной – среда порциями подается в ферментер и так же порциями отбирается из него;
- добавление среды к периодической культуре без отбора культуры. Этот метод удлиняет время культивирования, но приводит к более полному использованию имеющихся в среде элементов питания и большему выходу продукта.
3.2.3. СПОСОБЫ ВЫРАЩИВАНИЯ КЛЕТОК РАСТЕНИЙ
В природных условиях клетки растений находятся в тканях и органах и защищены от механического воздействия внешней среды. Они нуждаются в различных компонентах минеральной и органической природы для метаболизма и роста.
В искусственных условиях растительные клетки могут культивироваться как поверхностным, так и глубинным способами. При глубинном культивировании клеток растений используют те же методические приемы, что и при культивировании микроорганизмов. Подбор оптимальной питательной среды, массообмен, создание асептических условий культивирования, контроль протекания процесса осуществляются аналогично решению этих вопросов в технологии микробного синтеза (рис. 3.8).
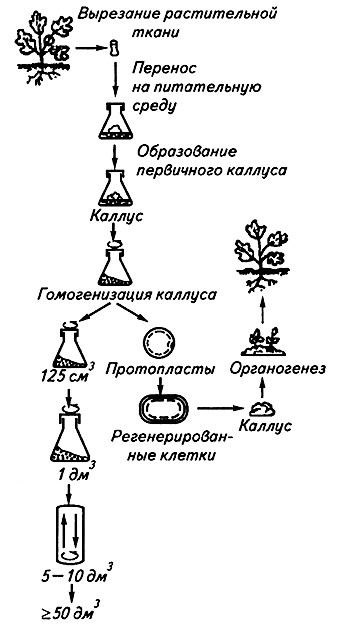
Рис. 3.8. Этапы получения культуры клеток растений
и регенерации целого растения из отдельной клетей и протопласта
В искусственных условиях растительные клетки культивируют, как правило, в виде каллуса. Он состоит из дезорганизованной массы недифференцированных клеток, теоретически способных к неограниченному росту и образованию метаболитов, характерных для растения. Каллус можно в дальнейшем культивировать на твердой среде или использовать для получения суспензии клеток.
Каллусные клетки получают из фрагментов тканей разных органов высших растений, помещая кусочки такой ткани в питательную среду (в пробирках, колбах, на чашках Петри). В природных условиях каллусная ткань возникает в травмированных местах для анатомической регенерации пострадавшего органа. От инфекции каллусную ткань в природе защищают иммунные механизмы растения. В искусственных условиях необходимо строго соблюдать асептические условия всеми доступными средствами. Обычно эксплантат обрабатывают дезинфицирующими растворами, а затем отмывают стерильной водой. Среду, посуду и аппаратуру стерилизуют традиционными средствами (автоклавирование, ультрафильтрация, облучение). Чтобы обеспечить развитие каллусных клеток в средах, содержащих необходимые для роста вещества, клетки тканей должны терять способность к дифференцировке, чему способствует предварительная инкубация эксплантатов на среде без гормонов в течение 3–6 сут.
Через 4–6 нед. культивирования трансплантата возникает первичный каллус, который переносят на свежую питательную среду. Каллусная ткань, выросшая на поверхности твердой питательной среды, имеет аморфную структуру и представляет собой массу тонкостенных паренния химных клеток. По химическому составу каллусная ткань обычно отличается от соответствующего органа растений.
После ряда делений каллусные клетки переходят на обычный для данного растения цикл развития, т.е. начинается их дифференцировка. Этот процесс регулируют гормоны.
Каллусная ткань чрезвычайно гетерогенна. По морфологическим и биохимическим признакам клеток суспензионная культура, полученная при культивировании клеток растений глубинным методом, более гомогенна, обладает более высокими скоростью роста и адаптивными способностями, чем клетки каллуса. Для культивирования в глубинных условиях необходимо получить линии клеток, образующих небольшие агрегаты (по 5–10 клеток). Рекомендуется использовать среды, содержащие 2,4-дихлорфеноксиуксусную кислоту и не содержащие ионы Са2+. В таких средах крупные агрегаты клеток не образуются. Перед пересевом первичную культуру фильтруют через сита (нейлоновые, металлические) для отделения крупных агрегатов каллусной ткани и остатков трансплантата. На образование клеточных агрегатов оказывает также влияние интенсивность перемешивания среды.
Глубинное культивирование можно осуществить в колбах на качалке, в специальных сосудах, вращаемых роллерами, и в стеклянных или металлических ферментерах различной конструкции (с мешалками или барботажного типа). Режим ферментации периодический или непрерывный, главным образом хемостатный.
Растительные клетки растут и размножаются значительно медленнее, чем клетки микроорганизмов. Время их удвоения 1–3 сут. Процесс культивирования растительных клеток занимает 2–3 нед., что повышает требования к обеспечению асептических условий.
В настоящее время методом культивирования растительных клеток получают вещества вторичного метаболизма: алкалоиды, гликозиды, полисахариды, терпеноиды, полифенолы, эфирные масла, пигменты, антиканцерогены, ингибиторы пептидной природы и др.
Как в любом биотехнологическом процессе, при получении метаболитов клеток культивированием важное значение имеет активность продуцента. Методами клеточной инженерии было показано, что в ряде случаев метаболиты, активно продуцируемые растительными клетками, можно получить методом слияния протопластов двух исходных растительных клеток. При этом гибридные клетки продуцируют не только метаболиты исходных растений, но и совершенно новые. Гибридизацию растительных протопластов успешно осуществляют методом электростимуляции слияния клеток или прямым микроинъецированием ДНК одной клетки в другую.
Обычно биосинтез этих веществ протекает в фазах замедленного роста и в стационарной. Растительные клетки можно использовать также для трансформации различных органических соединений.
3.3. ВЫДЕЛЕНИЕ, КОНЦЕНТРИРОВАНИЕ,
ОЧИСТКА И СУШКА ЦЕЛЕВЫХ ПРОДУКТОВ
Конечным продуктом стадии культивирования является суспензия микроорганизмов, или так называемая культуральная жидкость (КЖ). В подавляющем большинстве культуральная жидкость не может быть использована без дальнейшей переработки и не может храниться длительное время. Накопленный в ней полезный продукт микробиологического синтеза (биомасса, фермент, витамин и т.д.) необходимо сконцентрировать и выделить. Методы концентрирования и выделения продуктов микробиологического синтеза определяются как свойствами целевых продуктов и культуральных жидкостей, так и требованиями, которые предъявляют к конечным формам целевых продуктов.
Культуральные жидкости обычно являются сложными смесями большого числа компонентов, многие из которых обладают близкими химическими и физико-химическими свойствами. Наряду с растворенными минеральными солями, углеводами, белками и другими органическими веществами культуральные жидкости содержат в значительном количестве полидисперсные коллоидные частицы и взвеси. Следовательно, они являются не только многокомпонентными растворами, но и суспензиями. Дисперсная фаза этих суспензий состоит из мицелия или клеток, т. е. живой ткани, а также из остатков неиспользованных твердых частиц питательных сред.
Характерной особенностью культуральных жидкостей является сравнительно низкое содержание целевых продуктов.
Большинство целевых продуктов микробиологического синтеза нестабильно и подвержено влиянию различных факторов. Так, белки (ферменты) исключительно чувствительны к нагреванию, изменениям рН, а также ко многим другим физическим воздействиям и химическим агентам.
При выборе метода концентрирования и выделения того или иного продукта необходимо учитывать следующие факторы:
- свойства культуральной жидкости (в основном физико-химические и физические);
- свойства выделяемого продукта (термолабильность, стойкость к различным химическим агентам и т.п.);
- требования к конечной форме продукта (степень чистоты и степень концентрирования);
- технологические и технико-экономические показатели (выход, производительность оборудования, необходимость дальнейшей переработки).
В подавляющем большинстве случаев концентрирование целевых продуктов микробиологического синтеза невозможно без их выделения и очистки.
Все методы выделения продуктов микробиологического синтеза из культуральных жидкостей делят на две группы в зависимости от того, находится ли целевой продукт в нативном растворе или внутри клеток.
В первом случае используют такие методы, как экстракция, ионный обмен, адсорбция, кристаллизация. Во втором – более простые методы: осаждение, фильтрование, центрифугирование. В случае необходимости применяют последующее выделение биологически активного вещества из клетки.
Очень часто применяют комбинацию нескольких методов и в процессе выделения переводят продукт из растворимой формы в нерастворимую (или наоборот), иногда по нескольку раз. Как правило, при выделении растворенных веществ приходится подвергать культуральную жидкость предварительной обработке и очистке с помощью осаждения, фильтрации, центрифугирования и мембранных методов (электродиализ, ультрафильтрация, микрофильтрация).
Технология извлечения растворенных веществ с помощью экстракции, ионного обмена или адсорбции основывается на химических или физико-химических свойствах данного продукта и обычно весьма специфична. Такие же методы, как осаждение, фильтрация, центрифугирование и мембранные, более универсальны и применяются при выделении большинства продуктов микробиологического синтеза (табл. 3.1).
Таблица 3.1. Наиболее широко применяемые в биотехнологии
методы выделения и очистки продуктов

От метода выделения и концентрирования продукта значительно зависят затраты. Так, термическое обезвоживание всегда обходится дороже механического. Перспективным методом концентрирования продукта является мембранное разделение, с помощью которого концентрирование обходится в 3 раза дешевле, чем сгущение до такой же степени путем выпаривания. В свою очередь, обезвоживание на выпарной установке выгоднее, чем сушка. Для удаления 1 кг воды в конвективных сушилках требуется 1,3–2 кг пара, в трехкорпусных вакуум-выпарных установках – всего 0,3 кг.
Щадящими для биологических объектов методами обезвоживания являются лиофилизация и сублимационная сушка. Однако эти методы очень дорогие. Так, в распылительной сушилке для удаления из продукта 1 кг воды требуется 2500 кДж энергии, а при лиофилизации – 6500 кДж.
При производстве органических кислот и аминокислот продукт можно выделить концентрированием КЖ и непосредственной кристаллизацией, но для этого необходимо, чтобы питательная среда не содержала много окрашенных и балластных веществ.
Выделение продуктов из КЖ – достаточно дешевый процесс. Значительно труднее выделить целевой продукт из биомассы, для этого ее необходимо дезинтегрировать. Известны механические и ферментативные методы дезинтеграции клеточной массы. Принципы действия механических дезинтеграторов различны. В промышленности применяют гомогенизаторы-дезинтеграторы с перепадом давления, в которых суспензия клеток продавливается через клапаны или микрощели под давлением от 30 до 300 кПа. Производительность таких дезинтеграторов очень велика. В лабораторной практике применяют ультразвуковые установки или фрикционные со стеклянными микрошариками. В последнем случае дезинтеграция происходит в течение 1–2 мин при частоте вращения мешалки 10 000 мин-1 и более. Микрошарики удаляют центрифугированием.
Клеточные стенки микроорганизмов можно разрушить, используя препараты литических ферментов. Существуют многочисленные схемы выделения биологически активных веществ из биомассы микроорганизмов, вплоть до кристаллических и гомогенных препаратов. Такие схемы в большинстве своем очень сложны и сочетают в себе самые различные комбинации методов выделения и очистки, которые зависят от каждого конкретного целевого продукта.
Сушка
Большинство продуктов микробиологического синтеза выпускают в сухом виде с остаточной влажностью не более 5–12%.
Основным промышленным способом получения готовых форм продуктов микробиологического синтеза в виде сухих порошков является тепловая сушка.
Выбор метода тепловой сушки и соответствующее аппаратурное оснащение зависят от свойств исходных материалов, которые обычно имеют вид влажной пасты, густой суспензии или высококонцентрированного раствора. К важнейшим свойствам материала, влияющим на выбор метода сушки, относятся физико-химические (влажность), биологические (термоустойчивость, ксерочувствительность), структурные и теплофизические свойства, а также химический состав.
По исходному агрегатному состоянию влаги различают сушку из жидкого состояния и сублимацию – испарение из твердого состояния, минуя жидкое.
По энергетическому признаку, т.е. по способу подвода теплоты, различают контактную, конвективную и радиационную сушку.
При контактной сушке тепло передается высушиваемому материалу непосредственно от нагретых поверхностей (плит, вальцов). При этом испаряющаяся влага переходит в окружающий материал воздух. Из сушилок, основанных на этом методе, для сушки продуктов микробиологического синтеза применяются одно- и двухвальцовые сушилки и сушильные шкафы.
При конвективной сушке тепло, необходимое для процесса сушки, доставляется газообразным сушильным агентом, который играет роль теплоносителя и среды, в которую переходит влага из материала. Этот метод широко применяется для сушки продуктов микробиологического синтеза, и прежде всего в пневматических, аэрофонтанных, распылительных сушилках, а также в сушилках с псевдокипящим слоем.
При радиационной сушке инфракрасными лучами теплота передается от источника энергии (излучателя) электромагнитными волнами. Температура излучателей обычно составляет от 700 до 2200 °С.
Известны типы сушильных установок, в которых применяются различные комбинации перечисленных методов нагрева, например, в сублимационных сушилках используется сочетание контактного и радиационного способов подвода теплоты.
Большинство продуктов микробиологического синтеза термолабильны, поэтому для их сушки применяют наиболее щадящие методы. При этом стремятся снизить температуру и время сушки.
В настоящее время для сушки продуктов микробиологического синтеза наиболее широко используют сушилки, основанные на конвективном способе подвода теплоты (пневматические, с псевдо- кипящим слоем, распылительные). Для сушки клеток микроорганизмов, некоторых видов ферментов и других термолабильных продуктов используют сублимационные сушилки.

