Ферментами называются органические или биологические катализаторы, т.е. такие вещества, которые облегчают или ускоряют течение реакции, не претерпевая при этом существенных изменений.
Производство ферментных препаратов – одно из ведущих направлений в современной биотехнологии, объем продукции которого постоянно увеличивается, а сфера применения неуклонно расширяется. Ферментные препараты особенно широко используют в различных отраслях пищевой промышленности. Они имеют большое преимущество по сравнению с химическими катализаторами, поскольку действуют при нормальном давлении, температуре 20...70 °С, рН 4–9 и обладают высокой субстратной специфичностью.
ГЛАВА 4. ОБЩИЕ СВЕДЕНИЯ О ФЕРМЕНТНЫХ ПРЕПАРАТАХ
В глубокой древности люди хорошо знали способы приготовления хлеба, вина, пива, сыра, различных соусов и других продуктов, хотя они и не имели никакого представления о микроорганизмах и выделяемых ими ферментах, которые играют при этом главную роль.
Только в начале XIX в. русским ученым академиком К.С. Киргофом впервые был получен жидкий ферментный препарат амилазы из проросшего ячменя и описаны все основные черты ферментативного процесса. Впоследствии многие ученые мира активно изучали свойства ферментов, кинетику их действия на субстрат, исследовали микроорганизмы, растения, животные ткани с целью обнаружения в них ферментов или проявления их действия.
Бурное развитие технической микробиологии и биохимии, успехи научных исследований и открытия в области энзимологии позволили в течение нескольких десятилетий XX в. значительно усовершенствовать и интенсифицировать производства, связанные с жизнедеятельностью микроорганизмов.
За последние сорок лет изучено большое количество ферментов, выделенных из животных тканей и растений, а также полученных с помощью микроорганизмов. Создано специализированное производство ферментных препаратов, в основу которого положено культивирование микроорганизмов – продуцентов ферментов с применением современных эффективных методов выделения и очистки целевых ферментов от сопутствующих балластных веществ.
Согласно принятой в мире классификации и номенклатуре сейчас идентифицировано около 2000 ферментов (1780 в основном списке и около 200 в дополнительном). Промышленностью выпускается около 250 наименований ферментных препаратов, причем 99 % общей суммы реализации ферментов приходится только на 18 из них. Судя по объемам производства, основными из этих ферментов являются: бактериальные и грибные протеазы, глюкоамилаза, α-амилаза, глюкозоизомераза, пекголитические, целлюлолитические и гемицеллюлазные ферменты, молокосвертывающая кислая протеиназа, β-галактозидаза, липазы и некоторые другие. Наибольшее развитие ферментная промышленность получила в США, Японии, Англии, ФРГ, Дании, Нидерландах, Франции. За последние 20 лет ежегодный рост объема производства ферментных препаратов составлял 8–15 %.
В наибольшем объеме выпускаются комплексные препараты протеаз, широко используемые в синтетических моющих средствах (CMC), и амилазы, служащие для переработки крахмала. Эти два вида препаратов составляют до 65 % общего объема выпуска ферментных препаратов за рубежом. Другими крупными отраслями – потребителями ферментов являются, %: производство соков и вин – 10; сыроделие – 5; производство спирта – 5; хлебопечение – 5; пивоварение – 4 и все прочие отрасли – 6. В нашей стране, помимо использования в CMC и пищевых технологиях, ферментные препараты будут широко применяться при приготовлении кормов для сельскохозяйственных животных и птицы (табл. 4.1).
Таблица 4.1. Ферменты, используемые в промышленности

Особое положение в общем производстве ферментов занимают высокоочищенные (60–70 % общего количества белка) ферментные препараты для медицины, аналитических целей и научных исследований. Доля их в общем объеме выпускаемых препаратов мала, но технология их сложна, требует больших затрат материалов и времени.
Очевидно, в ближайшем будущем существующая ныне тенденция развития производства ферментных препаратов не изменится. Большое внимание будет уделяться производству технических препаратов промышленного назначения широкого спектра и малотоннажной ферментной продукции высокой чистоты для аналитических, диагностических и терапевтических целей.
С диагностической целью определяют активность таких ферментов, как а-амилаза, креатинкиназа, фруктозодифосфатальдолаза, кислотная и щелочная фосфатазы, лактатдегидрогеназа и др. Для улучшения действия пищеварительной системы используются ферменты протеазы, амилазы, целлюлазы, липазы и др.
Помимо традиционных областей применения возрастает потребность в ферментных препаратах для очистки сточных вод и утилизации различных видов отходов. Кроме того, очевидна перспектива использования не только отдельных ферментов, но и их определенного сочетания, необходимого для конкретной области применения. Эти препараты получили название мультиэнзимных комплексов.
4.1. ИСТОЧНИКИ ПОЛУЧЕНИЯ ФЕРМЕНТОВ
Ферменты присущи всем живым объектам и находятся практически во всех растениях, животных и микроорганизмах. Однако биосинтез ферментов связан с обеспечением метаболизма клеток и строго определяется жизненной потребностью организма, поэтому большинство объектов не может служить источником получения ферментных препаратов. Для этого пригодны только некоторые растительные организмы или отдельные органы и ткани растений и животных, способные накапливать значительное количество ферментов.
Растительное сырье
Источником ферментов может быть пророщенное зерно различных злаков (солод). Солод может использоваться непосредственно как технический ферментный препарат или служить исходным материалом для получения очищенных ферментных препаратов. В тропических и субтропических странах в качестве сырья для промышленного производства протеазы используют латекс дынного дерева и растений, относящихся к роду фикусов, листья и побеги инжира, сок зеленой массы ананаса.
Органы и ткани животных
На всех мясоперерабатывающих комбинатах собирают сырье, содержащее ферменты, консервируют его и используют для получения ферментных препаратов. Таким сырьем являются поджелудочная железа, слизистые оболочки желудков и тонких кишок свиней, сычуги крупного рогатого скота, сычужки молочных телят и ягнят, семенники половозрелых животных. Поджелудочная железа содержит большое количество разнообразных ферментов: химотрипсин, коллагеназу, эластазу, трипсин, амилазу, липазу и др. Слизистая оболочка желудков свиней и сычугов крупного рогатого скота служит источником пепсина и липазы. Из сычужков молочных телят и ягнят получают реннин (сычужный фермент). Семенники половозрелого скота содержат фермент гиалуронидазу.
Микроорганизмы
В специально созданных условиях микроорганизмы способны синтезировать огромное количество разнообразных ферментов. Они неприхотливы к составу питательной среды, легко переключаются с синтеза одного фермента на другой и имеют сравнительно короткий цикл роста. Для промышленного получения ферментных препаратов используют как природные штаммы микроорганизмов, выделенные из естественных объектов, так и мутантные. Продуцентами ферментов могут быть различные микроорганизмы: бактерии, грибы, дрожжи. Микроорганизмы могут синтезировать одновременно целый комплекс ферментов, но есть и такие, особенно среди мутантных штаммов, которые являются моноферментными, т. е. образуют в больших количествах только один фермент.
4.2. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА
ФЕРМЕНТОВ И ФЕРМЕНТНЫХ ПРЕПАРАТОВ
По современной классификации все ферменты делят на шесть основных классов по типу катализируемой реакции:
1) оксидоредуктазы;
2) трансферазы;
3) гидролазы;
4) лиазы;
5) изомеразы
6) лигазы (синтетазы).
Большинство промышленно важных ферментов, потребность в которых определяется десятками тысяч тонн, относятся к третьему классу – гидролазам. Подавляющее количество препаратов, выпускаемых различными фирмами мира, являются комплексными, содержащими помимо основного фермента еще значительное количество сопутствующих ферментов и белков. Поэтому в технологии ферментов препараты чаще классифицируют по основному компоненту в смеси ферментов, присутствующих в данном препарате: амилолитические, протеолитические, липолитические и т.д.
В нашей стране существует определенная система названия ферментных препаратов, в которой учитываются основной фермент, источник его получения и степень очистки.
Наименование каждого препарата включает сокращенное название основного фермента, к которому добавляются видовое название продуцента и суффикс «ин». Например, амилолитические препараты, получаемые из культур Aspergillus oryzae и Bacillus subtilis, называются соответственно амил-ориз-ин (амилоризин) и амил-о-субтил-ин (амилосубтилин).
Далее ставится индекс, в котором обозначены способ производства и степень очистки фермента от балластных веществ.
При глубинном способе культивирования после названия ставится буква Г, а при поверхностном – П.
Если это неочищенная культура продуцента, то далее следует буква X.
Между буквами П, Г и X может стоять цифра, обозначающая степень чистоты препарата.
Индексы обозначают:
2 – жидкий неочищенный концентрат исходной культуры;
3 – сухой ферментный препарат, полученный высушиванием путем распыления неочищенного раствора фермента (экстракта из поверхностной культуры или фильтрата культуральной жидкости);
10 – сухие препараты, полученные осаждением ферментов органическими растворителями или методом высаливания.
15, 18, 20 – препараты, частично освобожденные не только от балластных веществ, но и от сопутствующих ферментов. Номенклатура препаратов с индексом выше 20 не используется, поскольку в этих случаях речь идет о высокоочгаценных и даже гомогенных ферментных препаратах, которые именуются в классификации ферментов. Названия ферментных препаратов зарубежных фирм не несут информации о составе и степени очистки, например, Церемикс, Ультрафло (фирма «Новозаймс», Дания).
4.2.1. ОКСИДОРЕДУКТАЗЫ
К этому классу относятся ферменты, катализирующие окислительно-восстановительные реакции. Эта ферменты участвуют в биологическом окислении и восстановлении и, следовательно, связаны с процессами дыхания и брожения. К оксидоредуктазам относятся различные дегидрогеназы, оксидазы, пероксидазы, гидроксилазы.
Дегидрогеназы (осуществляют процесс дегидрирования – отщепление ионов водорода), в свою очередь, делятся на никотинамидные и флавиннуклеотадные. Никотинамидные дегидрогеназы активируют водород субстратов или метаболитов и катализируют его перенос на акцепторы или переносчики, отличные от молекулярного кислорода. Это анаэробные дегидрогеназы. Схема действия этих ферментов может быть представлена в следующем виде:
Субстрат + NAD(NADP) ↔ Окисленный субстрат + NADH2(NADPH2)
Коферментами, которые переносят из субстрата водород, являются никотинамидадениндинуклеотид (NAD) и никотинамидадениндинуклеотадфосфат (NADP).
Флавиннуклеотидные дегидрогеназы очень часто являются акцепторами водорода восстановленных никотинамиднуклеотидных дегидрогеназ, которые при этом снова окисляются:
NADH2 + Флавопротеид (FAD) ↔ NAD + Восстановленный флавопротеид (FADH2)
Некоторые из этих дегидрогеназ могут переносить водород от субстратов непосредственно к кислороду.
Поведение некоторых оксидоредуктаз хорошо исследовано при производстве пива; в процессе окисления они влияют на феноль- ные вещества солода и пива (которые определяют цвет, стабильность). Полифенолоксидазы – это оксидазы со смешанными функциями, у которых продукт окисления – дифенол – одновременно играет роль донора водорода. Определенная часть полифенолоксидаз окисляет дифенолы.
Пероксидазы действуют на пероксид водорода или органические пероксиды, расщепляя их. При этом обязательно должен присутствовать донор водорода, например фенол или ароматические амины, а пероксид водорода играет роль акцептора.
Каталаза, например, разлагает пероксид водорода на воду и кислород и катализирует окисление Н-доноров (метанол, этанол, муравьиная кислота, фенолы) с потреблением пероксида водорода:
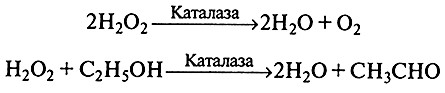
4.2.2. ТРАНСФЕРАЗЫ
К этому классу ферментов относятся биокатализаторы, переносящие ту или иную группу, например метальную или гликозильную, от одного соединения (которое рассматривается как донор группы) к другому соединению (которое рассматривается как акцептор).
Реакции, катализируемые трансферазами, в общем виде представляют следующим образом:
Д–R + А ↔ Д + R–А,
где Д – донор; R – переносимый радикал; А – акцептор.
К этим ферментам относятся гликозилтрансферазы и фосфотрансферазы.
Гликозилтрансферазы – ферменты, которые катализируют синтез таких полисахаридов, как крахмал, гликоген, декстран, леван, сахароза.
Фосфотрансферазы – ферменты, которые катализируют перенос богатых энергией (макроэргических) фосфатных остатков. Перенос макроэргических остатков производится только в присутствии аденозинтрифосфата (АТР) в качестве донора и аденозиндифосфата (ADP) или аденозинмонофосфата (AMP) в качестве акцептора.
АТР и ADP в организме (например, дрожжей) являются источником «активного фосфата». В АТР из имеющихся двух макроэргических связей используется только одна концевая, а другие связи могут использоваться только после перевода в концевую макроэргическую связь АТР:
ADP + ADP ↔ AMP + АТР
Под действием фосфотрансфераз осуществляется перенос остатков фосфорной кислоты от аденозинтрифосфата на глюкозу или фруктозу. В этом случае образуются аденозиндифосфат и фосфорный эфир соответствующего сахара:
![]()
Полученный таким образом глюкозо-6-фосфат может затем под действием фосфотрансферазы присоединять еще один остаток фосфорной кислоты, получив его от новой молекулы аденозинтрифосфата:
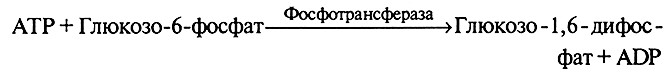
Фосфотрансфераза, под действием которой происходит образование гексозомонофосфата из гексозы и аденозинтрифосфата, называется гексокиназой, а фермент, катализирующий образование из гексозомонофосфата гексозодифосфата, – фосфогексокиназой. Гексокиназа и фосфогексокиназа содержатся в дрожжах и играют важную роль в начальных реакциях спиртового брожения.
4.2.3. ГИДРОЛАЗЫ
К классу гидролаз относятся многие ферменты, входящие в состав ферментных препаратов, выпускаемых отечественной промышленностью. Гидролазы катализируют реакции присоединения или отщепления воды (гидротазы и дегидротазы).
Наибольший интерес для специалистов в области пищевой биотехнологии представляют три подкласса ферментов класса гидролаз: эстеразы, гликозидазы и протеазы.
Эстеразы
В эту группу включен ряд ферментов, обладающих сравнительно широкой специфичностью. Эти ферменты, катализируя разрыв эфирных связей, гидролизуют очень большое число различных эфиров, хотя и не с одинаковой скоростью.
Наиболее широко применяется в производстве соков, используемых для безалкогольных напитков, фермент пектинэстераза (ПЭ), который, действуя на пектин, гидролизует его сложноэфирные связи, в результате чего от него отщепляется метиловый спирт по схеме, приведенной на рисунке 4.1.
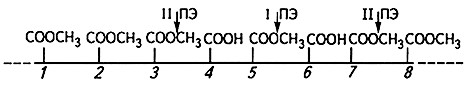
Рис. 4.1. Схема действия пектинэстеразы на пектин
Данный фермент в больших количествах содержится в таких препаратах, выпускаемых отечественной ферментной промышленностью, как Пектаваморин, Пектофоетидин и Ксилоглюкано-фоетидин.
Фосфатазы. Фосфомоноэстеразы и фосфодиэстеразы относятся к ферментам со сравнительно широкой специфичностью. Но в этой группе находятся также ферменты с узкой специфичностью. Фермент фитаза катализирует гидролиз фитина по уравнению
С6Н6(ОН2РО3)6 + 6Н2О → СбН12Об + 6Н3РО4
Фитин Инозит
Фитаза содержится в относительно большом количестве в ячменном солоде. Фитаза отщепляет от фитина фосфорную кислоту, и при этом образуется инозит. Фосфорная кислота проявляет свое действие при брожении, а инозит способствует росту дрожжевых клеток.
Гликозидазы
К этой группе относятся ферменты, гидролизующие не только истинные гликозиды, но и N-гликозильные, а также S-гликозильные соединения. В подгруппу истинных гликозидаз включены ферменты, действующие на простые гликозиды (например, β-глюкозидаза – фермент, содержащийся в таких отечественных препаратах, как Ксилоглюканофоетидин, Пектаваморин, Пектофоетидин). В эту же группу включены также амилазы, гидролизующие гликозидные связи в крахмале.
Гидролиз крахмала катализируют ферменты из группы гликозидаз при участии ферментов из группы трансгликозидаз. К ферментам первой группы относятся α- и β-амилазы, а также глюкоамилаза, которые разрывают молекулу крахмала гидролизом α-гликозидных связей. Равновесие этих реакций в основном сдвинуто в сторону гидролиза, поэтому они практически необратимы.
α-Амилаза – эндоамилаза, вызывающая гидролитическое расщепление α-1,4-гликозидных связей внутри высокополимеризованного субстрата. Схему гидролиза под действием α-амилазы можно записать следующим образом:
![]()
α-Амилаза содержится в больших количествах в таких отечественных ферментных препаратах, как Амилосубтилин и Амилоризин. При этом Амилосубтилин содержит главным образом α-амилазу разжижающего действия, а Амилоризин – осахаривающего.
β-Амилаза катализирует гидролиз крахмала до мальтозы. Это экзофермент концевого действия, проявляющий сродство к предпоследней α-1,4-связи с нередуцирующего конца амилозы линейного участка амилопектина. Действие β-амилазы на крахмал можно изобразить в виде следующей схемы:
![]()
Глюкоамилаза отщепляет одиночные остатки глюкозы от нередуцирующего конца цепей крахмала, гликогена и некоторых продуктов их гидролиза. Данный фермент содержится в таком ферментном препарате, как Глюкаваморин, и в небольших количествах в ферментном препарате Амилоризин.
β-Глюканаза гидролизует β-1,4-глюкановые связи в целлюлозе и β-глюкане. Этот фермент содержится в значительных количествах в ферментных препаратах Амилосубтилин, Ксилоглюканофоетидин, Цитороземин, Пектофоетидин, Пектаваморин, Целловиридин.
Ксиланаза гидролизует β-1,4- и β-1,3-ксилановые связи. Этот фермент содержится в препаратах Ксилоглюканофоетидин, Ксилонигрин, Пектаваморин, Пектофоетидин.
Целлобиогидролазы гидролизуют целлюлозу, отщепляя с нередуцирующих концов ангидроглюкозных цепей β-1,4-глюканов целлобиозу. Данные ферменты содержатся в таких препаратах как Целлокандин и Целловиридин.
β-Глюкозидаза гидролизует β-глюкозидную связь в дисахаридах и глюкозидах. Тождествен ферменту мальтазе. В результате действия этого фермента на мальтозу образуются двемолекулы глюкозы. Фермент содержится в солоде и в препарате Глюкаваморин.
β-Галактозидаза (лакгаза) гидролизует лактозу с образованием глюкозы и галактозы, содержится в так называемых лактозных дрожжах и препарате Лактоканесцин.
β-Фруктофуранозидаза (сахараза, инвертаза) гидролизует сахарозу с образованием глюкозы и фруктозы, содержится в дрожжах, в том числе в пивных.
Протеазы
До недавнего времени считалось, что протеазы включают протеиназы и пептидазы, причем протеиназы расщепляют только крупные молекулы, тогда как пептидазы – в основном мелкие молекулы азотистых веществ. В настоящее время протеазы разделяют на две группы. Для одной группы ферментов присутствие примыкающих концевых карбоксильных или аминных групп необязательно, для другой группы – необходимо.
Ферменты первой группы – эндопептидазы – могут действовать на центральные участки пептидной цепи и расщеплять молекулы белка на более мелкие фрагменты, небольшие пептиды они гидролизуют только тогда, когда их концевые группы искусственно блокированы химическим путем. Экзопептидазы не гидролизуют пептидные связи, находящиеся в середине цепи, а действуют либо с карбоксильного, либо с аминного конца цепи, отщепляя последовательно одну за другой концевые аминокислоты.
Расщепляя белок, эндо- и экзопептидазы действуют согласованно: первые образуют большое число свободных концов, а вторые воздействуют на образовавшиеся фрагменты. Эндопептидазы содержатся в ряде отечественных препаратов, таких, как Протосубтилин (щелочная протеаза), Амилосубгилин, Протомезентерин; экзопептидазы – в таких, как Амилоризин, Пектаваморин, Пектофоетидин, Ксилоглюканофоетидин.
4.2.4. ЛИАЗЫ
К данному классу относятся ферменты, разрывающие связи С–С, С–О, С–N и др. в результате реакции элиминирования, что приводит к образованию двойных связей, или, наоборот, присоединяющие определенные группы по двойным связям.
Карбоксилазы
Эти ферменты катализируют отщепление СО2 от молекул амино- и оксикислот или его фиксацию:
R–CH2–COOH → R–СН3 + СО2
Пируватдекарбоксилаза, или карбоксилаза (карбоксилаза-2-оксикислота), катализирует важную реакцию при спиртовом брожении – расщепление пировиноградной кислоты на ацетальдегид и СО2- Равновесие реакции сильно сдвинуто в сторону декарбоксилирования:
СН3–СО–СООН → СО2 + СН3-СОН
Этот фермент содержится в дрожжах.
Гидролиазы
Эти ферменты катализируют отщепление или присоединение воды (прежнее название – дегидратазы и гидратазы). В данном случае не происходит гидролиз, поскольку субстрат не расщепляется на два компонента, как при реакциях, катализируемых гидролазами.
Карбонатгидролиаза
Этот фермент катализирует расщепление угольной кислоты на воду и диоксид углерода, содержится в дрожжах.
Ферменты группы лиаз, в частности пектатгрансэлиминаза, содержатся в таких отечественных препаратах, как Пектоклостридин и Мацеробациллин.
4.2.5. ИЗОМЕРАЗЫ
Изомеразы – ферменты, катализирующие изменение геометрической или пространственной конфигурации молекулы. Ферменты данного класса осуществляют рацемизацию аминокислот или эпимеризацию углеводов.
Рацемазы обусловливают образование оптически активных метаболитов (оптических антиподов). В случае, когда они осуществляют D-L-превращение субстратов с большим числом асимметрических атомов углерода, их называют эпимеразами. Многие из них содержат в качестве кофермента пиридоксальфосфат. Для пищевой промышленности весьма важным является фермент глюкозоизомераза, превращающий глюкозу во фруктозу.
4.2.6. ЛИГАЗЫ
Ферменты этого класса катализируют соединение двух молекул. Процесс этот сопряжен с разрывом пирофосфатной связи в молекуле АТР. Энергия, высвобождаемая при расщеплении, используется для синтеза.
Лигазы (синтетазы) катализируют синтез новых продуктов с образованием связи атома углерода с атомами кислорода, серы, азота или углерода. Лигазы, катализирующие образование связей С–О, обусловливают взаимодействие аминокислот с соответствующей транспортной рибонуклеиновой кислотой S-PHK и участвуют в синтезе белковых веществ.
Лигазы, катализирующие образование связей С–N, играют важную роль в превращении азотистых веществ (амид- и пептидсинтетазы).
Лигазы катализируют образование связей С–С в реакциях таких веществ, как кетокислоты и ацилкоферменты, с диоксидом углерода. В результате реакции возникает новая карбоксильная группа. В данном случае коферментом является биотин.
Лигазы, катализирующие образование связей С–S, чаще всего осуществляют синтез ацилкофермента из соответствующих кислот при участии АТР и кофермента А.
4.3. ХАРАКТЕРИСТИКА АКТИВНОСТИ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Ферменты являются веществами белковой природы, поэтому в смеси с другими белками определить их количество невозможно. Наличие определенного фермента в данном препарате может быть установлено по результатам той реакции, которую катализирует фермент, т.е. по количеству образовавшихся продуктов реакции или уменьшению исходного субстрата. В количественном выражении активность фермента условно определяют по начальной скорости ферментативной реакции. Начальная скорость зависит от многих факторов, наиболее важные из них – температура, концентрация субстрата, рН реакционной смеси и время от начала реакции. Поэтому по предложению Комиссии по ферментам Международного биохимического союза были приняты правила определения активностей препаратов и их выражения в единицах активности.
Стандартная единица активности
Эта величина для любого фермента обозначает то количество его, которое катализирует превращение 1 мкмоль субстрата в 1 мин при заданных регламентированных условиях. Часто количество субстрата нельзя выразить числом микромолей, так как точно неизвестна масса молекулы, например, при действии на белок, крахмал, пектин, целлюлозу. В этих случаях определяют микроэквивалент затронутых реакцией групп. Так, при гидролизе белка учитывают не число прогидролизованных молекул, а число образовавшихся свободных карбоксильных или аминных групп, т. е. число расщепленных пептидных связей; при гидролизе крахмала и полисахаридов – число прогидролизованных гликозидных связей и т.д.
Комиссия по ферментам рекомендовала придерживаться определенных условий при установлении активности фермента: стараться вести реакцию при температуре 30 °С и определять активность по начальной скорости реакции, когда концентрация субстрата достаточна для насыщения фермента и соответствует кинетике реакции нулевого порядка. Для данного фермента выбирают оптимальные концентрации субстрата, фермента и рН.
Активность ферментных препаратов
Содержание фермента в данном препарате условно выражают в стандартных единицах активности фермента на 1 см3 ферментного раствора или 1 г препарата. Активность ферментного препарата выражают в микромолях субстрата, прореагировавшего в присутствии 1 см3 ферментного раствора или 1 г препарата в заданных условиях за 1 мин. Число микромолей и будет равно числу стандартных единиц. При гомогенности фермента его удельную активность можно выразить в стандартных единицах на 1 мг фермента; если фермент содержит балласт в виде неактивного белка, то его удельную активность выражают в стандартных единицах на 1 мг белка в ферментном препарате.
Молекулярная активность представляет собой число миллимолей субстрата или эквивалентов затронутой реакцией групп, прореагировавших в течение 1 мин с 1 ммоль фермента при оптимальных концентрациях субстрата, или число стандартных единиц, содержащихся в 1 ммоль фермента.
Если фермент содержит характерную простатическую группу или несколько каталитических центров, которые поддаются измерению, его активность можно выразить в величине активности каталитического центра. Такая активность будет соответствовать молекулярной активности, если молекула фермента имеет один активный центр; если же число каталитических центров n, то активность одного центра будет в n раз меньше молекулярной.
4.4. СВОЙСТВА ФЕРМЕНТОВ
В отличие от обычных химических катализаторов ферменты ускоряют реакции во много раз. В то время как химические катализаторы работают при повышенных температурах и давлении, ферменты активны при нормальном давлении и, как правило, в пределах температур 40...70 °С, характерных для технологических процессов в пищевой промышленности.
Специфичность действия
Фермент действует на определенное вещество, не затрагивая другие, что весьма ценно для создания разных технологий, особенно направленных на переработку сельскохозяйственного сырья и получение пищевых продуктов. Химически чистые ферменты различаются по числу и виду субстратов, с которыми они могут взаимодействовать. По этим свойствам ферменты можно разделить на четыре группы специфичности.
Ферменты первой группы катализируют реакции только с одним конкретным субстратом и не действуют даже на его ближайшие аналоги. Такие ферменты некоторые исследователи называют абсолютными (например, уреаза, расщепляющая мочевину на аммиак и воду).
Ферменты второй группы реагируют с одним типом оптического изомера, но иногда катализируют реакции с участием серии родственных соединений с аналогичной конфигурацией. Примером могут служить протеолитические ферменты, гидролизующие пептидные связи в белках и других азотистых соединениях. Эту группу ферментов относят к стереоспецифическим.
Ферменты третьей группы катализируют реакции с субстратами, имеющими определенный тип химической связи, почти независимо от ассоциируемых групп. Примером могут служить липазы и фосфатазы. Первые гидролизовые многие органические эфиры, а вторые расщепляют сложные эфиры фосфорной кислоты на спирт и кислоту. Эти ферменты обладают специфичностью по типу разрываемой связи.
Ферменты четвертой группы осуществляют реакцию в том случае, когда в непосредственной близости от центра реакции имеется специфическая группа.
Способность катализировать протекание реакции в определенных условиях
Окислительно-восстановительный потенциал субстрата влияет на активность ферментов. Для различных ферментов характерна значительная разница в оптимальных значениях рН. Так, например, кислотоустойчивая протеаза гриба Aspergillus foetidus 26 в препарате Пектофоетидин П10Х имеет оптимум рН в пределах 4–4,5, нейтральная протеаза бактерий Bacillus subtilis 103 в препарате Протосубтилин Г10Х – в пределах рН 6–6,5, а щелочеустойчивая пептидаза бактерий Bacillus subtilis 72 в препарате Протосубтилин Г10Х (щелочная протеаза) – в пределах рН 8–9,5.
Механизм действия ферментов заключается в том, что молекула фермента образует временный комплекс с одной или несколькими молекулами субстрата. Далее этот комплекс распадается на различные фрагменты, одним из которых является, как правило, свободный фермент, готовый принять участие в дальнейшей реакции.
В большинстве случаев ферменты требуют присутствия других соединений, называемых кофакторами, коферментами, активаторами или, если они прочно связаны с белковой частью молекулы фермента, простетическими группами. Кофакторы подразделяют на четыре группы: ионы металлов, комплексные органические или металлоорганические соединения, комплексные металлоорганические структуры, витамины группы В.
Некоторые элементы и микроэлементы могут быть активаторами различных ферментов, причем они могут действовать только в определенных оптимальных концентрациях, избыток ионов может значительно снижать активность фермента, главным образом в тех случаях, когда применяются ионы тяжелых металлов. Поэтому загрязнение сырья и оборудования неорганическими веществами может привести к нежелательным результатам, если микроорганизмы продуцируют целый ряд различных ферментов. Это также относится и к ряду металлов, из которых изготовляют оборудование.
Оборудование из обычных марок черных сталей, используемое для процессов ферментации, подвергается сильному корродированию. Это приводит не только к преждевременному износу аппаратуры, но и к ингибированию целого ряда ферментов под действием повышенного количества ионов металлов, выщелачиваемых с поверхности оборудования. Поэтому необходимо тщательно выбирать материалы для оборудования, особенно для ферментеров.
Значения молекулярных масс ферментов колеблются в широких пределах: от 104 до 106. Мелкие молекулы относительно стабильны. Значительное количество ферментов образуют монодисперсные растворы, однако иногда молекулы ферментов с большой молекулярной массой претерпевают обратимую спонтанную диссоциацию на две или четыре эквивалентные части. Нередко препараты ферментов, выделенные из двух разных источников, подобны один другому, но не тождественны.
4.5. СТАБИЛИЗАЦИЯ ФЕРМЕНТОВ ПУТЕМ ИММОБИЛИЗАЦИИ
В живых системах ферменты способны длительно работать без потери активности. В искусственных условиях ферментные препараты после одноразового использования обычно инактивируются, при этом обрабатываемый материал загрязняется препаратом. Поэтому были созданы новые формы ферментных препаратов многократного использования. Наибольшее распространение получили препараты, в которых ферменты в активной форме прикреплены к нерастворимой основе. Такие ферментные препараты называются в литературе по-разному: связанные, пришитые, фиксированные, матрицированные, прикрепленные, но чаще всего их называют иммобилизованными. Иммобилизованный ферментный препарат – это единая система, которая состоит из трех частей: фермента, носителя и связующего их звена.
Для иммобилизации ферментов большое значение имеют природа функциональных групп белка; характер реакций, которые они катализируют; положение активного центра; наличие или отсутствие простетической группы, небелкового фрагмента и т.д. Некоторые группы белка особенно легко подвергаются химическим превращениям. Например, остатки тирозина легко атакуются элекгрофильными реагентами и вступают в реакции азосочетания, галоидирования, нитрования и др.; остатки метионина и дисульфидные группы легко подвергаются окислительно-восстановительным превращениям.
Условно реакции модификации функциональных групп белка можно разделить на реакции замещения, присоединения и отщепления. Для иммобилизации ферментов имеют значение реакции присоединения по карбоксильным группам реагента или белка, реакции замещения; по типу превращений можно различать реакции ацилирования, алкилирования, конденсации, окисления-восстановления, азосочетания и т.д.
Все носители подразделяют на две группы: органические полимерные и неорганические носители.
Носитель имеет очень большое значение для успешной иммобилизации ферментов. К носителям предъявляются определенные требования: нерастворимость в реакционной среде; иной заряд, чем у фермента; высокая гидрофильность; химическая, биологическая стойкость; механическая прочность; отсутствие способности к неспецифической адсорбции и сильным конформационным изменениям молекулы белка; способность гранулироваться и активироваться. Носители для иммобилизации могут иметь зернистую структуру, могут быть выполнены в виде волокон, пленок, полых трубок, мембран.
Органические полимерные носители
Они разделяются на природные и синтетические. Природные носители бывают полисахаридные и белковые. Синтетические полимерные носители подразделяются на полиметиленовые, полиамидные и полиэфирные.
Основой природных полисахаридных носителей могут быть целлюлоза, декстран, агароза, губчатый крахмал, хитин и другие полисахариды.
В качестве носителей ферментов можно использовать белки. Но они подвержены микробному воздействию и вызывают иммунную реакцию. Исключением является только коллаген, обработанный танином. В качестве белковых носителей применяют коллаген, его модифицированные формы, желатин, кератин, нерастворимые глобулины хлопчатника и некоторые другие белки.
Синтетические полимерные носители используют для иммобилизации ферментов методами адсорбции, включения в гель, ковалентного связывания и микрокапсулирования. Для процессов адсорбции их применяют в виде макро- и микропористых материалов. Чаще всего используют ионообменники типа дауэкса и амберлита, представляющие собой сополимеры стирола и дивинилбензола в форме гранул. Для иммобилизации ферментов в гель чаще используют носители на основе полиакриламида, гели поливинилового спирта и других полимеров (сополимеры этилгликольметакрилата, диметакрилата и т.д.) – реже.
Существует очень много синтетических полимерных носителей.
Неорганические носители
В эту группу носителей входят: синтетические кремнеземные сорбенты, металлы и их оксиды, нержавеющая сталь, различные виды глин, керамики и природные минералы. Неорганические носители обладают рядом неоспоримых достоинств. Они легко регенерируются, им можно придать любой вид (порошки, шарики, частицы неправильной формы, пористый материал или монолит, образующий многоканальную систему).
Сшивающие агенты
Для иммобилизации используют очень широкий круг различных агентов, пригодных для активации полимерных носителей, непосредственной конденсации белков на носителях, содержащих различные функциональные группы.
Наиболее широко для иммобилизации ферментов используют следующие сшивающие соединения: глутаровый альдегид, изоксалевые соли, галогенцианы (чаще бромциан), 1,6-гексаметиленди- амин, изоцианиды, карбодиимиды, карбонилдиимидазол, n-нитробензоилхлорид, ненасыщенные сульфоны.
Способы иммобилизации ферментов
Их можно подразделить на две большие группы: химические и физические, т. е. с образованием ковалентных связей и без их участия.
Физические методы заключаются в связывании фермента без участия ковалентных связей. Они подразделяются на два типа: адсорбционные и механические. При адсорбционной иммобилизации фермент удерживается на поверхности носителя с помощью электростатических, гидрофобных, водородных связей, а также в силу дисперсионных взаимодействий. При механической иммобилизации производят включение фермента в гели, сшитые поперечными связями, заключение фермента в микрокапсулы, волокна, мембраны и т. д. Все физические методы иммобилизации достаточно просты, быстры и эффективны.
К химическим методам иммобилизации относят иммобилизацию ферментов путем ковалентного сшивания с полимерным носителем и поперечного сшивания ковалентными связями молекул белка без носителя (используется редко). Химический способ является основным способом получения иммобилизованных ферментных препаратов. К преимуществам таких препаратов относятся: их стабильность, невымываемость ферментов, уменьшение отрицательного влияния матрицы. Существенный недостаток этого способа – значительная инактивация фермента, что случается достаточно часто.
Один из перспективных путей создания высокоактивных полиферментных систем – иммобилизация клеток микроорганизмов, но пока он развивается медленно.
Иммобилизованные ферменты по своим свойствам отличаются от нативных, поскольку в результате иммобилизации в той или иной степени изменяется пространственная структура белковой молекулы.
Активность иммобилизованных ферментов в пересчете на 1 мг белка в подавляющем большинстве случаев падает за счет диффузионного сопротивления, экранирования активного центра, конформационных изменений молекулы и т.д. Иммобилизованные ферменты проявляют большее сродство к низкомолекулярным субстратам. В то же время иммобилизация часто способствует повышению стабильности фермента в более широкой зоне рН и температуры, устойчивости к действию ингибиторов, что очень важно при длительном использовании ферментов. Оптимальные рН и температура иммобилизованных ферментов почти не меняются, энергия активации ферментативных реакций также остается неизменной.
4.6. ПРИНЦИП ДЕЙСТВИЯ ФЕРМЕНТОВ
И КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Тысячи различных ферментативных реакций протекают в клетке согласованно и одновременно. Эти реакции могут происходить лишь в тех случаях, когда ферменты способны «узнавать» свой субстрат. Это свойство во многом определяет так называемый принцип «ключа и замка». Например, фермент глюкозооксидаза из нескольких Сахаров в среде «узнает» свой субстрат – глюкозу и кислород; в результате образуется фермент-субстратный комплекс из этих двух субстратов, а затем – продукты (глюконолактон и пероксид водорода). В этом случае можно говорить о высокой субстратной специфичности фермента. Однако в процессе эволюции возникли менее специфичные ферменты, например пепсин, который расщепляет в пищеварительном тракте все белки в местах соединения совершенно определенных аминокислот (триптофан, фенил аланин, тирозин, метионин, лейцин).
У простых ферментов типа лизоцима каталитическое действие осуществляется таким образом: фермент влияет на конформацию субстрата и переводит его в напряженное состояние, способствующее протеканию реакции. Кроме того, в активном центре сосредоточено много неполярных групп, и эта область действует как органический растворитель. В этой области находится небольшое число заряженных полярных боковых групп аминокислот, реакционная способность которых выше, чем ионов воды. Имея большую гибкую молекулу, ферменты способны сосредоточить на небольшом участке необходимые группы для осуществления конкретной реакции с субстратом.
У сложных ферментов, имеющих простетические группы и коферменты, возможности взаимодействия с субстратом увеличиваются. Во время катализа простетические группы отдают электроны, протоны или целые химические группы, а после каталитической реакции регенерируются.
Соединение фермента с субстратом в каталитическом центре может происходить с помощью ковалентных связей, при участии электронов, с помощью водородных связей или более слабых взаимодействий, например сил Ван-дер-Ваальса. Для этого фермент и субстрат в районе каталитического центра должны сблизиться до расстояния 1,5–2 нм для ослабления внутренних связей в молекуле субстрата.


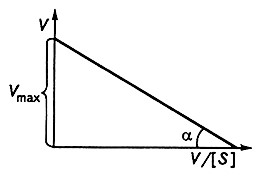
Рис. 4.2. Зависимость кинетики ферментативных реакций от концентрации субстрата
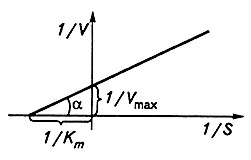
Рис. 4.3. Кинетика ферментативных реакций в координатах 1/V–1/S
Встречаются реакции других типов, например, обратимые с одним субстратом, необратимые с несколькими субстратами или реакции, в которых из одного субстрата образуются два продукта. В ходе этих реакций также происходит образование фермент-субстратных комплексов подобно тому, как это имеет место в односубстратных реакциях, и при исследовании кинетики этих реакций могут быть определены Кm для каждого из субстратов и Vmax для реакции. Такие реакции осуществляются либо по последовательному типу, либо по типу пинг-понг, либо по смешанному.
Ферменты обладают очень высокой каталитической активностью. Одна молекула фермента за 1 мин может прореагировать с тысячами и даже миллионами молекул специфического субстрата.
Известно, что для действия каждого фермента характерна оптимальная температура, при которой скорость реакции максимальна. Оптимум температуры большинства используемых в биотехнологии ферментов микроорганизмов составляет 30...40 °С.
Оптимум действия одних ферментов, например пепсина, наблюдается в кислой среде (рН 2), других – в щелочной, а у большинства ферментов – в нейтральной.
На действие ферментов могут оказывать влияние активаторы и ингибиторы. Активаторами многих ферментов являются цистеин и глутатион. Эти вещества восстанавливают дисульфидную связь, образуя SH-группы, которые входят в состав каталитических центров и часто определяют ферментативную активность. Ингибиторы ферментов могут быть неспецифическими (например, соли тяжелых металлов, которые при связывании с белками осаждают их из растворов) или специфическими (например, синильная кислота, которая реагирует с определенными химическими группами ферментов и ингибирует действие железосодержащих дыхательных ферментов).
Различают три типа обратимого ингибирования ферментов: конкурентное, неконкурентное и бесконкурентное. Конкурентные ингибиторы способны обратимо связываться с активным центром фермента и конкурировать с субстратом за активный центр. При неконкурентном ингибировании взаимодействие ингибитора и фермента происходит не на том участке, с которым связывается фермент, но они вызывают изменение конформации фермента, нарушая таким образом нормальное взаимодействие активного центра с ферментом. Бесконкурентное ингибирование наблюдается в том случае, когда ингибитор обратимо взаимодействует только с субстратом и ферментом, образуя комплекс и не образуя продуктов (ферментативная реакция с участием двух и более субстратов).

