11.1. ФЕРМЕНТНЫЕ СИСТЕМЫ
На основе фундаментальных научных исследований биотехнологических систем, протекающих в них процессов метаболизма и участвующих в них соединений созданы искусственные ферментные системы для анализа субстратов. Они нашли практическое применение в области оценки качества продуктов питания, пищевого сырья и биологических материалов. В настоящее время различают следующие группы ферментативных методов.
1. Анализ активностей ферментов
Эти методы используют при изучении механизмов регуляции ферментативных активностей в растительных и животных материалах, биотехнологических процессах с целью разработки способов их интенсификации, а также для создания новых технологических процессов переработки сырья.
2. Анализ субстратов с использованием ферментов в качестве реагентов
К этой группе методов относится ферментативный анализ на основе оксидазных и дегидрогеназных систем, а также комбинированный ферментативный анализ. Эти методы используют в оценке качества продуктов питания и пищевого сырья.
3. Ферментативный анализ на основе ингибирующего эффекта
Этот анализ проводят для определения остаточных количеств загрязнителей (например, пестицидов, тяжелых металлов и т.п.) в продуктах питания и пищевом сырье.
4. Иммуноферментативный анализ
Его применяют в различных областях, в том числе и для оценки качества при определении ряда специфичных компонентов в биологических материалах.
5. Анализ на основе метода PCR (полимеразной цепной реакции) и его модификаций
Его проводят при исследовании генетически измененных организмов, патогенных микроорганизмов, сырья или продуктов питания, содержащих эти организмы, с целью их идентификации.
В настоящей главе рассмотрены методы второй группы, т. е. методы анализа субстратов, входящих в состав продуктов питания и пищевого сырья. В этой области разработаны и широко используются три типа ферментных систем: дегидрогеназные, комбинированные и предназначенные для анализа пищевых волокон (табл. 11.1-11.3).
Таблица 11.1. Компоненты дегидрогеназных ферментных систем (ДФС)

Таблица 11.2. Компоненты комбинированных ферментных систем (КФС)

Таблица 11.3. Компоненты ферментной системы для анализа пищевых волокон (ФПВ)

11.2. МЕТОДОЛОГИЧЕСКИЕ ОСНОВЫ
ФЕРМЕНТАТИВНОГО АНАЛИЗА
Ферментативный анализ субстратов представляет собой метод с использованием в качестве реактивов ферментов, которые способны в определенных условиях преобразовывать отдельные вещества (субстраты) с высокой специфичностью в продукты реакции. Субстраты, с которыми взаимодействуют ферменты, относятся к соединениям природного происхождения (например, сахара, органические кислоты и их соли, спирты и др.), участвующим в процессах метаболизма живой клетки. Таким образом, методологическую основу ферментативного анализа составляют природныебиохимические механизмы процесса обмена веществ, отдельные реакции которого воспроизводятся с большой точностью в искусственных условиях с целью количественного определения субстратов в монопродуктах или продуктах со сложным составом. Для проявления высокоспецифичных свойств ферментов и получения достоверного результата условия воспроизведения реакции максимально приближены к физиологическим условиям, существующим в живой клетке. В ходе ферментативной реакции должно быть достигнуто полное количественное преобразование исследуемого субстрата.
Специфичность, т.е. избирательность действия ферментов, обеспечивает достоверность результата ферментативной реакции, протекающей в искусственных условиях, поскольку он не зависит от влияния соединений, которые имеют сходное с анализируемым компонентом строение и входят с ним в матрицу исследуемой пробы.
Ход ферментативной реакции и ее ответ на внесение в систему субстрата контролируют с помощью физических методов путем измерения изменений качественного и количественного состава вспомогательных соединений или процессов.
В дегидрогеназных ферментных системах в качестве вспомогательных соединений используют окисленные или восстановленные формы коферментов NAD+/NADH, NADP+/NADPH. Эти коферменты участвуют в системе в качестве переносчиков водорода.
Количество окисленных коферментов NADH или NADPH стехиометрически соотносится с количеством анализируемого соединения (рис. 11.1).
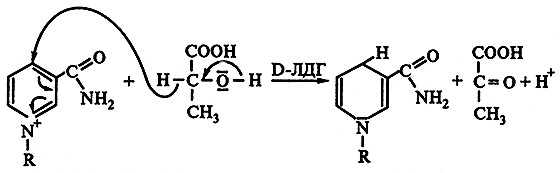
Рис. 11.1. Механизм действия NADPH в дегидрогеназной ферментативной реакции
на примере определения D-молочной кислоты (D-ЛДГ – D-лактатдегидрогеназа)
Изменение формы коферментов контролируют спектрофотометрическим измерением оптической плотности – экстинкции – системы при 334, 340 или 365 нм. В интервале длин волн от 334 до 365 нм (оптимум 340) восстановленная форма NADH или NADPH проявляет максимальное поглощение (рис. 11.2).
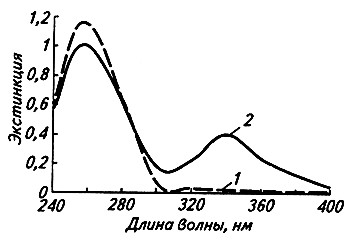
Рис. 11.2. Спектры поглощения NADP (1) и NADPH (2)
Конечный результат ферментативной реакции рассчитывают на основании закона Ламберта–Бера из полученных значений оптической плотности восстановленной дегидрогеназной ферментной системы в начале и конце реакции.
В отдельных системах, например в определении сульфита, в качестве первичного фермента наряду с дегидрогеназами используют оксидазы. В ходе окислительной реакции происходит перенос водорода от субстрата к кислороду с образованием пероксида водорода. Последний может быть преобразован двумя различными способами с помощью фермента пероксидазы или с помощью фермента NADH-пероксидазы и NADH.
В комбинированных ферментных системах (КФС) определение субстратов также основано на использовании специфичного действия ферментов. Однако результат определения рассчитывают, исходя из интенсивности окрашивания системы, измерение которой проводят фотометрическим способом в видимой области спектра. В качестве вспомогательных соединений в КФС участвуют акцепторы электронов.
В ферментной системе в качестве суммарного определения пищевых волокон проводят предварительный гидролиз пробы с помощью гидролаз – α-амилазы, протеазы, глюкоамилазы. Продукты реакции после промежуточных стадий очистки и концентрирования определяют гравиметрическим способом.
11.3. ПРИМЕНЕНИЕ МЕТОДОВ ФЕРМЕНТАТИВНОГО АНАЛИЗА
Ферментативный анализ как неотъемлемая часть всего аналитического потенциала, используемого при оценке и контроле качества пищевого сырья и продуктов питания, получил мировое признание по следующим причинам:
- сырье и пища представляют собой продукты биологического происхождения, состоящие из соединений, образованных при протекании реакций процесса обмена веществ, катализируемых ферментами;
- ферменты как биологические катализаторы вступают в специфическое взаимодействие с различными соединениями;
- ферментативный анализ превосходит методы химического и физико-химического анализа по степени достоверности.
Основные требования к методам анализа, используемым в оценке качества продуктов питания и пищевого сырья, могут быть сформулированы следующим образом:
- в основе метода должна быть специфичность определения искомого вещества, что определяет его достоверность;
- подготовка пробы к определению должна быть простой и исключающей потери искомого соединения или модификацию его структуры;
- схема определения и методика его выполнения должны быть простыми;
- результаты определения веществ должны быть достоверными, что подтверждает надежность метода;
- метод должен обладать достаточной чувствительностью для определения низких концентраций веществ;
- влияние матрицы пробы на механизм реакции, лежащей в основе метода, должно отсутствовать или быть минимальным;
- затраты времени на проведение анализа должны быть минимальными, поскольку оценка качества продукции часто входит в производственный контроль;
- внедрение и использование метода должно быть экономически оправдано;
- метод должен обладать предпосылками для его дальнейшей механизации или автоматизации;
- реактивы, используемые в определении, должны быть безопасными и легко утилизируемыми.
Методы ферментативного анализа по многим позициям отвечают этим требованиям. В ферментативном анализе искомое соединение, как правило, не выделяют из матрицы пробы, поскольку ферменты реагируют только с теми веществами, к которым они проявляют специфичность. Недостатком ферментативных методов является невозможность получения широкого спектра соединений в ходе одного определения (до трех соединений).
Количественное определение соединений с помощью ферментов используется в промышленности в системах производственного контроля и обеспечения качества готовой пищевой продукции и в определении изменений ее состава в процессе хранения (табл. 11.4).
Таблица 11.4. Определение соединений, входящих в состав продуктов питания, ферментативными методами



Ошибка ферментативных методов составляет 0,5–2,5 %.
Ферментативный анализ, наряду с традиционными аналитическими методами, широко используют при определении качества напитков, их идентичности.
О натуральности вин и сусел можно судить на основании анализа сахаров (сахарозы, D-глюкозы, D-фруктозы), органических кислот (D- и L-яблочной, лимонной, D- и L-молочной, уксусной, янтарной, муравьиной, D-глюконовой, L-аскорбиновой), а также этанола, глицерина, ацетальдегида и некоторых органических компонентов. По результатам анализов может быть установлен факт фальсификации вина путем добавления спирта, инвертных сахарных сиропов, сахарозы, ГФС. Состав продуктов брожения и их соотношение характеризуют процесс брожения, участие в нем определенных видов микроорганизмов. Так, при развитии молочнокислых бактерий в вине накапливаются пропанол и D-молочная кислота, что ухудшает органолептические свойства. Янтарная кислота в концентрации выше 1 г/дм3 появляется при участии в брожении посторонних рас дрожжей. Повышенная концентрация D-сорбита в вине свидетельствует о купажировании виноградных вин с плодово-ягодными винами или соками и т.д.
Гидролитические ферменты используют для определения содержания пищевых волокон в продуктах питания. Пищевые волокна – это комплекс биополимеров: целлюлозы, гемицеллюлоз, пектиновых веществ и лигнина. Чтобы определить содержание пищевых волокон в продукте, нужно удалить из него жиры, белки, крахмал и определить зольность. Высушенный пищевой продукт обезжиривают петролейным эфиром, вновь высушивают и измельчают. Далее следует постадийный ферментативный гидролиз:
- проводят клейстеризацию-разжижение крахмала при рН 6 и температуре 90 °С с помощью термостабильной а-амилазы;
- гидролизуют белок нейтральной протеазой при рН 7,5 и температуре 60 °С;
завершают гидролиз крахмала с помощью глюкоамилазы при рН 4,5 и температуре 60 °С.
Продолжительность каждой стадии 30 мин. По окончании гидролиза пищевые волокна осаждают этанолом. Сформировавшийся осадок отделяют фильтрацией и промывают на фильтре этанолом и ацетоном для удаления продуктов гидролиза, затем высушивают и взвешивают. Массовую долю пищевых волокон рассчитывают с учетом поправки на зольность осадка и наличие негидролизованного белка. Метод имеет высокую точность. Получаемые результаты более достоверны, чем при использовании химических методов, поскольку последние не позволяют избирательно удалять нужные компоненты.
В широком смысле к ферментативному анализу относят и методы определения ферментативной активности в разнообразных технологических процессах и продуктах.
Применение ферментативных методов анализа в пищевой биотехнологии будет расширяться, поскольку эти методы просты, точны, легко автоматизируются и основаны на использовании безопасных реактивов – ферментных препаратов.

