Долгое время вещества, которые сейчас называются пищевыми волокнами, считались балластом, не представляющим никакой ценности для человека. Теория адекватного питания, разработанная российским физиологом А. М. Угоревым в 80-е годы XX в., указала на важную роль балластных веществ в процессах пищеварения и обмена веществ в целом, их влияния на рост и развитие нормальной кишечной микрофлоры.
Пищевые волокна (ПВ). Это основные биополимеры однолетних и многолетних растений, трав, стеблей злаков и древесины и обязательная составная часть продуктов переработки пищевого сырья: зерна, овощей, фруктов, ягод – повседневной пищи человека.
Пищевые волокна (диетические, растительные, грубые, сырые волокна, балластные вещества) – комплекс биополимеров, включающий полисахариды, олигосахариды, а также лигнин, формирующие клеточные стенки растений и ассоциированные растительные вещества, устойчивые к перевариванию в тонком кишечнике человека, полностью или частично ферментируемые в толстом кишечнике (рис. 12.1).
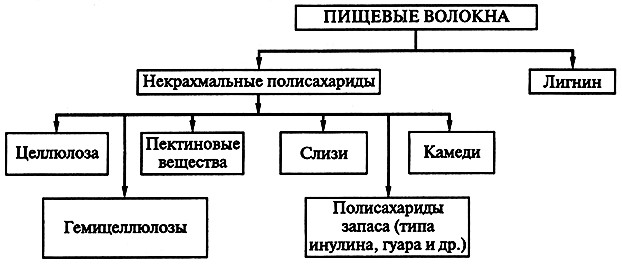
Рис. 12.1. Классификационная схема пищевых волокон
Совершенствование технологии пищевых продуктов ведет к очищению от ПВ, а следовательно, к уменьшению количества их в ежедневных рационах питания.
Как следствие, в конце XX в. в мире получили развитие ряд заболеваний, названных «болезнями века»: колиты, запоры, дивертикулез, диабет, атеросклероз, рак прямой кишки и др.
Одновременно снизилась сопротивляемость организма человека воздействию экологически вредных веществ. Получили развитие гиподинамия и гипокинезия.
Длительное уменьшение мышечной деятельности человека, обусловленное снижением активности его движения, привело к ухудшению моторной деятельности кишечника. Уменьшение содержания ПВ в продуктах питания способствует усугублению этого процесса.
Растворимые и нерастворимые пищевые волокна влияют на функции пищеварительного тракта разными путями. В желудочно-кишечном тракте отсутствуют ферменты, расщепляющие волокна, поэтому последние достигают толстого кишечника в неизмененном виде. Содержащиеся здесь бактерии обладают ферментами, способными метаболизировать некоторые волокна, в первую очередь растворимые, и получать энергию для размножения и строительства новых клеток.
Нерастворимые пищевые волокна, которые не подвергаются действию ферментов бактерий, удерживают воду в кишечнике, стимулируют моторную деятельность, участвуют в механизме предупреждения кариеса, а также выполняют функции энтеросорбентов, связывая токсические вещества и радионуклиды и выводя их из организма.
Наиболее важные физиологические функции растворимых ПВ обусловлены их пребиотическими свойствами, которые связаны с участием в формировании питательной среды для развития нормальной кишечной микрофлоры.
Установлена физиологическая суточная потребность организма взрослого человека в ПВ, которая составляет от 25 до 38 г.
Недостаток ПВ в пище обусловил необходимость анализа содержания ПВ в разнообразных видах растительного сырья и поиска путей их восполнения в ней. Среди них:
- введение в ежедневные рационы питания растительной массы, содержащей повышенное количество ПВ;
- производство и использование концентратов ПВ, выделяемых преимущественно из вторичных ресурсов переработки зерна и другого сырья;
- производство новых комплексных продуктов питания, обогащенных ПВ.
Растительное сырье содержит различное количество ПВ, что зависит от его ботанической принадлежности, морфологических и анатомических особенностей тканей.
ПВ, формирующие клеточные стенки различных растений, в основном содержат целлюлозу, гемицеллюлозы, пектиновые вещества, лигнин. Структуры этих веществ и их межмолекулярное взаимодействие определяют свойства ПВ в целом: способность удерживать влагу, ионитные и другие особенности, поведение при кулинарной обработке и качество пищи.
Целлюлоза
По молекулярному строению – это высокополимерный линейный гомополисахарид растений, состоящий из остатков D-глюкозы, соединенных между собой β-1,4-гликозидными связями. Большинство остатков глюкозы в целлюлозе содержит три свободных гидроксила у 2, 3 и 6-го углеродных атомов, которые являются основой для образования водородных связей и формирования прочных волокон. В среднем одна нить целлюлозы состоит из 6000–12 000 глюкозных остатков с молекулярной массой 3 • 105–2 • 107. Количество звеньев макроцепи в молекулах нативной целлюлозы, или степень полимеризации (СП), может составлять более 10 тыс. глюкозных единиц.
Молекулярное строение целлюлозы определяет ее надмолекулярную структуру, а также физико-химические и морфологические свойства:
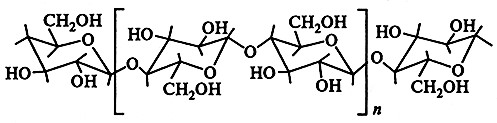
Линейные гидрофильные молекулы целлюлозы объединяются в виде параллельных нитей в характерное образование, называемое фибриллами. Первичная фибрилла представляет собой наименьшее надмолекулярное звено волокна целлюлозы.
В первичных фибриллах однородные высокоупорядоченные кристаллические зоны, или «кристаллиты», чередуются с неоднородными и менее упорядоченными аморфными зонами. В кристаллитах существует трехмерный дальний порядок в расположении цепей. В аморфных участках стройный дальний порядок отсутствует и сохраняется лишь общая продольная направленность цепей.
Первичные фибриллы целлюлозы соединяются между собой с помощью водородных связей в микрофибриллы, которые и являются основой строения волокон целлюлозы.
Лигнин и гемицеллюлозы заполняют пространство между элементарными фибриллами целлюлозы. Таким образом, одревесневшее вещество является полимерной структурой, состоящей из целлюлозной арматуры, погруженной в лигноцеллюлозную матрицу, имеющую сетчатое строение.
Количество целлюлозы в пищевых волокнах примерно около 30 %, и хотя ее содержание в растительной пище около 1 %, она в значительной степени структурирует пищу. Ее усвояемость в кишечнике человека в большой степени определяется происхождением, содержанием в пищевом рационе и характером предварительной обработки и колеблется в среднем от 6 до 23 % (переваримость целлюлозы пшеничных отрубей – порядка 15 %). Клетчатка овощей переваривается значительно лучше, чем клетчатка зерновых культур.
Роль целлюлозы в пищеварительном тракте человека заключается в следующем: стимулирование деятельности кишечника, усиление его перистальтики, нормализация деятельности кишечной микрофлоры, сорбция стеринов (препятствует их всасыванию, что способствует выделению холестерина).
Неволокнистая порошкообразная модификация природной целлюлозы, нашедшая значительное применение, – микрокристаллическая целлюлоза (МКЦ). Основными поставщиками этого продукта являются фирмы США и Японии. МКЦ снижает калорийность пищи, является ее загустителем и диспергатором, улучшает ее товарный вид и качество блюд, способствует длительному сохранению пищи. В пищевой промышленности Японии применяется легкотекущая, высокогигроскопичная, порошковая модификация микроволокнистой целлюлозы.
Гемицеллюлозы (ГМЦ)
Это растительные гомо- и гетерополисахариды с меньшей, чем у целлюлозы, молекулярной массой (10000 –40000), состоящие из остатков разных пентоз и гексоз. Основные компоненты гемицеллюлоз – глюканы, ксиланы, маннаны, галакганы, фрукгозаны, арабиногалактаны и т.д. Больше всего в растениях содержится ксиланов. Много ГМЦ в семенах, косточках, соломе, подсолнечной лузге, шелухе семян хлопчатника, кукурузной кочерыжке. В среднем гемицеллюлозами представлено 25 % (по массе) органического вещества однолетних растений.
При гидролизе ГМЦ дают разнообразный набор соединений: D-фруктозу, D-ксилозу, D-галактозу, D-маннозу, L-арабинозу, L-рамнозу, D-глюкозу, D-галактуроновую и 4-0-метил-0-глюку- роновую кислоты, которые присутствуют в виде боковых ответвлений. Моносахариды входят в состав ГМЦ в пиранозной и фура- нозной формах, уроновые кислоты – в пиранозной форме. Отдельные моносахариды в ГМЦ связаны β-1 → 2-, β-1 → 3-, β-1 → 4- и β-1 → 6-связями.
Полисахариды ГМЦ – обязательная составная часть клеточных стенок растений, выполняют в основном конструктивные функции, инкрустируя целлюлозу. В ряде случаев наряду с крахмалом полисахариды ГМЦ являются запасными питательными веществами. Они входят в состав клеточных стенок различных микроорганизмов.
В отличие от целлюлозы ГМЦ относятся к легкогидролизуемым полисахаридам. Их извлекают из измельченных, обезжиренных и обессмоленных растительных тканей или делигнифицированного сырья водными растворами щелочей, диметилсульфоксидом. Из полученных растворов ГМЦ осаждают спиртом, ацетоном, реактивом Фелинга, солями, цетилтриметиламмонием, отделяют центрифугированием, промывают и лиофильно высушивают.
Полисахариды ГМЦ отличаются разнообразными свойствами, что обусловлено различным расположением звеньев в полимерной цепи, типом связи межцу остатками моносахаридов, степенью и характером ветвления звеньев, величиной молекулярной массы и содержанием различных функциональных групп.
Особенности отдельных видов полисахаридов ГМЦ приведены на рисунке 12.2.
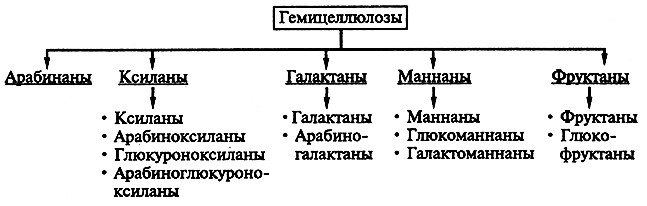
Рис. 12.2. Состав гемицеллюлоз растительного сырья
Арабинаны – полисахариды, сопутствующие пектиновым веществам в растительных тканях. Выделенные из различных видов сырья (корней сахарной свеклы, земляного ореха, яблок, цитрусовых), арабинаны отличаются друг от друга степенью ветвления. Они растворимы в воде, легко гидролизуются.
Ксиланы – наиболее распространенные полисахариды, входящие в группу гемицеллюлоз. Их молекулярная масса порядка 30 000–40 000 Да. Как правило, макромолекулы этих соединений разветвлены. Основная наиболее длинная цепь сформирована из остатков D-ксилопираноз, соединенных между собой β-связыо по месту 1 → 4 углеродных атомов. В составе боковых, менее разветвленных цепей найдены: L-арабиноза, D-ксилоза, глюкуроновая кислота и ее метиловый эфир, реже D-глюкоза и D-галактоза. Они могут быть одинаковыми или сочетаться друг с другом.
Для разных видов растений и их анатомических частей характерны различные по составу боковых цепей полисахариды, что влияет и на качество пищевых продуктов.
Галактаны – их количества колеблются от менее 1 до 15,8 %, они формируют клеточные стенки разнообразных растений. Строение макромолекул галактанов зависит от вида растительного сырья. Из семян белого люпина выделен линейный полимер, построенный из остатков D-галактопираноз, соединенных β-1 → 4 связью. Галактозы в линейной цепи полисахарида березы соединены α-связью.
Сульфированные галактаны, выделяемые из водорослей, обладают значительными желирующими свойствами и широко используются в кондитерском производстве. Они делятся на две группы: агар и каррагинан. Агар является смесью двух полисахаридов – агарозы и агаропектина. Основная фракция агарозы – линейный полисахарид, построенный из повторяющихся звеньев агаробиозы, соединенной в цепи гликозидной связью β-1 –> 3. Моносахаридные остатки в агаробиозе – D-галакгозы и 3,6-ангидро-L-галактозы – соединены связью α-1 → 4. Серная кислота посредством эфира присоединена к 6-му углеродному атому галакгопиранозы.
Каррагинаны состоят из двух фракций: λ- и X-каррагинанов, которые построены из звеньев сульфированной галактозы и 3,6-ангидрогалакгозы. Агаро- и каррагинаноподобные полисахариды образуют прочные студни даже в водных растворах очень малых концентраций – 0,1–3 %. Эти свойства обусловлены спецификой конформаций сульфополисахаридов в растворе.
Сульфированные полисахариды широко используют в кондитерской промышленности при производстве желе, мармеладов, киселей и других пищевых продуктов.
Маннаны – формируют клеточные стенки хвойной древесины, дрожжей, водорослей и другого сырья. Они построены из остатков D-маннапираноз, соединенных 1 → 4 или 1 → 6 связями. К ним относятся галактоманнан, глюкоманнан, галакгоглюкоман- нан. Молекулы могут быть линейными или разветвленными, причем боковые цепи соединены с основной связями 1 → 2 или 1 → 3.
Фруктаны – содержатся в зерне пшеницы, ячменя и других покрытосеменных растениях, в топинамбуре, травах, бактериях.
Фруктаны построены из остатков фруктозы, соединенных по месту 2 → 1 или 2 → 6 углеродных атомов. К их числу относятся инулин, аспарагозин и другие вещества.
Роль гемицеллюлоз в питании человека разнообразна. Они безвредны для организма человека и перевариваются в зависимости от строения на 69–95 %. ГМЦ служат источником энергии, влияют на липидный обмен, играют роль энтеросорбентов, снижают содержание холестерина, сорбируют микрофлору, соли тяжелых металлов. В настоящее время определено значительное влияние ГМЦ на качество пищевых продуктов. В качестве пищевых добавок используют маннаны и галактаны.
Пектин
Это растительный полимер, представляющий собой частично этерифицированную метанолом полигалактуроновую кислоту с боковыми цепями из остатков D-галактозы, L-арабинозы, D-ксилозы, L-рамнозы и других соединений. В небольшом количестве пектину сопутствуют пектиновые вещества (ПВ) – полигалактурониды, содержащиеся как в наземных, так и в водных растениях. Они входят в состав клеточных стенок и межклеточных образований. В клетках они ассоциированы с целлюлозой, ГМЦ и лигнином. В большинстве случаев пектиновые вещества – гетерополисахариды, сформированные из галактуронана, арабинана, галактана. В состав галактуронана часто входят остатки рамнозы и арабинозы. Нерастворимые пектиновые вещества – протопектины – содержатся в сырье в виде кальциевых, магниевых солей и частично метоксилированы.
Нерастворимый пектин образован из длинных, переплетающихся цепей пектиновой кислоты, видимо, связанных друг с другом в местах скрещивания через кальциевые, магниевые соли. В результате обработки разбавленными кислотами образуются водорастворимые пектиновые кислоты.
Молекулярная масса пектина колеблется от 2000 до 50 000 Да в зависимости от вида исходного сырья.
Пектин используют в кондитерской промышленности как студнеобразующую добавку при производстве мармелада, желе; в консервной – при получении джемов, желе; в хлебопечении – при выпечке медленно черствеющих сортов хлеба; сыроварении – для увеличения водопоглотительной способности сыров, а также в ряде других производств.
Пектин является энтеросорбентом различных вредных веществ: радионуклидов, солей тяжелых металлов, многих токсичных органических веществ – и способен выводить их из организма. В промышленности пектин выделяют из яблочных выжимок, жмыха подсолнечника, свекловичного жома, отходов переработки цитрусовых.
Лигнин
Он формирует значительную часть пищевых волокон. Это инкрустирующий групповой полимер ароматического характера, построен из фенилпропановых структурных звеньев трех типов: n-оксифенилпропана (I), гваяцилпропана (II), сирингилпропана (III). Находясь в различных соотношениях, они формируют лигнины всех растений. Их состав и строение зависят от ботанической принадлежности растений, например, для лигнина хвойных пород характерна структура II типа, лиственных пород – II и III типов.
Содержание лигнина может колебаться от 6,8 % (оберточные листья кукурузы) до 30,5 % (сосна).
В естественных условиях лигнин как таковой не существует, а представляет собой лигнинполисахаридный комплекс, в котором предполагается наличие химической связи между ГМЦ и лигнином.
Считается, что 3/4 общего количества лигнина связано с углеводами.
Природа связи между углеводами и лигнином окончательно не определена. Вероятно присутствие сложноэфирных связей между гидроксилами и карбоксилами, простых эфирных, фенилгликозидных и др. Кроме химических между лигнином и углеводами существуют и водородные связи, обусловленные силами Ван-дер-Ваальса, механического сцепления.
Камеди
Это растительные и микробные полисахариды (камедь гуара, камедь рожкового дерева, камедь ксантана и др.) или гликопротеиды (гуммиарабик), включающие глюкуроновую и галактуроновую кислоты, галактозу, ксилозу, арабинозу, маннозу в различных последовательностях и соотношениях, а также полипептидные фрагменты.
Полисахариды запаса
Это комплекс растительных полимеров, состоящих из остатков D-фруктофуранозы, связанных 1,2-β-гликозидными связями (инулин и др.).
Углеводно-белковые комплексы
Для клеточных стенок растений характерна тесная взаимосвязь ГМЦ, лигнина, белков, существование лигноуглеводных, углеводно-белковых комплексов. Вероятно, при применении мягких методов фракционирования возможно сохранение этих комплексов, содержащих ковалентные связи между макромолекулами, и в ПВ.
12.1. МЕТОДЫ ВЫДЕЛЕНИЯ ПИЩЕВЫХ ВОЛОКОН
В соответствии с рекомендациями ФАО/ВОЗ продукт, в 100 г которого содержится 3 г ПВ, рассматривается как источник этого функционального ингредиента, при содержании 6г ПВ в 100г продукта он считается обогащенным пищевыми волокнами.
Существуют различные способы обогащения продуктов пищевыми волокнами, каждый из которых обладает определенными достоинствами и недостатками:
- использование в полном объеме сырья, содержащего ПВ;
- добавление вторичных продуктов с высоким содержанием ПВ;
- введение препаратов ПВ.
Среди известных способов обогащения продуктов питания пищевыми волокнами наиболее перспективно введение в продукт очищенных препаратов ПВ, позволяющих наряду с обогащением продукта решить технологическую задачу формирования необходимой консистенции или улучшения свойств продукта.
Получение препаратов ПВ основано на их выделении из растительного сырья и последующей очистке. Известные методы выделения ПВ включают удаление из измельченной растительной ткани низкомолекулярных веществ: моносахаридов, гликозидов, алкалоидов, минеральных соединений, либо гидролиз и экстракцию сопутствующего крахмала.
Выбор метода выделения ПВ из растительного сырья определяется их содержанием и плотностью упаковки биополимеров клеточных стенок.
В зависимости от вида перерабатываемого сырья экстракция низкомолекулярных веществ и крахмала ведется водой при нагревании (выжимки и вытерки ряда овощей, фруктов, винограда), разбавленными растворами минеральных кислот (серной, хлоридной, фосфорной), щелочами (отруби, мучки, отходы переработки овощей), солями сернистой кислоты, пероксидами, детергентами (стебли злаков, пленки, оболочки зерна, травы, древесина), либо крахмал разрушают амилолитическими ферментами.
Нагревание сырья при температурах около 100 °С с разбавленными растворами кислот приводит к деструкции крахмала, частичному гидролизу полисахаридов гемицеллюлоз. Последующая отмывка водой позволяет удалить низкомолекулярные вещества. Выделенные ПВ отличаются от исходного сырья увеличенной внутренней поверхностью, повышенной способностью к сорбции и достаточной чистотой. Одновременно идет полная инактивация микрофлоры, в том числе патогенной, что повышает качество получаемых пищевых добавок.
Выделение ПВ возможно при нагревании сырья с детергентами – поверхностно-активными веществами, используемыми в малых концентрациях при небольших температурах. В более жестких условиях идет распад макромолекул ПВ.
С помощью ферментативной обработки сырья получают наименее деструктированные ПВ. В этом случае его последовательно обрабатывают амилолитическими (для удаления крахмала), а затем протеолитическими (для удаления белков) ферментами (α-амилаза, глюкоамилаза, протеаза и др., в количествах от 0,4 до 1 мг/дм3).
С использованием ферментативных методов выделены концентраты пищевых волокон из вторичных ресурсов переработки зерна, овощей, фруктов и отходов их переработки, вторичных ресурсов переработки винограда, трав, тростника и водорослей, лиственной древесины и дана их характеристика.
Известные методы определения содержания ПВ в растительном сырье основаны на максимальном удалении сопутствующих им веществ и сохранении целлюлозы, гемицеллюлоз и лигнинного комплекса.
Злаковые продукты, овощи, фрукты, виноград, орехи являются основными источниками ПВ. Кроме того, значительную часть клеточных стенок древесины, трав, стеблей злаков, кустарников составляют аналогичные компоненты, о чем свидетельствует состав их гидролизатов. Поэтому ПВ возможно получать не только из пищевого сырья, но и из древесины, трав, стеблей злаков, запасы которых практически неисчерпаемы.
Технологии выделения ПВ из нетрадиционного растительного сырья должны обязательно включать удаление из него антипитательных веществ типа гликозидов и алкалоидов, очистку от других сопутствующих низкомолекулярных и высокомолекулярных веществ (например, крахмала), снижение содержания минеральных солей. С этой целью возможно использование механических, физических, химических и биологических методов.
12.1.1. МЕТОДЫ ВЫДЕЛЕНИЯ ПВ
С ПРЕИМУЩЕСТВЕННЫМ СОДЕРЖАНИЕМ ЦЕЛЛЮЛОЗЫ
Целлюлоза в растениях очень редко находится в свободном состоянии, ей, как правило, сопутствуют гемицеллюлозы и лигнин. Если гемицеллюлозы достаточно быстро гидролизуюгся и целлюлозу легко освободить от них, то удалить лигнин очень трудно.
Природную целлюлозу можно разделить на два типа: лигноцеллюлозу (древесина, кустарники, листья и трава, морские и речные макро- и микроводоросли и т.д.) и чистую целлюлозу (хлопок, его отходы и лен).
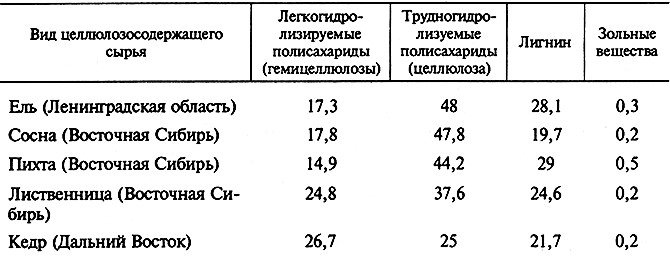
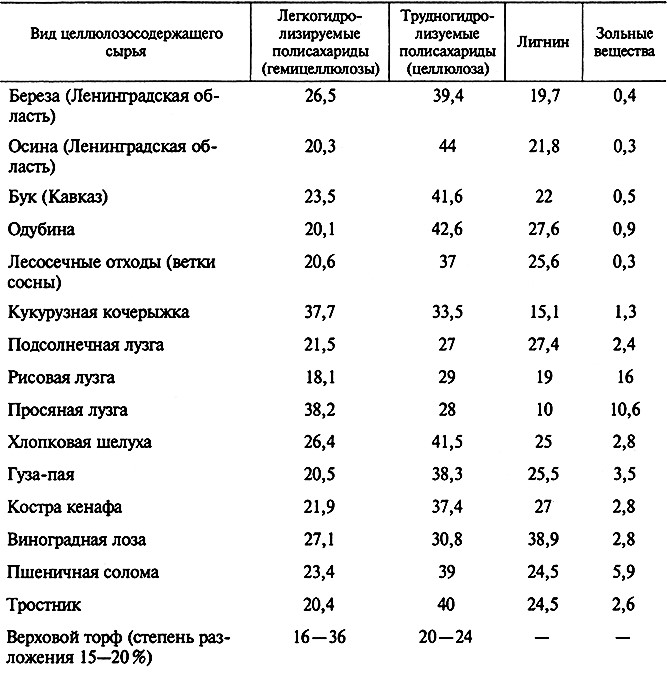
Удаление лигнина очень важный шаг в получении пищевых волокон целлюлозы. Состав природных целлюлозосодержащих материалов (ЦСМ) представлен в таблице 12.1. Данные, приведенные в таблице, свидетельствуют о том, что лигнин присутствует почти во всех растительных материалах, исключение составляет только природой обработанный материал – верховой торф.
Таблица 12.1. Состав целлюлозосодержащих материалов, %
Методы делигнификации ЦСМ разделяют на химические и биологические. Предобработка ЦСМ осуществляется физическими и механическими методами.
К физическим методам предобработки относятся различные виды облучения и другие способы:
- облучения γ-лучами или потоком электронов;
- обработка микроволновым излучением (2400–2500 мГц);
- нагревание на воздухе или в атмосфере СО2 (100 °С), в воде или в керосине, охлаждение, воздействие повышенного или пониженного давления, действие ультразвука.
Эти методы вызывают частичную деградацию сложной структуры целлюлозы и лигнина, особенно кристаллической.
К механическим методам предобработки относят различные способы измельчения сухих и влажных ЦСМ:
- на шаровых, коллоидных и вибромельницах;
- в дезинтеграторах;
- на дробилках;
- на вальцах.
Химическая делигнификация ЦСМ осуществляется кипячением или автоклавированием в течение 30–60 мин в разбавленных растворах щелочи (1–2 %), обычно NaOH или NH4OH, а также обработкой перегретым водяным паром. Делигнификация может быть проведена сульфатной и сульфитной варкой (способ, принятый в целлюлозно-бумажной промышленности), а кроме того, раствором аммиака, смешанным с пероксидом водорода или надуксусной кислотой или со смесью 99,9%-го уксусного ангидрида и 30%-го пероксида водорода (1:1 при 80 °С), водными растворами этанола или бутанола. Делигнификация этанолом осуществляется при рН 8,2, температуре 150 °С и избыточном давлении 0,5 МПа; бутанолом – в смеси с водой (1:1) в присутствии небольших добавок (до 0,3 %) НС1, NH3, NaOH или Na2CО3, процесс осуществляется в течение 1 ч при 170 °С. В качестве катализаторов используют H2SO4, FeCl3, NH4H2PО4, антрахинон (при 165 °С, 3 мин), бензол, нитробензол, толуол, фенол, уксусную кислоту (при 120 °С, 2 ч). Возможна делигнификация ЦСМ этилен-гликолем, озоном.
У нас в стране осуществлена предобработка целлюлозы методом взрывной дефибрации ЦСМ по декомпрессионному принципу или паровым взрывом. ЦСМ подвергают кратковременному воздействию перегретого пара под высоким давлением (несколько секунд, 240...300 °С, 3,5–7,5 МПа) в присутствии или отсутствии SO2, далее давление сбрасывают, что вызывает взрыв ЦСМ. Лигнин плавится, целлюлоза частично деградирует, а гемицеллюлозы гидролизуются.
К биологическим методам предобработки ЦСМ относят использование лигнолитических микроорганизмов, способных утилизировать лигнин из лигнинцеллюлозы в качестве источника углерода или ферментов, синтезируемых этими микроорганизмами. Такие микроорганизмы встречаются среди грибов, актиномицетов, бактерий, дрожжей. Но биологические методы пока недостаточно изучены. Пока они очень длительны (сутки и даже месяцы), но относительно эффективны, поскольку увеличивают реакционную способность ЦСМ в несколько раз.
Ферментативная деградация лигнина перспективна и эффективна при переработке древесного растительного сырья, а получаемые отходы можно использовать для получения кормового белка и сырья для химической промышленности. Однако пока еще не найдены активные продуценты лигнинразрушающих ферментов, хотя исследования в данном направлении ведутся уже более 50 лет. В 50-е годы XX в. было показано, что разложение целлюлозы и лигнина древесины осуществляют базидиальные грибы, которые образуют на поверхности гниющего дерева красно-коричневую (бурую) и белую гниль. Возбудители бурой гнили (Brown-rot fungi) активно гидролизуют целлюлозу, гемицеллюлозные комплексы и лишь незначительно воздействуют на лигнин, т. е. вызывают реакцию де- метилирования лигнина. В то же время возбудители белой гнили (White-rot fungi) разрушают древесину, превращая ее в белую массу. Они действуют в первую очередь на лигнин и почти не затрагивают целлюлозу. К таким грибам можно отнести следующие виды: Polyporus versicolor, Pleurotus ostreatus, Poria subacida. Разложение этими грибами лигнина идет окислительным путем, который включает деметилирование, образование дифенолов под действием диоксигеназ. Однако эти и другие грибы вызывают медленное гниение древесины и не используются для практических целей.
В 70–80-е годы было показано, что разрушать лигнин способны также аскомицеты (Ascomycetes: Penicillium, Aspergillus), несовершенные грибы (Fusarium, Alternaria), а также актиномицеты родов Streptomyces и Thermomonospora, бактерии родов Achromobacter, Agrobacterium, Pseudomonas.
Необходимо отметить, что состав лигнина разных пород деревьев неодинаков: лигнин хвойных пород имеет мономером конифериловый спирт; лиственных пород – конифериловый и синаповый спирты, а травянистых растений – конифериловый и паракумаровый, или n-оксикоричный, спирты:
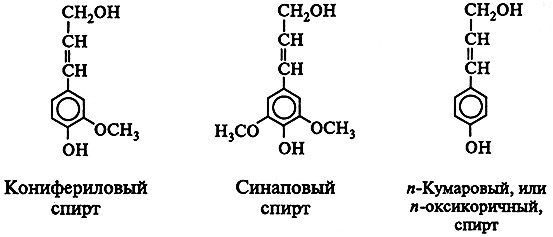
Фенилпропаноидные единицы в молекуле лигнина различным образом соединены между собой при помощи эфирных и С–С-связей, которые очень устойчивы к воздействию ферментов. Лигнин содержит значительное количество функциональных групп, но в связи с большими сложностями извлечения его из древесины в нативном виде четких представлений о его строении пока нет.
Жесткая аморфная нестереорегулярная структура лигнина отличается неупорядоченной полимеризацией радикалов, образованных растительными пероксидами из мономеров-предшественников – кумарового, синапового и кониферилового спирта.
Насчитывают не менее десяти типов связей между фенилпро- пановыми структурными единицами лигнина. Наиболее часто встречаются β-О-4- и С–С-связи типа β-1. В лигнине много метальных, метокси- и гидроксильных групп. Лигнины различного происхождения отличаются главным образом мономерами и соотношением этих мономеров в составе того или другого лигнина.
Деградация лигнина – сложный, трудноконтролируемый процесс. В нем участвует ряд окислительных ферментов, таких, как лигниназа, фенолоксидазы (лакказа, тирозиназа), пероксидаза и др. Очень важно в этом процессе и соотношение этих ферментов в реакционной среде.
Технологические особенности микробной деградации лигнинсодержащего сырья пока еще полностью не изучены, поскольку нигде не получают лигниназных препаратов для последующего использования при обработке лигнина. Поэтому сейчас стоит задача поиска природных микробных продуцентов лигнинразрушающих ферментов и разработки условий их культивирования для последующего получения технических препаратов и их апробации на различных вариантах лигнинсодержащего сырья.
Изучение биохимического состава различных представителей нетрадиционного для пищевой промышленности растительного сырья, а именно: образцов березовых и сосновых опилок, листьев березы и соломы хлебных злаков, проведенное в МГУПП, показало, что сосновые опилки наиболее богаты целлюлозой, которая составляет в них в среднем 51 %, тогда как в остальных видах исследованного сырья содержание целлюлозы меньше и варьирует в пределах 32–43 % в зависимости от вида растительного сырья.
Выделенная из них и очищенная целлюлоза может быть использована в виде пищевой добавки, способной снижать калорийность пищи, быть диспергатором, улучшать товарный вид и качество пищевых продуктов.
С целью поиска активного продуцента лигнинразрушающих ферментов, способного быстро трансформировать биополимеры растительного сырья, было испытано более 100 культур микроорганизмов: грибов, относящихся к родам Aspergillus, Penicillium, Trichoderma, Fusarium, Mucor, Rhizopus, Oospora, а также бактерий родов Bacillus, Pseudomonas, Entembacter, Micrococcus, дрожжей родов Candida, Endo- mycopsis, Trichosporon и акгиномицетов рода Streptomyces. На основании проведенного скрининга микроорганизмов был выбран штамм Streptomyces mersei С-24, способный утилизировать лигнин на 73,9 % в условиях глубинной ферментации на питательной среде следующего состава, %: сосновые опилки – 10, NH4NО3 – 1,5, КН2РО4 – 0,5, MgSО4 • 7Н2О – 0,01, кукурузный экстракт – 2, глюкоза – 1.
Из культуральной жидкости S. mersei С-24 путем осаждения белка этанолом при соотношении культуральная жидкость: этанол 1:3, отделения осадка фильтрацией и сушкой под вакуумом при температуре 40...50 °С был получен ферментный препарат лигниназы, обладающий гемицеллюлазной, лактазной и пероксидазной активностями.
Выделенный ферментный препарат использовали для получения концентрата пищевых волокон с повышенным содержанием целлюлозы (КПВЦ) из сосновых опилок по разработанной технологической схеме, представленной на рисунке 12.3. Обработка растительного сырья ферментным препаратом позволила получить КПВЦ следующего состава, %: целлюлоза – 87, гемицеллюлоза – 11, лигнин – 2.
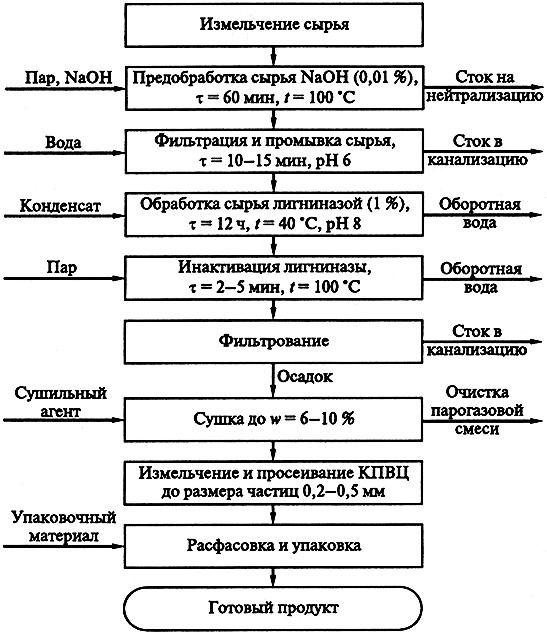
Рис. 12.3. Принципиальная технологическая схема процесса получения КПВЦ из растительного сырья
Исследования функциональных свойств полученного КПВЦ показали, что он может быть использован при производстве функциональных пищевых продуктов, в частности хлебобулочных изделий.
12.1.2. МИКРОБИОЛОГИЧЕСКИЙ СПОСОБ ВЫДЕЛЕНИЯ ПЕКТИНА
ИЗ ОТХОДОВ РАСТИТЕЛЬНОГО СЫРЬЯ
Традиционная технология получения пектина основана на кислотно-термическом гидролизе и последующем спиртовом осаждении из гидролизата. Получение пектина зарубежными компаниями в настоящий момент основано именно на такой технологии.
По оценкам многих экспертов за рубежом, производство пектина по классической технологии целесообразно лишь при объемах производства не менее 2000 т пектина в год из-за огромных затрат на производство, утилизацию кислых сред и амортизационные отчисления на восстановление технологического оборудования.
Использование ферментных препаратов существенно упрощает технологический процесс получения пектина и его аппаратурное оформление, сокращает расход этанола на стадии выделения пектина. С этой целью используют целлюлазы и гемицеллюлазы или пекголитические ферменты.
Гидролиз пектолитическими ферментами приводит к удалению с помощью эндополигалактуроназ фрагментов полигалактуроновой кислоты из состава протопектина. При этом структура комплекса целлюлозы и гемицеллюлозы не затрагивается, что физически затрудняет процесс экстракции пектина и позволяет получать его препараты с более высоким относительным содержанием полигалактуроновой кислоты. В этом варианте технологии важно ограничить степень гидролиза пектина в процессе экстракции, чтобы получить продукт достаточно высокой молекулярной массы.
Большинство полигалактуроназ эндотипа синтезируются в сочетании с пектинэстеразой, которая необходима для проявления их активности. В препаратах пектолитических ферментов соответственно присутствуют оба вида фермента. При гидролизе растительного сырья пектолитическими препаратами происходит не только вырезание фрагментов полигалактуроновой кислоты, но и частичная деэтерификация последней. Это оценивается положительно в тех случаях, когда получают пектин лечебно-профилактического назначения с высокой комплексообразующей способностью. При получении пектинов-структурообразователей важно сохранить высокую степень этерификации, поэтому целесообразно использовать первый путь ферментативного гидролиза сырья.
При гидролизе целлюлозы облегчается выход комплекса полигалактуроновой кислоты и гемицеллюлоз из клеточных стенок. Гидролиз гемицеллюлоз приводит к повышению содержания полигалакгуроновой кислоты в выделяемом пектине. При отсутствии в используемых ферментных препаратах пектолитических ферментов полигалактуроновая кислота пектина не расщепляется, а степень ее этерификации не изменяется. Получаемый пектин содержит частично метоксилированную полигалактуроновую кислоту, ковалентно связанную с фрагментами гемицеллюлозы, поскольку полное отщепление нейтральных полисахаридов обычно не достигается. Одновременно с этим из сырья выделяются растворимые формы пектина, если они не извлечены на предшествующих стадиях переработки сырья.
В 70-е годы был разработан способ получения пектина из выжимок (яблок, груш, айвы и др.), основанный на гидролизе сырья Целловиридином ГЗХ. В препарате практически отсутствует пектолитическая активность. Гидролиз свежего сырья проводят в течение 2–З ч при температуре 45...50 °С, гидромодуле 1:3 и дозе препарата 0,1–0,3 % массы сырья. При гидролизе в экстракт переходит 85–90 % пектина, который представлен в виде как пектиновой кислоты, так и протопектина. При гидролизе этого же сырья Целловиридином Г20Х в дозе 5,7–6,5 ед. целлюлазы на 1 г СВ сырья в течение 2–3 ч получают пектин со степенью этерификации 88 %. Из экстракта получают концентрированные жидкие или спиртоосажденные препараты пектина. Способ применим и к другим видам сырья (выжимки смородины и рябины).
Позднее было выяснено, что возможно использование пектинрасщепляющих ферментных препаратов (Пектомацерин Г10Х и Пекталлиацин Г10Х) для выделения пектина из цитрусовых выжимок. Оптимальная доза первого препарата – 0,0025–0,0062, второго – 0,05–0,07 % массы сырья. При осаждении пектина из экстракта выход составляет 14 % массы сырья. Повышение дозы препаратов приводит к деградации пектина.
Разработан способ получения пектина из тыквенного жома, который является отходом производства тыквенного сока, с использованием ферментного препарата Пектаваморин в количестве 14 % массы воздушно-сухого жома по сравнению с 7 % при кислотной экстракции. Ферментный препарат обладает целлюлазной, β-глюкозидазной, эндополигалактуроназной и пектинэстеразной активностями. Полученный тыквенный биопектин эффективно образует комплексы с тяжелыми металлами и может быть использован при производстве функциональных продуктов питания.
Разработан способ получения пектина из яблочных выжимок с использованием препарата Винозим JI путем перевода протопектина в растворимый пектин при гидромодуле 1:1. Винозим Л является комплексным ферментным препаратом с пектолитической, целлюлазной, гемицеллюлазной и β-глюканазной активностями, поэтому при его действии наблюдается одновременное нарушение структуры полисахаридов – целлюлозы, гемицеллюлозы, крахмала, приводящее к образованию простых соединений.
Поскольку степень экстрагирования растворимого пектина из выжимок отстает от степени гидролиза, при проведении кратковременной ферментативной обработки выжимок в течение 30 мин создаются условия, благоприятные для перевода протопектина в растворимый пектин, а принятый гидромодуль 1:1 сдерживает экстрагирование растворимого пектина в гидролизат. При этом растворимый пектин остается в выжимках, что очень важно для получения сгуднеобразующего порошка, который можно использовать в консервной, кондитерской отраслях при выработке повидла, конфитюра, подварок, начинок для конфет, а также в качестве биологически активных добавок при выработке соков с мякотью, хлебобулочных и других изделий.
Возможно получение пектина с использованием пекгиназно-целлюлазного комплекса (соотношение пектиназы и целлюлазы 1:10).
Пектинсодержащее растительное сырье разбавляют водой при гидромодуле 1: (4–5), нагревают до 40...50°С, вносят пектиназно-целлюлазный ферментный препарат в количестве 0,03–0,05 % массы сырья, проводят ферментолиз в течение 90–120 мин при периодическом перемешивании и разделяют фазы. Возможно осуществление промывки твердой фазы водой и смешивание повторно отделенной жидкой фазы с ферментолизатом. Далее из жидкой фазы выделяют целевой продукт, например мембранным концентрированием или спиртовым осаждением и сушкой. Выход пектина повышается в среднем на 10 % и зависит от вида сырья.
12.1.3. ИЗМЕНЕНИЕ СОСТАВА ПИЩЕВЫХ ВОЛОКОН
С ПОМОЩЬЮ ГЕМИЦЕЛЛЮЛАЗНЫХ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Во всем мире при переработке растительного сырья придают большое значение его обработке гемицеллюлазными ферментами. С помощью этих ферментов можно изменять биохимический состав пищевых волокон и одновременно получать глюкозу и пентозы, которые можно использовать для производства кормовых белковых препаратов, для получения ксилита, фурфурола, этанола, биогаза и т.д.
Как уже говорилось ранее, гемицеллюлозы являются широко распространенными в природе полисахаридами, состоящими из различных моносахаров.
Соответственно в природе есть тысячи микроорганизмов – продуцентов гемицеллюлазных ферментов, которые относятся к самым разнообразным таксономическим группам.
Все гемицеллюлазные ферменты можно разделить на три группы: β-D-глюканазы, β-ксиланазы, β-глюкозидазы.
β-D-Глюканазы
К ним относят группу ферментов, катализирующих расщепление β-глюканов с β-1,2-, β-1,3-, β-1,4- и β-1,6-связями. Согласно номенклатуре ферментов в нее входят шесть энзимов. Объединяет же всю эту группу ферментов их способность к гидролитическому расщеплению внутримолекулярных глюкозидных связей в β-глюканах различного происхождения.
β-Ксиланазы
К ним относят систему ферментов, катализирующих расщепление β-гликозидных связей в β-ксиланах, эта группа включает пять ферментов.
При изучении ксиланаз на различных субстратах было установлено, что по механизму воздействия их можно подразделить на две группы: гидролизующие α-1,3-связь, расположенную между ксилозой и арабинозой; ферменты, не отщепляющие арабинозу от арабиноксиланов, арабиноглюкуроноксиланов и олигосахаридов.
β-Глюкозидазы
β-Глюкозидаза – фермент экзогенного действия. Она гидролитически расщепляет последнюю с нередуцирующего конца β-1,4-связь в β-D-глюкозидах, высвобождая β-D-глюкозу. β-Глюкозидаза проявляет широкую субстратную специфичность. Некоторые ферменты этой группы гидролизуюг не только β-D-глюкозиды, но и β-D-галактозиды, α-L-арабинозиды и β-D-ксилозиды.
β-Глюканазы образуются грибами, бактериями и дрожжами. Спороносные бактерии В. subtilis и В. mesenterial синтезируют из комплекса гемицеллюлаз только β-глюканазы, что снижает их практическую значимость.
Продуцентами ксиланаз являются грибы, актиномицеты, бактерии, дрожжи. Наибольшей продуцирующей способностью обладают грибы, относящиеся к родам Trichoderma, Trichothecium, Penicillium, Stachybotrys и особенно виды рода Aspergillus.
β-Глюкозидазы образуются бактериями, дрожжами, грибами. Наиболее активными продуцентами β-глюкозидаз являются грибы, принадлежащие к родам Trichoderma и Aspergillus.
Гемицеллюлазные ферментные препараты в лабораторных и промышленных условиях получают поверхностным и глубинным способами на основе различных видов микроорганизмов: Trichothecium roseum, Aspergillus awamori, A. foetidus, A. niger, Streptomyces afghaniensis, Trichoderma viride, T. longibrachiatum, Geotrichum candi- dum, Actinomyces griseinus, а также с помощью анаэробных бактерий, относящихся к родам Clostridium, Acetivibrio и др., например С. thermocellum, A. cellulolyticus.
12.2. СВОЙСТВА ПИЩЕВЫХ ВОЛОКОН
Пищевые волокна – сложный комплекс биополимеров (полисахаридов и лигнина) линейной и разветвленной структуры. Первичные и вторичные гидроксильные группы, фенольные, карбоксильные группы обусловливают межмолекулярное взаимодействие (водородные связи), способность сорбировать воду и другие полярные молекулы и ионы. Поэтому ПВ обладают рядом физико-химических свойств, в том числе: водоудерживающей способностью, взаимодействием с белками, ферментами, гормонами, продуктами распада углеводов, пептидами и аминокислотами, жирными и другими кислотами в процессе пищеварения в желудочно-кишечном тракте человека. Вид этих взаимодействий зависит от состава и строения ПВ, вида и плотности межмолекулярной упаковки, количества аморфных и кристаллических участков волокон.
Пищевые волокна, выделяемые из растительного сырья, представляют собой порошкообразные продукты. Их физические свойства определяют возможность их использования в виде пищевых добавок и лечебно-профилактических средств.
Препараты ПВ, выделенные из различного растительного сырья, характеризуются более развитой удельной поверхностью, большим средним радиусом пор, чем в исходном сырье, что определяет целесообразность их использования в качестве сорбентов.
Водоудерживающая способность (ВУС) связана не только с особенностями состава, строения биополимеров ПВ, но и с размерами их частиц, характером поверхности, пористостью. Компоненты ПВ характеризуются разной способностью сорбировать воду. Так, пектиновые вещества, полисахариды гемицеллюлоз обладают повышенными влагоудерживающими свойствами.
У лигнина меньшая ВУС, что связано с межмолекулярной упаковкой. Способность поглощать и удерживать воду у целлюлозы значительно выше из-за наличия системы тончайших субмикроскопических капилляров.
По способности прочно удерживать воду ПВ располагают в следующий ряд: ПВ яблок > ПВ трав > ПВ древесины > ПВ сельскохозяйственных отходов и продуктов переработки зерна > ПВ листовой ткани и морских растений.
Считают, что самые большие размеры пор у ПВ отрубей, яблок; меньшие – у ПВ, выделенных из других видов сырья.
Пищевые продукты имеют различную влажность и относительное содержание ПВ, что определяет их водоудерживающую способность и влияет на их свойства в пищеварительном тракте.
Ионообменные свойства ПВ
Пищевые волокна оказывают влияние на минеральный обмен в желудочно-кишечном тракте за счет присутствия в них карбоксильных групп гемицеллюлоз и пектиновых веществ, фенольных гидроксилов лигнина, которые связываются катионами и в меньшей степени анионами.
Они способны вступать во взаимодействие с рядом металлов, в том числе с тяжелыми, анионами кислот, а также с полярными органическими веществами: фенолом, карбамидом, холевыми кислотами и др.
На этот процесс значительное влияние оказывает целый рад факторов: размеры частиц сырья, величина рН среды, температура, время контакта.
Катионообменная способность ПВ (КОС) определяется в основном содержанием в них карбоксильных групп, большая часть которых находится в форме солей, способных под воздействием сильных минеральных кислот переходить в Н+-форму. Поэтому предварительная обработка сырья в процессе выделения ПВ способствует повышению их концентрации и увеличивает их катионообменную способность.
ПВ обладают как ионитной, так и молекулярной сорбцией. Они способны связывать ионы как свинца, так и кадмия, а также других тяжелых металлов (присутствующих в воде и почве, а следовательно, в пище), нитраты, нитриты, аммиак, радионуклиды и целый рад органических веществ, в том числе фенолы, формальдегид, карбамид и др.
Концентраты ПВ, выделенные из различных видов растительного сырья, обладают разной способностью связывать экологически вредные вещества (ЭВВ).
Наилучшими сорбционными свойствами из всех видов ПВ обладает лигнин. Эффективен комплекс целлюлозы с гемицеллюлозами. Целлюлоза обладает высокой сорбционной способностью по отношению к нитратам и нитритам, карбамиду, меньшей – к другим ЭВВ.
Сорбционная способность ПВ как полиэлектролита зависит от их вида и величины рН раствора. Так, при сорбции РЬ2+ из раствора концентрации 0,01 моль/дм3 активность ПВ виноградных выжимок > ПВ свеклы > ПВ люцерны > ПВ клевера > ПВ лигнина > ПВ активированного угля. Возможно применение ПВ в лечебной практике в качестве энтеросорбентов.
Однако при использовании ПВ в лечебно-профилактических целях необходимо учитывать, что длительное и избыточное введение их с пищей может несколько снизить (на 1,5–3 %) всасывание незаменимых микро- и макроэлементов и ряда водорастворимых витаминов. Считается, что ПВ связывают фолиевую кислоту и некоторые витамины группы В. В то же время имеются данные об усилении под действием ПВ внутрикишечного бактериального синтеза витаминов В1 В2, B6, РР и фолиевой кислоты. Благодаря адсорбционным и катионообменным свойствам, а также наличию фитатов ПВ снижают поступление в организм кальция, цинка, фосфора, железа, магния и др. Все это следует учитывать при введении препаратов ПВ в рецептуры пищевых продуктов.
Радиопротекторные свойства ПВ
Различные виды пищевых волокон способны связывать радиоактивные цезий-137 и стронций-90 в организме животных и человека.
Наибольшей способностью связывать изотопы стронция-85 и снижать их накопление в организме обладают пищевые волокна, выделенные из люцерны и кожуры лимона.
Сорбция холевых кислот (ХК)
Эти кислоты содержатся в желчи человека и обычно связаны амидными связями с аминокислотами и таурином. Печеночная ткань превращает приблизительно 80 % холестерина в желчные кислоты, преимущественно в собственно холевую и хенодезоксихолевую. Причем ежедневно из организма человека выводится от 0,8 до 1 г всех желчных кислот.
Поэтому способность ПВ сорбировать и выводить из организма холевые (желчные) кислоты представляет значительный интерес, поскольку приводит к понижению содержания в нем холестерина и замедлению развития атеросклероза.
Способность ПВ, выделенных из разного сырья, сорбировать холевые кислоты зависит от способа получения препаратов и состава ПВ, концентрации кислоты (холевой, дезоксихолевой и др.), температуры, рН и других факторов. Среди ПВ целлюлоза обладает наименьшей способностью сорбировать холевые кислоты.
Адсорбция патогенных микроорганизмов
Кишечный тракт позвоночных животных и человека является естественной средой обитания для значительного большинства энтеробакгерий. В организме человека ряд энтеробакгерий входит в состав микробных биоценозов тонкого и толстого кишечника. Патогенные виды (возбудители брюшного тифа, дизентерии, сальмонеллезов и др.) встречаются только у больных и бактерионосителей. Патогенные свойства энтеробакгерий определяются их адгезивностью – способностью прикрепляться к слизистой оболочке стенок кишечника, обусловленной положительным хемотаксисом между поверхностными структурами микроба и рецепторами эпителиальных клеток, и токсигенностью (наличием эндо- и экзотоксинов).
В лабораторных условиях для исследований обычно используются непатогенные представители семейства Enterobacteriaceae – штаммы Escherichia coli.
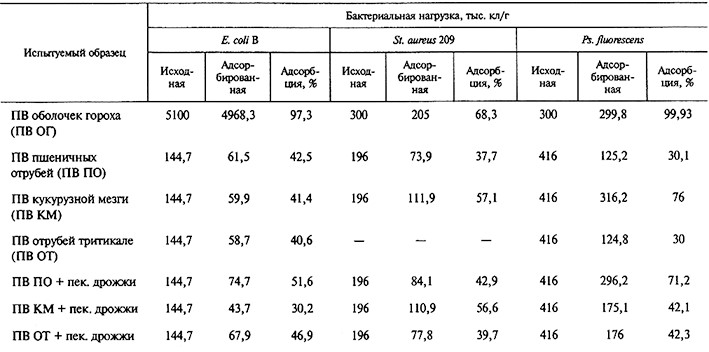
Таблица 12.2. Сорбционные свойства пищевых волокон и их комплексов с пекарскими дрожжами по отношению к различным микроорганизмам
Среди бактерий семейства Pseudomonadaceae есть виды (Ps. aeruginosa), также способные вызывать ряд заболеваний: псевдомонадный энтерит, возникающий при употреблении контаминированной возбудителем воды и клинически сходный с симптомами брюшного тифа; некротизирующий колит у детей с острым лейкозом; диарею у новорожденных; селективное размножение и активацию псевдомонад у онкологических больных. У таких больных количество псевдомонад может достигать 50–75 % всей микрофлоры фекалий; в небольшом количестве (0,1 %) псевдомонады присутствуют в кишечнике у 5–20 % здоровых людей.
Представители семейства Micrococcus, а именно рода Staphilococcus, являются представителями нормальной микрофлоры кожи человека, дыхательных путей и пищеварительного тракта; их постоянно обнаруживают в воздухе и окружающей среде. Патогенные свойства конкретного штамма стафилококка определяются суммирующим действием экзо- и энтеротоксинов и ферментов (лейкоцидина, коагулазы). Наличие у S. aureus энтеротоксина обусловливает возникновение широко распространенного типа пищевых токсикоинфекций.
Украинскими исследователями показан высокий уровень адсорбции условно-патогенных микроорганизмов пищевыми волокнами, выделенными из различного сырья (табл. 12.2).
При бактериальной нагрузке на 1 г ПВ, равной сотням тысяч микроорганизмов, уровень адсорбции Е. coli составил 40,6–42,5 %, St. aureus – 37,7–57,1, Ps.fluorescens – 30–76 %.
Способность адсорбировать палочковидные грамотрицательные бактерии (кишечную палочку и псевдомонаду) и грамположительные кокки сохраняется у пищевых волокон, обогащенных пекарскими дрожжами. Пищевыми волокнами из суспензии Е. coli в физиологическом растворе сорбировалось 30,2–51,6% бактериальных клеток; концентрация St. aureus снижалась на 39,7–56,6, Ps. fluorescens – на 42,1–71,2 %.
12.3. СИСТЕМАТИКА ПИЩЕВЫХ ВОЛОКОН
Украинскими учеными М. С. Дудкиным и Л. Ф. Щелкуновым предпринята попытка систематики ПВ по ряду признаков.
По источникам выделения ПВ из растительного сырья (I) различают:
- традиционные для пищевой промышленности источники сырья (злаки, овощи, фрукты, ягоды);
- нетрадиционные источники сырья (травы, водоросли, древесина).
По характеру биополимеров (II) ПВ разделяют на:
- гомогенные (однородные), сформированные из однотипных высокомолекулярных веществ (целлюлоза, пектин, маннаны, арабинаны, лигнин и др.);
- гетерогенные (неоднородные), включающие биополимеры нескольких видов (холоцеллюлоза, целлолигнин, белково-полисахаридные комплексы, гемицеллюлозо-целлюлозолигнины, белково-полисахаридолигнинные комплексы и др.).
По содержанию ПВ в комплексах (III)различают:
- исходное растительное сырье, содержащее до 30 % ПВ (побочные продукты переработки зерна, фруктовые выжимки, очистки, вытерки, травы, ряд овощей и др.);
- полуконцентраты ПВ, включающие 30–60 % собственно волокон (отруби зерна и др.);
- концентраты ПВ, содержащие 60–90% этих компонентов (концентраты ПВ томатных выжимок, виноградной лозы, пшеничных отрубей и др.);
- изоляты ПВ, в которых более 90 % собственно ПВ (лигнин, целлолигнин, целлюлоза, холоцеллюлоза различного сырья и другие высокоочищенные продукты).
По растворимости в воде (IV) – одному из основных свойств ПВ, определяющих их поведение в желудочно-кишечном тракте человека, ПВ можно подразделить на:
- водорастворимые (пектиновые вещества, альгиновые кислоты, арабиноксиланы, камеди, слизи и др.);
- малорастворимые и нерастворимые в воде (целлюлоза, лигнин, целлюлозолигнинные комплексы, некоторые виды гемицеллюлоз).
По водоудерживающей способности (V) – важному свойству, также влияющему на различные эффекты в желудочно-кишечном тракте человека, ПВ разделяют на:
- сильноводосвязывающие – более 8 г Н2О на 1 г ПВ (ПВ жома сахарной свеклы, виноградной лозы, клевера и др.);
- средневодосвязывающие – 2–8 г Н2О на 1 г ПВ (ПВ пшеничных отрубей, люцерны, виноградных выжимок и др.);
- слабоводосвязывающие – до 2 г Н2О на 1 г ПВ (ПВ жмыха виноградных семян, целлюлоза жмыха виноградных семян и др.).
Пищевые волокна оказывают значительное влияние на минеральный, витаминный и другие виды обменов, происходящих в организме животных и человека. Они способны связывать и выводить из организма как экологически вредные вещества (нитраты, нитриты, формальдегид, фенолы, пестициды, тяжелые металлы, микотоксины), так и нужные организму микро- и макроэлементы, витамины, влияют на обмен липидов (холестерин, холевые кислоты и т. д.). В связи с этим возможна систематизация ПВ по сорбционной способности.
По сорбционной способности (VI) ПВ подразделяют на:
- катиониты:
сильные – более 3 мг-экв. сорбата на 1 г ПВ (ПВ рисовой лузги, клевера, люцерны, салата и др.);
средние – 1–3 мг-экв. сорбата на 1 г ПВ (сельдерей, ревень, лук, яблоки, морковь, баклажаны, ПВ сои, ПВ оболочек гречихи и др.);
слабые – до 1 мг-экв. сорбата на 1 г ПВ (ПВ жома сахарной свеклы, целлюлоза жмыха виноградных семян, ПВ груши, гороха и др.); - аниониты:
сильные – более 3 мг-экв. сорбата на 1 г ПВ (ПВ люцерны, клевера, столовой свеклы, виноградной лозы и др.);
средние – 1–3 мг-экв. сорбата на 1 г ПВ (ПВ оболочек гороха, оболочек гречихи, рисовой лузги, виноградных выжимок и др.);
слабые – до 1 мг-экв. сорбата на 1 г ПВ (целлюлоза и целлолигнин жмыха виноградных семян и др.); - амфолиты:
сильные – более 3 мг-экв. сорбата на 1 г ПВ (ПВ виноградных выжимок, ПВ люцерны и др.);
средние – 1–3 мг-экв. сорбата на 1 г ПВ (ПВ сахарной свеклы и др.);
слабые – до 1 мг-экв. сорбата на 1 г ПВ (ПВ оболочек гороха и др.).
Пищевые волокна входят в ежедневный рацион питания и играют важную роль, уменьшая всасывание, а в ряде случаев и увеличивая выведение радионуклидов по сравнению с естественным выведением их из организма. Поэтому целесообразно классифицировать ПВ по этому признаку.
По радиозащитным свойствам (VII) ПВ разделяют на:
- снижающие всасывание (накопление) радионуклидов – блокаторы:
слабые – до 10 % (ПВ пшеничных отрубей, ПВ сахарной свеклы и др.);
средние – 10–30 % (целлолигнин и холоцеллюлоза люцерны, ПВ столовой свеклы, ПВ жмыха виноградных семян, ПВ кожуры апельсина и др.);
сильные – более 30 % (альгинаты, ламинария, ПВ люцерны, кожуры лимона и др.); - увеличивающие выведение радионуклидов – декорпоранты:
слабые – до 5 % (пектиновые вещества некоторых видов растительного сырья и др.);
средние – 5–20 % (ПВ люцерны, холоцеллюлоза и целлолигнин люцерны и др.);
сильные – более 20 % (ламинария).
По степени микробной атакуемости в пищеварительном тракте (VIII) ПВ целесообразно разделять на:
- ферментируемые (пектин, камеди, слизи, некоторые виды гемицеллюлоз);
- плохоферментируемые (некоторые виды гемицеллюлоз, целлюлоза).
По основным медико-биологическим эффектам (IX) ПВ разделяют на:
- влияющие на обмен липидов (ПВ пшеничных отрубей, клевера, виноградных выжимок, лигнин люцерны, гуар и др.);
- влияющие на обмен углеводов (пектин, гуар, ПВ березы, подорожника и др.);
- влияющие на обмен белковых веществ (глюкоманнаны из корней Eremurusa R. – семейство лилейных и др.);
- влияющие на обмен других веществ и соединений – минеральные вещества, витамины и т.д. (ПВ пшеничных отрубей, ПВ сахарной свеклы и др.).
Иногда ПВ одного вида сырья могут влиять на обмен различных веществ в организме, поэтому IX пункт классификации нуждается в дальнейшем совершенствовании.
Изложенная систематика позволяет:
- реализовывать ПВ того или иного вида сырья, состава и других показателей в качестве компонентов разных видов продуктов питания;
- расширять возможности создания и выделения композиционных видов этих добавок;
- устанавливать взаимосвязь между строением, свойствами, медико-биологической направленностью этих добавок;
- решать вопросы рецептуры и сбыта новых видов пищи.
12.4. ИСПОЛЬЗОВАНИЕ КОНЦЕНТРАТА
ПИЩЕВЫХ ВОЛОКОН ЦЕЛЛЮЛОЗЫ В ХЛЕБОПЕЧЕНИИ
Пищевые волокна можно непосредственно давать человеку в рассыпном виде либо в виде таблеток или вводить их в количестве 5–10% в хлеб, булочки, печенье, мясные фаршевые изделия, овощные консервы, различного вида пищевые концентраты, продукты общественного питания.
В настоящее время представленный на рынке ассортимент хлебобулочных изделий значительно расширился за счет создания новых сортов с повышенным содержанием ПВ. Рациональным представляется использование в качестве источника диетических волокон ПВ древесины, запасы которой неисчерпаемы. Такие ПВ не оказали бы значительного влияния на вкус хлеба, столь привычный для потребителя, но при этом выполняли бы лечебно-профилактическую функцию: очищали желудочно-кишечный тракт от патогенной микрофлоры и токсических компонентов, таких, как тяжелые металлы.
Для решения этой задачи в МГУПП проводилось исследование влияния концентрата пищевых волокон целлюлозы (КПВЦ), полученного из нетрадиционного растительного сырья биотехнологическим способом, на свойства и качество хлебобулочных изделий.
КПВЦ был получен в результате химико-ферментативного гидролиза сосновых опилок (см. раздел 12.2) и имел следующий состав, %: целлюлоза – 87; гемицеллюлоза – 11; лигнин – 2.
Введение новых ингредиентов в рецептуры пищевых продуктов возможно только после установления соответствия их функциональных свойств технологическим требованиям. Поэтому проводился сравнительный анализ функциональных свойств КПВЦ, пшеничной муки и отрубей. Результаты представлены в таблице 12.3.
Таблица 12.3. Сравнительная характеристика функциональных свойств КПВЦ, отрубей и пшеничной муки

КПВЦ обладал высокой водо- и жиросвязывающей способностями и небольшой растворимостью, что определило возможность его введения в рецептуру хлеба, поскольку повышенная способность ПВ удерживать воду удлиняет сроки хранения и улучшает структуру пищевой продукции.
Ярко выраженная способность препарата к сорбции патогенной и условно-патогенной микрофлоры может придать хлебу лечебно-профилактические свойства.
КПВЦ обладает также сорбционной способностью по отношению к ионам тяжелых металлов. Сорбируемость железа этим препаратом составляет 79,1 %, меди – 37,6, кобальта – 29,1 и свинца - 8,4 %.
Полученный КПВЦ был включен в рецептуры приготовления хлеба из пшеничной муки высшего сорта (в/с) (в качестве заменителя 5 и 10 % муки) и хлеба с отрубями (в качестве заменителя 5 и 10 % отрубей).
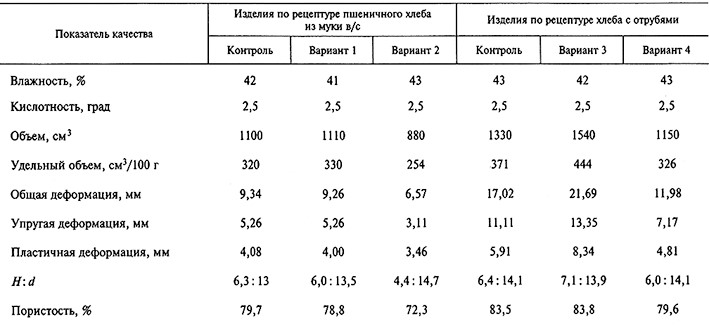
В таблицах 12.4 и 12.5 представлены органолептические и физико-химические показатели качества хлеба, выпеченного с добавлением КПВЦ.
Варианты:
1 – пшеничный хлеб, в рецептуру которого добавили КПВЦ в количестве 5 % общей массы изделия;
2 – то же, но 10 %;
3 – хлеб с отрубями, в рецептуру которого добавлен КПВЦ в количестве 5 % общей массы изделия вместо отрубей;
4 – то же, но 10 %.
Контролем служил хлеб, изготовленный по традиционным рецептурам пшеничного и хлеба с отрубями.
Внесение КПВЦ в количестве 5 % в рецептуры пшеничного и хлеба с отрубями не снижает качества изделий (по физико-химическим и органолептическим показателям). Введение такого же количества КПВЦ в рецептуру хлеба с отрубями даже способствует формированию необходимой консистенции и улучшает его качественные показатели. Так, объем хлеба с отрубями с добавкой 5 % КПВЦ увеличился на 15,8 %, возросли общая, упругая и пластичная деформации на 27,4, 20,2 и 41,1 % соответственно. При этом влажность, кислотность и пористость изделия практически не изменились.
Хлеб, выпеченный с добавлением 10 % КПВЦ, может быть использован в лечебно-профилактических целях, но его физико-химические и органолептические показатели уступают контролю. Однако его сорбционная способность выше по сравнению с контролем на 58 – 64 %.
Энергетическая ценность хлеба из пшеничной муки в/с составляет 80,2 кДж, тогда как аналогичный показатель хлеба, в рецептуре которого 5 % муки заменено на КПВЦ, – 76,2 кДж, с заменой 10 % – 72 кДж, что на 5,1 и 10,2 % соответственно ниже энергетической ценности пшеничного хлеба.
Таким образом, результаты проведенных опытных выпечек показали, что введение КПВЦ в рецептуры хлеба в количестве 5 % способствует снижению его энергетической ценности и придает ему лечебно-профилактические свойства за счет высокой сорбционной способности по отношению к условно-патогенной, патогенной микрофлоре и тяжелым металлам без потери его качества.
Таблица 12.4. Органолептические показатели качества хлеба с добавлением КПВЦ
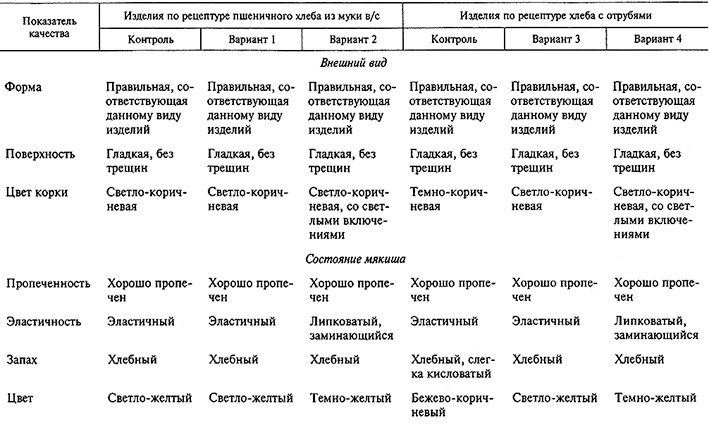
Таблица 12.5. Физико-химические показатели качества хлеба с добавлением КПВЦ