Антиокислители пищевых продуктов (АПП) – это природные или синтетические вещества, задерживающие процесс окисления жиров и жиросодержащих продуктов.
Использование антиокислителей позволяет продлить срок хранения пищевого сырья, полупродуктов и готовых продуктов, защищая их от порчи, вызванной окислением кислородом воздуха. Накопление продуктов окисления в маслах и жирах, в жировой фракции пищевых продуктов вызывает изменение их свойств, снижает пищевую ценность, приводит к порче и, как следствие, оказывает вредное влияние на организм человека.
16.1. КЛАССИФИКАЦИЯ И МЕХАНИЗМ ДЕЙСТВИЯ АНТИОКИСЛИТЕЛЕЙ
По происхождению антиокислители пищевых продуктов классифицируют на природные, синтетические и микробиологического происхождения (рис. 16.1).
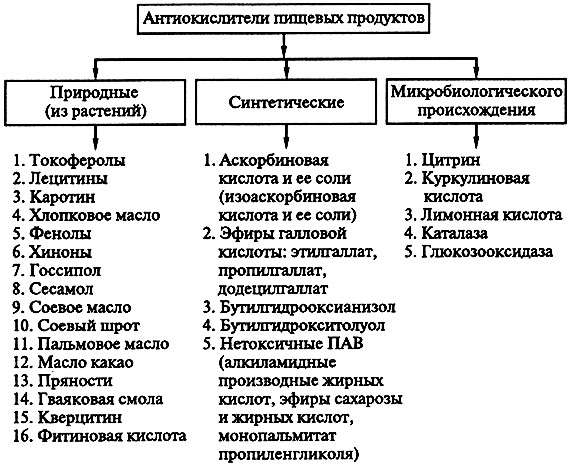
Рис. 16.1. Вещества, предотвращающие или замедляющие окисление молекулярным кислородом
По природе действия АПП разделяются на первичные антиокислители и синергисты – антиокислители и комплексообразователи. Первичные АПП являются ингибиторами цепного процесса автоокисления глицеридов.
Действие большинства антиоксидантов основано на их способности образовывать малоактивные радикалы, прерывая тем самым реакцию окисления. Антиокислители задерживают процесс окисления жиров в течение определенного времени. Эффективность действия антиокислителей определяется длиной индукционного периода. Эффективные антиокислители вводятся в количествах 0,01–0,009 % массы жира.
Из синтетических АПП для повышения стойкости животных жиров чаще всего используют сложные эфиры галловой кислоты (галлаты): этил-, пропил- и додецилгаллаты. Очень эффективные АПП – бутилгидрооксианизол, mpem и-бутилгидрохинон, галловая кислота и ее сложные эфиры; эти АПП добавляют в количестве до 0,02 % к пищевым маслам и жирам для предотвращения прогоркания последних в результате окисления.
С целью торможения окисления жиров используют нетоксичные ПАВ. К ним относятся ряд алкиламидных производных некоторых жирных кислот, а также некоторые эфиры сахарозы и жирных кислот и монопальмитат пропиленгликоля.
Из встречающихся в природе АПП наибольшее значение имеют токоферолы, которыми богаты рыбий жир, сахарная свекла, масло пшеничных зародышей, коровье масло. Токоферолы проявляют антиокислительное действие в концентрации 0,003–0,02 % массы жира. Стойкость свиного топленого жира к окислению увеличивается в 160 раз при добавлении 0,02 % токоферолов и 0,1 % аскорбиновой кислоты, которая является синергистом.
Синергисты – это вещества, усиливающие активность антиокислителей, но не обладающие антиокислительными свойствами, инактивирующие ионы тяжелых металлов с образованием комплексных соединений. Аскорбиновую кислоту и ее калиевую соль применяют для предотвращения окислительной порчи жировых продуктов: маргарина, топленых жиров. Она является в первую очередь синергистом, восстанавливающим фенольные соединения и связывающим ионы металлов.
В растительных маслах кроме токоферолов находится еще одна группа антиокислителей – госсипол и сесамол. Госсипол содержится в семенах хлопчатника, а сесамол – в семенах кунжута.
К эффективным натуральным антиокислителям жиров относятся лецитины и каротин, входящие в состав многих растительных жиров и некоторых ягод и овощей, их вводят в рафинированные хлопковое, соевое, пальмовое масла, масло какао в количестве 1–5 %.
Большой интерес представляют природные антиоксиданты – экстракты вкусоароматических добавок из пряноароматических растений, обладающих высоким антиокислительным действием, кроме того, они являются и полезными физиологическими добавками: перец (душистый, черный, красный), лавровый лист, гвоздика, корица, имбирь, укроп, петрушка, сельдерей, розмарин.
Все чайные экстракты из промышленных образцов зеленого, черного и чая в пакетиках обладают высокой антиокислительной активностью, особенно образцы черного китайского чая, которые способны на 73,6 % ингибировать перекисное окисление линолевой кислоты.
Природные антиоксиданты обладают рядом преимуществ, не уступая синтетическим по своей химической активности. В целом они менее токсичны, более функциональны и стабильны, характеризуются четкой направленностью действия.
В настоящее время идет поиск новых эффективных антиокислителей путем создания комбинированных антиокислительных препаратов и увеличения производства природных экологически чистых биоантиоксидантов.
Общее свойство биоантиоксидантов – их способность взаимодействовать с органическими гидропероксидами и модулировать действием ферментативных комплексов, задействованных в процессах окисления. Кроме того, они являются акцепторами синглетного кислорода, проявляющего повреждающие действия биологических объектов.
Нормальные метаболические процессы, протекающие в организме человека, как правило, включают перекисное окисление. Очевидно, этот путь окислительных реакций в природе наиболее предпочтителен, несмотря на возможность получения свободных радикальных форм при распаде перекисных соединений, нередко вызывающих патологические изменения в организме.
Относительная безопасность перекисного окисления обеспечивается наличием ферментативных и неферментативных механизмов, предупреждающих и устраняющих последствия окислительных повреждений. Основными участниками антиокислительных актов являются биоантиоксиданты, присутствующие в клетках в малых концентрациях и ингибирующие окислительные процессы.
Так как источником биоантиоксидантов для человека служат в основном продукты питания, определение антиоксидантной активности для контроля качества продуктов питания позволит иметь наиболее полное представление об их биологической ценности для организма человека.
Микроорганизмы также способны к биосинтезу антиоксидантов. Так, мицелиальные грибы – представители родов Aspergillus и Penicillium образуют антиоксиданты (цитрин, куркулиновую кислоту и др.), являющиеся антимикробными агентами, вызывающими изменение в составе мембранных липидов. Показано, что суммарные фракции антиоксидантов из этих грибов препятствуют окислению полиненасыщенных жирных кислот в мембранах. Суммарные фракции антиоксидантов увеличивают также степень ненасыщенности липидов, причем этот эффект особенно значительно проявляется при понижении температуры культивирования.
Стабилизацию пищевых продуктов осуществляют также введением в их состав антиоксиданта в виде препаратов, полученных путем последовательного экстрагирования биомасс микромицетов рода Mortierella видов М. pulchella, М. nigresceus, М. pusilla неполярным экстрагентом, например инертным газом, диоксидом углерода, азотом и другими неполярными экстрагентами в надкритическом состоянии, затем последовательно водой, щелочью, водой, кислотой, водой, щелочью и водой с последующим объединением первого экстракта с твердым остатком в количестве не менее 0,1 % по массе. Препараты позволяют увеличить срок хранения и улучшить органолептические свойства продукции.
Препараты, содержащие глюкозооксидазу и каталазу, чаще используют в виноделии, пивоварении, консервной, соковой и безалкогольной промышленности для удаления кислорода, что способствует повышению стойкости продуктов к длительному хранению и сохранению их цветности. Эти ферменты применяют совместно, так как их каталитические активности взаимосвязаны. Субстратом для глюкозооксидазы является глюкоза, а для действия каталазы – пероксид водорода. Реакция идет по схеме, представленной на рисунке 16.2.

Рис. 16.2. Совместное действие глюкозооксидазы и каталазы
Введение ферментов в напитки в момент их укупорки позволяет полностью удалить из продукта и воздушного объема кислород, что значительно замедляет процессы окисления различных соединений и исключает развитие микроорганизмов. Эти ферменты можно наносить в виде тончайшего покрытия на пергамент совместно с необходимым количеством глюкозы и буферных солей. Герметичная упаковка в такой момент, например сливочного масла, позволяет предотвратить его прогоркание и потери при хранении. Влага, выделяемая из масла, растворяет ферменты, буферные соли и глюкозу, а кислород, находящийся в воздушном пространстве между маслом и пергаментом, расходуется на окисление глюкозы и полностью потребляется. В такой атмосфере масло может храниться без образования прогорклого слоя длительное время. С применением определенных приемов с помощью глюкозооксидазы и каталазы в бескислородной среде можно хранить сыр, сырое мясо, жидкие концентраты, муку, крупы, майонез, молоко и т.д.
Источниками этих ферментов являются микроскопические грибы, относящиеся преимущественно к роду Penicillium и значительно реже к роду Aspergillus. Среди пеницилловых грибов наибольшей способностью к внеклеточному синтезу этих ферментов обладают виды: P. chrysogenum, P. casei, P. nigricans, P. notatum, P. adametzi, P. lividum, P. cyaneojfulvum, P. herguei и особенно P. vitale. Культура A. niger продуцирует эти ферменты внутриклеточно, как и целый ряд других микроорганизмов. Глкжозооксидазу производят также из корневой части хрена и некоторых других растений.
Препараты глюкозооксидазы и каталазы можно получать раздельно и совместно.
Технологический процесс раздельного получения этих ферментов основан на выращивании продуцента на среде, обеспечивающей максимальное накопление в культуральной жидкости одного из них, что достигается определенным соотношением источников углерода и азота. При совместном получении глюкозооксидазы и катал азы в среде должно содержаться 6–10 % сахара и 1,5 % KNO3. Последовательность получения этих ферментов следующая. По окончании культивирования культуральная жидкость имеет каталазную активность 40–42 ед. на 1 мг белка. Далее культуральную жидкость с рН около 3,5–4 после отделения мицелия подвергают обработке оксидом алюминия в статических условиях при интенсивном перемешивании. При этом значении рН из культуральной жидкости сорбируется до 95 % каталазы от содержания ее в культуральной жидкости, а глюкозооксидаза остается в ней, т.е. на этой стадии осуществляется разделение каталазы и глюкозооксидазы.
Оксид алюминия с сорбированной на нем каталазой отделяют, а освобожденную от каталазы культуральную жидкость подвергают дальнейшей обработке оксидом алюминия для сорбции глюкозооксидазы. Каталазу, сорбированную на оксиде алюминия, обрабатывают 0,1 М фосфатным буфером с рН 6,8 при перемешивании, что обеспечивает элюцию до 95 % каталазы. Объем элюента берут в 6 раз меньше объема культуральной жидкости, подвергавшейся первоначальной обработке. Это позволяет сконцентрировать раствор фермента в 6–7 раз.
При осаждении каталазы из элюатов различными растворителями наилучшие результаты получают при использовании изопропилового спирта. Осаждение каталазы в отличие от глюкозооксидазы проводят при температуре 18...24°С и соотношении осадителя и элюата 1:1. Получаемый осадок, легко отделяемый центрифугированием, высушивают при температуре 30...35 °С в вакууме. В готовом препарате каталазы содержится 80–85 % активного фермента от исходного количества в культуральной жидкости.
Из надосадочной жидкости после отделения вместе с оксидом алюминия каталазы можно извлечь глюкозооксидазу. Надосадочную жидкость концентрируют, ее рН доводят до 6,7–7. Затем ее обрабатывают около 1 ч оксидом алюминия при периодическом перемешивании. На оксид алюминия глюкозооксидаза сорбируется избирательно почти полностью. Сорбент вместе с глюкозооксидазой отделяют и направляют в реактор для поэтапной элюции. Элюция проводится аммонийфосфатным буфером из расчета 0,45–0,50 дм3 на 1 кг оксида алюминия. В процессе сорбции и элюции в связи с уменьшением объема обрабатываемой жидкости происходит концентрирование глюкозооксидазы в ферментном растворе в 10–20 раз. Из полученного элюата этанолом в соотношении 2:1 осаждают глюкозооксидазу, а затем осадок вновь растворяют в ледяной дистиллированной воде, центрифугированием отделяют нерастворимый балласт и из надосадочной жидкости фермент вновь осаждают ацетоном (2:1). Осадок растворяют в минимальном количестве воды и высушивают методом сублимации. Такие препараты обладают высокой активностью, выход активного фермента в препарат составляет 80–90 % исходной величины. Из очищенного препарата получают кристаллы глюкозооксидазы.

