- 4.2.1. Бродильное производство растворителей
О бродильном производстве глицерола шла речь в гл. 1, а о получении этанола — растворителя, пищевого продукта, промежуточного вещества в реакциях химического синтеза и горючего — в гл. 2. К числу других важных бродильных производств относится получение ацетона и бутанола. Впервые в промышленном масштабе они были осуществлены в Манчестере Вейсманном в ходе первой мировой войны. Ацетон был необходим для производства кордита и как метательное взрывчатое вещество в тяжелой артиллерии. До начала военных действий его импортировали из Германии. Ацетон низкого качества получали путем сухой перегонки древесины, но для упомянутых целей нужен был высококачественный растворитель.
Таблица 4.1. Биотехнология и химическая промышленность

Бродильный процесс (ферментация) был основан на переработке крахмала, концентрация которого составляла до 3,8% (вес/объем), анаэробными спорообразующими бактериями Clostridium acetobutyIicum. Превращению подвергалось до 30% субстрата, в результате чего получалась смесь растворителей (60% бутанола, 30% ацетона, 5—10% этанола, изопропанола и мезитилоксида). Остальная часть субстрата в ходе процесса, представленного на рис. 4.1, превращалась в водород и углекислый газ.
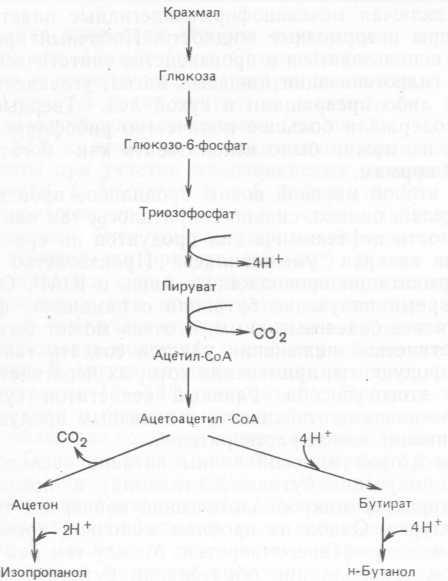
Рис. 4.1. Схема реакций ацетон-бутанольного брожения.
Поскольку образовывались большие объемы газов, при крупномасштабном производстве перемешивания не требовалось, а главная сложность заключалась в гашении пены. В зависимости от штаммов отношение ацетон: спирт несколько варьировало. Многие микробы, разрушающие крахмал и способные образовывать растворители, могут также сбраживать мелассу при содержании сахара в среде до 6% (вес/объем). Фактором, определяющим количество использованного субстрата, оказалась чувствительность организмов, участвующих в процессе, к н-бутанолу (верхний предел — около 1,2%, по объему) и ацетону (0,4%). Заражения бродильных емкостей аэробными бактериями обычно не происходило, и главной проблемой была инфекция бактериофагами. Впоследствии выяснилось, что участвующие в процессе микроорганизмы можно «иммунизировать» путем нескольких пересевов в присутствии бактериофага. Было установлено, что фаговая инфекция является штамм-специфичной.
Растворители отделяли от среды отгонкой. В конце первой мировой войны главную роль стало играть производство бутанола: он нашел применение при получении широкого круга веществ, включая мочевиноформ альдегидные пластмассы, пластификаторы и тормозные жидкости. Побочный продукт, водород, стал использоваться в производстве синтетического метанола и для гидрогенизации пищевых масел; углекислый газ либо сжижали, либо превращали в сухой лед. Твердые вещества отходов содержали большое количество рибофлавина (витамина B2), и их можно было использовать как богатую белком добавку к кормам.
После второй мировой войны бродильное производство этих растворителей, однако, сильно сократилось, так как относительная стоимость нефтехимических продуктов по сравнению с полимерами сахаров уменьшилась. Производство н-бутанола путем ферментации продолжалось лишь в ЮАР. Однако в настоящее время получение бутанола с помощью ферментации становится все более выгодным, и очень может быть, что методами генетической инженерии удастся создать такие микроорганизмы-продуценты, применение которых перетянет чашу весов в сторону этого способа. Главный недостаток существующих штаммов — низкая устойчивость к конечным продуктам и относительно низкий выход растворителей.
В ходе второй мировой войны активно исследовалась возможность получения бутилен-2,3-гликоля; в последнее время к этому процессу микробиологической конверсии также проявляется интерес. Одной из проблем молочной промышленности является использование сыворотки. Между тем она может быть источником углерода при образовании бутиленгликоля бактериями Klebsiella pneumoniae или Enterobacter aerogenes, который превращают затем в сырье для производства синтетического каучука.
- 4.2.2. Производство органических кислот
Среди органических кислот самая важная — уксусная. На рынок США ее ежегодно поступает около 1,4 млн. т общей стоимостью до 500 млн. долл, (без учета уксуса). В прошлом основную часть уксусной кислоты получали путем микробиологического окисления этанола, но сегодня, за исключением производства уксуса, этот процесс по экономическим соображениям не применяется. Впрочем, в результате ведущихся исследований термофильных бактерий, способных превращать целлюлозу в уксусную кислоту, а также штаммов Acetobacter и Clostridium, способных синтезировать ее из водорода и углекислого газа, этот метод, может быть, восстановит свои позиции. Техническая уксусная кислота используется при выработке многих химических веществ, включая каучук, пластмассы, волокна и инсектициды. При обычном способе производства микробиологическая конверсия этанола в уксусную кислоту при участии штаммов Acetobacter и Gluconobacter идет в аэробних условиях и поэтому, строго говоря, не является процессом брожения. Уксус по праву считается важнейшим продуктом микробиологической промышленности (см. гл. 3).
В конце XIX в. началось промышленное производство молочной кислоты при участии молочнокислых бактерий Lactobacillus delbrueckii, L. Ieichmannii и L. bulgaricus. Это был один из первых процессов, где применялась частичная стерилизация среды нагреванием. Этот микроаэрофильный процесс осуществляется при высокой температуре (45—50°). В нем используют содержащее крахмал сырье, которое предварительно обрабатывают ферментами или подвергают кислотному гидролизу (разд. 4.2.6). L. bulgaricus активно сбраживает лактозу и может поэтому использовать молочную сыворотку в качестве питательного субстрата. В других случаях конверсии подвергается сахароза (концентрация 12—18%, вес/объем). Процесс идет 3— 4 суток; при этом в больших количествах выделяется углекислый газ, что облегчает создание в среде оптимальных полуаэроб- ных условий. Описаны также способы конверсии 1,2-пропандиола в молочную кислоту при помощи Arthrobacter oxydans, Alca- Ugenes faecalis или Fusarium solani. Эти микроорганизмы в основном образуют L ( + )-изомер молочной кислоты, но некоторые штаммы L. Ieichmanii синтезируют D(—)-изомер. Было изучено образование молочной кислоты при непрерывном культивировании. В одностадийном процессе выход в случае L. delbrueckii составлял 89 г/л в сутки. При использовании препаратов молочнокислых бактерий, иммобилизованных в альгинатных гелях, степень конверсии достигала 97%. Доля L ( + )-изомера составляла 90%, а время полужизни—100 суток. В этих процессах молочную кислоту получают в форме кальциевой соли; чтобы выделить конечный продукт, ее обрабатывают серной кислотой. Молочную кислоту используют в качестве добавки к безалкогольным напиткам, эссенциям, фруктовым сокам, джемам и сиропам, для декальцификации кож в дубильной промышленности, а также при производстве пластмасс, когда Ь( + )-форму полимеризуют в полилактат, применяемый для производства пластиковых оберток. Соли молочной кислоты используются в медицине.
Производство лимонной кислоты методом ферментации при участии грибов (рис. 4.2) также принадлежит к числу давних биотехнологических процессов; оно было налажено в 1893 г.
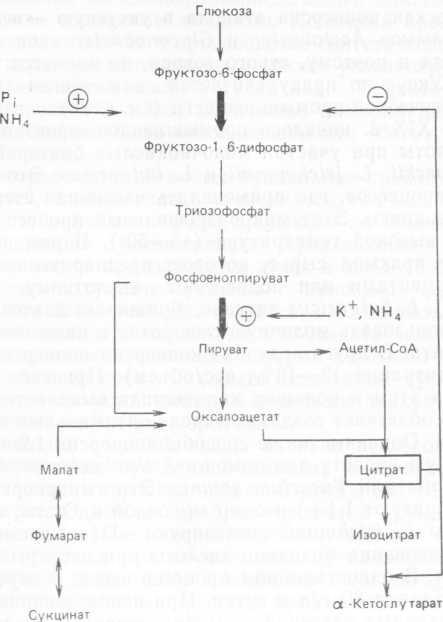
Рис. 4.2. Производство лимонной кислоты.
Его развитие шло в тесной связи с разработкой многих фундаментальных аспектов микробиологии. Вначале основные проблемы были связаны с микробным загрязнением. В поисках их решения было найдено, что процесс можно вести при очень низких pH, и это почти не сказывается на образовании кислоты грибами. В таких условиях создавать и поддерживать стерильность гораздо проще. За 1—2 недели ферментации при высоких концентрациях сахара в сырье выход достигал 60%. Наибольший выход получали, когда тем или иным способом ограничивали рост мицелия. Первоначальный вариант процесса основывался на поверхностной ферментации, но в 1950 г. было внесено важное изменение — освоено глубинное культивирование. Было показано, что стабильный процесс глубинной ферментации возможен только в том случае, если он осуществляется в две стадии: на первой идет рост мицелия, а на второй (в несодержащей фосфор среде)—образование лимонной кислоты. За короткий срок были разработаны схемы, основанные на использовании дешевого углеводного сырья: мелассы, крахмала и глюкозного сиропа. Наличие ионов металлов в исходном сырье приводит к резкому падению выхода; их нужно удалять либо путем осаждения гексацианоферратом, либо пропусканием через ионообменные смолы, либо применением солей четвертичного аммония. Для устранения вредного влияния этих примесей широко используется также метанол и другие низшие спирты. Механизм их действия неизвестен. Возможно, они как-то влияют на цитоплазматическую мембрану. В 60-х годах для производства лимонной кислоты был предложен новый процесс на основе н-парафинов (Сэ—зо) и штаммов Corynebacterium, Arthro- bacter и Brevibacterium, но рыночной продукции с его помощью получено не было. Изучалось также образование лимонной кислоты дрожжами Candida. Они синтезируют смесь лимонной и изолимонной кислот в соотношении, зависящем как от генетических факторов, так и от условий ферментации. Было найдено, что ключевую роль здесь играет аконитат-гидролаза: мутанты с малой активностью этого фермента продуцировали больше лимонной кислоты. Растущие на углеводородах дрожжи также способны синтезировать лимонную кислоту из глюкозы. Гриб Trichoderma viride образует большое количество цитрата из глюкозы; это позволяет вырабатывать лимонную кислоту из целлюлозы. C помощью некоторых видов Penicillium можно вести ферментацию с образованием Бэ-алло-изолимонной кислоты, диастереомера изолимонной кислоты.
В промышленном производстве лимонной кислоты в основном используется Aspergillus niger, но применяется также и A. wentii. Процесс ферментации очень сложен, так как лимонная кислота является продуктом первичного метаболизма этих грибов, и любое сколько-нибудь существенное выделение этого промежуточного соединения обмена веществ в окружающую среду свидетельствует о сильном нарушении метаболизма, возникающем вследствие его дисбаланса или генетических нарушений. Рост грибов обычно регулируют путем изменения состава среды (P, Mn, Fe, Zn). Субстрат должен легко усваиваться; негидролизованные полимеры обычно не используют, так как в этом случае внеклеточный гидролиз будет лимитировать скорость всего процесса.
Сверхпродукция лимонной кислоты является ответной реакцией на недостаток фосфата, но при выраженной нехватке металлов лимитирующим фактором не обязательно является фосфат. Роль металлов при этом до конца еще не понята. Оптимум pH составляет 1,7—2,0; в более щелочной среде происходит образование заметных количеств щавелевой и глюконовой кислот. Таким образом, тщательный контроль за культуральной средой позволяет обойти регуляторные системы обмена и создает оптимальный фон для образования лимонной кислоты. Видимо, в этих условиях стимулируется гликолиз и обеспечивается неограниченное поступление углерода в реакции промежуточного метаболизма. Уровень накопления цитрата зависит при этом от поступления оксалоацетата.
При недостатке марганца активность ферментов цикла трикарбоновых кислот уменьшается, что в свою очередь подавляет анаболизм. Такое нарушение обмена приводит к повышению концентрации аммонийных ионов внутри клеток, и они могут смягчать ингибирующее влияние цитрата на фосфофруктокиназу. Кроме того, марганец, видимо, как-то влияет на биохимические свойства поверхности клеток и морфологию гиф. Поскольку в процессе потребляется много кислорода, возможно повторное окисление цитоплазматического NADH без образования ATP. В нем участвует альтернативная, а не основная цепь дыхательных реакций. В результате без сколько-нибудь выраженного изменения обмена возникает метаболическая «утечка» (flux) через гликолиз. Эта утечка, происходящая при участии конститутивной пируваткарбоксилазы и некоторых ферментов цикла трикарбоновых кислот, а также необычная кинетика действия ферментов, участвующих в метаболизме оксалоацетата, приводят к увеличению внутриклеточной концентрации цитрата. Последний способствует дальнейшему накоплению цитрата путем ингибирования изоцитратдегидрогеназы.
В промышленном производстве лимонной кислоты применяется несколько вариантов процесса. Традиционным твердофазным вариантом является процесс Коджи; он имеет много общего с процессом поверхностной ферментации. Глубинная ферментация с технической точки зрения сложнее, чем поверхностная, но возможна в разных вариантах: периодическом с подпиткой и непрерывном. Периодическая ферментация используется при работе с глюкозосодержащими субстратами, а ее вариант с подпиткой чаще применяется при переработке мелассы. Непрерывное культивирование, дающее наибольший выход продукта, также возможно, но применение этого способа в промышленности в обозримом будущем маловероятно. Для процесса характерно два максимума скорости: роста и образования продукта. На первом этапе образуется значительное количество продукта, зависящее от скорости роста. На втором этапе рост отсутствует, а предельное количество образующегося продукта определяется концентрацией биомассы. В конце ферментации массу мицелия отделяют фильтрованием и промывают. Затем при pH<3,∙0 осаждают щавелевую кислоту в форме оксалата кальция. Богатый белком мицелий можно использовать на корм скоту. Лимонную кислоту осаждают из жидкой фазы в форме кальциевой трехзамещенной соли в комплексе с четырьмя молекулами воды. Осадок отфильтровывают, промывают и свободную кислоту получают путем обработки сульфатом кальция. Далее ее очищают при помощи активированного угля и ионообменных смол. Можно также экстрагировать кислоту растворителем.
У лимонной кислоты приятный кислый вкус, она хорошо растворима в воде. Ее широко используют в пищевой, фармацевтической и косметической промышленности. Эфиры лимонной кислоты применяются в производстве пластмасс. Поскольку лимонная кислота связывает (хелатирует) металлы, ее используют для их очистки. В составе детергентов она легко разрушается живыми организмами, и ею заменяют фосфаты.
- 4.2.3. Другие органические кислоты
Процессы, основанные на микробиологической ферментации, разработаны и для получения ряда других органических кислот. Среди них — глюконовая кислота и ее производные, яблочная, виннокаменная, салициловая, янтарная, пировиноградная и кое- вая кислоты. Хотя некоторые из них и поступают на рынок, в нынешних условиях в большинстве случаев такое производство экономически невыгодно.
D-глюконовая кислота и ее б-лактон представляют собой простые продукты окисления (дегидрогенизации) глюкозы (рис. 4.3). Еще в начале 20-х годов было налажено промышленное производство этой кислоты из глюкозы при участии Aspergillus niger. Нейтрализация кислоты позволяла получать большой выход продукта. В погруженных культурах за 48 ч конверсия субстрата составляла 90%. Исследования на полупромышленных установках показали, что если ферментацию вести при повышенном давлении, то выход кислоты за 24 ч составляет 95% от теоретического при использовании раствора глюкозы с концентрацией 150—200 г/л. Процесс можно вести в полунепрерывном режиме, заново используя мицелий (до девяти раз подряд). Более того, концентрацию глюкозы можно довести до 350 г/л, если для удаления кислоты использовать комплексообразование с соединениями бора и получать боро- глюконат кальция. Однако для осуществления этого процесса нужны особые, устойчивые штаммы. От него отказались после того, как было выяснено, что эта соль неблагоприятно влияет на кровеносные сосуды животных. Контроль за pH осуществляли путем добавления углекислого кальция либо едкого натра.
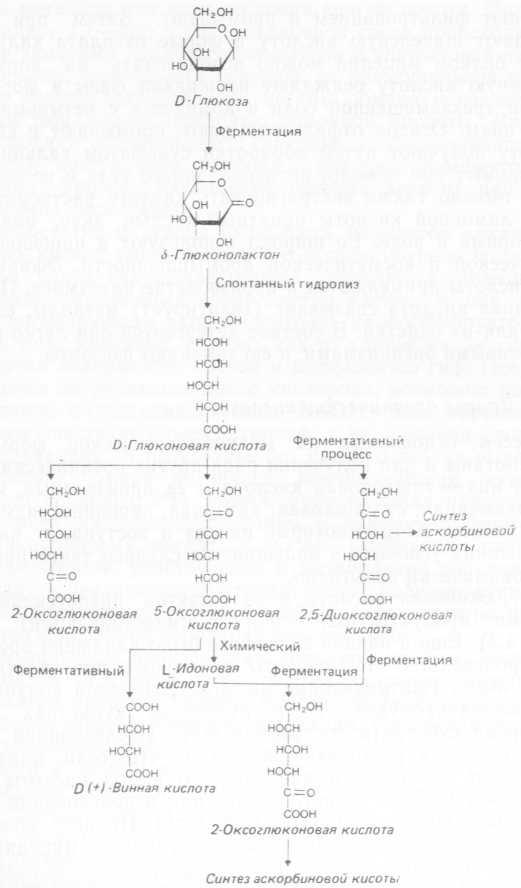
Рис. 4.3. Органические кислоты, получаемые из глюкозы.
Было найдено, что образование глюконата прямо связано с количеством глюкозооксидазы в среде. Этот фермент в промышленном масштабе получают методом ферментации.
Натриевая соль глюконовой кислоты используется для извлечения металлов. Когда pH процесса контролируют с помощью едкого натра, получают именно эту соль. Был разработан непрерывный процесс ее производства, при котором выход натриевой соли из 35%-ного (вес/объем) раствора глюкозы составляет 95%. Предпринимались попытки применить при брожении иммобилизованные системы (как целые клетки, так и глюкозооксидазу). Натриевая соль глюконовой кислоты в присутствии едкого натра играет роль ловушки кальция и поэтому используется в составе щелочных средств для мытья бутылок. Она также способна связывать ионы железа в широком диапазоне pH и как препятствующий отложению железа агент применяется в составе щелочных препаратов для борьбы со ржавчиной. Кальциевые и железные соли глюконсвой кислоты применяются как пероральные и внутривенные препараты в медицине, а чистая кислота — как моющее средство в молочной промышленности. Глюконолактон находит применение как медленно действующий подкислитель в составе пекарских порошков, при переработке мяса и в других отраслях пищевой промышленности.
Процесс образования глюконовой кислоты при участии бактерий нашел ограниченное применение лишь в некоторых странах Востока. Например, так называемый «чайный гриб» (ассоциация дрожжей, уксуснокислых и глюконовокислых бактерий) превращает подслащенный заваренный чай в напиток, содержащий смесь этих кислот. Малая эффективность реакций окисления глюкозы, идущих при участии бактерий, определяется тем, что одновременно с главным процессом идет образование 2-оксоглюконовой, 5-оксоглюконовой и диоксоглюконовой кислот. Для выработки этих кислот, которые могут служить субстратами для дальнейшей биологической или химической переработки, были разработаны специальные процессы. Так, 5-оксо- глюконовую кислоту можно гидрогенизировать в ходе химической реакции и получить L-идоновую кислоту, которая в свою очередь служит субстратом в ферментативной реакции синтеза 2-оксогулоновой кислоты (рис. 4.3). Такие превращения можно осуществить и чисто биологическим путем: при помощи видов Acetobacter глюкозу переводят в 2,5-диоксоглюконовую кислоту, которая превращается в 2-оксогулоновую кислоту при участии Corynebacterium или Brevibacterium в ходе двух- или одностадийного процесса на основе смешанных культур этих бактерий. Выход продукта, правда, невелик. 2-Оксогулоновая кислота — весьма ценный продукт, так как ее метиловый эфир в щелочных условиях легко превращается в аскорбиновую кислоту.
Виннокаменная кислота является обычным побочным продуктом виноделия. Однако ее можно получать и путем микробной трансформации 5-оксоглюконовой кислоты. Штаммы, способные превращать глюкозу в 5-оксоглюконат через глюконат, могут путем дальнейшей ферментации образовывать тартрат. Для этой цели обычно используют мутанты Acetobacter и Glu- Conobaeter. Виннокаменную кислоту можно вырабатывать также из транс- или цис-эпоксиянтарной кислоты. Соли ее (тартраты) находят широкое применение в пищевой промышленности, но методы биотехнологии в ее производстве обычно не используются.
Яблочную кислоту, которая применяется в качестве подкислителя в пищевой промышленности, можно получать из фумаровой либо путем ферментации при участии видов Paracolo- bactrum, либо с помощью иммобилизованной фумаразы. Описаны также способы ее получения из н-парафинов при помощи дрожжей и из этанола при участии Schizophyllum commune.
Итаконовую кислоту, идущую на производство пластмасс и красителей, получают с высоким выходом путем ферментации глюкозы с участием грибов из рода Aspergillus. Совсем недавно на основе биотехнологии из углеводных субстратов, а также С12-14-парафинов при участии Candida Iiydrocarbofurmarica получали 2-оксоглутаровую кислоту, но на смену этому способу пришло каталитическое окисление бензола.
Большинство органических кислот, вырабатываемых с помощью микробов, является продуктом переработки пищевого сырья; исключение составляют кислоты, производимые из н-парафинов. О возможности использования других видов углеводородного сырья как потенциального источника более ценных органических соединений говорится уже давно, но лишь немногие процессы используются сегодня для получения промышленной продукции. Так, из нафталина при помощи микробов вырабатывают салициловую кислоту и другие окисленные его производные. Об этом в последние двадцать лет писали не раз (Cain, 1980; Tangnu, Ghose, 1980, 1981).
К числу бактерий, способных вырабатывать салициловую кислоту (рис. 4.4) при росте в средах с нафталином, принадлежат многие виды Pseudomonas, Achromobacter и Corynebacte- rium. Запатентован способ выработки о-гидроксибензальпиро- виноградной кислоты и 1,2-дигидро-1,2-дигидроксинафталина при участии видов Nocardia. Большинство диких штаммов бактерий, расщепляющих нафталин, при хорошей аэрации в простых солевых средах редко образует салицилат в концентрации, превышающей 1%, но путем изменения сред и отбора подходящих штаммов могут быть получены и более высокие выходы.
Одним из основных факторов, влияющих на выход, является доступность субстрата, и накопление салицилата происходит лишь при постоянном присутствии нафталина: это угнетает дальнейшие окислительные превращения. Механизм деградации зависит от относительной концентрации нафталина и салициловой кислоты. Сложность заключается в том, что полиароматический нафталин плохо растворим в воде, в среде ферментации он обычно присутствует в виде тонкой взвеси.
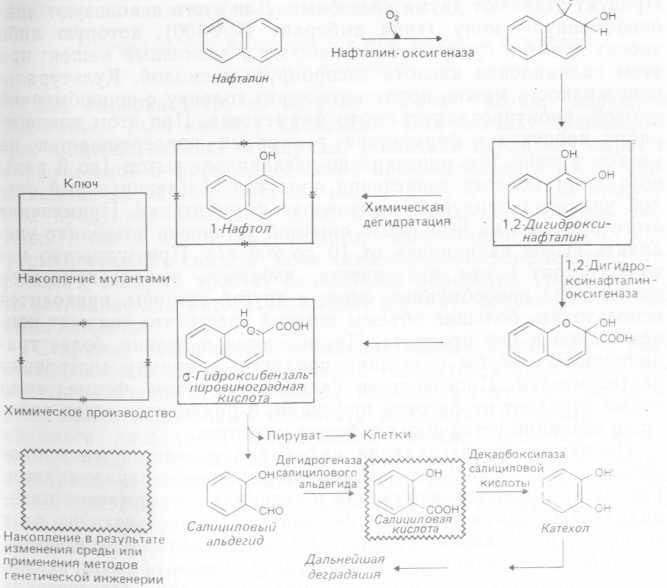
Рис. 4.4. Микробиологическая конверсия нафталина в полезные органические вещества.
Добавление эмульгаторов типа Span 80, Span 20, лецитина, кефалина и других поливиниловых спиртов существенно увеличивает накопления салицилата, так как при этом повышается доступность субстрата. Обычно используют чистый нафталин, но салицилат можно получать и из неочищенных нафтафракций. Примеси (алкилнафталины, тиофен, бензотиофен и крезолы) этому не мешают.
В ходе ферментации pH быстро падает, так что нужно использовать сильно забуференные среды с высокой концентрацией фосфата либо добавлять мочевину или углекислый кальций. Для максимального накопления салицилата необходимы ионы различных металлов. Сообщалось, что выход можно еще более повысить, если внести в среду особые добавки: органические и неорганические производные алюминия или бора, пантотеновую кислоту и ряд других веществ. Ферментация регулируется накапливающимся продуктом, а не субстратом; удаление салицилата из среды снимает его ингибирующее влияние на рост и приводит к дальнейшему образованию салициловой кислоты. Продукт отделяют двумя способами. Для этого используют анионообменную смолу (типа амберлит IRA-400), которую либо вносят прямо в среду, либо помещают в диализный мешок; при этом салициловая кислота адсорбируется смолой. Культуральную жидкость можно пропускать через колонку с ионообменной смолой, смонтированную около ферментера. При этом концентрация продукта в ферментере все время поддерживается на низком уровне, что многократно увеличивает выход (до 6 раз); возрастает полнота извлечения продукта. Альтернативный способ удаления продукта — диализная ферментация. Применение этого процесса на небольшой опытной установке позволило увеличить выход салицилата от 10 до 206 г/л. Преимущество метода состоит в том, что удается избежать неблагоприятного воздействия ионообменных смол; с другой стороны, приходится использовать большие объемы жидкой среды, что снижает концентрацию в ней продукта. Применяются и другие, более традиционные способы отделения продукта, например экстракция растворителем. Производство салицилата путем ферментации также страдает от фаговой инфекции, и приходится вести работу по селекции устойчивых к фагам мутантов.
Показано, что деградация нафталина и салицилата микроорганизмами нескольких родов детерминируется плазмидами. Так, за превращение нафталина в салицилат ответственна плазмида NAH: она несет гены ферментов, осуществляющих этот процесс (нафталиноксигеназы, 1,2-диоксинафталиноксигеназы, дегидрогеназы салицилового альдегида). Таким образом, у многих микроорганизмов, использующих нафталин, генетическая информация для осуществления этого процесса закодирована в плазмиде, но это бывает не всегда. В ходе использования таких плазмид создаются предпосылки для встраивания соответствующего генетического материала в хромосомы клеток хозяина, что превращает штаммы в продуценты салицилата. Способность использовать или окислять нафталин обычно закрепляется при росте на нафталине, салицилате или его аналогах, таких как бензоат или аминобензоат. Описаны интересные процессы сопутствующего окисления: мутантные штаммы Pseudomonas putida, выращенные на среде с глюкозой, которая служит единственным источником углерода и энергии, способны окислять нафталин до дигидрокси-1,2-дигидронафталина и 1,2-гидроксинафталина на основе индукции ферментов нафталином или другими соединениями-индукторами, происходящей после завершения роста. Первое из этих соединений после кислотной дегидратации превращается в а-нафтол — важное моноокисленное производное нафталина (рис. 4.4).
- 4.2.4. Аминокислоты (см. также гл. 3)
Производство аминокислот при помощи бактерий
и их мутантов
Все аминокислоты, из которых состоят белки, являются L-cc-амино- (или имино-) кислотами. Они находят применение как пищевые добавки, приправы, усилители вкуса, как сырье в парфюмерной и фармацевтической промышленности и при производстве других веществ. Их можно получать как из природных продуктов (главным образом при гидролизе белков растений), так и путем химического, микробиологического или ферментативного синтеза. Если химический синтез дает продуктрацемат, который требует дальнейшей обработки (разд. 4.2.6), то последние два метода позволяют получить оптические чистые аминокислоты.
Секретом большинства производственных процессов с участием микроорганизмов, о которых говорится в этой главе, является изменение условий среды: именно за счет этого достигается синтез избыточных количеств желаемого продукта. Необходимого дисбаланса метаболизма можно добиться путем эмпирического изменения таких факторов, как концентрация субстрата, pH, концентрация продукта, или же путем установления критических уровней содержания других веществ (ионов металлов, органических добавок) в среде. При переводе биологических процессов образования аминокислот на коммерческую основу были выработаны новые способы желаемых изменений метаболизма у организмов-продуцентов, направленных на увеличение выхода промежуточных продуктов, образование которых в иных условиях находится под строгим метаболическим контролем.
Для производства аминокислот бактерии стали использоваться с начала 50-х годов. Штаммы их постоянно улучшали генетическими методами, выделяя ауксотрофные мутанты и мутанты с измененными регуляторными свойствами. Чтобы обеспечить образование аминокислот в больших количествах, в любом случае необходимо изменить систему регуляции обмена. Для этого можно либо стимулировать потребление субстрата в некоторых путях биосинтеза и выделение аминокислот в среду, либо подавить побочные реакции и процессы деградации аминокислот.
Производство таких аминокислот, как L-глутамат, L-валин, DL-аланин, L-глутамин и L-пролин, при участии диких штаммов бактерий основано либо на использовании присущих этим бактериям особенностей метаболизма, либо на стимуляции образования аминокислот в ответ на изменение условий внешней среды. Образовывать аминокислоты способны бактерии многих родов (например, Corynebacterium, Brevibacterium, Bacillus, Aerobacter, Microbacterium, Escherichia), причем они настолько продуктивны, что производство становится рентабельным. Так, виды Corynebacterium или Brevibacterium, выращиваемые на углеводном сырье (гидролизат крахмала, мелассы из сахарного тростника и свеклы), на этаноле или ацетате при наличии достаточного количества биотина в среде способны синтезировать до 30 г/л глутамата. Для накопления этой аминокислоты важным условием является полное или частичное подавление активности а-кетоглутаратдегидрогеназы. Образование продукта увеличивается при добавлении ^-лактамных антибиотиков (пенициллина, цефалоспорина С), поверхностно-активных веществ и жирных кислот. Влияние двух последних агентов обусловлено увеличением проницаемости клеточных мембран для глутамата, которая зависит от внутриклеточной концентрации жирных кислот и липидов. Путем изменения условий среды процесс ферментации, в ходе которого образуется L-глутамат, может быть переключен на синтез L-глутамина или L-пролина. При высокой концентрации биотина и ионов аммония создаются благоприятные условия для образования L-пролина, а при больших концентрациях аммония и ионов цинка в слабо кислой среде усиливается синтез L-глутамина. DL-аланин, видимо, образуется в реакции трансаминирования при участии пирувата; затем он подвергается рацемизации ферментом аланинрацемазой.
Ауксотрофные мутанты не могут образовывать ингибиторы соответствующего метаболического пути, работающие по принципу отрицательной обратной связи, так как у них отсутствует определенная ключевая ферментативная реакция. Поэтому при выращивании мутантного штамма в среде с минимальной концентрацией необходимого питательного ингредиента они способны образовывать избыточные количества вещества-предшественника или близких к нему метаболитов блокированной реакции. Так, первые реакции в цепи биосинтеза L-аргинина (рис. 4.5) у Corynebacterium glutamicum ингибируются по механизму обратной связи самим конечным продуктом, и образование соответствующих ферментов подавляется L-аргинином.
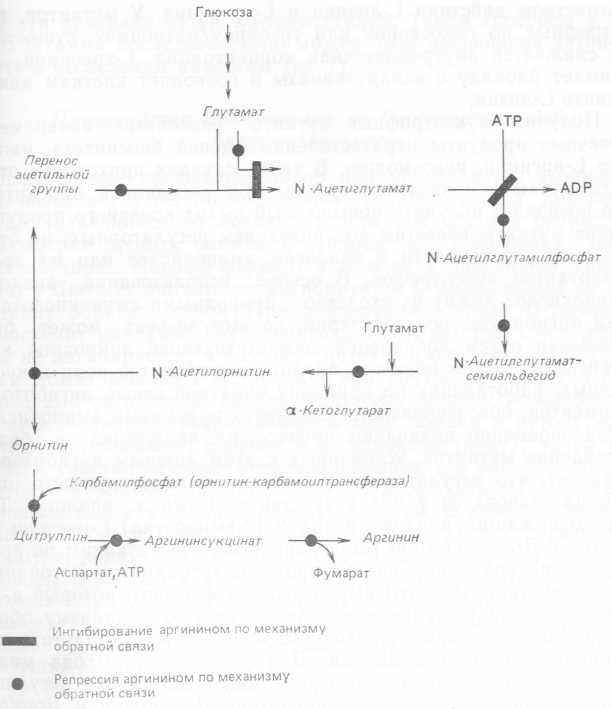
Рис. 4.5. Биосинтез L-аргинина.
У цитруллинового ауксотрофа этой бактерии отсутствует фермент, называемый орнитин-карбамоилтрансферазой, который катализирует превращение орнитина в цитруллин на одном из промежуточных этапов биосинтеза L-аргинина. Синтез аргинина не идет, что приводит к снятию ингибирования по принципу обратной связи со всех ферментов этого пути и накоплению избытка орнитина. Ауксотрофные мутанты находят применение и в тех случаях, когда необходимо синтезировать соединения, являющиеся конечными продуктами разветвленных цепей метаболических реакций. Так, L-acπapτaτ является общим предшественником для L-лизина, L-треонина, L-метионина и L-изолейцина. Первая реакция в процессе образования всех этих аминокислот катализируется аспартокиназой, активность которой может быть ингибирована по механизму обратней связи при совместном действии L-лизина и L-треонина. У мутантов, ауксотрофных по гомосерину или треонину/метионину, существенно снижается внутриклеточная концентрация L-треонина, что снимает блокаду с аспартокиназы и позволяет клеткам накапливать L-лизин.
Получить ауксотрофные мутанты, способные накапливать конечные продукты неразветвленных цепей биосинтеза, например L-аргинин, невозможно. В таких случаях приходится отбирать мутанты с частично нарушенной регуляцией биосинтеза, что позволяет получить повышенный выход конечного продукта. Такие мутанты известны под названием регуляторных; их отбирают по устойчивости к аналогам аминокислот или же среди ревертантов ауксотрофов. В основе использования аналогов аминокислот лежит их сходство с природными аминокислотами. Они ингибируют рост бактерий, но этот эффект может быть уменьшен путем добавления соответствующей природной аминокислоты. Таким образом, аналоги выступают в роли искусственных, работающих по принципу обратной связи, ингибиторов ферментов, обеспечивающих биосинтез природных аминокислот, и одновременно подавляют процесс их включения в белки. Появление мутантов, устойчивых к этим ложным ингибиторам, означает, что регуляторные ферменты соответствующего пути обмена становятся у них нечувствительными к аналогу. Так, серусодержащий аналог лизина 5-(2-аминоэтил)-Ь-цистеин является у Brevibacterium flavum ложным, действующим по принципу обратной связи ингибитором аспартокиназы. Устойчивые к его действию мутанты вырабатывают фермент, который в 150 раз менее чувствителен к ингибированию по механизму обратной связи, чем фермент исходного штамма, и в результате продуцируют до 33 г/л лизина. Для увеличения выхода можно воспользоваться как ауксотрофией, так и дефектами регуляции одновременно. Так, у Corynebacterium glutamicum и Brevibac- terium flavum сверхпродукции L-треонина не наблюдается, поскольку происходит сочетанное ингибирование по механизму обратной связи аспартокиназы и L-треонином, и L-лизином, а L-треонин ингибирует и гомосериндегидрогеназу. Мутант, устойчивый к аналогу треонина, а-аминоф-оксивалериановой кислоте, синтезирует в избыточном количестве треонин, так как ферменты его, ингибированные этой аминокислотой, десенсибилизированы. Принимающие участие в синтезе треонина гомосериндегидрогеназа и киназа также «выключаются» L-метиони- ном, и поэтому ауксотрофы по метионину образуют L-треонин с еще большим выходом.
Регуляторные мутанты можно получить путем трансдукции, проводя при этом отбор отдельных мутаций, вызывающих полное рассогласование регуляторных механизмов, а затем объединяя эти признаки путем котрансдукции. Таким способом у одного штамма последовательно может быть закреплена устойчивость к нескольким аналогам (гл. 7).
Производство аминокислот из биосинтетических
предшественников
Использование предшественников при производстве аминокислот позволяет успешно «обходить» метаболический контроль, осуществляющийся по механизму обратной связи и репрессии. Рассмотрим процесс синтеза L-лейцина из L-треонина через а-кетобутират. Первый фермент в этом пути биосинтеза, гидратаза, у Serratia marcescens ингибируется L-изолейцином по механизму обратной связи. При добавлении в среду D-треонина происходит индукция D-треонингидратазы, которая L-изолейцином не ингибируется, и поэтому синтез L-изолейцпна из D-треонина может миновать метаболический контроль. C другой стороны, для того чтобы обойти контроль, можно использовать предшественники, превращаемые в ходе обмена в кетобутират (например, а-амино-, а-бром- и а-гидроксибутират); точно так же при участии гидроксиметилтрансферазы и в присутствии достаточного количества метилентетрагидрофолата из предшественников глицина можно получать L-серин. В качестве поставщиков C-I могут выступать глицин, формальдегид, формиат, саркозин, холин или метионин. При наличии в среде глицина, глюкозы и метанола метиониновый ауксотроф Artrobacter glo- biformis образует до 5,2 г/л L-серина. Для такой конверсии, а также для образования L-глутамата, L-метионина и ароматических аминокислот могут использоваться и другие штаммы растущих на метаноле бактерий.
Синтез аминокислот с помощью ферментов
Об использовании чистых ферментов для нужд химии подробно будет говориться в разд. 4.2.6, а здесь мы остановимся на том, какова роль и ожидаемые преимущества применения ферментов при синтезе аминокислот. Эти процессы бывают одно- и многостадийными, а используемые в них методы весьма разнообразными от применения in situ интактных, но не растущих организмов до иммобилизованных препаратов. В этой связи целесообразно рассмотреть пять классов ферментов.
1. Гидролитические ферменты (или гидролазы), например Е-а-амино-е-капролактам-лиаза (синтез L-лизина) или 2-амино- тиазолин-4-карбоксилатгидролаза (синтез L-цистеина) (рис. 4.6).
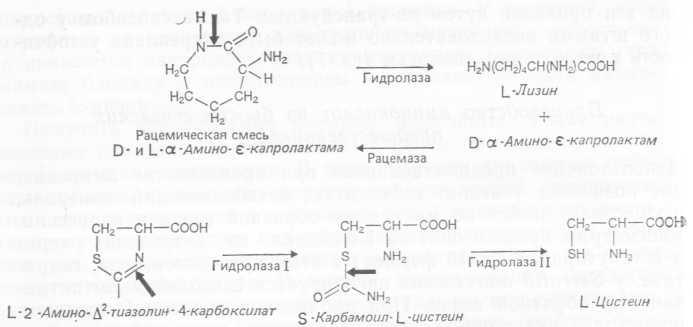
Рис. 4.6. Применение гидролитических ферментов при производстве аминокислот.
Чтобы можно было использовать неочищенные ферменты, целые клетки обрабатывают поверхностно-активными веществами, вызывающими изменение проницаемости. Кроме того, могут быть получены мутанты, у которых искомый продукт не вовлекается более в обмен веществ.
2. Лиазы. Эти ферменты часто используются в реакциях дезаминирования. Так, для образования L-acπapτa из фумарата аммония может использоваться (в обратной реакции) аспартаза, или L-acπapτaτ — аммиак-лиаза. В качестве доноров аммония могут, кроме того, выступать гидразин или гидроксиламин. Сходным образом L-фенилаланин — аммиак-лиаза может катализировать распад L-фенилаланина с образованием транс-коричной кислоты и аммиака. Хотя обычно равновесие в этих реакциях сдвинуто в сторону реакций распада, при высоких концентрациях аммонийных ионов начинают преобладать процессы синтеза.
3. Ферменты, содержащие пиридоксальфосфат. Это обычные коферменты, участвующие в метаболизме аминокислот. Они катализируют множество реакций: рацемизацию, трансаминирование, декарбоксилирование, реакции замещения и элиминации и являются своего рода универсальными. По-видимому, роль этих коферментов состоит в активации аминокислот, что облегчает их взаимодействие с апоферментом. Мы рассмотрим здесь лишь несколько ферментов из этой группы. Так, L-тирозин — фенол-лиаза ^-тирозиназа) катализирует реакцию р-элимина- ции, в которой тирозин распадается с образованием пирувата, фенола и аммиака. При оптимальных условиях Erwinia herbicola может синтезировать очень много этого фермента (до 10% растворимого белка). Его используют для синтеза тирозина: в иммобилизованной форме он применялся для непрерывного его производства. Субстратная специфичность этого фермента такова, что он может также осуществлять реакцию р-замещения между DL-серином и пирокатехолом, в результате которой образуется L-ДОФА (рис. 4.7).
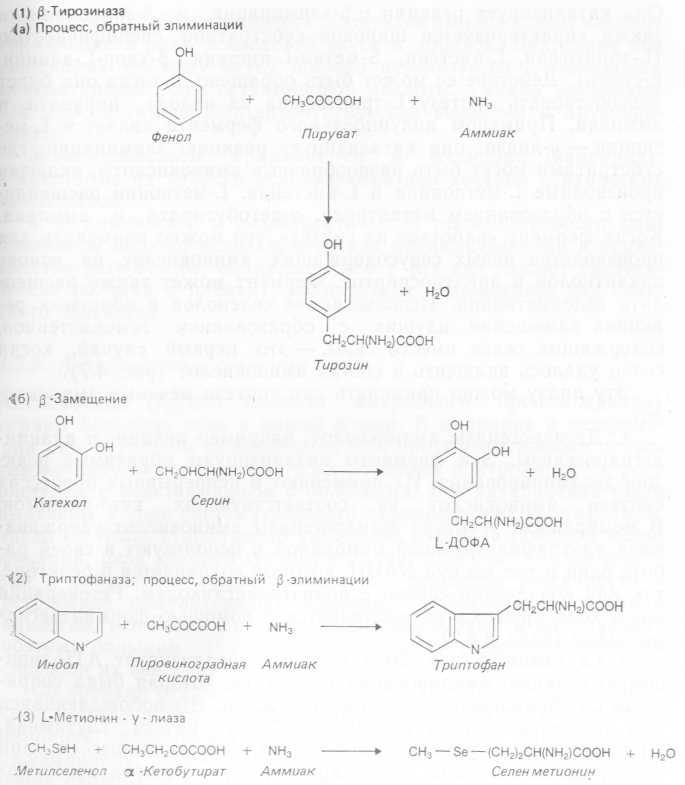
Рис. 4.7. Реакции синтеза, катализируемые пиридоксалевыми ферментами.
Примером широкого распространенного в природе фермента, осуществляющего дезаминирование, может служить L-триптофан — индол-лиаза (триптофаназа). Она катализирует реакции аф-элиминации и ^-замещения и. ∣ также характеризуется широкой субстратной специфичностью (L-триптофан, L-цистеин, Б-метил-Ь-цистеин, р-хлор-Ь-аланин,. L-серин). Действие ее может быть обращено, и тогда она будет способствовать синтезу L-триптофана из индола, пирувата и аммиака. Примером индуцибельного фермента является L-ме- тионин — у-лиаза: она катализирует реакцию элиминации, где субстратами могут быть разнообразные аминокислоты, включая производные L-метионина и L-цистеина. L-метионин расщепляется с образованием метантиола, а-кетобутирата и аммиака. Когда фермент «работает на синтез», его можно применять для производства новых серусодержащих аминокислот на основе алкантиолов и арилтиоспиртов. Фермент может также расщеплять селенметионин. Использование селенолов в обратных реакциях замещения, идущих с образованием гомоцистеинов,, содержащих селен вместо серы, — это первый случай, когда, селен удалось включить в состав аминокислот (рис. 4.7).
Эту лиазу можно применять для синтеза меченых аминокислот.
- Дегидрогеназы аминокислот, например лейцин- и аланиндегидрогеназы. Эти ферменты катализируют обратимые реакции дезаминирования. Их применяют в непрерывных процессах синтеза аминокислот из соответствующих кето-аналогов.. В мембранном реакторе дегидрогеназы аминокислот удерживаются ультрафильтрующей мембраной и используют в своей работе один и тот же пул NADH1 который сохраняется в реакторе,, так как ковалентно связан с полиэтиленгликолем. Регенерация: его в ходе процесса осуществляется с помощью формиатдегидрогеназы (разд. 4.2).
- Глутаминсинтаза. Этот фермент катализирует АТР-зави- симую реакцию аминирования глутамата, которая была сопряжена со сбраживанием сахара дрожжами. Высвобождающаяся' при брожении энергия используется для синтеза глутамина. 1 При распаде фруктозо-1,6-дифосфата, образовавшегося пр® сбраживании глюкозы, продуцируется ATP, которая необходима для энергоснабжения эндергонической реакции, катализируемой синтазой. При использовании бесклеточного экстракта пекарских дрожжей и глутаминсинтазы Gluconobacter suboxy- dans из глюкозы, глутамата и ионов аммония в качестве субстратов с высоким выходом (92 мол. %) был получен глутамин.
Применение аминокислот
Аминокислоты находят применение во многих сферах.
- Их используют в качестве пищевых добавок. Так, лизином, триптофаном и треонином обогащают растительные белки„ а метионин включают в блюда из сои.
- При выработке пищевых продуктов аминокислоты находят (Применение в роли усилителей вкуса и добавок. Благодаря выраженному мясному вкусу широко используется L-энантиомер мононатриевой соли глутаминовой кислоты. Глицин добавляют как подсластитель, бактериостатическое вещество и антиоксидант.
- Аминокислоты применяются в медицине (вливания), .а некоторые их аналоги используются для лечения психических заболеваний.
- В химической и фармацевтической промышленности аминокислоты широко используются как предшественники в производстве детергентов, полиаминокислот (из них делают синтетические волокна и пленки), полиуретана и химикатов для сельского хозяйства.
- 4.2.5. Антибиотики и стероиды
.Антибиотики (группа веществ микробного происхождения) играют большую роль в нашей жизни. В медицине и ветеринарии они с успехом применяются как противомикробные и противоопухолевые препараты; с их помощью контролируется рост .растений и ведется борьба с болезнями. Все антибиотики были выделены в ходе систематического скрининга микроорганизмов; число их было существенно увеличено путем химической модификации, цель которой состоит в 1) расширении спектра действия и повышении эффективности; 2) снижении токсичности и устранении нежелательных побочных эффектов; 3) создании аналогов, устойчивых к разрушению микробами и обладающих поэтому большим не менем полужизни; 4) усовершенствовании способов их введения.
Со времени открытия и описания первых антибиотиков получили путевку в жизнь целое поколение полусинтетических пенициллинов, цефалоспоринов, аминогликозидов, тетрациклинов, рифамицинов, макролидов и линкозаминидов. Эти соединения очень сложны, и метод полного химического синтеза не может конкурировать с их производством методом ферментации. Поскольку микробы могут разрушать антибиотики, возникла мысль модифицировать природные антибиотики ферментами микроорганизмов (вспомним о превращениях стероидов), но лишь немногие из таких веществ оказались экономически приемлемыми (6-аминопенициллановая кислота, 6-диметилтет-фациклины). Существует три основных способа получения новых антибиотиков.
1. Прямая ферментация. В этом случае используются образующие антибиотик микроорганизмы, которые синтезируют новые биологически активные соединения в присутствии подходящих предшественников или ингибиторов метаболизма. Так, Penicillium Chrysogenum не только синтезирует пенициллин, но и включает фенилуксусную кислоту в бензилпенициллин, а другие предшественники — в аналоги пенициллина. Этот принцип находит широкое применение, например, при получении новых блеомицинов путем добавления аминов к культуре S. Verticillus- и новых актиномицинов — путем добавления 4-метилпролина к среде для выращивания S. parυιιlus. При подавлении синтеза антибиотиков также иногда образуются полезные вещества. Так, при подавлении процесса присоединения хлора S. aureofa- ciens образует тетрациклин, а не хлортетрациклин. Если в среду ферментации добавить L-метионин, то ингибируются реакции, метилирования и синтезируется 6-деметил-7-хлортетрациклин (табл. 4.2).
Таблица 4.2
2. Мутанты организмов-продуцентов иногда образуют биологически активные промежуточные продукты какого-то определенного пути биосинтеза антибиотиков либо соединения, которые могут оказаться полезными как предшественники при создании новых аналогов. «Блокированные» мутанты этого типа не способны образовать нужный антибиотик, если в среде отсутствует метаболитический предшественник, который в норме образуется при участии фермента, действующего вслед заблокированным звеном метаболизма.
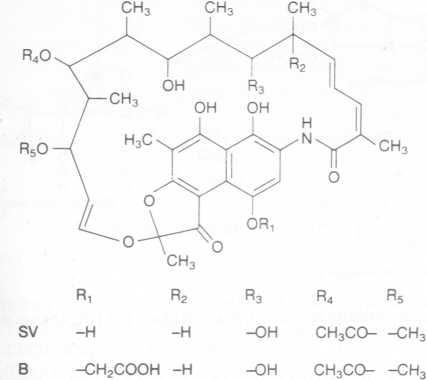
Рис. 4.8. Структура рифамицина.
Поскольку ферменты, участвующие во вторичном метаболизме, нередко обладают относительно низкой субстратной специфичностью, аналоги предшественников антибиотиков могут быть относительно легко превращены мутантом в аналоги самого антибиотика в ходе процесса, известного как мутационный биосинтез, или мутасин- тез. Nocardia mediterranei синтезирует около двадцати разных рифамицинов (рис. 4.8). Путем добавления барбитала ход ферментации и как следствие спектр образуемых антибиотиков существенно меняется. Мутанты этого организма, у которого подавлена способность к ацилированию, образуют предшественник рифамицина В — рифамицин SV1 который служит исходным веществом для получения многих синтетических рифамицинов (например, рифампицина, препарата для лечения туберкулеза, который действует и на возбудителя проказы). Другой мутант, с блокированным метилированием, синтезирует 27-деметилрифамицин SV1 ценный субстрат для синтезов, который исключительно сложно получить химическими методами.
2. Особенно успешно модификация антибиотиков микробами идет в следующих двух процессах.
а. При ферментативном гидролизе пенициллина с образованием 6-аминопенициллановой кислоты (6-АПК, рис. 9), которая является ценным исходным продуктом при производстве .некоторых полусинтетических, важных для медицины аналогов пенициллина. В промышленности 6-АПК, ядро молекулы пенициллина, получают путем гидролиза пенициллина или бензилпенициллина при участии штаммов, с высоким выходом образующих в ходе ферментации пенициллинацилазу; для этой же цели используют также иммобилизованную пенициллинацилазу.
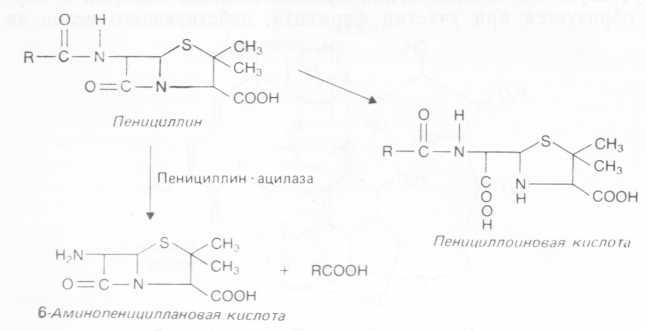
Рис. 4.9. Гидролиз пенициллина с образованием 6-АПК (ядра молекулы пенициллина) или пенициллиновой кислоты.
Исходя из типа пенициллина, который ацилазы предпочтительно гидролизуют, их подразделяют на группы. Некоторые из них способны катализировать и обратные реакции. На основе 6-АПК было получено более 40 000 полусинтетических пенициллинов. В некоторых случаях не было необходимости выделять 6-АПК: примером может быть превращение бензилпенициллина в ампициллин. Гидролиз бензилпенициллина осуществляют при участии мутанта Kluyvera Cltrophila, после чего в ферментер
вносят мутант Pseudomonas melanogenum и метиловый эфир DL-фенилглицина. Условия процесса изменяют таким образом, чтобы они способствовали образованию ампициллина (рис. 4.10). В роли катализатора выступает ацилаза, образуемая вторым мутантным организмом, которая не способна в этих условиях гидролизовать или синтезировать бензилпенициллин. В ходе этого двухстадийного процесса образуется только ампициллин: [D (—) -а-аминобензилпенициллин].
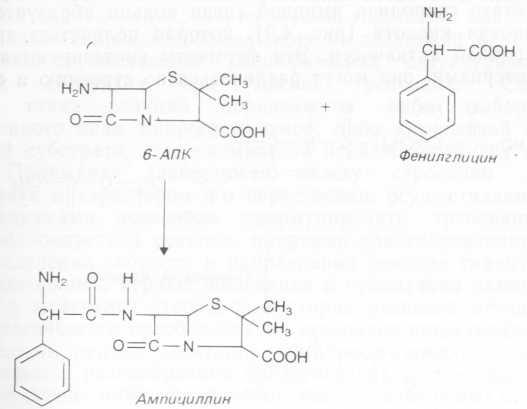
Рис. 4.10. Синтез ампициллина.
б. В клинике широко применяются аминогликозидные антибиотики (стрептомицин, неомицин, канамицин, гентамицин). Бактерии, способные их инактивировать, были выделены нетолько от больных, но и как самостоятельные, образующие антибиотики штаммы. Их ферментативная активность может быть частью механизма детоксикации, при помощи которого организмы-продуценты защищают себя от неблагоприятного воздействия образуемых ими же веществ. К числу модификаций, происходящих при инактивации антибиотиков, относятся N- ацетилирование, О-фосфорилирование, О-аденилирование и О-нуклеотидилирование. Установление механизма модификации позволило планировать и осуществлять химический синтез новых аналогов, устойчивых к такой инактивации.
Инактивация антибиотиков по другому механизму, включая гидролиз, гидроксилирование, эпоксидирование, сульфоокисление, фосфорилирование или восстановление, обычно приводит к образованию или полностью, или частично неактивных производных. Их изучение позволит синтезировать новые аналоги, выявить те участки молекул, которые ответственны за антибиотическую активность, а также создать рациональные основы «конструирования» антибиотиков и усовершенствования производства.
Пенициллиназы (р-лактамазы) гидролизуют р-лактамное кольцо молекулы субстрата и являются основой устойчивости болезнетворных бактерий к пенициллинам и цефалоспоринам. В результате гидролиза амидной связи кольца образуется пенициллиновая кислота (рис. 4.9), которая полностью лишена антимикробной активности. Эти ферменты синтезируются многими бактериями; они могут различаться по строению и специфичности. Глубокое изучение механизмов их действия позволило наладить производство устойчивых аналогов антибиотиков, таких как ампициллин и карбенициллин, а также найти природные ингибиторы лактамазы — клавулановую и оливановую кислоты. р-Лактамазы используются для оценки количества пенициллинов в пищевых продуктах и биологическом сырье, а также для инактивации пенициллина в молоке, что предотвращает аллергические реакции у его потребителей.
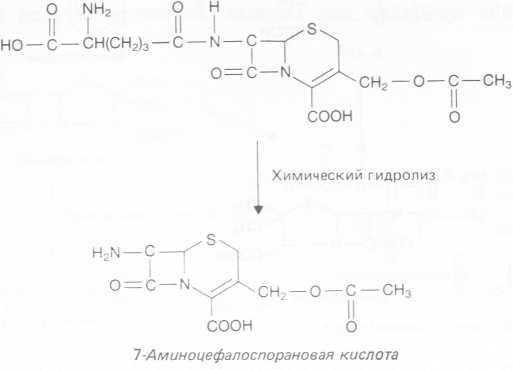
Рис. 4.11. Гидролиз цефалоспорина С.
В некоторых случаях получить полезные предшественники с помощью микробов не удается. Так, при выработке цефалоспорина в основном образуется цефалоспорин С, который приходится затем химическим методом гидролизовать до 7-амино- -цефалоспорановой кислоты (рис. 4.11) и уже ее использовать как субстрат для получения новых полусинтетических цефалоспоринов.
Способность микроорганизмов выступать в роли химических катализаторов впервые удалось использовать в полной мере для синтеза промышленно важных стероидов. В последние тридцать лет субстратная и стереоспецифичность ферментов нашла широкое применение в производстве стероидов при осуществлении разнообразных реакций: гидроксилирования, дегидроксилирования, эпоксидирования, окисления, восстановления, гидрогенизации, дегидрогенизации, этерификации, гидролиза эфиров и изомеризации. Целью всеобъемлющих исследований в этой области было осуществление специфических структурных перестроек стероидов при мягких условиях. Специфичность таких реакций определяется либо выбором определенного вида микроорганизмов, либо химической модификацией субстрата, стереохимически исключающей другие реакции. Понимание зависимости между строением молекул субстрата и характером его перестройки, осуществляемой микроорганизмами, позволило сформулировать требования для каждой конкретной реакции, например для гидроксилирования. В определении скорости и направления реакции главную роль, как выяснилось, играют положение и ориентация замещающих групп в молекулах стероидов. История развития методов микробиологического преобразования стероидов представляет собой прекрасный пример сочетания химического подхода со специфичностью и разнообразием биологических систем. Кроме того, на этой основе может быть осуществлен синтез новых стероидов, обладающих лучшими фармакологическими свойствами.
Первый запатентованный процесс микробной трансформации стероидов был разработан в 1937 г., но внедрить его в промышленность удалось лишь в 1952 г. [процесс 11-гидроксилирования прогестерона некоторыми видами грибов (рис. 4.12)]. C технологической точки зрения этот процесс не потерял значения и теперь. Сегодня в нем используются виды грибов с весьма высокой субстратной специфичностью относительно места гидроксилирования. Дальнейшее усовершенствование процесса может быть основано на использовании спор грибов или же на изменении состава культуральных сред. Упомянутая выше трансформация может быть выполнена с высоким выходом при концентрации субстрата 20—50 г/л. Сходным образом по положению 7 и 14 может быть гидроксилирован дезоксикортикостерон. Если провести баметилирование ядра молекулы стероида, то нежелательного гидроксилирования по 7а-положению не произойдет. Направленное гидроксилирование путем химической модификации широко используется для повышения эффективности процесса.
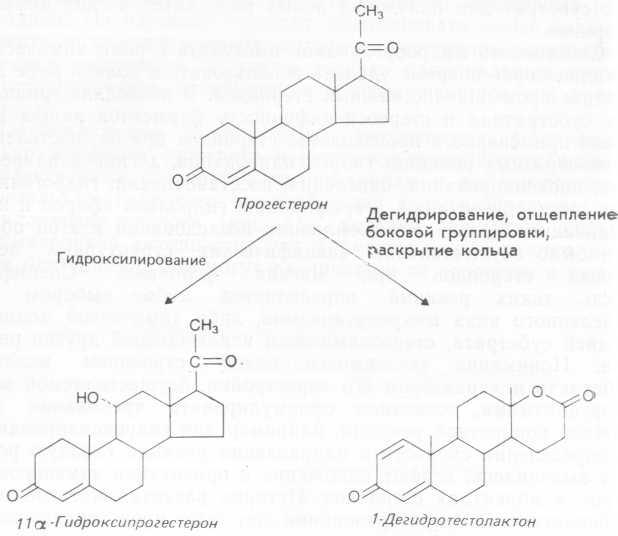
Рис. 4.12. Схема применяемого в промышленности метода микробной трансформации прогестерона.
Большинство поступающих в продажу стероидов, обладающих противовоспалительным действием, — это производные преднизолона, и именно этим определяется важная роль процессов микробного гидроксилирования кортикостерона (вещества S Рейхштейна) и его производных. В промышленном масштабе производство гидрокортизона путем гидроксилирования кортикостерона осуществляется при участии некоторых видов грибов (например, Cunninghamella blakesleeana) с начала 50-х годов. За это время процесс был неоднократно усовершенствован. Проблемы, связанные с деградацией субстрата, которая происходит при обычных условиях производства, можно решить путем регулярного его добавления или использования других микроорганизмов, например Thieghemella orchidis. Кроме того, ход синтеза можно контролировать, применяя метод химической модификации. Так, метилирование по 16а-положению подавляет нежелательное восстановление кетогруппы при С-20, а образование уксуснокислого эфира по С-17 стереохимически препятствует другим побочным реакциям. Конечное превращение гидрокортизона в коммерческие продукты со структурой преднизолона также осуществляется с помощью микробов. Химические методы здесь явно проигрывают по сравнению с микробиологическими. Одной из главных реакций в этом процессе является образование 1,2-двойной связи; для дегидрогенизации по положению 1 используют главным образом Mycobacterium gIobiforme и Arthrobacter simplex. Выход этой реакции зависит от того, какой форме подается субстрат. Если он поступает в среду в микрокристаллах, то концентрацию субстрата можно довести до 400 г/л и получить выход 80—90%. При модификации прегнана получают многие фармакологически ценные кортикоиды, гестагены и анестезирующие средства стероидной природы. Их производство основано на проведении широкого спектра превращений, осуществляемых микробами.
Другой важной группой соединений, модифицируемых с помощью микробов, являются андростаны и эстраны. Их используют в промышленном синтезе половых гормонов и минералокортикоидных соединений. Примером такого рода служит превращение дрожжами 4-андростен-3,17-диона в тестостерон. Все возрастающее значение приобретает процесс окислительного расщепления боковой цепи С1э-стероидов: он позволяет использовать дешевые стероиды для производства предшественников, идущих на синтез стероидов, крайне нужных фармакологам. И в этом случае приходится проводить химическую модификацию, чтобы предотвратить разрушение «скелета» молекул стероидов. Она заключается в гидроксилировании по положению С-9 и направляет процесс микробной перестройки Структур на разрушение боковых цепей. Так, холестерол или его соли превращаются в 4-холестен-З-он и 1,4-андростадиен-3,17-дион. Для более глубокого знакомства с проблемой микробной трансформации стероидов мы отсылаем читателя к литературе, приведенной в конце главы.
Дальнейшие успехи в области применения методов микробиологии в химии стероидов будут основаны на применении иммобилизованных клеток и органических растворителей, что позволит расширить масштабы производства.
- 4.2.6. Коммерческие аспекты применения ферментов
Применение ферментов в химической технологии обычно бывает обусловлено их высокой избирательностью и стереоспецифичностью, однако, как отмечалось ранее, эти их свойства не всегда оказываются желательны. Примером такого рода могут служить случаи использования широкой субстратной специфичности фермента для производства аналогов основного продукта. Второе важное преимущество технологии на основе ферментов перед химическим катализом заключается в том, что при относительно мягких условиях удается достичь более высоких скоростей превращений. Об использовании отдельных ферментативных реакций для получения аминокислот и антибиотиков мы уже говорили; в этом разделе будет описано сегодняшнее положение дел в сфере использования ферментных препаратов в промышленности (табл. 4.3).
Протеиназы
Протеиназы давно применяются в пищевой промышленности. Ранее ферменты для этих целей выделяли из животных и растений; сегодня их частично замещают протеазы микробов. Первым ферментом, нашедшим применение в промышленности, была а-амилаза (такадиастаза) из Aspergillus oryzae, производство которой началось в 1890 г. Эти препараты содержали значительную примесь протеазы, и их рекомендовали использовать как средство, способствующее пищеварению. Отметим, что производство и поступление на рынок такого рода продуктов было весьма ограниченным вплоть до начала 60-х годов, когда их стали использовать в составе детергентов. Впрочем, о такой возможности было известно за пятьдесят лет до этого; средство для замачивания белья, содержащее соду и панкреатические ферменты, продавалось еще в 1913 г. Крупный успех в производстве и продаже таких средств был достигнут лишь после того, как стали использоваться протеазы Bacillus subtilis, в особенности субтилизин Carlsberg. В конце 60-х годов приблизительно 50% всех детергентов, выпускавшихся в Европе и США, уже содержали протеазы. Постоянно ведется работа по увеличению активности ферментов (особенно их способности удалять пятна) и стабильности их в моющих растворах. Еще одна отрасль, где наблюдалось бурное развитие технологий на основе протеаз, — это производство сыра. Здесь все усилия были направлены на поиск микробных заменителей сычуга телят. Для выработки протеаз в промышленном масштабе нужны штаммы микроорганизмов, синтезирующие внеклеточные протеазы с высоким выходом. Эти ферменты подразделяют сегодня на три группы: сериновые, кислые и металлопротеазы.
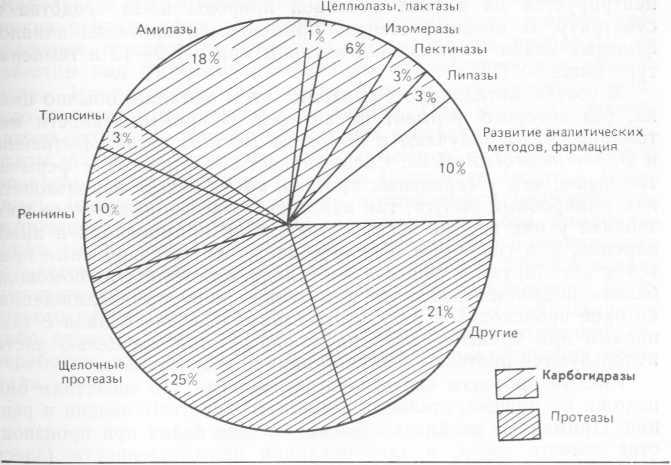
Таблица 4.3
Среди сериновых протеаз на первом месте стоит субтилизин Carlsberg. При участии Bacillus Ucheniformis ежегодно производится около 500 т очищенного фермента. Накопление протеазы начинается в конце логарифмической фазы роста микробов, и выход фермента увеличивается при использовании аспорогенных штаммов (они удобны еще и тем, что при этом удается исключить технически сложную операцию по отделению спор от фермента). Сериновые протеазы не гидролизуют белки до аминокислот. В стиральные порошки обычно добавляют 0,5% (по весу) препарата, содержащего 3% активного фермента. Хотя содержание фермента в них и мало, при стирке он концентрируется на пятнах белковой природы из-за сродства к субстрату. В меньшей степени применяются протеазы алкало- фильных видов Bacillus-, они активны при pH 9—12 и температуре выше 50 °C.
В состав металлопротеаз входит атом металла, обычно цинка, без которого фермент не активен. В промышленности металлопротеазы получают с помощью Bacillus amyloliquefaciens и В. Ihermoproteolyticus. Специфичность действия этих ферментов выше, чем у сериновых протеаз, но их нельзя использовать как «микробный сычуг», так как уровень неспецифического протеолиза у них все же весьма высок. Они применяются в пивоварении, при гидролизе белков ячменя, так как сериновые протеазы ингибируются веществами солода. Удаление с их помощью белков позволяет избежать помутнения пива при охлаждении, которое происходит в результате взаимодействия белков с тан- нинами при хранении пива на холоде. C той же целью часто используются протеазы растений папаин и бромелаин.
Кислые протеазы синтезируются грибами. По свойствам они похожи на пищеварительные ферменты животных пепсин и реннин. Применяют их для гидролиза соевого белка при производстве соевого соуса, в хлебопекарной промышленности (здесь с их помощью видоизменяют свойства клейковины муки так, чтобы получить мягкое, пластичное тесто, из которого делают бисквиты), как средства, способствующие пищеварению или же предотвращающие помутнение пива при охлаждении. Большинство протеаз вызывает свертывание молока, но творог получается невкусным, из-за глубокого гидролиза казеина. Субстратная специфичность кислых протеаз термофильных грибов Mucor pusillus и Mucor miehei уже. Они похожи на ферменты сычуга и широко применяются для створаживания молока. Менее широко используются протеазы Enthothia parasitica, так как они обладают большей, чем «сычужные» ферменты Mucor, протеолитической активностью; они применяются, например, при выделке эмментальского сыра. Разрабатывается и другой подход: на основе технологии рекомбинантных ДНК проведено клонирование и получена экспрессия гена реннина телят в микроорганизмах (например, E. coli). Синтезированный таким способом фермент успешно прошел испытания при опытном производстве сыра (гл. 3).
Протеазы находят применение и в кожевенной промышленности, при удалении шерсти и умягчении кож. Такая обработка делает кожи мягкими и эластичными.
Глюкозоизомераза
«Королевой» иммобилизованных ферментов в промышленности можно считать глюкозоизомеразу, которая катализирует превращение глюкозы во фруктозу. Коммерческие препараты ее известны под фирменным названием «Sweetzyme» или «Маха- zyme». Их появление послужило толчком для развития крупного производства фруктозного сиропа. При высоких концентрациях субстрата и нейтральных pH несладкая глюкоза с выходом 42—47% изомеризуется ферментом в более сладкую фруктозу. Такие фруктозные сиропы (Isomerose, Isosyrup, Cornsweet, Isosweet) сегодня широко потребляются пищевой промышленностью. Запатентовано множество способов иммобилизации и использования как самой изомеразы, так и содержащих ее клеток. Процесс идет при 60—65 0C при pH 7,0—8,5 в присутствии ионов магния. При производстве насыщенного фруктозного сиропа из кукурузы в качестве субстрата используется либо глюкоза, либо продукт комплексной ферментативной переработки, заключающейся в ожижении и осахаривании крахмала.
Амилазы и амилоглюкозидазы
Использование ферментов в производстве крахмала позволяет контролировать глубину его гидролиза и получать продукцию с желаемыми свойствами: вязкостью, сладостью, осмотическим давлением и устойчивостью к кристаллизации. Гидролиз катализируется ферментами трех разновидностей: эндоамилазами, экзоамилазами и а-1,6-глюкозидазами.
Эндоамилазы — это а-амилазы, они расщепляют а-1,4-глю- козидные связи в амилозе и амилопектине с образованием олигосахаридов с разной длиной цепи и a-конфигурацией при Ci-атоме глюкозы, способной служить восстановителем. Для ожижения крахмала при высокой температуре используют термостабильные а-амилазы. Так, температурный оптимум у фермента из Bacillus amyloliquefaciens лежит при 70 °C, а у амилазы В. Iicheniformis — при 92 °C. Непродолжительное время последняя может работать при температуре до HO0C. В этих условиях активность фермента стабилизируется ионами кальция и высокой концентрацией субстрата в среде. Для ожижения крахмал диспергируют в воде при нагревании; для уменьшения вязкости и во избежание оседания крахмала при охлаждении проводят частичный его гидролиз. При одностадийном ожижении фермент добавляют в самом начале, до приготовления суспензии, которое проводят при 150 0C в течение 5 мин, после чего гидролиз ферментом ведут 2 ч при 95 0C .При кислотно-ферментном ожижении фермент вносят после желирования крахмала, вызванного нагреванием.
При осахаривании используются термостабильные а-амилазы, особенно мальтогенные ферменты из грибов. Лучше всего они работают при 55oC и концентрации субстрата 30—40%. Процесс обычно продолжается более 48 ч. Получаемые из крахмала сиропы содержат много мальтозы (40—50%); они находят применение при производстве карамели и замороженных десертных блюд. Для получения сиропов с очень высоким содержанием мальтозы (80%) мальтогенные экзоамилазы используются вместе с а-1,6-глюкозидазами.
Экзоамилазы расщепляют а-1,4-глюкозидные связи, а глю- когенные экзоамилазы гидролизуют а-1,6-глюкозидные связи в разветвленных молекулах олигосахаридов, в то время как мальтогенные экзоамилазы (например, З-амилаза злаков) не способны проходить эти точки ветвления. Последовательное удаление низкомолекулярных компонент (глюкозы или мальтозы) с нередуцирующего конца полимерной молекулы крахмала приводит к постепенному уменьшению вязкости; образующийся продукт имеет р-конфигурацию при Ci-атоме восстанавливающей молекулы глюкозы. Для промышленных целей глюкоамилазы получают из Aspergillus niger или Rhizopus spp. Это низкоспецифичные ферменты, которые гидролизуют связи а-1,3 и а-1,6 медленнее, чем а-1,4. Они стабильны в широком диапазоне pH и более активны при 75 °C, хотя обычно им приходится функционировать при 65 °C. Эти ферменты могут также катализировать полимеризацию глюкозы с образованием мальтозы и изомальтозы, но осахаривание никогда не достигает равновесия, и эта реакция особого значения не имеет. В препаратах этих ферментов присутствует загрязняющая примесь трансглюкозилаза, катализирующая образование несбраживаемых олигомеров глюкозы за счет реакции переноса молекул глюкозы при осахаривании. Это может существенно снижать выход глюкозы. Глюкоамилазы применяются в основном в производстве концентрированного сиропа (90—97% D-глюкозы), из которого вырабатывают кристаллическую глюкозу или же концентрированные фруктозные сиропы (см. предыдущий раздел). Для получения максимального выхода продукта при осахаривании ключевое значение имеет процесс ожижения; при ферментативном ожижении выход продукта больше, чем при кислотном, так как в этом случае образуется меньше побочных продуктов. Глюкоамилазы применяются также при выработке сиропов с высоким декстрозным эквивалентом или с высокой степенью конверсии (35—43% глюкозы, 30—37% мальтозы и 8—13% мальтотриозы) для пищевой промышленности. Сиропы, полученные кислотным гидролизом, обрабатывают мальтогенными и глюкогенными амилазами. Состав продукта при этом зависит от соотношения использованных в производстве ферментов.
Большинство разновидностей крахмала, важных в промышленном отношении, содержит 80% амилопектина, который лишь частично расщепляется в ходе ферментативного гидролиза. Под действием а-амилаз из него образуются производные декстринов, которые далее уже гидролизоваться не могут. Так как по точкам ветвления гидролиз под действием глюкоамилаз идет медленно, используют а-1,6-глюкозидазы, из них в промышленном масштабе — пуллуланазу (пуллулан-6-глюканогидролазу).
Ферментативная переработка крахмала проводится сегодня в широком диапазоне pH. Задачей будущего является выделение термостабильных ацидофильных ферментов, что позволит вести переработку при одном и том же pH (4-5).
Другие ферменты, имеющие коммерческое значение
(см. также гл. 3)
Сегодня ферменты применяются наиболее широко для превращения углеводов, играющих особую роль в пищевой и молочной промышленности. Так, р-галактозидазу (лактазу) применяют для гидролиза лактозы в снятом молоке. Получаемый безлактозный продукт используется теми людьми, организм которых не способен синтезировать лактазу. Этот фермент применяется, кроме того, для переработки лактозы сыворотки в глюкозогалактозные сиропы, а также подкисленной сыворотки, образующейся при получении творога.
Под действием инвертазы из сахарозы получают глюкозу. Для определения количества глюкозы в жидкостях тела в клиниках в последнее время стала широко использоваться глюкозо- оксидаза — как в свободной форме, так и иммобилизованная.
На коммерческий уровень поставлено ферментативное разделение рацемических смесей аминокислот и эфиров терпенов. Такие смеси аминокислот образуются при химическом синтезе, и разделение их по оптическим свойствам составляющих имеет важное практическое значение. Известно, что для этого можно использовать соответствующие физико-химические методы (механическое разделение, избирательная кристаллизация, хроматографическое разделение) и химические подходы (фракционная кристаллизация солей диастереомеров), но гораздо более эффективными и удобными оказываются процессы, основанные на стереоспецифичности ферментов. Укажем некоторые из используемых здесь приемов.
- Получение асимметричных производных, например образование амидов М-ацил-L-аминокислот, катализируемое папаином, бромелином или фицином. Так, взяв анилин и папаин, мы получаем нерастворимые L-анилиды аминокислот. Их можно гидролизовать химическим способом и получить L-изомер.
- Асимметричный гидролиз. В этом случае осуществляется стереоспецифический гидролиз производных аминокислот, в результате которого образуется лишь один энантиомер. Эфиры L-аминокислот гидролизуют протеолитическими ферментами (например, химотрипсином); нужный продукт и не вступающие в реакцию D-эфиры разделяют по растворимости.
- Использование амидаз. Эти ферменты из почек и поджелудочной железы млекопитающих или из микроорганизмов стереоспецифически гидролизуют амиды L-аминокислот, которые затем отделяют методом дифференциальной растворимости. Амиды менее склонны к спонтанному гидролизу, чем эфиры, и с помощью этого метода получают оптически более чистые препараты аминокислот.
- Стереоспецифический гидролиз М-ацил-Ь-аминокислот. В этом случае используются аминоацилазы или карбоксипептидазы, и в результате образуются L-аминокислоты. Ацилазы получают из самых разных микроорганизмов. Иммобилизованная аминоацилаза одного из грибов успешно использовалась в установке для непрерывного ферментативного разделения.
В конце 60-х годов в промышленности стали применять метод разделения рацемических смесей эфиров терпенов при помощи гидролаз: было обнаружено, что ферментативный гидролиз этих эфиров идет только в том случае, если эфирная связь экваториальна или же легко принимает эту конформацию. Разделение по оптическим свойствам зависело также от положения диастереомерных центров; оно шло успешно в случае эпимеров вторичных спиртов. В качестве катализатора применяли дрожжи, иммобилизованные в полиуретане. Опыт проводили с DL-ментолсукцинатом, для которого в водонасыщенном н-геп- тане степень конверсии составила 72,6%. В результате был получен оптически чистый L-ментол. Этот метод разделения с производительностью 800 кг был запатентован. Рацематы терпенов можно разделять и путем обращенного гидролиза: сначала при участии липазы получают эфиры, а затем гидролизуют их химическим методом.
Будущее технологии иммобилизованных ферментов
Сегодня в промышленности реализовано всего четыре крупномасштабные технологии на основе иммобилизованных ферментов (глюкозоизомеразы, аминоацилазы, пенициллинацилазы и лактазы). Последнюю иммобилизовали на частицах кремнезема и применяли для конверсии лактозы сыворотки в глюкозу и галактозу. В обозримом будущем иммобилизованные ферменты могут быть использованы для следующих целей.
- Холинэстераза может применяться для определения пестицидов. Степень ингибирования этого фермента в присутствии пестицидов оценивают электрохимическими или колориметрическими методами.
- Аналогичным образом другие ферменты могут использоваться для определения токсических веществ. Так, карбоангидраза очень чувствительна даже к малым концентрациям хлор- производных углеводородов, гексокиназа — к хлордану, линдану и токсафену.
- Иммобилизованная диизопропилфторфосфатаза нервных клеток кальмара может найти применение для обезвреживания фосфоорганических нервных газов (зомана, зарина).
- Иммобилизованная гепариназа может применяться для предотвращения тромбообразования в аппаратах искусственного кровообращения.
- Иммобилизованная билирубиноксидаза может использоваться для удаления билирубина из крови новорожденных, страдающих желтухой.
- Предложен новый способ применения иммобилизованного гемоглобина. Суть его состоит в том, что включенный в полиуретановую матрицу белок образует «гемогубку», способную поглощать кислород прямо из воды с эффективностью 80%; Далее кислород высвобождается из полимера под действием слабого электрического разряда или в вакууме. Предполагается, что такая система может снабжать кислородом водолазов либо работающие под водой двигатели.
- Возможно, вскоре удастся создать системы из нескольких иммобилизованных ферментов. Так, если заключить в микрокапсулы три фермента — уреазу, глутаматдегидрогеназу и глюкозодегидрогеназу, то их можно будет использовать для удаления мочевины из крови больных с почечной недостаточностью.
- Иммобилизованные ферменты найдут дальнейшее применение в молочной промышленности. При производстве сыра могут использоваться иммобилизованные свертывающие молоко белки — реннин и пепсин. Для гидролиза жира в молоке можно использовать иммобилизованные липазы и эстеразы.
- Разнообразные иммобилизованные ферменты со временем найдут применение и в датчиках для быстрого анализа. Сегодня в таком качестве используются лишь несколько ферментов, но когда будет решена проблема стабилизации, их число увеличится. Особенно полезными из-за их высокой стабильности могут оказаться ферменты термофилов.

