7.2.1. Мутагенез и отбор
В прошлом для увеличения продуктивности штаммов обычно использовали мутагенез и отбор: именно таким путем удалось повысить выход антибиотиков, синтезируемых грибами и акти- номицетами. Рис. 7.1 иллюстрирует применение этих методов для повышения выхода пенициллина. Было последовательно отобрано свыше двадцати штаммов, продуцирующих все больше пенициллина, и в конечном счете продуктивность увеличилась в 55 раз. Как в этом случае, так и во многих других прямого отбора не происходило, поскольку не удавалось создать условия, при которых росли бы только искомые штаммы. Вместо этого пришлось применять метод скрининга: клетки, выжившие после воздействия больших доз мутагенов, размножали в колбах на качалках, после чего в фильтратах культуральной среды определяли количество антибиотика.
Скрининг требует много времени и напряженного труда. Часто штаммы, для которых был получен большой выход при выращивании в колбах, оказывались непродуктивными в условиях роста в ферментере большого объема. Нередко успеху способствовало знание «секретов мастерства»: так, оказывается, что большая продуктивность обычно свойственна особым: морфологическим вариантам.
Скрининг с использованием чашек с агаром вместо колб на качалках позволяет обследовать гораздо больше мутантов. Образование антибиотиков или метаболитов нередко оценивается методом биопроб, когда в агар вводят индикаторные организмы. Разработаны устройства для автоматического скрининга чашек. В них используются механические приспособления для инокуляции и производится периодическое фотографирование и последующий компьютерный анализ изображений.
Можно создать особые условия, при которых мутанты с нужными свойствами не растут. В этом случае применяется так называемый метод обогащения, когда активно растущие клетки дикого типа погибают, а нерастущие мутантные выживают. Так, например, пенициллин или нистатин вызывает гибель растущих клеток бактерий или грибов соответственно. При работе с грибами недостаток в среде инозитола приводит к автолизу растущих, но не покоящихся клеток.
Наиболее подходящим способом является, конечно, прямой отбор, когда создаются условия для роста только мутантных клеток. Этот подход применялся для выделения штаммов — еверхпродуцентов некоторых метаболитов, например аминокислот или цитрата. Обработанную мутагеном культуру выращивают в присутствии ингибитора (например, аналога аминокислоты), в результате чего отбираются мутанты, преодолевающие нарушение обмена за счет образования избытка желаемого соединения.

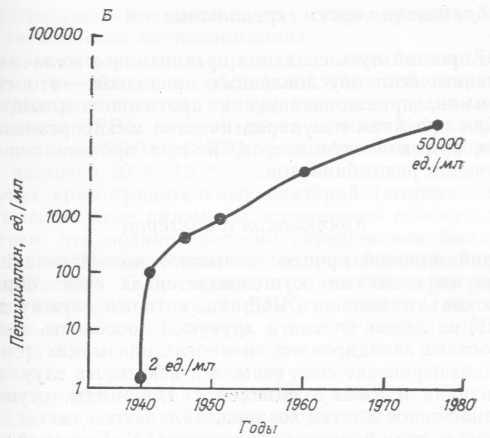
Рис. 7.1. А. Последовательный отбор штаммов, образующих все большее количество пенициллина, с помощью генетических методов (Impacts of Applied Genetics, Office of Technology Assessment, US Government Printing Office, Washington DC, USA). Б. Иллюстрация тех изменений, которые произошли в производстве пенициллина. Показано, как росла конечная концентрация пенициллина в культуральной среде при его промышленном производстве в период с 1940 по 1975 г.
Отбор на чашках с агаром основан на том, что часть организмов отвечает на воздействие по принципу «все или ничего». Колонии мутантов растут, а диких клеток — нет. Однако при получении промышленных штаммов, особенно предназначенных для использования в длительных процессах ферментации, нередко стремятся получить для конкретных условий относительно небольшие различия в скорости роста. В этом случае отбор происходит при непрерывном культивировании. В хемостатах при длительном выращивании культура все время находится в экспоненциальной фазе роста, и это позволяет выделять даже те мутанты, у которых сродство к субстрату, удельная скорость роста или устойчивость к токсическому действию высоких концентраций субстрата или продукта лишь немного превышает исходный уровень.
- 7.2.2. Гибридизация путем скрещивания
Наиболее простой путь создания организмов с желаемым комплексом генетически обусловленных признаков — это скрещивание штаммов, принадлежащих к противоположным половым типам. Как про-, так и эукариотические микроорганизмы скрещиваются при контакте клеток, и этот процесс используется для получения рекомбинантов.
Конъюгация у бактерий
У бактерий половой процесс называют конъюгацией. Контакт между двумя клетками осуществляется за счет образования длинного конъюгационного мостика, который служит для переноса ДНК из одной клетки в другую. Способность к формированию мостика закодирована во многих плазмидах (см. далее); по нему они переносят свои гены, а в некоторых случаях и гены клетки-хозяина в клетку-реципиент. Плазмиды, осуществляющие перенос генов клетки-хозяина, обладают, таким образом, способностью к мобилизации хромосом. У Escherichia coli такие F-плазмиды выступают в роли фактора пола. Они способны мобилизовать хромосому не только Е. coli, но и родственных энтеробактерий (Shigella, Klebsiella, Salmonella, Erwinia) и поэтому могут использоваться для переноса генов между бактериями разных родов. Некоторые плазмиды, выделенные из Pseudomonas aeruginosa, еще более «неразборчивы». Так, плазмида R68.45 может переносить хромосомные гены между видами Pseudomonas, в том числе и Pseudomonas putida, но кроме этого, обладает способностью к мобилизации хромосом и таких родов, как Rhizobium, Rhodopseudomonas, Azospirillum, Agrobacterium и Escherichia.
К числу наиболее широко используемых в промышленности микроорганизмов относятся разнообразные виды Streptomy- ces: с их помощью получают более 60% разновидностей применяющихся сегодня антибиотиков. У этих организмов хорошо развиты системы скрещивания, которые обнаружены и у их близких родственников, видов Nocardia (они синтезируют антибиотики рифамицины). Способность к конъюгации была открыта при изучении Streptomyces coelicolor (этот вид применения в промышленности не нашел и используется в лабораториях). В клетках этого организма было найдено два типа плазмид, SCPl и SCP2, несущих фактор пола. SCP2 продуцирует рекомбинантные формы с очень высокой частотой. SCPl по своим свойствам близка к F-плазмиде Е. coli. Она может встраиваться в хромосому Streptomyces, а также включать фрагменты хромосомной ДНК. Это довольно крупная плазмида (Mr = 18∙ IO6), несущая все шестнадцать генов, нужных для образования антибиотика метиленомицина.
Многие используемые в промышленности виды Streptomy- ces, видимо, не обладают собственной системой скрещивания, но у Streptomyces rimosus, продуцента окситетрациклина, найдена плазмида SRPl, которая несет активный фактор пола, и при скрещивании SRP1+×SRP1- рекомбинантные формы образуются с частотой IO-4—IO-3.
У других грамотрицательных бактерий (помимо Streptomy- ces) конъюгационные плазмиды встречаются относительно редко. Отметим, что недавно система скрещивания была обнаружена у бактерий такого важного в промышленном отношении рода, как Bacillus. Существенно, что эти бактерии способны легко акцептировать «голую» ДНК, и поэтому рекомбинантные формы несложно получить путем трансформации. Такая возможность была использована при создании штаммов Bacillus, у которых около 50% синтезируемого ими белка составляет гидролизующий крахмал фермент а-амилаза. При этом были отобраны несколько мутантов по разным генам с повышенной способностью к образованию фермента. Эти разные мутации были затем сведены воедино у одного штамма путем последовательной трансформации хромосомной ДНК и отбора на повышенную способность гидролизовать крахмал.
Системы скрещивания у грибов
У грибов существуют разнообразные типы скрещивания, которые используются в генетических исследованиях. Многие гри- бы-аскомицеты и базидиомицеты обладают сложноорганизованными системами скрещивания, препятствующими самооплодотворению и другими формами инбридинга. Половой процесс контролируется системой несовместимости. У некоторых грибов система несовместимости биполярна; при этом процесс скрещивания контролируется всего одним локусом, который существует в двух альтернативных аллельных формах. Это дает два типа спаривания, например а и а у Saccharomyces cereυisiae, причем разрешена лишь комбинация а/а. У других грибов (например, Schizophyllum commune) система несовместимости тетраполярна. У них тип спаривания определяется двумя генами, каждый из которых имеет множество аллельных форм. Для успешного скрещивания два партнера должны обладать разными аллелями каждого из двух локусов типа спаривания (например, AxBy×AyBx — это полностью совместимое спаривание, а комбинации AxByXAxBx или же AxByXAyBy и AxBy× XAxBy невозможны, так как приводят к гибели клеток на разных стадиях процесса скрещивания).
Парасексуальный цикл у грибов
Многие мицелиальные формы грибов, применяющиеся в промышленности, не имеют истинного полового цикла, во время: которого можно было бы провести скрещивание с целью конструирования более продуктивных штаммов. Однако в этом случае для осуществления рекомбинации можно использовать парасексуальный цикл. Именно этот подход применялся при работе с грибами таких промышленно важных родов, как As- pergillus, Penicillium, Cephalosporium и Fusarium. Суть парасексуального цикла отражена на рис. 7.2.
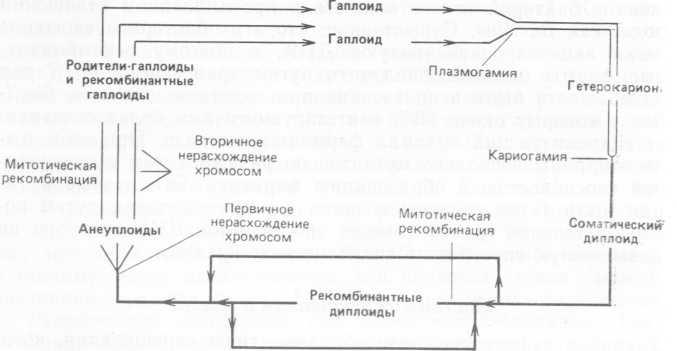
Рис. 7.2. Обычный парасексуальный цикл. [С. E. Caten (1981) Parasexual processes in fungi. In: The Fungal Nucleus (eds. K. Gull, S. G. Oliver), pp. 191— 214. Cambridge University Press.] Тонкие линии — гаплоидные или анеуплоидные ядра; жирные линии — диплоидные ядра.
Гетерокарионы, у которых в одной клетке сосуществуют генетически разные ядра, могут быть получены либо путем слияния (анастомоза) гиф разных мицелиев, либо в результате образования мутантного ядра в мицелии. Слияние ядер в гетерокарионе происходит с низкой частотой (10~5—IO-4), но этот процесс ускоряется под действием (+)-камфоры или УФ-све- та. Митотическую рекомбинацию в диплоидном ядре можно индуцировать с помощью химических и физических воздействий, которые либо вызывают мутации, либо ингибируют синтез ДНК. Возврат к гаплоидному состоянию после рекомбинации, видимо, происходит в результате постепенной утраты отдельных хромосом. Этому способствуют такие вещества, как п-фтор- фенилаланин и карбаматы бензимидазола, препятствующие образованию микротрубочек.
По сравнению с истинными системами пола парасексуаль ный цикл — это малоэффективный механизм образования рекомбинантов. Впрочем, его эффективность можно повысить, применяя интенсивный отбор и разнообразные ещества. Эта система была использована для повышения выхода антибиотиков, синтезируемых Penicillum и Cephalosporium.

