- 7.3.1. Плазмиды
Многие свойства бактерий, интересные с точки зрения биотехнологии, кодируются плазмидами. Плазмиды — это кольцевые молекулы ДНК, которые стабильно передаются потомству бактериальных клеток независимо от хромосомной ДНК- В генетической инженерии плазмиды используются для клонирования нужных генов. Мы опишем в этом разделе некоторые важнейшие свойства плазмид и обсудим те из них, которые особенно ценны для биотехнологии.
Структура и репликация
Мол. масса плазмид составляет от I-IO6 до 200∙ IO6. Таким образом, самые мелкие плазмиды кодируют один-два белка среднего размера, тогда как более крупные — 300 или более белков. Крупные плазмиды могут кодировать множество ферментов, необходимых для работы целой последовательности биохимических реакций, например для превращения толуола в катехол. Плазмиды с мол. массой более IOO-IO6 обнаружены только у грамотрицательных бактерий, в частности у видов Pseudomonas и Agrobacterium. Мол. масса плазмид грамположитель- ных бактерий лишь в отдельных случаях превышает 40-IO6.
В бактериальных клетках плазмиды существуют в виде кольцевых двухцепочечных ДНК, которые, кроме того, находятся в сверхспиральном состоянии. Некоторые из плазмид могут существовать лишь в клетках одного или двух близких видов. К числу плазмид с широким кругом хозяев относятся RP4, R68.45, RK2 и сходные с ними плазмиды, несущие маркер устойчивости к лекарственным препаратам (R-плазмиды), которые принадлежат P-группе несовместимости (члены одной и той же группы несовместимости не могут сосуществовать в бактериальной клетке). Эти плазмиды были перенесены во многие виды грамотрицательных бактерий; создается впечатление, что их хозяевами могут быть все штаммы грамотрицательных бактерий.
Таким образом, R-плазмиды, относящиеся к группе Р, особенно подходят для генетических экспериментов с грамотрицательными бактериями, используемыми в промышленности. При помощи этих плазмид мы можем осуществлять перенос хромосомных генов между неродственными видами. Небольшие по размеру производные плазмид RP4 и RK2 используются как векторы для клонирования молекул ДНК, которая затем может быть перенесена в клетки самых разных видов.
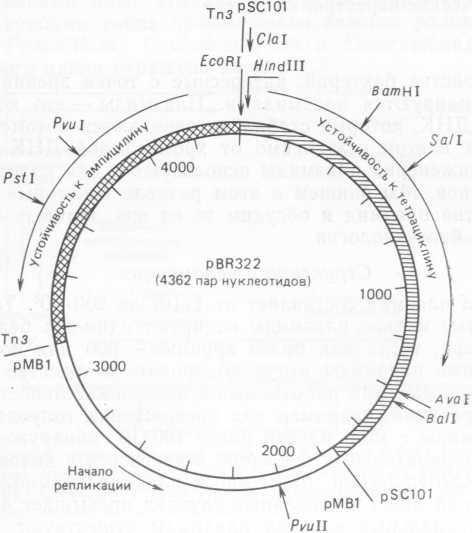
Рис. 7.3. Плазмиду pBR322 получают путем объединения плазмид TnJ, pSC101 и pMBl. [J. G. Sutcliffe (1979) Cold Spring Harbor Simposia on Quantitative Biology, 43, 77—90.] Плазмида pMBl сходна с плазмидой ColEl. Устойчивость к ампициллину определяется геном р-лактамазы. Указано направление транскрипции этого гена. Стрелками отмечены уникальные сайты расщепления pBR322 некоторыми ферментами.
Репликация некоторых типов плазмид тщательно изучена, и нам известны сегодня многие детали этого процесса, особенно для небольшой плазмиды ColEl. Эта информация помогает при использовании плазмид для клонирования генов. Чаще всего применяют производные плазмиды pBR322 длиной 4362 пар нуклеотидов, несущей гены устойчивости к пенициллину и тетрациклину. Эти гены были перенесены из R-плазмид (рис. 7.3)
Плазмиды pBR322 и ColEl могут реплицироваться в Е. coll и близких видах Enterobacteriaceae. В бактериальных клетках они представлены несколькими копиями; так, для ColEl число плазмидных копий на хромосому равно примерно 20, а для pBR322 — 40. Это обстоятельство очень важно для клонирования. Чем больше число копий клонированного гена, тем выше выход кодируемого белка. Кроме того, многокопийные плазмиды не так легко утрачиваются при культивировании. C другой стороны, малое число копий плазмиды иногда имеет свои преимущества, например при клонировании таких генов, продукты; которых гибельны для бактериальной клетки в большом количестве.
Изучению механизмов контроля репликации и числа копий бактериальных плазмид посвящено множество работ. Было обнаружено, что число копий плазмид примерно одинаково в клетках, размножающихся с разной скоростью. Из этого следует, что репликация плазмид как-то связана с ростом бактерий. Такая координация достигается при участии механизмов,, контролирующих начало репликации. Если уж репликация началась, то она идет с относительно постоянной скоростью при любом темпе размножения бактерий. При высокой скорости размножения репликация индуцируется чаще в случае много.- копийных плазмид, чем малокопийных.
Начало репликации ColEl и pBR322 контролируется небольшими молекулами РНК, которые взаимодействуют с особым; участком плазмиды, расположенным поблизости от точки инициации репликации. Начавшись, репликация идет в одном направлении и заканчивается вблизи точки инициации. Генетики, стремящиеся максимально увеличить выход белков, кодируемых клонированными в pBR322 генами, получали мутанты с модифицированными РНК. У некоторых таких мутантов число копий плазмиды составляет более 100, что приводит к существенному увеличению выхода продуктов, кодируемых клонированными генами. Интересная особенность репликации ColEl и pBR322 заключается в том, что она полностью обеспечивается ферментами хозяина. Сами плазмиды не несут информации, нужной для кодирования ферментов репликации.
Процессы репликации pBR322 и ColEl, с одной стороны, и хромосомы Е. coll — с другой, различаются тем, что первый не подавляется хлорамфениколом, который блокирует синтез белка. В присутствии этого соединения репликация хромосом прекращается по завершении уже начавшегося раунда репликации. Такого подавления репликации pBR322 не происходит, и плазмиды накапливаются в обработанных хлорамфениколом.
Инициация репликации плазмиды Rl Е. coli регулируется белком-репрессором, кодируемым одним из генов Rl. Были подучены мутантные плазмиды, которые кодируют аномальный репрессор или же имеют несовершенный механизм регуляции его образования. Некоторые из этих мутантов — температурочувствительные (репрессор неактивен при 43 0C). При 30 0C репликация идет нормально, и на клетку образуется 1—2 плаз- мидные копии, а при 43 oC репликация инициируется гораздо чаще, так что в клетке накапливается по нескольку сот плазмид. Небольшой сегмент Rl, содержащий участок начала репликации и связанные с ними регулирующие элементы, был использован для создания плазмид-векторов, применяемых при клонировании разнообразных генов. Преимущество таких векторов заключается в том, что при повышенной температуре с их помощью можно получать множества копий клонируемого гена, а следовательно, и много белка, кодируемого этим геном.
Важнейшие гены плазмид
Для биотехнологии особенно интересны те гены плазмид, в которых закодирована способность к фиксации азота и деградации органических соединений, а также факторы вирулентности патогенных бактерий.
По-видимому, одним из крупных достижений генной инженерии может оказаться использование бактерий или их генов для передачи растениям способности фиксировать азот. На корнях бобовых растений при участии бактерии Rhizobium образуются клубеньки, в которых и происходит фиксация азота — перевод его в форму, доступную растениям. Недавно было установлено, что по крайней мере некоторые гены бактерий, детерминирующие образование клубеньков и фиксацию азота, локализованы в плазмидах. Впервые указания на это были получены в опытах по передаче плазмид при конъюгации от одного штамма Rhizobium другому. Каждый конкретный вид из рода Rhizobium обычно вступает в симбиотические отношения только с одним определенным бобовым растением. Так, R. phaseoli участвует в образовании клубеньков у фасоли, а R. Iegumino- sarum — у гороха. Было найдено, что варианты R. Ieguminosa- гит, утратившие способность индуцировать образование клубеньков у гороха, вновь ее обретали, если путем конъюгации им передавалась плазмида от штамма, обладающего такой способностью. Более того, если подобная конъюгативная плазмида передавалась от R. Ieguminosarum к R. phaseoli, то эти бактерии с большей эффективностью индуцировали образование клубенька у гороха, чем у фасоли. Крупные плазмиды с мол. массой более 90-IO6, которые имеются у Rhizobium trifolii и R. те- Iiloti, также несут по меньшей мере часть генов, нужных для: образования клубеньков и фиксации азота.
Плазмиды могут обусловливать увеличение вирулентности патогенных бактерий. В некоторых случаях идентификация связанных с плазмидами факторов вирулентности помогает в борьбе с патогенными микроорганизмами. К числу наиболее изученных в этом отношении плазмид принадлежат плазмиды вирулентности патогенных штаммов Е. coli. Энтеротоксигенные штаммы Е. coll часто вызывают острую диарею у молодняка животных, а у людей — «диарею путешественников». Плазмиды этих штаммов нередко несут ген температурочувствительного токсина, близкого к токсину холеры, и ген температуроус- стойчивого токсина. Энтеротоксигенные штаммы обычно содержат и плазмиды с генами фимбрий (pili), которые называют также «факторами колонизации». Эти факторы находятся на поверхности бактериальных клеток, которые с их помощью' прикрепляются к стенке тонкого кишечника. Штаммы, инфицирующие определенный вид животных, обладают обычно одинаковым фактором колонизации. Так, у штаммов Е. coli, вызывающих диарею у свиней, в состав этих липких выростов обычно входит антиген К88 или 987Р, в то время как у штаммов,, выделенных от телят, образуется антиген К89. Потеря энтеро- токсигенными штаммами плазмид, кодирующих антигены — факторы колонизации, сильно снижает их вирулентность, хотя штаммы и продолжают образовывать токсины.
Одним из способов борьбы с заболеванием свиней, вызываемым энтеротокоигенными штаммами, была вакцинация животных препаратом, содержащим антиген К88. Предпринимаются' попытки повысить выход применяемого в вакцинах антигена К.88, используя технологию рекомбинантных ДНК. Эти методы нашли применение также и в производстве некоего токсоида, который можно не опасаясь вводить животным для образования у них антител к токсинам, продуцируемым энтеротоксиген- ными бактериями. Другой подход в борьбе с диареей в животноводстве состоит в выведении пород, устойчивых к кодируемым плазмидами антигенам — факторам колонизации.
Tранспозоны
Транспозоны и вставочные последовательности — это сходные элементы в хромосомных ДНК бактерий, ДНК бактериофагов, и плазмид. В опытах с бактериями транспозоны используются для получения мутантов и для клонирования нужных бактериальных генов. Открыты они были Хеджесом и Жакобом, которые показали, что небольшой фрагмент плазмиды RP4, определяющий устойчивость к пенициллину, может встраиваться в другие плазмиды, последовательность которых не гомологична RP4. Обычный механизм рекомбинации в клетках бактерий, основанный на взаимодействии гомологичных молекул ДНК и зависимый от продукта бактериального гена rec А+, в переносе этого гена устойчивости к антибиотику не используется. В последующие годы было описано множество других транспозонов. Большинство из них было обнаружено в R-плазмидах грамот- рицательных бактерий; обычно они придают им устойчивость к антибиотикам. Лучше всего изучен транспозон ТпЗ длиною 4957 пар нуклеотидов, обеспечивающий устойчивость к пенициллину. Последовательности из 38 пар нуклеотидов на концах Tn∙3 одинаковы, но противоположно направлены. В транспозоне закодирована информация о ферменте транспозазе, играющем важную роль в его перемещениях (транспозициях). Этот транспозон может встраиваться во множество сегментов молекулы ДНК, но предпочитает АТ-богатые участки.
Транспозоны могут служить маркером гена, предназначенного для клонирования. Как известно, при клонировании хромосомных генов бактерий иногда возникают сложности, связанные с тем, что нет простого метода, позволяющего выявить, какая из плазмид, несущих встроенный фрагмент хромосомной ДНК, содержит интересующий исследователя ген. Иногда эту проблему удается решить, выделив сначала мутант по этому тену с включенным в него или расположенным поблизости транспозоном.
- 7.2.2. Слияние протопластов
C целью преодоления преград для генетического обмена, существующих в обычных системах скрещивания, был разработан метод слияния протопластов (клеток с удаленными клеточными оболочками). Этот метод пригоден для получения межвидовых и даже межродовых гибридов. Его можно использовать при гибридизации клеток одного вида, которые принадлежат к несовместимым группам спаривания или же когда природная система скрещивания малоэффективна в плане образования генетических рекомбинантов.
Слияние протопластов бактерий
Метод слияния протопластов был впервые использован в опытах с бактериями для получения межвидовых гибридов Bacillus megateriurnXBacillus subtilis. В природе эти бактерии не конъюгируют, но легко трансформируются изолированной ДНК- Путем слияния протопластов, индуцируемого либо полиэтиленгликолем, либо CaCl2, получить их гибриды несложно. При этом частота рекомбинации может достигать IO-5—IO-4; процесс нечувствителен к ДНКазе, следовательно, он осуществляется без трансформации.
Этот метод нашел широкое применение при гибридизации видов Streptomyces. Так, Streptomyces coelicolor обладает плазмидозависимой системой фертильности или скрещивания (с. 300), однако эта система малоэффективна, а многие используемые в промышленности виды Streptomyces вообще не способны к обычному скрещиванию. Если же применить метод •слияния протопластов, индуцируемого полиэтиленгликолем, то частоту рекомбинации удается повысить примерно на четыре порядка по сравнению с наблюдаемой при обычном скрещивании. Максимальная частота рекомбинации, достижимая при работе этим методом, составляет 10—20%. Штаммы не обязательно должны нести селективные генетические маркеры, поскольку при использовании этого метода возможен прямой отбор гибридов с нужным свойством. Это дает большие преимущества при конструировании промышленно важных штаммов, поскольку работа по введению подходящих маркеров нередко превращается в утомительное трудоемкое занятие.
Слияние протопластов грибов
Образование гибридов грибов с помощью слияния протопластов изучалось очень активно; этот метод нашел применение в промышленности при создании штаммов Cephalosporium acremo- nium, для которых характерны высокая скорость роста и большой выход цефалоспорина. Первые опыты по слиянию были выполнены с ауксотрофными мутантами Geotrichum Candidum, у которых не обнаружено ни половой, ни парасексуальной систем. Слияние протопластов осуществляли путем центрифугирования, причем прототрофные гетерокарионы образовывались с низкой частотой. Впоследствии слияние обычно осуществляли, добавляя ионы Ca2++ или ПЭГ.
Межвидовые слияния удалось провести как в опытах с различными мицелиальными грибами, так и с дрожжами, среди которых были и такие промышленно важные организмы, как Penicillium chrysogenum, Aspergillus niger, Candida tropicalis, Yarrowia Iipolytica, Kluyveromyces Iactis и Saccharomyces се- Tevisiae. Слияние обычно происходит с частотой 0,2—2%. Вероятность слияния ядер, приводящего после слияния клеток к образованию диплоидов, зависит от вида организма. Здесь вскрыта определенная закономерность: мицелиальные грибы дают гетерокарионы, диморфные дрожжи — нестабильные диплоиды, а истинные дрожжи — стабильные диплоиды (рис. 7.4).
Межвидовые слияния также происходят с достаточно высокой частотой, особенно у относительно близкородственных видов Aspergillus или Penicillium. Если сливаются ядра, то за этим обычно следует потеря хромосом. Нередко после выращивания в неселективных условиях образуются споры с гаплоидными ядрами лишь одного из двух родительских видов.
Гетерокарионы
Geotrichum Candidum
Phycomyces blakesleeanus
Mucor racemosus
Гетерокарионы и часто образующиеся нестабильные диплоиды
Cephalosporium acremonium
Гетерокарионы и редкие стабильные диплоиды
Aspergillus
PeniciHum
Гетерокарионы и часто образующиеся стабильные диплоиды
Candida Iropicalis
Нестабильные диплоиды
Yarrowia Iipolytica
Стабильные диплоиды
Saccharomyces Cerevisiae
Kluyveromyces Iactis
Рис. 7.4. Результаты внутривидовых слияний протопластов.
Предпринимались попытки осуществить слияние протопластов дрожжей разных родов (например, CandidaXSaccharomy- copsis, YarrowiaXPichia, YarrowiaxKluyveromyces, Saccharo- mycesXSchizosaccharomyces). Однако такие гибриды оказались нестабильными, а частота их образования очень низкой (10^^5—IO-4). В последнем варианте обычно формировались многоядерные "клетки. Сообщалось об успешном слиянии протопластов мицелиальных грибов (целлюлолитический организм Trichoderma reesii) и дрожжей (5. cerevisiae), но эти наблюдения нуждаются в подтверждении.
При многих слияниях образуются нестабильные гетерокарионы, в которых обычно доминирует ядро одной из родительских форм. Впрочем, далеко не всегда это препятствует генетическому обмену. Так, убедительно показана возможность межъядерных генетических обменов в гетерокарионах Schizop-hilum commune и Saccharomyces cerevisiae. Таким образом, слияние протопластов может быть полезным методом установления гетерокариотического состояния, при котором возможен в ограниченном объеме перенос генов.
Образование гибридов растений путем слияния протопластов
Протопласты растений можно получить путем механического или ферментативного разрушения клеточных стенок. Такие протопласты — ценный инструмент в руках генетика растений. Они довольно быстро и эффективно регенерируют клеточную стенку, у них легко индуцировать деление с образованием каллусной ткани. Из каллуса можно вырастить растения, способные цвести и давать всхожие семена. Доступность жизнеспособных протопластов позволила генетикам растений проводить опыты по мутагенезу и селекции на уровне единичной клетки, т. е. примерно так, как это делают микробиологи. В результате, например, были получены растения табака, устойчивые к болезни «wild-fire»: мутации у протопластов вызывали этилметансульфонатом, а затем отбирали мутанты, устойчивые к действию метионинсульфоксима. Дело в том, что токсин, образуемый Pseudomonas tabaci (организмом, вызывающим упомянутое заболевание),— это тоже аналог метионина.
Слияние протопластов растений осуществляют с помощью ряда агентов, включая азотнокислый натрий, гидроксид кальция и ПЭГ. Наибольшая частота слияния наблюдается при действии ПЭГ, но гибриды, полученные в присутствии кальция, проще регенерировать в целое растение. Таким путем удалось получить межсортовые внутривидовые гибриды, гибриды между видами одного рода и даже разных родов. Опыты эти проводились на таких важных культурах, как картофель, табак и спаржа.
Результатом слияния может быть простое сращение клеток одной и той же родительской линии или образование гибридов двух типов клеток. Как и для большинства других разновидностей скрещивания, основная трудность здесь состоит в выборе метода отбора гибридов; кроме того, работа с растениями сильно осложняется недостатком подходящих генетических маркеров. В большинстве тех случаев, когда гибриды удавалось получить путем слияния протопластов, гибридизация уже была осуществлена обычными генетическими методами. Таким образом, фенотип гибрида был уже известен, и его можно было принять за стандарт при отборе. В этой новой области селекции растений предстоит еще большая работа, и успех ее определяется тем, сможем ли мы использовать обширный набор маркеров (например, устойчивости к химическим веществам и токсинам) или ауксотрофных мутантов растений.
- 7.2.3. Слияние клеток животных
Осуществить слияние клеток и получить внутри- или межвидовые гибриды клеток млекопитающих методически проще, чем в случае микроорганизмов или растений, так как клетки млекопитающих не имеют клеточной стенки, которую необходимо удалять перед слиянием. Первый метод контролируемого слияния клеток млекопитающих был основан на использовании инактивированного вируса Сендай. Этот вирус относится к группе парамиксовирусов; его вирион покрыт липидсодержащей оболочкой, сливающейся с мембраной клетки-хозяина и обеспечивающей проникновение вируса в клетку. Вирус способствует слиянию, связываясь одновременно с мембранами двух клеток. В опытах по слиянию клеток млекопитающих используются также некоторые химические вещества (ионы кальция, лизолецитин, ПЭГ).
Отбор гибридов из смеси продуктов слияния лучше всего- вести в селективных условиях, хотя для этого можно использовать и трудоемкий метод скрининга. Так, отбор может происходить в результате комплементации ауксотрофных и температурочувствительных мутаций, но чаще всего для этого используются маркеры устойчивости к химическим веществам. Последний метод был предложен Литтлфилдом, который провел опыты по слиянию устойчивой к бромдезоксиуридину линии (BUdRr) L-клеток мыши и еще одной линии, устойчивой к азагуанину (AGr). В клетках BUdRr отсутствует фермент тимидинкиназа (TK), а в клетках AGr — инозинпирофосфорилаза (IPP). Ни клетки TK-IPP+, ни клетки TK+IPP- не растут на среде, содержащей гипоксантин, аминоптерин и тимидин. Аминоптерин ингибирует биосинтез нуклеотидов; трифосфаты пуриновых и пиримидиновых нуклеозидов могут синтезироваться только клетками, способными использовать и тимидин, и гипоксантин. Для жизнедеятельности этим клеткам необходимы активные ферменты TK и IPP. Таким образом, среди продуктов слияния TK+IPP-, TK-IPP+ и TK+IPP+ способностью к росту будут обладать лишь клетки, у которых активны оба фермента.
Использование таких приемов отбора позволило получить гибриды не только путем слияния линий клеток одного вида, но и межродовые гибриды клеток человека с клетками мыши и крысы. Эти линии клеток грызунов/человека нестабильны, причем легче они теряют хромосомы человека, так что после тридцати делений в процессе выращивания у них остается всего семь из 24 хромосом человека, изначально присутствовавших в гибридной клетке. Этот процесс элиминации хромосом был применен при картировании генома человека, поскольку таким путем удается быстро локализовать определенные гены на хромосомах.
Моноклональные антитела
Один из результатов использования метода слияния клеток млекопитающих чрезвычайно быстро нашел применение в биотехнологии: это линии клеток, полученных при гибридизации с участием клеток миеломы (так называемые «гибридомы»), с помощью которых могут вырабатываться моноклональные антитела. Этот метод, разработанный в Кембридже Мильштейном и его сотр., основан на создании «бессмертных» клеток, производящих антитела, за счет слияния их с клетками миеломы.
Большинство антигенов вызывает в организме образование целого набора антител, но каждый отдельно взятый лимфоцит продуцирует лишь одно из них. Миеломы — это злокачественные новообразования иммунной системы; они развиваются в результате неконтролируемой пролиферации одной линии лимфоцитов. При этом в больших количествах синтезируется один тип белков-антител. Иными словами, миеломы являются природными продуцентами моноклональных антител. По методу Мильштейна проводят слияние нормальных (неопухолевых) лимфоцитов и клеток миеломы. Вначале полученные гибриды синтезируют смесь антител, включающую два типа антител родительских клеток, а также гибридные их формы, образующиеся путем ассоциации тяжелых и легких цепей антител двух родительских форм. Впоследствии в результате элиминации хромосом образуются клетки, способные к синтезу антител лишь одного типа. Это могут быть либо антитела, закодированные в геноме лимфоцита, либо антитела, характерные для клеток миеломы. Скрининг и обнаружение клона, синтезирующего искомое антитело, ведут при помощи биохимических и иммунохимических методов. Схема этого метода дана на рис. 7.5.
Область возможного применения моноклональных антител весьма обширна. Их используют в диагностике, например для быстрого и точного типирования тканей и органов, предназначенных для пересадки. Они находят применение при очистке белков и других биологических соединений методом иммуноадсорбции. Секер и Берке использовали моноклональные антитела для очистки больших количеств интерферона из лимфоцитов человека (гл. 8). Очевидно, что такой подход пригоден и для очистки интерферона, синтезируемого бактериями-рекомбинантами. Возможности применения моноклональных антител для пассивной иммунизации ограничены, во всяком случае, у больных людей, поскольку пока не удалось получить стабильные клоны на основе клеток человека.
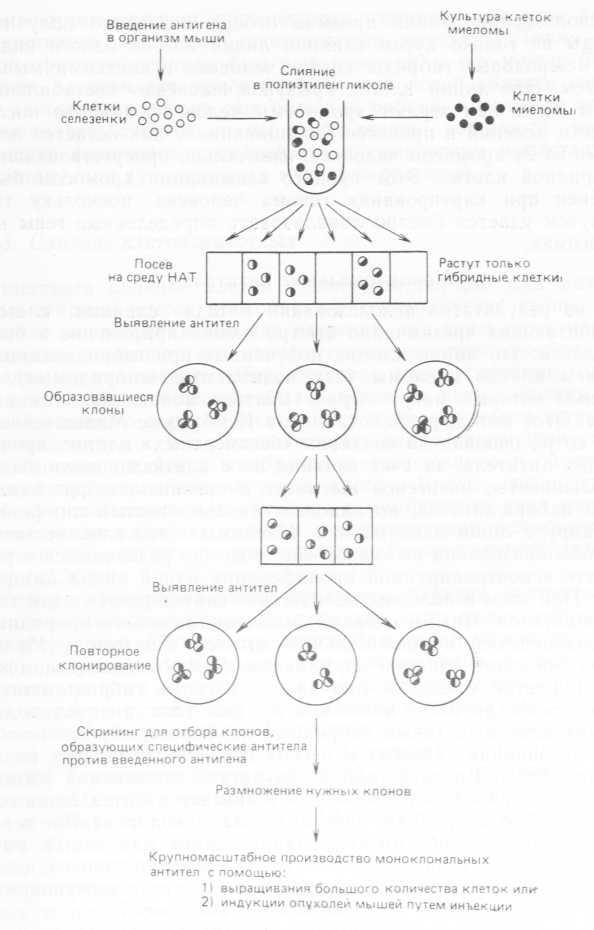
Рис. 7.5. Метод Мильштейна

