- 8.2.1. Антибиотики
Можно считать, что клиническая биотехнология зародилась с началом промышленного производства пенициллина в 40-х гг. и его использования в терапии. По-видимому, применение этого первого природного пенициллина повлияло на снижение заболеваемости и смертности больше, чем какого-либо другого препарата, но, с другой стороны, поставило ряд новых проблем, которые удалось решить опять-таки с помощью биотехнологии. Во-первых, успешное применение пенициллина вызвало большую потребность в этом лекарственном препарате, и для ее удовлетворения нужно было резко повысить выход пенициллина при его производстве. Во-вторых, первый пенициллин —G (бензилпенициллин) —действовал главным образом на грампо- ложительные бактерии (например, Streptococci и Staphylococci), а нужно было получить антибиотики с более широким спектром действия и/или активностью, поражающие и грамот- рицательные бактерии типа E. coli и Pseudomonas. В-третьих, поскольку антибиотики вызывали аллергические реакции (чаще всего незначительные, вроде сыпи на коже, но иногда и тяжелые, угрожающие жизни проявления анафилаксии), необходимо было иметь целый набор антибактериальных средств, с тем чтобы можно было выбрать из равноэффективных препаратов такой, который не вызывал бы у больного аллергию. В-четвертых, пенициллин нестабилен в кислой среде желудка и его нельзя назначать для приема внутрь. Наконец, многие бактерии приобретают устойчивость к антибиотикам. Классический пример тому — образование стафилококками фермента пенициллиназы (правильнее, р-лактамазы), который гидролизует амидную связь в р-лактамном кольце пенициллина с образованием фармакологически неактивной пенициллоиновой кислоты (рис. 8.1).
Увеличить выход пенициллина при его производстве удалось в основном благодаря последовательному использованию серии мутантов исходного штамма Penicillium Chrysogenum (полученных в результате воздействия УФ- и рентгеновского облучения, азотистого иприта и в результате спонтанного мутагенеза), а также путем изменения условий выращивания. Были выделены новые антибиотики, эффективные в случае грамотрицатель- ных бактерий: стрептомицин, синтезируемый нитчатыми бактериями (Actinomycetes) рода Streptomycetes, и цефалоспорин, продуцируемый плесневым грибом Cephalosporium. Хотя цефалоспорины и относятся к р-лактамным антибиотикам, содержащим р-лактамное ядро, аналогичное таковому у пенициллинов, по своему строению они существенно отличаются от последних, что позволяет назначать их больным, у которых пенициллин вызывает аллергию (рис. 8.1).
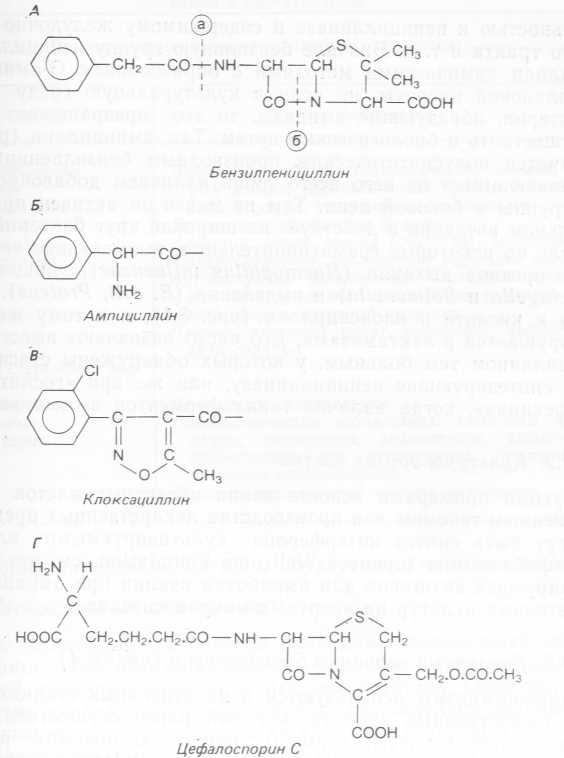
Рис. 8.1. Структурные формулы природного бензилпенициллина и сопоставление с полусинтетическими пенициллинами (ампициллином и клоксациллином) и другим природным Р-лактамным антибиотиком — цефалоспорином. А. Бензилпенициллин; (а)—место отщепления боковой цепи от 6-аминопеницилла- новой кислоты, (б) —место расщепления р-лактамного кольца пенициллиназами. Б. Боковая цепь ампициллина. В. Боковая цепь клоксациллина. Г. Цефалоспорин С.
Путем замещения боковой цепи природной р-лактамной молекулы получено множество полусинтетических антибиотиков с новыми свойствами: с другим спектром действия, чувствительностью к пенициллиназе и содержимому желудочно-кишечного тракта и т. д. Вначале бензильную группу пенициллина G удаляли химическими методами с образованием G-аминопени- циллановой кислоты, но если в культуральную среду ввести бактерии, образующие амидазы, то это превращение можно осуществить и биологическим путем. Так, ампициллин (рис. 8.1) является полусинтетическим производным бензилпенициллина, отличающимся от него всего лишь наличием добавочной аминогруппы в боковой цепи. Тем не менее он активен при пероральном введении и действует на широкий круг бактерий, в том числе на некоторые грамотрицательные, вызывающие заболевания органов дыхания (Haemophilus influenzae), пищеварения (Schigella и Salmonella) и выделения (E. coli, Proteus). Устойчив к кислоте и клоксациллин (рис. 8.1), и к тому же он не разрушается З-лактамазами. Его часто назначают вместе с ампициллином тем больным, у которых обнаружены стафилококки, синтезирующие пенициллиназу, или же при «госпитальных инфекциях», когда наличие таких ферментов весьма вероятно.
- 8.2.2. Культуры других клеток
Другими примерами использования интактных клеток с неизмененным геномом для производства лекарственных препаратов могут быть синтез интерферона культивируемыми клетками лимфобластомы (процесс Wellcome Foundation, см. разд. 8.3.2) и вирусных антигенов для выработки вакцин при выращивании клеточных культур на инертных микроносителях.
- 8.2.3. Различные варианты биоконверсии (см. гл. 4)
Микроорганизмы используются и на отдельных стадиях синтеза лекарственных веществ, который ранее осуществлялся путем многоступенчатых и дорогостоящих химических реакций. Так, один из штаммов хлебной плесени, Rhizopus arrhizus, на начальном этапе синтеза производного стероида, кортизона, может гидроксилировать прогестерон по 11-му положению. Применение подобной стратегии биоконверсии наряду с традиционными химическими превращениями позволило получать многие стероиды более простыми и дешевыми способами на основе стеролсодержащего растительного сырья. Именно благодаря этому такие стероиды, как преднизон, дексаметазон, тестостерон и эстрадиол, могут сегодня широко применяться в клинике. Некоторое представление об исключительной важности этих веществ в терапии можно получить, ознакомившись с табл. 8.1, где перечислены основные области применения стероидов.
Таблица 8.1. Примеры использования в клинике стероидных препаратов