- 8.3.1. Моноклональные антитела
Еще до разработки технологии гибридом, позволившей получать гомогенные антитела, большое влияние на развитие клинической медицины оказали «обычные» антитела. Отметим, что наработка подходящих антител всегда осложнялась непредсказуемостью иммунного ответа, и их титр, как и перекрестные реакции, варьировали от животного к животному и от одной партии сыворотки к другой. Это определялось тем, что данный антиген вызывает образование целого набора антител. В основу метода получения практически неограниченного количества гомогенных антител, которые находят самое широкое применение, легла фундаментальная работа Кёлера и Мильштейна, выполненная в начале 70-х г. Рассмотрим несколько примеров.
Иммунологический анализ
Разработка Ялоу и Берсоном метода радиоиммунологического анализа (РИА) оказала глубочайшее влияние на многие области клинической медицины и науку вообще. Он позволяет определять очень небольшие количества вещества путем вытеснения меченного радиоактивным изотопом антигена из комплекса со специфическим антителом при добавлении все возрастающего количества немеченого испытуемого или стандартного антигена. Особенно ярко достоинства метода проявились в эндокринологии, так как «рабочая» концентрация гормонов обычно очень невелика, а определение их при помощи биологических методов анализа — долгая, утомительная, иногда попросту неосуществимая процедура. Анализируемые вещества бывают нестабильны даже вне условий анализа, а при анализе их нередко приходится концентрировать; кроме того, они содержат примеси, которые могут обладать биологической активностью, сходной с таковой у изучаемого гормона. Так, инсулиноподобные факторы роста, соматомедины, можно определять биологическими методами, но они не инактивируются антисыворотками против инсулина. Приведем лишь один пример гормона, определение которого с помощью радиоиммунологиче- ского анализа открыло принципиально новые возможности: это пролактин. Применяя быстрый и относительно простой способ его определения при помощи РИА в плазме большого числа пациентов и здоровых добровольцев, удалось установить, что повышенное содержание пролактина в плазме ассоциировано с наличием наиболее распространенного типа опухолей переднего отдела гипофиза (пролактиномы), а нередко и с индуцируемыми пролактином галактореей и аменореей (отсутствием менструаций), а также иными нарушениями менструального цикла. Сегодня определение содержания пролактина стало важной частью исследований бесплодия и аменореи. Приблизительно у 20% женщин с аменореей обнаруживается повышенное содержание пролактина в плазме, причиной которого мо- жеть быть опухоль гипофиза, прием лекарств, вызывающих повышение уровня пролактина, и т. д.
Моноклональные антитела уже используются в коммерчес ских наборах для проведения радиоиммунологического анализа, и их доступность позволила предложить альтернативные методы анализа, когда используется избыток меченых антител (иммунорадиометрический анализ). Эти методы иногда обладают большей чувствительностью.
Иммуногистохимия
Меченые антитела могут использоваться для изучения распределения антигенов в срезах тканей с помощью как светового, так и электронного микроскопа. При работе по общепринятому «сэндвич-методу» на срез наносят немеченые специфические антитела, отмывают их избыток, а затем добавляют антитело против иммуноглобулина (обычно несущее флуоресцентную метку или связанное с ферментом). Таким образом осуществляется непрямое мечение изучаемого антигена. В биологических исследованиях и в медицине применение этого метода оказалось исключительно плодотворным. Одним из примеров использования обычных поликлональных антисывороток может быть топографическое картирование различных типов клеток в тканях, например островков Лангерганса. Иммуногистохимические опыты с применением различных антисывороток показали, что содержащие инсулин В-клетки располагаются в центральной части островков, а секретирующие глюкагон А-клет- ки — на их периферии. На стыке двух слоев располагаются D-клетки, образующие соматостатин. Возможно, такое взаиморасположение клеток имеет функциональное значение.
Примером современного метода использования моноклональных антител для гистопатологической диагностики заболеваний человека может быть анализ биоптатов (образцов ткани) лимфатических узлов как способ определения типа опухолей лимфатической системы (например, болезни Ходжкина, различных лимфом и др.).
Методы иммуногистохимии находят также применение в диагностике для определения природы клеток, давших начало опухоли, по типу содержащегося в них антигена.
Типирование подлежащих пересадке тканей
Гуморальные и клеточные реакции, ответственные за отторжение тканей и органов при межвидовой их пересадке или же при пересадке пациенту, не состоящему в родстве с донором, направлены в основном против так называемых антигенов гистосовместимости, расположенных на поверхности клеток. Впервые эти белки были открыты при изучении антигенов лейкоцитов человека (HLA). Кодирующие их гены расположены на 6-й хромосоме. Эти поверхностные маркеры играют ключевую роль в узнавании организмом «своих» и «чужих» клеток. Предварительный подбор HLA-гаплотипов донора и реципиента существенно улучшил результаты операций по пересадке органов. Четыре из пяти главных локусов (А, В, C и Dr) комплекса генов HLA (рис. 8.2) кодируют серологически определенные антигены, т. е. типируемые при помощи антител. В отличие от них локус D отвечает за пролиферативный ответ культуры при смешивании лимфоцитов, хотя он может быть таким же, как в случае локуса Dr. Гены каждого локуса исключительно полиморфны: одному антигену соответствует до тридцати аллелей. Типирование HLA-комплекса у пациентов можно существенно улучшить путем применения моноклональных антител против различных антигенов комплекса HLA, так как это повышает надежность и воспроизводимость результатов.
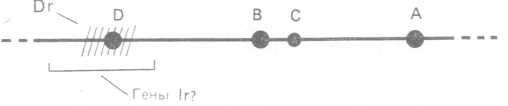
Рис. 8.2. Основные локусы HLA (А, В, С, D и Dr) на 6-й хромосоме. Гипотетический ген иммунного ответа Dr, видимо, близок к локусу D. Связь между HLA и подверженностью определенным заболеваниям может опосредоваться именно этим локусом.
Антигены HLA связаны также с некоторыми заболеваниями. Изучение частоты встречаемости их у населения позволило выявить, что некоторые болезни возникают чаще в группах с определенными специфическими гаплотипами HLA. Так, степень риска возникновения целиакии составляет около 73 для гаплотипа D3, а ревматоидного артрита — 4 для D4, т. е. эти заболевания встречаются соответственно в 73 или 4 раза чаще у лиц, обладающих этими антигенами, чем у тех, кто этих антигенов не имеет. Таким образом, HLA-типирование позволяет оценить вероятность возникновения определенного заболевания в конкретной популяции и способствует осуществлению мер по идентификации и предотвращению болезней (там, где такие меры предпринимаются).
Диагностика злокачественных новообразований
и наблюдение за ними
Известны несколько специфических опухолевых маркеров, которые с успехом используются в диагностике, прогнозировании и выявлении распространения опухолей (т. е. метастазов). Некоторые из них обнаруживаются в крови (обычно с помощью метода радиоиммунологического анализа), а другие находят в препаратах опухолей. Так, а-фетопротеин является главным белком сыворотки плода; его содержание уменьшается в течение первого года жизни. Определяя содержание a-фетопротеина в плазме при помощи метода РИА, удалось установить, что оно повышается у многих больных с гепатомой (рак печени) и при раке семенников (тератоме). У многих больных, страдающих раком прямой кишки, в плазме отмечается повышенное содержание карциноэмбрионального антигена. Дальнейшее его увеличение может служить указанием на неэффективность химио- или лучевой терапии.
Помимо того что моноклональные антитела применяются как специфические реагенты в стандартных тестах, они могут использоваться и для идентификации новых, более специфических маркеров опухолей. Так, Ритсу и его сотр. (Ritz et al., 1980) удалось получить моноклональные антитела к антигену клеток при остром лимфолейкозе человека. Были также выделены гомогенные антитела к клеткам злокачественной меланомы человека (одна из разновидностей рака кожи), которые не давали перекрестной реакции с нормальными клетками кожи. Введение радиоактивных и флуоресцентных меток в опухолеспецифичные антитела, вероятно, облегчит выявление метастазов и оценку первичных реакций опухолей в ходе лечения как in vivo, так и при анализе препаратов, полученных при биопсии. Развитию новых способов лечения (см. далее) может способствовать направленное введение лекарственных препаратов, присоединенных к антителам против данных опухолей.
Направленное введение лекарственных препаратов
Моноклональные антитела могут найти применение для введения лекарственных веществ и токсинов в определенную часть тела (например, опухоль) либо путем их непосредственного присоединения к таким веществам, либо путем связывания с поверхностью липосом, содержащих внутри такие вещества.
Были получены комплексы антител к поверхностным антигенам раковых клеток со многими неспецифичными противораковыми средствами, но далеко не всегда они оказывались эффективными. Вероятно, наиболее многообещающим является использование сильнодействующих растительных и бактериальных токсинов, одна молекула которых, как принято считать, может вызвать гибель клетки. Молекулы токсина дифтерии и рицина образованы двумя полипептидными цепями, связанными дисульфидными мостиками. Цепь В связывается с клеточной поверхностью, а цепь А, обладающая ферментативной активностью, проникает внутрь клетки и нарушает работу механизма биосинтеза белка. Были предприняты попытки заменить В-цепь токсинов специфическими антителами, преимущественно гомогенными. Недавно был получен препарат моноклональных антител к антигену раковых клеток прямой кишки, ассоциированных с A-цепью токсина, который избирательно действует на эти клетки в культуре.
Получен ассоциат липосом, содержащих метатрексат (ингибитор дигидрофолатредуктазы, противораковое средство), и моноклональных антител к антигенам гистосовместимости мышей. Было показано, что он оказывает специфическое влияние на клетки селезенки. Надо сказать, что исследования по направленному введению лекарственных веществ, содержащихся в липосомах, только начинаются.
Передозировка лекарств
Антитела против лекарственных препаратов, например дигоксина, могут оказаться полезными для снятия последствий его передозировки, хотя сегодня и не ясно, нужно ли применять их экстракорпорально, связанными с твердым носителем, через; который циркулирует кровь, или же вводить в кровоток.
Получение важных для медицины веществ
Примером использования моноклональных антител для очистки и крупномасштабного производства важных для медицины веществ может быть работа Секера и Берке (Secher, Burke1 1980). Им удалось ковалентно пришить мышиное моноклональное антитело против лейкоцитарного интерферона человека к. твердому носителю — сефарозе. C помощью полученного таким образом специфического иммуноадсорбента удалось за один цикл очистить в 5000 раз лимфобластоидный интерферон. Важное преимущество этого способа заключается в том, что для производства антител требуется очень немного частично очищенного антигена, поскольку разработаны методы отбора и клонирования искомого гибрида.
- 8.3.2. Технология рекомбинантных ДНК (см. также гл. 7)
Общеизвестно, что разработка методов изменения генетического аппарата клеток, позволяющих вводить в них чужеродные гены, клонировать их, экспрессировать и получать нужные продукты, совершила настоящую революцию в биологии. Эти достижения находят самое широкое применение и в медицине. Белки и пептиды, доступные совсем недавно лишь в очень небольшом количестве, сегодня предполагается производить в массовом масштабе и использовать для лечения многих больных. Вот несколько тому примеров.
Инсулин
Сегодня 1—2% населения Англии, Европы и США страдают диабетом, и приблизительно 20% этих больных не могут существовать без инъекций инсулина. Со времени проведения первых опытов по использованию инсулина для лечения диабета в 1922 г. этот гормон выделяли из поджелудочной железы животных (коров или свиней). Существует несколько причин, по которым целесообразна разработка методов крупномасштабного производства и выпуск на рынок инсулина человека: среди них и коммерческие соображения, и эмоциональные факторы, и потребности развития науки, и возможные преимущества при лечении.
Инсулин как коров, так и свиней немного отличается по аминокислотной последовательности от инсулина человека. Ocoбенно близки инсулины человека и свиньи: у последнего лишь С-концевой треонин В-цепи заменен на аланин. Инсулины коровы и человека различаются по трем аминокислотным остаткам, и именно этими различиями определяется повышенная иммуногенная активность инсулина коровы по сравнению с инсулином свиньи. Почти у всех больных, которых лечат обычным методом, т. е. вводят им инсулин коровы, в крови появляются антитела к инсулину. Антигенные свойства инсулина частично определяются и примесями в его препаратах. Скорее всего именно образованием антител к инсулину объясняются некоторые незначительные побочные эффекты при инъекциях инсулина коровы, например атрофия подкожной жировой прослойки в месте повторного введения. В случае высокоочищенного инсулина свиньи эти эффекты отсутствуют. Далее, антитела к инсулину инактивируют его в кровотоке, так что больному приходится вводить большие дозы, чем это необходимо. Антитела, вероятно, влияют и на продолжительность биологического действия введенного инсулина. Надежных данных о том, что антитела способны вызвать более долгосрочные и серьезные нарушения, нет. Можно думать, что инсулин человека будет еще менее иммуногенным, чем инсулин свиньи (это естественно, поскольку он не является чужеродным белком).
Так как число больных диабетом и соответственно потребность в инсулине растут, то вполне возможно, что доступность его в будущем уменьшится из-за нехватки исходного сырья — поджелудочной железы животных. Столь же очевидно, что из- за чисто эмоциональных факторов лучше использовать инсулин человека, чем каких-либо животных.
Ряд производителей инсулина во главе с фирмой Eli Lilly and Со. использовали как основу для производства инсулина человека технологию рекомбинатных ДНК. Согласно схеме процесса, разработанного Eli Lilly в сотрудничестве с фирмой Genenetech Inc. (рис. 8.3), на первом этапе воссоздают последовательность ДНК по аминокислотной последовательности инсулина, раздельно синтезируя искусственные гены его А- и В-це- пей. На 5'-конце каждого из них располагается кодон метионина (который в синтезированном белке оказывается N-конце- вым), а на З'-конце — терминирующие последовательности. Каждый из генов встраивают затем в ген З-галактозидазы плазмид, а их в свою очередь вводят в клетки E. coli. Поскольку бактерии растят на среде с галактозой, а не с глюкозой, то в них индуцируется синтез З-галактозидазы, а вместе с ней — А- и В-цепей инсулина, присоединенных через остаток метионина. После лизиса бактерий и обработки бромцианом, который специфически расщепляет белки по остатку метионина, цепи инсулина отделяют от 3-галактозидазы (инсулин метионина не содержит). Затем проводят очистку цепей и их объединение (с низким выходом), в результате чего образуется нативный двухцепочечный инсулин. Было показано, что он не содержит белков E. coli, эндотоксинов и пирогенных веществ, по физическим свойствам неотличим от инсулина из поджелудочной железы человека и в тест-системе (гипогликемия у животных) проявляет полную биологическую активность.
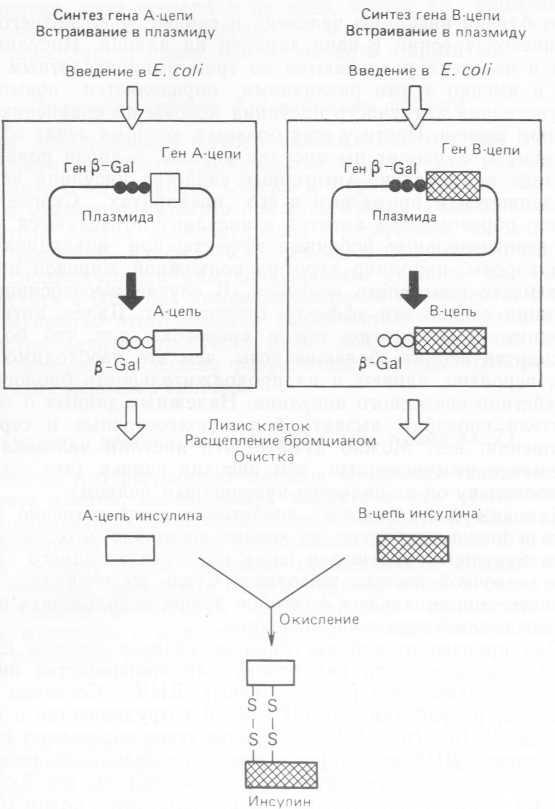
Рис. 8.3. Получение инсулина человека на основе технологии рекомбинантных ДНК (Miller, Baxter, 1980).
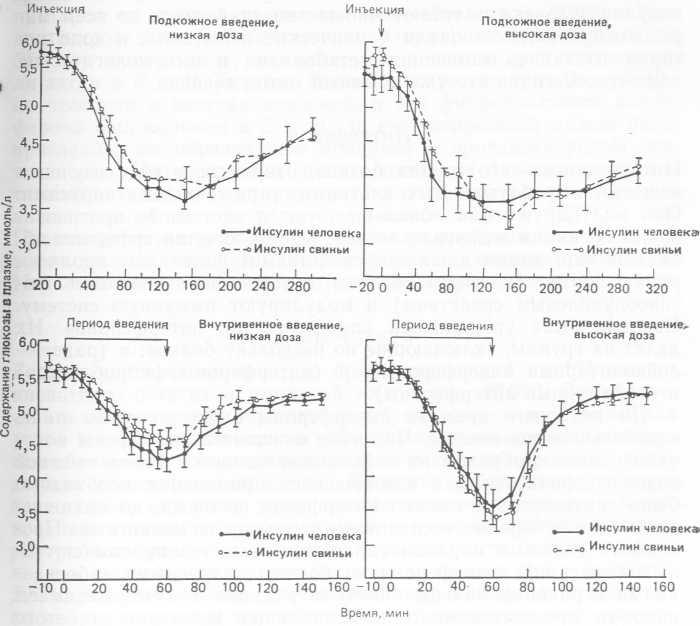
Рис. 8.4. Изменение содержания глюкозы в плазме здоровых добровольцев под. действием малых и больших доз инсулина человека, полученного на основе технологии рекомбинантных ДНК, и инсулина из поджелудочной железы свиньи (Keen et al., 1980). Вверху — биологический ответ при подкожном введении, внизу — при внутривенном введении в течение 1 ч.
Впоследствии был испытан альтернативный метод: синтезировали ген молекулы-предшественника, проинсулина, который и вводили в Е. coli. После очистки проинсулина его расщепляли трипсином и З-карбоксипептидазой и получали нативный инсулин.
Инсулин человека, полученный с помощью Е. coli, оказался первым «генно-инженерным» белком, испытанным на людях. В опытах со здоровыми добровольцами было установлено, что он безопасен, во всяком случае при краткосрочном применении (не вызывает аллергических и иных нежелательных реакций) и обладает практически одинаковой с инсулином свиньи способностью снижать уровень глюкозы в крови при введении его под кожу или внутривенно (рис. 8.4). В настоящее время такой инсулин человека получают множество диабетиков во всем мире. Этому предшествовали клинические испытания, в ходе которых изучались изменения метаболизма и иммунологические эффекты. Сегодня это уже обычный метод лечения.
Интерферон
Интерфероны — это группа белков, открытых в ходе изучения веществ, вырабатываемых клетками, зараженными вирусами. ’Они индуцируют как локальные, так и системные противовирусные реакции в других клетках. Кроме того, интерфероны обладают еще двумя важными свойствами: подавляют пролиферацию клеток (и, таким образом, потенциально являются противоопухолевым средством) и модулируют иммунную систему. Недавно была упорядочена классификация интерферонов. Их делят на группы, включающие по нескольку белков: а (ранее — -лейкоцитарные интерфероны), β (интерфероны фибробластов) и у (иммунные интерфероны).
До недавнего времени интерфероны были доступны лишь в небольшом количестве. Частично очищенные препараты получали главным образом из лейкоцитов человека. Из-за высокой видоспецифичности для клинического применения необходимо было синтезировать именно интерферон человека, но его нельзя было всесторонне исследовать в опытах на животных. Проведение должным образом спланированных и широкомасштабных испытаний интерферона на больных вирусными заболеваниями и раковых больных было затруднено, но мы уже имеем какое-то представление о потенциальных возможностях этого препарата. Так, лейкоцитарный интерферон существенно уменьшает распространение пузырьков и продолжительность их формирования, а также снимает боль у больных с одной из форм герпеса (herpes zoster, опоясывающий лишай). Гепатит В также поддается лечению интерфероном (см. ниже). Среди онкологических больных были проведены испытания на пациентах с метастазирующим раком молочной железы, и у двенадцати из сорока трех диаметр опухоли уменьшился по меньшей мере на 50%. Изучалось его действие на лимфомы (иные, чем лимфома Ходжкина), остеосаркомы и злокачественные меланомы. Однако здесь нужно проделать большую работу по подбору оптимальных доз, частоты и способа введения интерферона и выяснению эффективности комплексного лечения с применением других противоопухолевых средств. Неоднократно сообщалось о побочных эффектах (лихорадка, общее недомогание, потеря веса) при применении интерферона.
Понятно, что в изучении, клинических испытаниях и внедрении интерферона в практику будет достигнут большой прогресс, если удастся получать в большом количестве чистый препарат на основе технологии рекомбинатных ДНК- Уже синтезирован ген лейкоцитарного интерферона человека длиной 514 пар нуклеотидов; его включали в плазмиду и клонировали затем в Е. coll. Удалось достичь экспрессии гена интерферона человека в клетках дрожжей, а ген фибробластного интерферона был включен в Е. coll. За его экспрессией можно была проследить по образованию продукта с противовирусной активностью. Интересен сам факт проявления биологической активности, так как этот природный интерферон гликозилирован,, а получаемый по технологии рекомбинантных ДНК — нет. Производство интерферона на основе рекомбинантных ДНК освоили уже по меньшей мере две фармацевтические компании. Начались и клинические испытания этих препаратов.
Гормон роста
Гормон роста человека — это белок, состоящий из 191 аминокислотного остатка и имеющий мол. массу 22 000. Он образуется и секретируется передней долей гипофиза и необходим для: роста костей. Выяснено, что у 7—10 людей на 1 млн. этот гормон образуется в недостаточном количестве, что приводит к задержке роста (карликовости). Хотя это заболевание обычна врожденное, задержка роста становится заметной лишь в более позднем, детском возрасте, так как гормон не нужен для внутриутробного развития. Строение гормона роста видоспецифично, и в клинике можно применять лишь гормон роста человека. До недавнего времени его получали из гипофиза трупов, но по вполне понятным причинам этот способ имеет свои ограничения. Фармацевтическая компания Kabi Vitrum в сотрудничестве с Genentech Inc. предприняла попытки наладить производство гормона роста на основе технологии рекомбинантных ДНК с использованием Е. coll. Можно надеяться, что с помощью такого подхода мы вскоре не будем испытывать в нем недостатка. Очищенный препарат гормона из бактерий по биологической активности подобен гормону из гипофиза. Сейчас ведутся клинические испытания: гормон роста вводят детям, страдающим от его недостатка.
Вакцины
Гепатит В — заболевание, при котором трудно получить подходящий антиген для иммунизации. Исход этой вирусной болезни печени трудно прогнозировать, особенно у пожилых и ослабленных больных. Заражение происходит при переливании крови и плазмы, при использовании плохо стерилизованных шприцев, игл и других медицинских инструментов, а также при половых сношениях. К числу групп с высокой степенью риска, где может помочь вакцинация, относятся больные с синдромом приобретенного иммунодефицита, раковые больные, которым необходимо переливать кровь в большом количестве, а также лица, проводящие гемодиализ, осуществляющие трансплантации, персонал онкологических учреждений, наркоманы, умственно отсталые и обслуживающие их, проститутки и гомосексуалисты.
Вирус гепатита В не размножается в культуре тканей. Вакцины против него получали путем тепловой обработки сыворотки бессимптомных носителей. Впоследствии была предложена вакцина на основе инактивированных сферических частичек его поверхностного антигена (HBsAg), присутствовавших в сыворотке носителей. Эти вакцины эффективны и безопасны, однако для их получения необходимо большое количество смешанной сыворотки, осуществление дорогостоящих защитных мер и крупные затраты на оборудование.
Альтернативным способом получения антигена может быть наработка белков вируса гепатита В клетками прокариот, который и был разработан Эдманом и др. (Edman et al., 1981). Другой подход заключается в инокуляции пептидов синтетического поверхностного антигена. Исходя из нуклеотидной последовательности вирусного генома была реконструирована аминокислотная последовательность HBsAg, и многие исследователи попытались с помощью ЭВМ выявить в ней антигенные последовательности. Так, Дрисману и др. (Dreesman et al., 1982) удалось синтезировать два циклических пептида, которые при одноразовом введении вызывали образование антител у мышей.
Ферменты
Ферменты составляют основу многих тестов, используемых в клинической медицине. Они все чаще применяются при автоматизированном анализе и биохимическом скрининге жидкостей тела, которые ведутся в биохимических лабораториях современных клиник. Примером таких ферментов могут быть глю- козооксидаза, гексокиназа, холестеролоксидаза и эстераза, уреаза, уриказа, лактатдегидрогеназа и алкогольдегидрогеназа. Иногда ферменты применяют и в терапии (например, стрептокиназу или урокиназу; они оказывают мощное фибринолитическое действие при тяжелом тромбозе сосудов).
В будущем ферменты (скорее всего иммобилизованные) найдут, вероятно, значительно более широкое применение в составе фермент-содержащих электродов, используемых для мониторинга in vivo и in vitro. Много подобных устройств уже сконструировано, но в клинике не применяется. Так, многими учеными был разработан электрод с глюкозооксидазой. В устройстве Апдайка и Хикса глюкозооксидаза наслоена непосредственно на поверхность обычного платинового электрода (рис. 8.5). Чем больше кислорода потребляется в реакции Глюкоза-)-Кислород=Глюконовая кислота+Перекись водорода, тем меньше количество его регистрируется внутренней частью электрода.
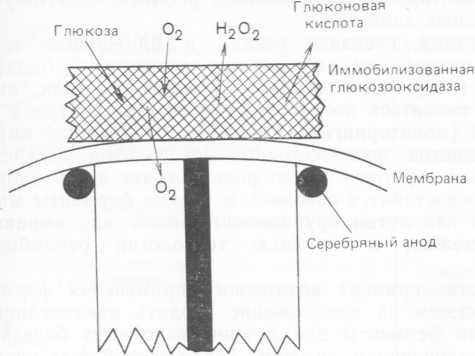
Платиновый катод
Рис. 8.5. Устройство ферментного электрода с глюкозооксидазой (Updike1 Hicks1 1967).
К сожалению, это устройство все еще работает недостаточно надежно, что не позволяет использовать его как имплантируемый аппарат для постоянной регистрации содержания глюкозы. Возникающие здесь проблемы связаны с наличием конкурентных отношений между глюкозой и кислородом в жидкостях тела, инактивацией фермента in vivo, сложностью калибровки и дрейфом характеристик электрода. Ведущиеся интенсивные исследования позволяют надеяться, что, усовершенствовав такие электроды с ферментами, удастся со временем создать датчик глюкозы для автономно работающего, полностью автоматического и небольшого по размеру протеза поджелудочной железы, нужного для лечения больных диабетом. В этой связи особенно интересны последние достижения в области разработки фермент-содержащих электродов. Исследователи, работающие в Крэнфилдском технологическом институте Оксфордского университета и в госпитале Гая в Лондоне, разрабатывают глюкозный электрод, в котором для переноса электронов от простетической группы (ФАД) глюкозооксидазы на графитовый электрод используется органический медиатор (например, ферроцен), т. е. процесс идет без участия кислорода, который обычно выступает в роли конечного акцептора электронов. Работа этого электрода, таким образом, не связана с кислородом. Он может оказаться особенно полезным при создании имплантируемого, способного работать in vivo устройства для больных диабетом.
По-видимому, основные усилия в ближайшие несколька лет будут направлены на развитие технологии биодатчиков. Ферменты (и другие лиганды, например антитела; см. разд. 8.5) могут оказаться весьма полезными для контроля за концентрацией (мониторинга) разнообразных веществ, интересующих клиницистов: промежуточных метаболитов, лекарственных: препаратов и гормонов. Свою роль сыграет здесь биотехнология: она предоставит и обычные, и редкие ферменты микробов, полученные как путем крупномасштабного их выращивания, так и, возможно, с помощью технологии рекомбинантных ДНК.
В качестве примера возможного применения ферментов в терапии укажем на предложение вводить инкапсулированные в липосомах ферменты для лечения некоторых болезней, связанных с накоплением лизосом. Такой способ был испытан на нескольких больных болезнью Гоше, с врожденной недостаточностью по глюкоцереброзид 3-глюкозидазе. Полученные результаты не позволяют сделать однозначных выводов.

