- 9.4.1. Роль везикулярно-арбускулярной микоризы
Корни растений в природных условиях никогда не бывают стерильными. На их поверхности всегда присутствует типичная для данного местообитания микрофлора, причем нередко корни бывают заражены почвенными патогенными микробами. Под действием некоторых непатогенных грибов формируются особые структуры; одни грибы, размножаясь, образуют вокруг мелких корешков чехол — эктомикоризу, другие, проникая в кортикальную ткань корней, образуют эндомикоризу. В результате устанавливаются симбиотические отношения, выгодные растениям-хозяевам. Эктомикоризы, образованные грибами-базидиомицетами и аскомицетами, обнаружены у некоторых де- девьев и кустарников, в частности тех, которые произрастают в умеренном поясе северного полушария, а две из трех известных разновидностей эндомикоризы встречаются только в пределах семейств Ericaceae и Orchidaceae. Третья из них известна под названием «везикулярно-арбускулярная микориза» (BA): при ее образовании в покровных тканях формируются характерные структуры. Эта разновидность микориз особенно важна для сельского хозяйства (рис. 9.3—9.5). Микориза BA, образуемая грибом-фикомицетом из семейства Endogonaceae, встречается особенно часто в большинстве почв всех климатических зон: она присуща большей части покрытосеменных, многим голосеменным, а также некоторым папоротникам и печеночникам. Микориза BA найдена у большинства важнейших видов сельскохозяйственных растений, она обычно встречается у важнейших культур из семейств Gramineae и Leguminoseae, но не найдена у видов семейства Cruciferae и сахарной свеклы.
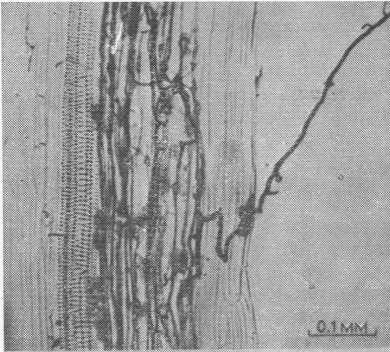
Рис. 9.3. Интактные корни лука, инфицированные везикулярно-арбускулярным микоризным грибом (Phillips, Hayman, 1970). После осветления препарат был окрашен КОН-трипановым синим. Корни инокулированы штаммом Endogone с желтыми вакуолярными спорами. Видны выходящие наружу гифы и несколько зон проникновения, но инфекция в глубине ткани слабая.
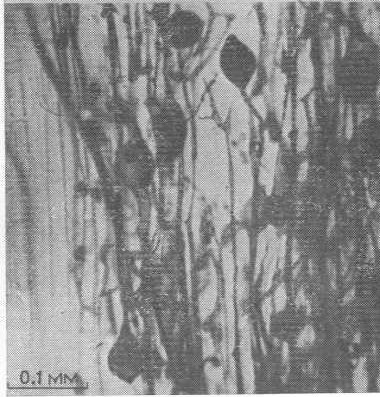
Рис. 9.4. Корень лука (см. рис. 9.3) с везикулами и гифами, располагающимися в коре продольно (Phillips, Hayman, 1970).
Значение BA-микоризы в сельском хозяйстве определяется тем, что она помогает растениям поглощать из почвы фосфаты. Фосфат-ионы в почве не очень подвижны, и поэтому вокруг корней их часто недостает. Гифы микоризы, вырастающие из корневого мицелия и распространяющиеся за пределы области^ где недостает фосфата, переносят его прямо в клетки хозяина. Растения со слабо развитой корневой системой, имеющие короткие торчащие корни с небольшим числом волосков (например, лук и цитрусовые), обычно не очень успешно поглощают фосфаты из почвы и «полагаются» в этом на ВА-микоризу.

Рис. 9.5. Корень лука (см. рис. 9.3) (Phillips, Hayman, 1970). Видны арбускулы, ответвляющиеся от расположенных продольно гиф.
Благодаря микоризам нередко существенно улучшается рост растений на почвах, бедных фосфором. При этом также увеличивается поступление микроэлементов, например цинка и меди. Выявлено, что концентрация гормонов роста в растениях с микоризой бывает выше, чем в ее отсутствие. Есть и другие преимущества; когда образование микоризы происходит в присутствии подходящих видов Rhizobium, у бобовых усиливаются образование клубеньков и азотфиксация.
Поскольку фосфатные удобрения приходится расходовать экономно, большое внимание сегодня уделяется тому, как эффективнее использовать преимущества BA-микоризы в растениеводстве. Хотя микоризные грибы встречаются повсеместно, .в почве, на которой предполагается выращивать новую культуру, может и не быть нужных их разновидностей. Они наверняка отсутствуют в стерилизованной почве теплиц и средах для выращивания растений в горшках. Частичная стерилизация, необходимая для уничтожения патогенов и вредителей растений, убивает и полезные грибы-эндофиты. Чтобы размножить в почве эндофиты или ввести их туда заново, нужна инокуляция, но здесь возникает немало сложностей, поскольку гриб не развивается без растения-хозяина. Осыпающиеся с корней крупные покоящиеся споры гриба-эндофита (около 0,15 мм в диаметре) можно отсеять от почвы и поместить на среду с агаром. Они прорастут, но в отсутствие растения-хозяина, в которое проникает мицелий, вскоре перестанут расти. Единственный способ получения больших количеств эндофита — это выращивание его на подходящей линии растений. На самом деле инокулятом должна служить смесь корней мицелия и спор. На рис. 9.6 показано, какое благотворное действие на растения оказывает внесение в почву грибов, вызывающих образование ВА-микоризы.
- 9.4.2. Инокуляция эндофитом
Выделение спор эндофита из почвы
Почву, содержащую тонкие корешки, замачивают в воде и размешивают до разделения почвенных частиц, а затем процеживают через сито с отверстиями диаметром 500—600 мкм. Прошедшую сквозь сито киселеобразную массу перемешивают, встряхивают и дают постоять, чтобы осели грубые минеральные частицы, после чего пропускают через другое сито, с диаметром «отверстий 70—100 мкм. Осадок на сите изучают под микроскопом. Такой способ отсеивания дает вполне хорошие результаты, поскольку покоящиеся споры эндофита диаметром 100—200 мкм превышают по размеру крупнейшие среди грибов. Этот метод особенно хорош для легких песчаных почв, так как при избытке органики в почве обнаружить споры бывает сложно. Морфологические признаки таких спор весьма своеобразны, и на них основана систематика этих грибов.

Рис. 9.6. Проростки белого клевера, растущие на нестерильном торфе, взятом с горного луга в среднем Уэльсе. Обе группы растений были инфицированы одним и тем же местным микоризным грибом, но росли плохо (слева) до тех пор, пока не была проведена инокуляция микоризным грибом, взятым с ближайшего горного луга той же местности (справа). Во все горшки был добавлен суперфосфат (40 кг/га).
Другой метод заключается в выделении спор из обогатительной культуры, которую получают путем инокуляции определенных сортов растений, выращиваемых в горшках, кусочками корней с микоризой. В результате заражения в пересчете на горшок образуется гораздо больше спор (несколько тысяч), чем в полевых условиях (несколько сот на 100 г почвы), поэтому выделить их намного проще.
Получение одноразовых культур
Для получения одноразовой культуры на растениях определенного сорта для инокуляции корней проростков в стерильной почве берут 10—20 идентичных спор. В случае успешного заражения через 3—4 мес в горшке развивается гомогенная популяция спор. Их можно выделить одним из описанных выше способов и использовать для заражения новых партий опытных растений.
Крупномасштабное производство инокулятов
Технология, предложенная Менге и др. (Menge et al., 1977), представляет собой по сути дела модификацию только что описанного маломасштабного способа культивирования в горшках.. Корни растения с BA-микоризой или же инфицированную почву используют для инокуляции растения-хозяина. При этом у растения-донора и растения-хозяина, для которого предназначен вырабатываемый инокулят, не должно быть общих заболеваний корневой системы. Так, инокулят для цитрусовых можно получать, размножая эндофит на суданской траве; использовать для этого цитрусовые не следует.
Споры, полученные при таком способе культивирования, можно подвегнуть поверхностной стерилизации и использовать для инокуляции других линий растений той же разновидности. Убедившись, что горшечные растения свободны от болезней и вредителей, которые могли бы поразить выбранные для инокуляции растения-хозяева, можно провести инокуляцию последних содержимым горшков. При получении инокулята рекомендуется использовать подходящие пестициды и фунгициды, не действующие на BA-микоризу. Методы, подобные описанному, позволяют получать инокуляты в количестве, достаточном для промышленного выращивания растений с хорошо развитой BA-микоризой в горшечной культуре. И все же метод горшечной культуры малоэффективен, и таким путем трудно получить инокуляты в количестве, необходимом для полевых опытов. Не удивительно поэтому, что наряду с ним изучаются и другие методы. Кроме того, есть надежда, что исследование физиологии эндофита позволит разработать метод его выращивания в чистой культуре, без растения-хозяина, в лабораториях. Это существенно упростило бы производство инокулята, позволило бы получать более гомогенный, свободный от патогенов препарат. Сегодня же основой для производства инокулята остаются несущие микоризу растения.
Получение чистых инфицированных корней
В настоящее время изучается возможность получения чистых корней, инфицированных эндофитом BA (с помощью метода питательной пленки; разд. 9.2). Опубликованы результаты первых опытов, в которых при производстве инокулята использовали фасоль (Phaseolus vulgaris) и кукурузу (Zea mays). Споры или корешки с микоризой, завернутые в небольшие кусочки гигроскопичного материала, помещали между корнями, где циркулировал питательный раствор, и получали гораздо более чистые инфицированные корни, чем при выращивании в почве,, но эндофит распространялся в корневой массе медленно. Когда такие корни с микоризой применяли для инокуляции в опытах с проростками салата, лука, фасоли и кукурузы, наблюдалось нормальное образование BA-микориз. При инфицировании проростков фасоли и салата культурами трех разных видов эндофитов рода Glomus, полученными с помощью метода питательной пленки, во всех случаях образовывались видоспецифичные микоризы. Каждый препарат данного инокулята был не менее эффективен, чем препарат такой же массы, полученный методом горшечной культуры. При высушивании на воздухе инфекционность уменьшалась, но инактивации препарата не происходило (Elmes1 Mosse, 1980).
Метод питательной пленки хорош тем, что можно строго контролировать условия роста и видоизменять их так, чтобы микориза развивалась успешно, без помех со стороны коллоидов почвы. Так, опыты, о которых речь шла выше, показали, «что для хорошего развития проростков кукурузы и микоризы необходимо присутствие 5,6 мг/л железа в форме NaFe-ЭДТА; при концентрации азота в циркулирующем растворе И мг/л (95% в форме NO3- и 5% в виде NH4+) наблюдалось подавление заражения эндофитом, но если концентрация азота в растворе была 1 мг/л, то заражение протекало нормально. Таким образом, этот метод весьма перспективен как для изучения микоризных заражений, так и при крупномасштабном производстве инокулятов для полевых опытов и на продажу.
- 9.4.3. Методы инокуляции
Инокулировать BA-эндофитами молодые многолетние растения, например сеянцы деревьев или черенки, относительно просто, особенно если выращивать их в контейнерах. Несколько граммов неочищенного инокулята, полученного из горшечной культуры растения-хозяина, либо добавляют в среду, либо помещают его поблизости от молодых корней так, чтобы до пересадки при участии эндофита успела образоваться мощная микориза. Те, кто занимается разведением лесов и цитрусовых, все более убеждаются, что это очень эффективный метод.
В практику сельского хозяйства инокуляция полевых культур BA-эндофитами не внедрена, но в опытах используется широко. Этот метод хорош для выращивания многолетних культур в контейнерах, но не нашел применения для инокуляции в полевых условиях, так как препарата нужно очень много. На гектар приходится вносить около 2—3 т неочищенного инокулята, а получить такие количества методом горшечной культуры растения-хозяина практически невозможно. Даже при работе на небольших опытных делянках для получения хорошего результата следует вносить ценный инокулят очень аккуратно. Рассмотрим один пример такого рода.
В опытах с красным клевером (Trifolium pratense) на Ротам- стедской станции в 1979 г. было проведено сопоставление четырех способов инокуляции. Для заражения использовали неочищенные препараты (растение-хозяин с почвой), содержащие эндофиты двух типов. Инокулят вносили: 1) под семена в борозды; 2) разбрасыванием, с заделкой граблями вместе с семенами; 3) в форме многосеменных гранул объемом около 1 см3. По четвертому методу, называемому «мокрым высевом», неочищенный инокулят обогащали, отмывая его на сите, суспендировали в 4 %-ном растворе метилцеллюлозы вместе с пророщенными семенами и вносили эту кашицу в борозды. Через девять, месяцев выяснилось, что второй метод дает плохие результаты, так как BA-микориза образовывалась всего у 5—10% растений — примерно у такого же их числа, как и в контроле без: инокуляции, когда она формировалась при участии природных эндофитов почвы. При внесении гранул микориза образовывалась чаще, приблизительно в 25% случаев, но наилучшие результаты были получены при внесении инокулята в борозды или при «мокром высеве». И в том и в другом случае микориза формировалась у большинства растений (65—70%).
Мокрый высев, по-видимому, наиболее удобен для проведения инокуляции в полевых условиях, так как при этом нужно- меньше препарата, чем при его внесении другими способами. Кроме того, в метилцеллюлозный гель можно добавлять и другие микроорганизмы, например Rhizobium. Использование гранул также имеет свои преимущества, поскольку с семенами и инокулятом можно вносить одновременно большие количества- малорастворимых веществ, например извести (Hayman et al.,. 1981).

