В любом микробиологическом процессе ключевую роль играет культура используемых микроорганизмов. В промышленной микробиологии широко применяются плесневые грибы, дрожжи, актиномицеты, бактерии и водоросли в виде чистых или смешанных культур. В традиционных процессах ферментации предпочтение обычно отдается смешанным культурам, а в большинстве современных ферментационных процессов — монокультурам, выращиваемым в асептических условиях. Говорить об идеальных культурах можно лишь в самых общих чертах. Следует отдавать себе отчет в том, что идеального микроорганизма не существует, а разнообразие продуктов, которые можно получать с помощью микроорганизмов, определяется разнообразием самих микроорганизмов и их субстратов. Впрочем, возможно, когда-нибудь мы и сумеем создавать такие идеальные микроорганизмы с помощью генетической инженерии и тем самым опровергнем высказанное выше утверждение. Большинство используемых сегодня культур получено из природных источников; однако эти культуры были затем улучшены или путем выращивания в условиях, характерных для данного процесса (для повышения выхода биомассы и первичных метаболитов), или с помощью мутагенеза (для производства вторичных метаболитов).
Приведем основные уравнения, описывающие рост микроорганизмов, в частности одноклеточных, в ферментерах и в других микробиологических реакторах. Для выращивания любой культуры необходимы: 1) жизнеспособный посевной материал; 2) источники энергии и углерода; 3) питательные вещества для синтеза биомассы; 4) отсутствие ингибиторов роста; 5) соответствующие физико-химические условия.
Если все эти требования выполнены, то скорость роста (увеличения биомассы) одноклеточных микроорганизмов с бинарным делением, размножающихся в условиях хорошо перемешиваемой периодической культуры, будет пропорциональна концентрации микробной биомассы, т. е.
![]()
где dx/dt- скорость роста, μ-коэффициент пропорциональности, обычно называемый удельной скоростью роста, х— концентрация биомассы (на сухой вес). Если μ— постоянная величина, уравнение (1) можно преобразовать и проинтегрировать:
![]() (2)
(2)
где Xo — концентрация микробной биомассы в момент времени /=0, t — время. Уравнение (2) можно переписать в виде:
![]() (3) , откуда
(3) , откуда ![]() (4)
(4)
Если построить график зависимости Inx от времени, то мы получим прямую с наклоном μ. Такой рост называют экспоненциальным или логарифмическим; он имеет место тогда, когда состав микробной биомассы и условия окружающей среды остаются постоянными. Приведенные выше уравнения применимы и к смешанным культурам, в которых одноклеточные организмы равномерно распределены в культуральной среде.
При описании роста микроорганизмов с бинарным делением в периодических культурах широко используется величина, характеризующая время удвоения биомассы. Связь между удельной скоростью роста μ и временем удвоения биомассы ty можно 'найти из уравнения (3), заменив х на 2x0, a t — на ty:
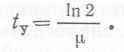 (5)
(5)
- 10.2.1. Эффективность роста: коэффициент выхода биомассы
При любой количественной оценке роста микроорганизмов и/или синтеза конечного продукта необходимо связать образование микробной биомассы и продуктов с расходованием субстратов и питательных веществ. Для описания соотношения между ростом микроорганизмов (в расчете на сухой вес) и потреблением углеродного энергетического субстрата были введены понятия урожая бактериальной культуры и выхода биомассы (AIonocK 1942). В математической форме коэффициент выхода микробной биомассы Yχ∕s можно представить следующим образом:
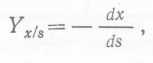 (6)
(6)
где ds — бесконечно малое уменьшение концентрации субстрата^ соответствующее бесконечно малому увеличению концентрации микробной биомассы dx. Знак минус указывает, что знаки изменения XHS противоположны. При постоянных условиях роста коэффициент выхода остается постоянным, т. е. если Xo и So — 'Концентрации субстрата и биомассы в момент времени to, а х и s — в момент I, то:
![]() (7)
(7)
В общем случае коэффициент выхода биомассы является переменной величиной, зависящей от условий культивирования. Вариабельность этого коэффициента очень важна с точки зрения оптимизации процесса. Понятие коэффициента выхода можно распространить на все разнообразие питательных веществ, используемых растущими микроорганизмами, и на все получающиеся продукты. Кроме того, при оценке относительной эффективности биохимических путей, лежащих в основе роста и метаболизма микроорганизмов, широко применяют понятия молярного урожая биомассы и выхода, когда учитывается число электронов, поступающих от субстратов, и суммарное количество потребляемой энергии.
Когда микроорганизмы растут на хорошо растворимых субстратах, коэффициент выхода и коэффициент конверсии совпадают; однако при росте на плохо растворимых и несмешиваю- щихся субстратах они могут заметно различаться. Коэффициент конверсии можно определить как количество микробной биомассы, образующейся на единицу массы субстрата.
Для описания процесса образования какого-либо продукта микроорганизмом, растущим на данном субстрате, можно воспользоваться уравнениями, аналогичными (6) и (7):
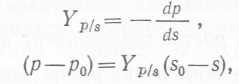 (8), (9)
(8), (9)
где Yp∕s — коэффициент выхода продукта, dp — бесконечно малое увеличение концентрации продукта, ро и р — соответственно исходная концентрация продукта и концентрация его в момент времени t.
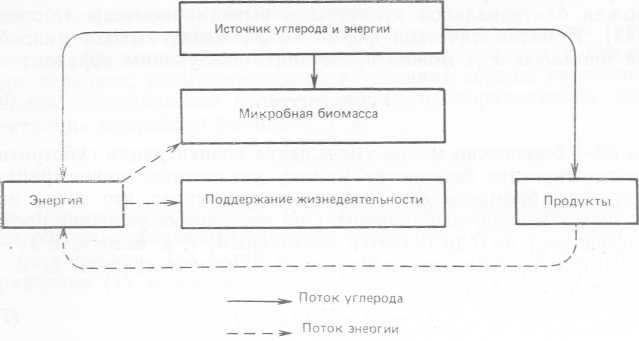
Рис. 10.1. Потоки углерода и энергии при гетеротрофнОхМ росте микробов и образовании продукта.
Для роста любого микроорганизма необходимы источники углерода и энергии. В случае гетеротрофных микроорганизмов это одно соединение или смесь углеродсодержащих соединений, которые удовлетворяют обе эти потребности. У автотрофных микроорганизмов углеродные и энергетические субстраты различаются. Для гетеротрофных микроорганизмов и коэффициент выхода биомассы, и коэффициент выхода продукта зависят от распределения энергии и углерода между процессами анаболизма и катаболизма. На рис. 10.1 представлена диаграмма распределения потоков энергии и углерода при росте гетеротрофных микроорганизмов и образовании ими соответствующего продукта. Коэффициенты выходов зависят от природы источника углерода и энергии, а также от биохимических особенностей данного микроорганизма; когда источник энергии и углерода подавляет рост, коэффициенты выхода зависят также и от его концентрации. В случае источника углерода и энергии с относительно высоким содержанием углерода (по сравнению с другими элементами) и, следовательно, с высокой энергетической константой при аэробном окислении наблюдается нарушение равновесия между высвобождением энергии и потреблением углерода; это ограничивает максимальный коэффициент выхода биомассы.
К этой категории углеродных энергетических субстратов относятся углеводороды. Избыточная энергия, высвобождаемая при их использовании, рассеивается в виде тепла и приводит к необходимости охлаждения микробиологических реакторов.
Скорость потребления определенного субстрата растущими культурами часто представляют в виде: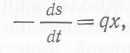 (10)
(10)
где q — метаболический коэффициент, который очень широко используется в микробиологии, особенно для кислорода и углеродных энергетических субстратов. Подставив в это уравнение выражение для х из уравнения (1), получим: 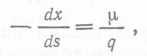 (11) откуда с помощью уравнения (6) имеем:
(11) откуда с помощью уравнения (6) имеем: 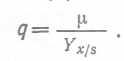 (12).
(12).
- 10.2.2. Кинетика роста и образования продукта
Экспоненциальная модель, описываемая уравнением (1), представляет собой лишь одну из нескольких относительно широко распространенных моделей роста микроорганизмов; каждая из таких моделей применима к специфическим физическим условиям или той или иной морфологии биомассы. Другими альтернативными моделями роста являются линейная модель и модель кубического корня. Первая из них относится к случаю, когда р®ст лимитируется диффузией субстрата или какого-либо питательного вещества. Вторая модель часто применяется при описании образования осадков (в случае плесневых грибов) или бактериальных хлопьев, которые разрастаются только по периферии. На самом деле она представляет собой комбинацию модели экспоненциального роста и модели, в которой лимитирующим фактором является перенос вещества. Модель кубического корня адекватно описывает образование мицелиальных осадков в периодической культуре, однако малопригодна для случая непрерывной культуры, поскольку не учитывает разрушение хлопьев в биореакторе под действием гидродинамических сил.
Если для периодической культуры наблюдается экспоненциальный рост, то это означает, что для широкого круга субстратов и в широком диапазоне их концентраций скорость роста фактически не зависит от концентрации субстрата. В этом случае процесс роста следует кинетике нулевого порядка и можно ожидать, что потребление субстрата будет подчиняться следующему уравнению ферментативной кинетики: ![]() (13), где qm— максимальный метаболический коэффициент при s^>Ks> Ks — константа насыщения, эквивалентная константе Михаэлиса—Ментен в ферментативной кинетике. Подставив вместо q и qm выражения, полученные из (12), мы придем к хорошо известному соотношению Моно:
(13), где qm— максимальный метаболический коэффициент при s^>Ks> Ks — константа насыщения, эквивалентная константе Михаэлиса—Ментен в ферментативной кинетике. Подставив вместо q и qm выражения, полученные из (12), мы придем к хорошо известному соотношению Моно: 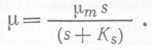 (14).
(14).
График этой функции представлен на рис. 10.2. Соотношение Моно широко используется не только потому, что дает универсальное описание кинетики роста микроорганизмов, но и благодаря своей простоте.
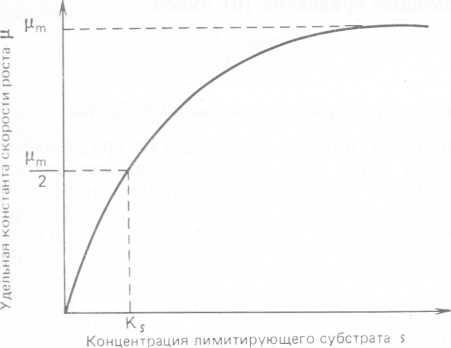
Рис. 10.2. Графическое представление соотношения Моно, описывающего зависимость удельной константы скорости роста от концентрации лимитирующего субстрата.
Для оценки μm и Ks (последняя из этих величин обратно пропорциональна сродству микроорганизмов к определенному субстрату) уравнение (14) можно преобразовать следующим образом: 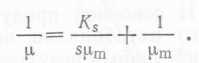
Таким образом, график зависимосоти l∕μ от 1/s (т. е. график Лайнуивера — Бэрка) является прямой и пересекает ось абсцисс в точке —Ks, а ось ординат — в точке μm. Данных о значениях константы насыщения Ks очень немного. Для углеродных энергетических субстратов и для минеральных питательных веществ значение Ks обычно составляют ~10-s М, а для кислорода ~ IO-6—10~5 М.
Рост микроорганизмов (прирост биомассы) в промышленной установке можно описать с помощью уравнений (1), (14) и (7), к которым нужно еще добавить уравнения, описывающие потоки в реакторе:
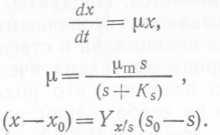
Если при этом происходит образование какого-то продукта, то нужно использовать еще и уравнение (9):![]()
Однако образование микробных продуктов отнюдь не обязательно связано с ростом. Поэтому, прежде чем применять те или иные кинетические уравнения для анализа процессов в реакторе, необходимо установить, какая именно взаимосвязь существует между образованием продукта и ростом микроорганизмов.
Пожалуй, наиболее полезная классификация процессов образования продукта в периодических культурах была предложена более двадцати пяти лет назад Гэйденом (Gaden, 1959). Согласно этой классификации, все процессы можно разделить на три основные группы, которые обозначают как процессы типа I, II, III.
В процессах типа I основной продукт образуется в ходе реакций первичного энергетического метаболизма, когда между потреблением субстрата и образованием продукта существует постоянное стехиометрическое соотношение, метаболические пути представляют собой цепь последовательных реакций, а скорость любого процесса имеет один максимум, обычно совпадающий с максимумом для других процессов. Типичными примерами процессов типа 1 служат образование этанола, глюконовой и молочной кислот из глюкозы, а также, разумеется, образование» микробной биомассы.
В процессах типа II основной продукт образуется в ходе реакций энергетического метаболизма непрямым путем: либо в ходе побочных реакций, либо в результате последующего взаимодействия между прямыми продуктами метаболизма. Кинетические кривые имеют сложный вид, причем максимумы скоростей различных процессов не совпадают. Типичными примерами процессов типа II являются образование лимонной и итаконовой кислот, а также некоторых аминокислот.
К процессам типа III относятся те, в которых основной продукт образуется не в результате энергетического метаболизма, а независимым путем. В таких процессах рост и метаболическая активность достигают максимума на ранних этапах периодического процесса, а максимум образования интересующего нас продукта приходится на более поздние стадии, когда окислительная активность снижается. Продукты, образующиеся в ходе таких процессов, называются вторичными метаболитами; это, например, антибиотики пенициллин и стрептомицин.
Три этих типа процессов схематически представлены на рис. 10.3. Совершенно очевидно, что подобная классификация была принята только из соображений удобства и не является ни совершенной, ни всеобъемлющей. Существуют процессы с совсем иными характеристиками, протекающие в средах разного состава и при разных условиях. Отметим, что замена штамма мало сказывается на общем характере кинетических кривых. Впрочем, известны и исключения, особенно в процессах типа III. Это наводит на мысль, что по мере усложнения биосинтетических реакций, в ходе которых образуется данный продукт, данный тип процессов можно подразделить на более мелкие классы.
Обратимся теперь к непрерывным микробиологическим процессам. Чтобы обеспечить протекание процесса в оптимальных условиях стационарного состояния, необходимо располагать соответствующими кинетическими данными. Если в условиях периодической культуры процесс относился к типу I, то необходимые условия для непрерывного культивирования можно теоретически определить прямо из данных для периодического процесса. В целом процессы такого типа лучше всего протекают в стационарных условиях в одностадийном биореакторе с полным перемешиванием. Те процессы, для которых в условиях периодической культуры характерны кинетики типа II или III, при непрерывном культивировании, по всей видимости, лучше всего осуществлять в многостадийных последовательных биореактоpax. В этом случае можно так подобрать условия, чтобы скорость роста и связанный с ним энергетический метаболизм достигали максимума на одной стадии, а образование продукта — на другой. Прежде чем переводить такие процессы из периодических в непрерывные, очень важно выяснить соотношения между скоростями отдельных процессов и основными контролируемыми переменными.
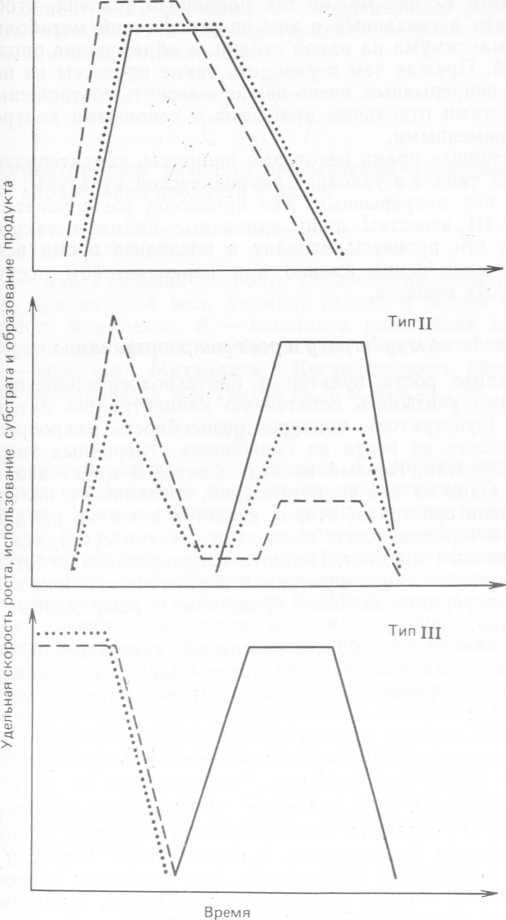
Рис. 10.3. Кинетические кривые для периодического процесса ферментации, предложенные Гэйденом (Gaden, 1959). Штриховые кривые — рост, пунктирные— использование субстрата, сплошные — образование продукта.
В настоящее время некоторые процессы, характеризующиеся кинетикой типа I в условиях периодической культуры, осуществляются как непрерывные; для процессов же с кинетикой типа II и III известны лишь единичные примеры такого рода. Впрочем, эти процессы находят в последнее время все более широкое применение именно при периодическом поступлении питательных веществ.
- 10.2.3. Сродство к субстрату и рост микроорганизмов
При анализе роста культур в биотехнологических процессах необходимо учитывать остаточную концентрацию питательных веществ (субстратов), конкурентоспособность микроорганизмов- и особенности их роста на смешанных углеродных энергетических субстратах. Первый из этих факторов имеет два важных аспекта. Один из них экономический, связанный с полнотой использования субстрата; второй касается качества продукта, его чистоты и нетоксичности, поскольку остатки субстрата попадают в конечный продукт. Полнота использования субстрата, который является лимитирующим в периодической или непрерывной культуре, определяется сродством к нему данных микроорганизмов.
По-видимому, наиболее известной кинетической моделью ферментативных процессов является модель Михаэлиса — Ментен. Реакция фермента с субстратом описывается следующим уравнением: 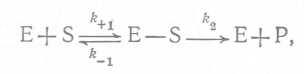 (16),
(16),
где E — фермент, S — субстрат, E—S - фермент-субстратный комплекс, P — продукт, ⅛+ι — константа скорости первой реакции в прямом направлении, k-↑— константа скорости первой реакции в обратном направлении, k2— константа скорости второй реакции, которая считается необратимой. Изменение концентрации фермент-субстратного комплекса описывается следующим уравнением: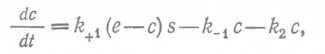 (17)
(17)
где е — концентрация фермента, с — концентрация фермент-субстратного комплекса, s— концентрация субстрата.
Если s3>e, то для стационарного состояния 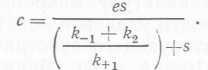 (18)
(18)
Для ферментативной реакции, описываемой уравнением (16), скорость образования продукта v равна
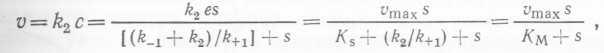 (19)
(19)
где υmax — максимальная скорость образования продукта, т. е. скорость, при которой весь фермент входит в состав фермент- субстратного комплекса, Ks — константа равновесия для реак¬ции диссоциации фермент-субстратного комплекса, KM,=KS + +k2∕k+↑ — константа Михаэлиса. Когда скорость образования продукта определяется константой k2, т. е. ⅛2⅛⅛+ι, то![]() (20)
(20)
При выполнении условия (20) величина Км обратно пропорциональна сродству фермента к субстрату: чем меньше Км, тем выше сродство. Если мы заменим величины V, Omax и Км В (19) на μ, μm и Ks соответственно, то получим соотношение Моно (14), которое уже было введено нами ранее и графически представлено на рис. 10.2. Микроорганизмы, для которых кривая зависимости между μ и s имеет большой начальный наклон, обладают высоким сродством к лимитирующему субстрату. И наоборот, микроорганизмы, для которых эта кривая пологая, обладают низким сродством, и в таких культурах будут наблюдаться более высокие остаточные концентрации субстрата.
При непрерывном культивировании в хемостате конкуренция между двумя видами микроорганизмов за один лимитирующий субстрат определяется обычно именно их сродством к этому субстрату, а не максимальной удельной константой скорости роста μm. При стационарном режиме в простом хемостате без повторного использования биомассы концентрация лимитирующего субстрата равна 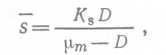 (21),
(21),
где D — скорость разбавления. Из этого соотношения видно, что концентрация лимитирующего субстрата в стационарном состоянии зависит от скорости образования клеток за счет роста, которая в точности равна скорости разбавления, и от параметров, характеризующих рост данного микроорганизма. Ясно, что параметры, характеризующие рост разных микроорганизмов на одном и том же субстрате, вряд ли будут одинаковы. Предположим, что мы имеем культуру микроорганизмов А и В. По-, строив график зависимости удельной константы скорости роста μ от концентрации лимитирующего субстрата s, мы получим два разных случая (рис. 10.4, А и Б).
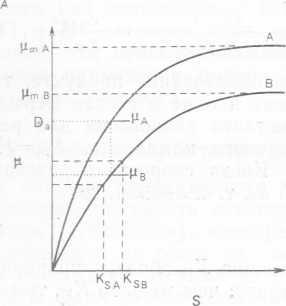
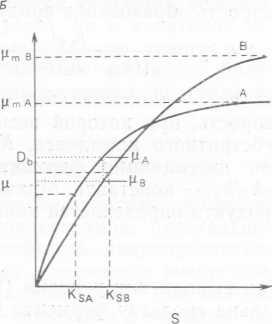
В ситуации, изображенной на рис. 10.4, А, для микроорганизма А при любой данной скорости разбавления (скорости роста) будет наблюдаться более низкая концентрация лимитирующего субстрата, чем для микроорганизма В при той же скорости разбавления (скорости роста). Следовательно, в хемостате, где рост двух видов микроорганизмов А и В лимитируется одним и тем же субстратом, А всегда будет вытеснять В, поскольку последний не способен сохранять достаточно высокую скорость роста при той концентрации субстрата, которая наблюдается для вида А, даже если максимальная удельная скорость роста для В не была превышена. Напротив, в ситуации, изображенной на рис. 10.4, Б, относительная конкурентоспособность двух видов микроорганизмов, растущих в хемостате на одном лимитирующем субстрате, будет зависеть от степени разбавления. Подобный анализ конкурентного роста в хемостатах можно распространить и на многокомпонентные смешанные микробные популяции, однако такая экстраполяция не всегда оказывается возможной, поскольку в сложных смешанных культурах могут существовать несколько другие взаимоотношения. Кроме того, в смешанных культурах, применяющихся в биотехнологических процессах, использовать основной субстрат обычно может только один вид микроорганизмов из всех присутствующих, а другие лишь модифицируют среду с тем, чтобы оптимизировать рост основного вида, особенно если этот последний слишком прихотлив.
Вообще говоря, любой гетеротрофный микроорганизм способен расти на самых разных субстратах — источниках углерода и энергии. Большинство углеводов служат субстратом для очень широкого спектра микроорганизмов; для углеводородов этот спектр уже; на некоторых синтетических органических соединениях способны расти лишь очень немногие микроорганизмы, а большинство таких соединений вообще не могут служить субстратами. Один из основных вопросов, касающихся использования смешанных субстратов данным гетеротрофным штаммом, состоит в том, как расходуются эти субстраты — одновременно (конкурентным образом) или последовательно.
Для периодической чистой культуры микроорганизмов, растущей на смеси двух субстратов, обычно наблюдается так называемый диауксичный рост. При этом на кинетической кривой выявляются две четко различимые экспоненциальные фазы, разделенные интервалом, на котором скорость роста проходит через минимум. Такой характер роста обусловлен последовательным использованием субстратов. Диауксичный рост на сахарах впервые наблюдал Моно в 1942 г., однако подобная картина имеет место и для других субстратов. Диауксичный рост характеризуется тем, что микроорганизмы не способны синтезировать ферменты, необходимые для метаболизма второго углеродного субстрата, несмотря на его наличие, т. е. индукции не происходит даже в присутствии индуктора. Это явление получило название катаболитной репрессии.
При росте периодических культур на двухкомпонентном субстрате наблюдаются и другие явления. Субстраты могут использоваться независимо, так что потребление одного не сказывается на потреблении другого. В таком случае они могут метаболизироваться одновременно, и при этом иногда наблюдается даже стимуляция роста. Возможны ситуации, когда ферменты, необходимые для метаболизма второго субстрата, синтезируются, но их активность ингибируется, и тогда субстраты используются последовательно, но рост, строго говоря, не является диауксичным. В случаях двухкомпонентных смесей последовательно используемых субстратов тот субстрат, который метаболизируется быстрее, обычно расходуется первым, хотя известны и исключения. Однако в каждой конкретной двухкомпонентной смеси субстратов быстрее может использоваться то один, то другой субстрат в зависимости от того, какой микроорганизм растет на этой смеси.
В связи со всем сказанным выше важно отметить, что многие культуральные среды, применяющиеся в промышленных биотехнологических процессах, представляют собой сложные смеси субстратов и их состав влияет на производительность процесса. Характер потребления смешанных субстратов в непрерывных проточных культурах не всегда можно предсказать исходя из результатов, полученных на экспериментальных установках с периодическими культурами, растущими на таких же смесях субстратов. В непрерывных проточных системах компоненты смеси могут потребляться одновременно, даже если в периодической культуре того же микроорганизма они использовались последовательно. Особый интерес представляет следующее наблюдение, сделанное на хемостатной культуре. Оказалось, что в двухкомпонентной смеси субстратов критическая скорость разбавления для полного использования того компонента, который обеспечивает более медленный рост периодической культуры, может значительно превышать нормальную скорость вымывания. Кроме того, применяя двухкомпонентные смеси субстратов в непрерывной культуре, можно контролировать поступление углерода в те или иные метаболические пути, изменяя состав субстратной смеси или условия протекания процесса, и регулировать тем самым количество образующейся энергии или какого-либо продукта.
- 10.2.4. Стабильность культуры и требования, предъявляемые ею
Пригодность выбранной культуры для использования ее в данном промышленном микробиологическом процессе часто не оценивается и становится критическим фактором, когда дело доходит до практического ее применения. Совершенно очевидно, что, вообще говоря, самое главное — это генетическая стабильность культуры, но обсуждение вопросов этого круга выходит за рамки данной главы. Здесь в общих чертах мы рассмотрим физические, химические и пищевые факторы, а также требования, предъявляемые микроорганизмами. Основные условия, необходимые для роста микроорганизмов, были перечислены выше, но всегда остается вопрос: обеспечивают ли выбранные условия оптимальный рост и/или образование продукта? К каким последствиям могут привести изменения этих условий, в частности, как это скажется на продуктивности процесса?
Теплопередача и перенос веществ в биореакторах увеличиваются за счет диссипации энергии в системе, обычно в результате интенсивного механического перемешивания содержимого реактора вращающимися мешалками. Такие мешалки оказывают двоякое действие: способствуют диспергированию мелких пузырьков воздуха в толще культуральной среды и обеспечивают перемешивание, необходимое для минимизации концентрационных градиентов, эффективного охлаждения реактора и уменьшения выделения пузырьков воздуха. Однако возникающие при таком перемешивании гидродинамические силы могут повреждать клетки, особенно в случае волокнистых плесневых грибов,, актиномицетов, бактерий, имеющих жгутики, фимбрии, а также хрупких клеток тканей, выращиваемых в суспензионной культуре. Образование специфического продукта может зависеть от морфологии плесневого гриба; по этой причине явно непригодны для использования в промышленных процессах те штаммы,, морфология которых значительно изменяется при изменении условий культивирования. Кроме того, следует избегать таких условий проведения процесса, когда мицелий плесневых грибов повреждается.
Ранее считалось, что вероятность повреждений бактериальных клеток определяется скоростью вращения лопастей мешалки. Однако, согласно наиболее правдоподобной современной гипотезе о механизме повреждений, они обусловлены кавитационными явлениями в вихрях, возникающих сразу за лопастями мешалок. Вопрос о повреждении бактериальных клеток в интенсивно перемешиваемых культурах все еще не решен. Если анализировать свойства суспензий бактериальных клеток в потоке, используя для определения гидродинамических характеристик любой отдельной бактериальной клетки предположение, что она представляет собой сферическую частицу соответствующего диаметра, то оценить силы, вызывающие механическое повреждение клетки, не удается. Подобный подход не учитывает наличие жгутиков или фимбрий: они — особенно это касается жгутиков — могут в несколько раз превосходить по длине самые крупные несущие их бактериальные клетки. Вполне возможно, что именно разрыв этих структур и последующее вытекание клеточного содержимого ответственны за разрушение клеток при интенсивном перемешивании бактериальных культур. Заметим, что значительная часть исследований по генетической инженерии направлена на осуществление передачи специфических свойств от различных бактерий к Escherichia coli, которая не особенно пригодна для использования ее в процессах с интенсивным перемешиванием именно из-за наличия фимрий и жгутиков и, следовательно, подверженности механическим повреждениям.
Если среди плесневых грибов и бактерий, вероятно, можно отобрать выносливые микроорганизмы, более или менее пригодные для использования их в условиях, характерных для интенсивных процессов, то культуры тканей, в частности культуры клеток млекопитающих, нуждаются в особых биореакторах, конструкция которых учитывает присущую этим клеткам хрупкость.
Если говорить о других условиях среды, то совершенно очевидно, что наиболее пригодны для использования в промышленности микроорганизмы с широкими диапазонами оптимумов pH, концентрации растворенного кислорода и температуры. Впрочем, частично эти трудности позволяют обойти техническое усовершенствование установок и улучшение контроля за условиями в них. Отметим, однако, что в некоторых новых конструкциях промышленных биореакторов, в частности в колонных аппаратах и в циклических системах под давлением, создаются значительные градиенты как физических параметров, так и концентраций питательных веществ. Если экономические преимущества подобных систем над более привычными достаточно велики, то для достижения высокой экономичности процесса в целом крайне важно, чтобы в нем принимали участие микроорганизмы, сохраняющие высокую продуктивность в быстро меняющихся условиях.
В заключение следует отметить, что в последнее время не уделялось достаточно внимания использованию в промышленных биотехнологических процессах смешанных, неприхотливых культур определенного состава. Впрочем, даже в процессах, осуществляемых при участии таких культур, значительные изменения условий могут приводить к нарушению равновесия в соотношении между разными микроорганизмами, составляющими эти смешанные популяции.

