Любой процесс, в котором участвуют микроорганизмы, независимо от способа его осуществления можно отнести к одной из двух категорий, определяемой характером поставленной задачи: 1) получение нужных микроорганизмов; 2) осуществление определенных химических превращений.
Последний тип процессов можно подразделить еще на два класса: а) получение нужного конечного продукта; б) переработка сырья.
Все процессы, осуществляемые с целью химического превращения, обладают одной общей особенностью, резко отличающей их от процессов, цель которых — получение микробной биомассы: микроорганизмы, осуществляющие данное превращение, не обязательно должны при этом находиться в состоянии роста. Этот аспект нередко недооценивается, хотя общеизвестно, что химические превращения могут осуществляться даже микроорганизмами, уже потерявшими жизнеспособность. За такие превращения ответственны клеточные ферменты. Совершенно очевидно, что для контролируемого осуществления многих превращений с самым высоким выходом лучше всего использовать иммобилизованные покоящиеся клетки или иммобилизованные ферменты, выделенные из этих клеток. Роль таких систем при проведении некоторых превращений в промышленных масштабах становится все больше, однако при этом возникают проблемы, связанные со стабильностью подобных биокаталитиче- ских систем, регенерацией кофакторов и с диффузией. Наиболее широко применяемой в промышленных масштабах технологией остается химическое превращение, осуществляемое растущими культурами микроорганизмов. C биохимической точки зрения микробиологические процессы можно подразделить на две основные категории: катаболические, в ходе которых сложные соединения расщепляются до более простых, и биосинтетические, в ходе которых сложные соединения образуются из более простых.
В основе любого процесса, протекающего при участии микроорганизмов, лежит та или иная реакция или последовательность реакций. Тем не менее при реализации этого процесса в промышленном масштабе лимитирующим фактором, как правило, оказывается не кинетика этой реакции или последовательности реакций, а другой, на первый взгляд менее существенный фактор, который и определяет возможности использования данного процесса в промышленности.
Ключевыми факторами, влияющими на экономичность процесса в биореакторе, являются производительность и степень превращения, а они в свою очередь определяются теми физическими факторами, от которых зависит теплопередача и перенос массы. К этим факторам относятся: 1) гидродинамические свойства суспендированных микроорганизмов; 2) реологические свойства культуральных сред; 3) электрокинетические свойства микроорганизмов; 4) давление; 5) поверхностные и пристеночные эффекты, а также эффекты, возникающие на границе раздела фаз; 6) эффекты, связаные с наличием нескольких фаз в потоке; 7) флотационные, седиментационные и сегрегационные эффекты.
Интересно было бы обсудить, какую же реальную информацию о любом из этих факторов и/или их влиянии на рост микроорганизмов или на образование продукта могут дать микробиологические исследования процессов, протекающих с участием микроорганизмов.
- 10.3.1. Классификация биореакторов и их производительность
Химические реакции можно классифицировать по-разному. Если иметь в виду выбор конструкции реактора, то, вероятно, наиболее полезной будет классификация, основанная на том,, в однофазной или в многофазной среде протекает данная реакция. Реакции, идущие в однофазной среде, называются гомогенными, а в многофазных —гетерогенными. Для большинства ферментативных реакций и многих реакций, протекающих при участии микроорганизмов, подобная классификация не является однозначной, поскольку они занимают весьма обширную' область между гомогенными и гетерогенными реакциями. Чтобы упростить классификацию биохимических реакций, условились считать реакционные системы, в которых существуют только микроградиенты концентраций, гомогенными, а системы с макроградиентами— гетерогенными. Следовательно, для биохимических реакций понятия гомогенности и гетерогенности не совпадают с таковыми для химических реакций.
Любую систему, у которой существует ограничивающая ее поверхность и в которой протекают биохимические реакции, можно назвать биореактором. Промышленный биореактор — это емкость, в которой осуществляются рост микроорганизмов и/или различные химические превращения.
Промышленные биореакторы могут работать в периодическом режиме, периодическом режиме с доливом субстрата, полунепрерывном (полупериодическом) и непрерывном проточном режимах. Исторически в промышленности утвердился периодический способ работы при осуществлении химических превращений и полунепрерывный — при получении микробной биомассы. В последнее время для химических превращений стали применять реакторы с периодическим режимом и с доливом субстрата, а для получения микробной биомассы — реакторы, работающие в непрерывном проточном режиме. Традиционно биореакторы, работающие в непрерывном проточном режиме, использовались в промышленном масштабе только для аэробной переработки сточных вод и отходов (т. е. в процессах с самой большой пропускной способностью среди всех технологических операций), а также при производстве уксуса. За исключением этих двух случаев, биологическая промышленность проявляла исключительный консерватизм в том, что касалось перехода на непрерывную проточную технологию, причем без достаточных на то оснований.
Детальный анализ некоторых потенциальных режимов работы биореакторов указывает на превосходство проточного непрерывного режима. При работе по периодическому режиму в реактор загружают все необходимые компоненты (за исключением кислорода для аэробных процессов), ведут процесс до конца и собирают конечный продукт. Периодический режим с добавлением субстрата предусматривает периодическое или непрерывное введение субстрата без удаления конечного продукта, который собирают только по завершении процесса. При полунепрерывном ведении процесса, который называют также полупериодическим, по завершении начальной стадии в периодическом режиме реактор наполовину опорожняют, чтобы частично собрать продукт, а затем снова заполняют таким же объемом свежей среды и доводят процесс до конца; затем снова осуществляют ту же последовательность операций. Подобный подход направлен на лучшее использование производственной установки.
Сравним производительность реактора, работающего в периодическом и непрерывном проточном, с идеальным перемешиванием, режимах. Периодический процесс включает несколько этапов: подготовительный, лаг-период, фазу экспоненциального роста и период удаления продукта; с точки зрения производительности реактора важен только период экспоненциального роста. Время, необходимое для завершения цикла tц, можно представить как сумму продуктивного времени t и общего непродуктивного времени tн, т. е. ![]() (22)
(22)
Из уравнения (3), имея в виду, что для экспоненциального роста μ==μm, получаем 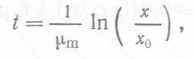 (23),
(23),
так что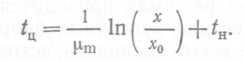 (24)
(24)
Для периодического процесса общая продуктивность равна суммарной продукции, деленной на полное время цикла. Суммарная продукция задается соотношением (7), но для таких периодических процессов, которые мы рассматриваем, остаточная концентрация субстрата s фактически равна нулю. Следовательно, суммарная продукция равна
![]() (25), производительность периодического процесса Pa составляет
(25), производительность периодического процесса Pa составляет 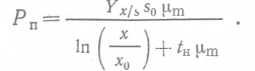 (26).
(26).
По определению производительность реактора (выход биомассы), работающего в непрерывном проточном режиме с идеальным перемешиванием, равна ![]() (27)
(27)
где х — концентрация биомассы в реакторе в стационарном состоянии. Если принять, что коэффициент выхода биомассы Yx∕s и концентрация субстрата в свежей среде S0 для периодического и непрерывного процессов одинаковы, а S — остаточная концентрация лимитирующего субстрата, то уравнение (27) имеет вид 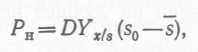 (28), откуда при s≪ s0 получаемPb = DYx,ss0. (29) .
(28), откуда при s≪ s0 получаемPb = DYx,ss0. (29) .
Следовательно, отношение производительностей равно 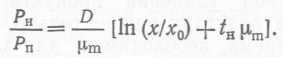 (30)
(30)
В реакторе, работающем в проточном непрерывном режиме с полным перемешиванием, максимальная скорость разбавления равна D = μm. Однако во избежание нестабильности на самом деле поддерживают скорость разбавления на уровне 0,8 μ∏b, и тогда 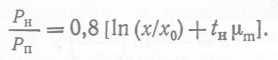 (31)
(31)
Графическое сопоставление продуктивности реактора в периодическом и непрерывном режимах приводится на рис. 10.5.
Рабочие характеристики проточных биореакторов непрерывного действия лучше всего оценивать исходя из расчета материального баланса по биомассе, лимитирующему субстрату и продукту. Используя самую приближенную классификацию проточных биореакторов непрерывного действия с суспензионными культурами, можно выделить два типа реакторов: реакторы с идеальным перемешиванием и проточные биореакторы в режиме полного вытеснения (реакторы поршневого типа). Биореакторы с идеальным перемешиванием могут работать как хемостаты или как турбидостаты. В хемостате поддерживается постоянная плотность микробной культуры за счет потребления лимитирующего субстрата или какого-либо иного питательного вещества, а в систему турбидостата входит светочувствительное устройство, которое измеряет оптическую плотность культуры и обеспечивает ее постоянство.
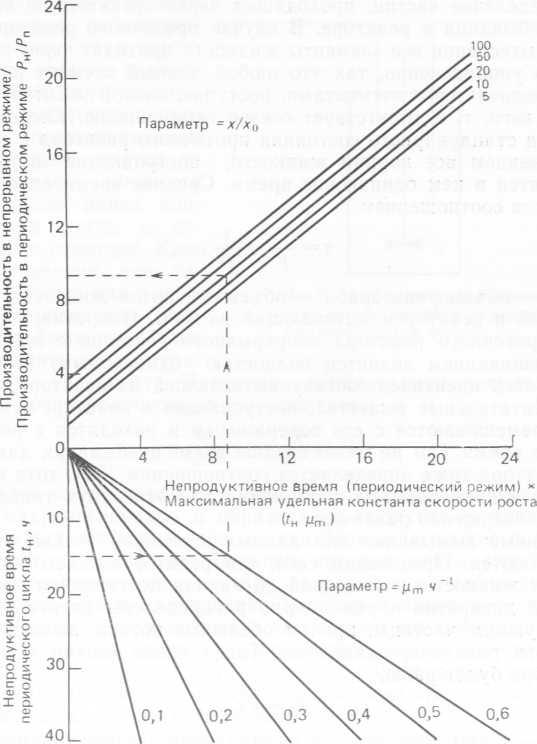
Рис. 10.5. Соотношение между образованием микробной биомассы в реакторе, работающем в непрерывном и периодическом режимах, для различных количеств посевого материала, максимальных удельных констант скорости роста и продолжительностей непродуктивного этапа периодического цикла; D = 0,8 μm для непрерывной системы (Aiba et al., 1973).
В промышленности, как правило, применяются реакторы, работающие в режиме хемостата, поэтому о турбидостатах мы далее говорить не будем.
Любой анализ производственных характеристик биореактора включает изучение свойств существующих в нем потоков, а также кинетики роста микроорганизмов и осуществляемых с их участием превращений. Для описания потока в проточном реакторе непрерывного действия удобнее всего использовать
распределение частиц, проходящих через реактор, по времени их пребывания в реакторе. В случае проточного реактора полного вытеснения все элементы жидкости проходят через реактор строго упорядоченно, так что любой данный элемент никак не перемешивается с элементами, поступающими в реактор до или после него, т. е. отсутствует осевое перемещение. Следовательно, для стационарного состояния проточного реактора с полным вытеснением все порции жидкости, поступающие в реактор, находятся в нем одинаковое время. Среднее время пребывания задается соотношением ![]() (32),
(32),
где V — объем реактора, F — объемный поток жидкости, поступающий в реактор и вытекающий из него. Напротив, содержимое проточного реактора непрерывного действия с идеальным перемешиванием является полностью однородным, а потому его состав идентичен составу вытекающей из реактора жидкости. Питательные вещества, поступающие в реактор, немедленно перемешиваются с его содержимым и находятся в реакторе разное время. Тем не менее среднее время пребывания для такого реактора тоже определяется соотношением (32), хотя кривые распределения времени пребывания для этих двух типов реакторов совершенно различны.
Кривые вымывания для данных реакторов также сильно различаются. Представим себе, что реактор каждого типа наполнен жидкостью, в которой до начала поступления новых ее порций дискретно и равномерно распределены инертные, несегрегирующие частицы, причем объемные потоки, выходящие из каждого реактора, одинаковы. Тогда число частиц в каждом реакторе будет равно 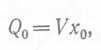 (33) , где V—объем жидкости, X0 — начальная концентрация. При поступлении в реактор новых порций чистой жидкости из него будет вытекать поток (обеспечивающий постоянство объема содержимого реактора), концентрация твердых частиц в котором будет неодинакова для разных типов реакторов. При этом число частиц, остающихся в реакторах, будет непрерывно уменьшаться.
(33) , где V—объем жидкости, X0 — начальная концентрация. При поступлении в реактор новых порций чистой жидкости из него будет вытекать поток (обеспечивающий постоянство объема содержимого реактора), концентрация твердых частиц в котором будет неодинакова для разных типов реакторов. При этом число частиц, остающихся в реакторах, будет непрерывно уменьшаться.
Для идеального проточного реактора с полным вытеснением концентрация частиц в вытекающей жидкости будет равна хо до тех пор, пока время вытекания t не станет равно времени пребывания τ; в этот момент х станет равным нулю. Число частиц, остающихся в реакторе, будет линейно уменьшаться во времени и при t=τ станет равным нулю. Для реальных проточных реакторов с полным вытеснением наблюдается несколько иная картина из-за осевого перемешивания и диффузии. Для реакторов с полным перемешиванием концентрация частиц в вытекающей жидкости всегда будет равна концентрации частиц в содержимом реактора. Кривая вымывания для таких реакторов, как и кривая распределения времени пребывания, будет представлять собой отрицательную экспоненту.
Рис. 10.6. Проточный биореактор непрерывного действия с полным перемешиванием (см. текст).
Изменение концентрации частиц и их числа в реакторе описываются уравнением 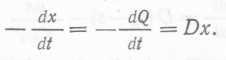 (34)
(34)
Используя соотношения для скорости вымывания, уравнения роста микроорганизмов и образования продукта, а также выражение для коэффициентов выхода биомассы, можно получить уравнения материального баланса, которые описывают работу идеального проточного реактора непрерывного действия. Для этого нужно найти соотношение, в котором накопление какого- либо продукта выражено через увеличение его количества благодаря входящему потоку, уменьшение из-за вытекающего потока, увеличение за счет роста или образования продукта в реакторе, уменьшение за счет использования в реакторе и увеличение за счет рециркуляции потока.
Уравнение материального баланса для биореактора, рабо-тающего в проточном режиме с идеальным перемешиванием без рецикла, т. е. обычного хемостата (рис. 10.6), где продуктом служит только микробная биомасса, выглядят следующим образом.
Для микробной биомассы
Накопление = Рост — Удаление
или для бесконечно малого интервала времени
![]() (35)
(35)
Для лимитирующего субстрата
Накопление = Поступление—Удаление—Использование
или для бесконечно малого интервала времени dt
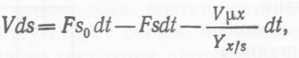 (36)
(36)
где V — постоянный объем жидкости в биореакторе, F — объемный поток жидкости, втекающий в биореактор и вытекающий из него, Yx∕s — коэффициент выхода микробной биомассы при росте на лимитирующем субстрате, х — концентрация биомассы в реакторе, Sо и s — соответственно концентрации лимитирующего субстрата в поступающем в биореактор растворе и в реакторе, μ — удельная константа скорости роста.
Разделив (35) и (36) на Vdt, получим 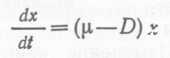 (37) и
(37) и 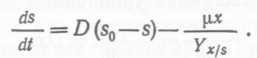 (38).
(38).
В стационарном состоянии dx/dt = Q и ds/dt=Q. Следовательно, ![]() (39), откуда
(39), откуда ![]() (40) , и таким образом
(40) , и таким образом 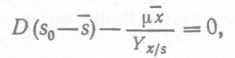 (41)
(41)
где х π s — соответственно концентрации микробной биомассы и лимитирующего субстрата в стационарном состоянии.
Соотношение Моно можно переписать следующим образом: 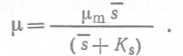 (42)
(42)
Отсюда можно получить выражение для концентрации лимитирующего субстрата в стационарном состоянии, заменив μ на D: 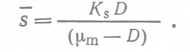 (21)
(21)
Концентрацию бактеральной биомассы в стационарном состоянии получим, заменив сначала в уравнении (41) μ на D, а затем подставив выражение (21) для S
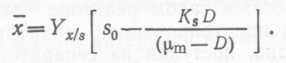 (43)
(43)
Производительность такой системы (выход микробной биомассы) в стационарном состоянии равна ![]() (27)
(27)
или, после подстановки выражения для х 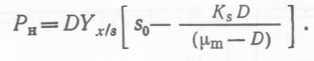 (44)
(44)
Графики зависимости х, s и Pa от скорости разбавления D, построенные в соответствии с соотношениями (43), (21) и (27), приведены на рис. 10.7.
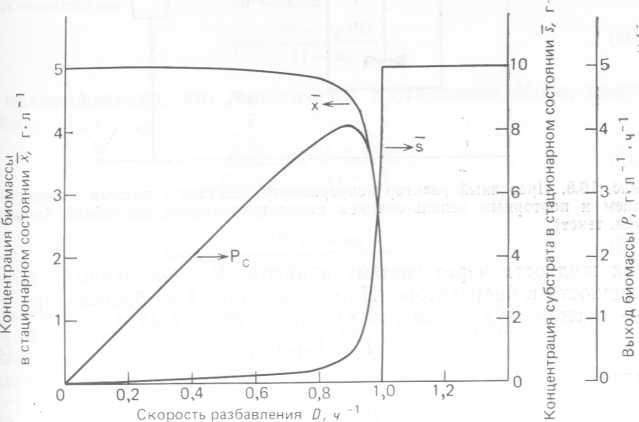
Рис. 10.7. Теоретическая зависимость концентрации биомассы, концентрации лимитирующего субстрата в стационарном состоянии, выхода микробной биомассы от скорости разбавления для простого хемостата (μtn=l,0 ч-1, Ks= = 0,1 г-л-1, 7x∕s=0,5, S0=IO г-л-*).
Найдем уравнения материального баланса для другой системы — проточного реактора непрерывного действия с полным перемешиванием, единственным продуктом которого является микробная биомасса; в таком реакторе для интенсификации процесса часть концентрированной микробной биомассы используется повторно, поступая из сепаратора, расположенного на выходе из реактора (это может быть седиментационный тэнк, применяемый при очистке сточных вод; центрифуга или система ультрафильтрации). В подобной системе, изображенной на рис. 10.8, скорость разбавления D равна F/V, где F — поток жидкости через систему в целом, V — постоянный объем жидкости в биореакторе.
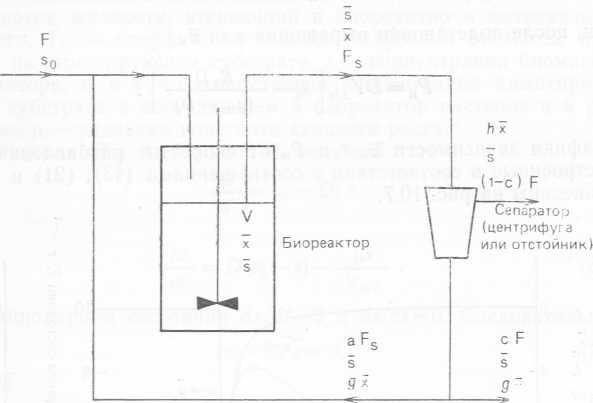
Рис. 10.8. Проточный реактор непрерывного действия с полным перемешиванием и повторным использованием концентрированной микробной биомассы (см. текст).
Поток, выходящий из биореактора (но не из системы в целом), можно представить в виде 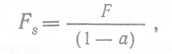 (45) или
(45) или 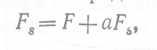 (46), где а — доля вытекающего из реактора содержимого, которая используется повторно. Если принять, что микробная биомасса становится более концентрированной в g раз, то количество биомассы, повторно используемой в биореакторе, будет равно aFsgx. Уравнение материального баланса по биомассе будет в этом случае иметь вид
(46), где а — доля вытекающего из реактора содержимого, которая используется повторно. Если принять, что микробная биомасса становится более концентрированной в g раз, то количество биомассы, повторно используемой в биореакторе, будет равно aFsgx. Уравнение материального баланса по биомассе будет в этом случае иметь вид
Накопление = Рост—Удаление + Повторное использование,
или для бесконечно мялпгп интепвяля впемени dt
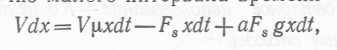 (47),
(47),
а соответствующее уравнение по лимитирующему субстрату —
Накопление = Поступление + Повторное использование—Удаление— — Расходование,
или для малого интервала времени
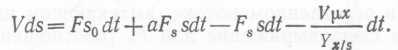 (48)
(48)
Подставив в (47) выражение для Fs и разделив на Vdt, мы получим для стационарного состояния (при котором dx/dt=G): 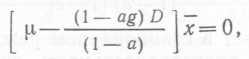 (49)
(49)
В предположении, что выполняется соотношение Моно, получаем 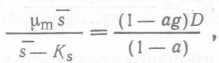 (51) или
(51) или 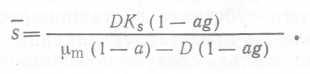 (52).
(52).
Подставив в (48) выражение для Fs и разделив на Vdt, мы получим для стационарного состояния (при котором ds∕dt=Q) уравнение, которое представляет собой уравнение для обычного хемостата (41). Подставив в него выражение для $, будем иметь 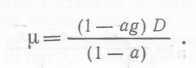 (53)
(53)
Для определения концентрации микробной биомассы hx в осветленном потоке, вытекающем из сепаратора, нужно найти уравнение материального баланса по биомассе в сепараторе. В предположении, что сепаратор работает в стационарном режиме, т. е. биомасса в нем не накапливается, уравнение материального баланса для биомассы можно записать следующим образом:
Поступление — Повторное использование + Концентрированные отходы + Осветленные отходы
или
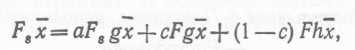 (54)
(54)
где с — доля потока F, вытекающего из системы в виде концентрированных отходов, h — концентрационный коэффициент по биомассе в осветленном потоке, вытекающем из сепаратора.
Если реактор работает в стационарном режиме, то его производительность (но не производительность системы в целом) по биомассе будет равна 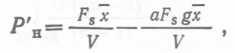 (56) или, после замены Fa,
(56) или, после замены Fa, 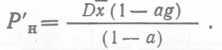 (57).
(57).
Зависимость между производительностью P'κ, концентрацией микробной биомассы в стационарном состоянии х, концентрацией лимитирующего субстрата в стационарном состоянии $ и скоростью разбавления представлена на рис. 10.9. Из этих соотношений с очевидностью следует потенциальная возможность увеличения рабочей скорости разбавления или благодаря повторному использованию биомассы, как в рассматриваемом нами случае, или путем удержания активной биомассы.
Вернемся теперь к анализу работы проточного биореактора с полным вытеснением. В этом случае в каждом малом элементе жидкости dυ, проходящем через биореактор, имеет место в основном экспоненциальный рост (μ = μm), если только концентрация первого лимитирующего субстрата значительно превышает константу насыщения Ks. Рост биомассы в таком биореакторе без рецикла описывается следующим уравнением: Inx= In x0 -∣- μm t, (58), где X0 — концентрация биомассы в среде, поступающей в биореактор, х — концентрация в момент времени t.
Если v — объем культуральной среды, вышедшей из биореактора за время t, то t≈υ∣F=υ∣Vd. Подставив это выражение для t в уравнение (58), получаем ![]() (59).
(59).
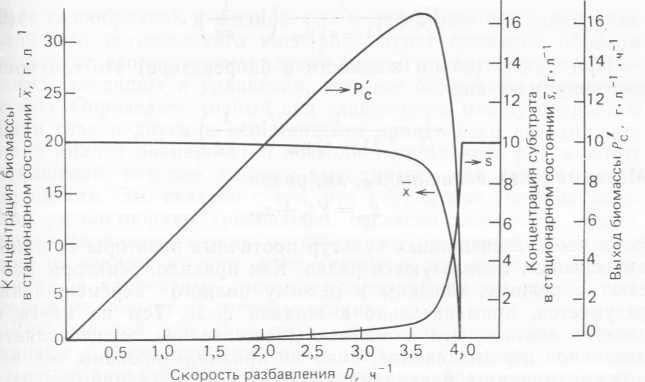
Рис. 10.9. Теоретическая зависимость концентрации биомассы и лимитирующего субстрата в стационарном состоянии, а также выхода микробной биомассы в биореакторе от скорости разбавления для хемостата с концентрированием микробной биомассы и ее повторным использованием (μm=l,0 ч-1, Ks= = 0,1 г-л-1, yx∕s=0,5, S0= 10 г-л-1, α=0,2, g=4).
При рециркуляции микробной биомассы в проточном биореакторе с полным вытеснением никакой внешней инокуляции не требуется. В подобной системе общий поток, вытекающий из биореактора (но не из всей системы), описывается уравнением (46), как и в случае рассмотренного выше реактора с рециркуляцией. Если биомасса концентрируется в сепараторе в g раз, то доля ее, повторно используемая в биореакторе, будет равна ag. Если xw — концентрация биомассы в потоке, вытекающем из биореактора, то в стационарном состоянии x0 = agxw. Время /, за которое из реактора вытечет объем V, равно ![]() (60).
(60).
Приняв υ =Vh — объему, при котором происходит исчерпание лимитирующего субстрата, и заменив х и t в уравнении (59), для стационарного состояния получим
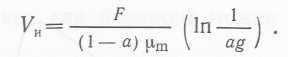 (61).
(61).
При Va = V (объем жидкости в биореакторе) это соотношение принимает вид 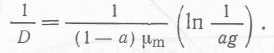
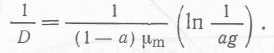 (62).
(62).
Максимальная величина xw, хт, равна ![]() (63).
(63).
В случае суспензионных культур проточные реакторы с полным вытеснением используются редко. Как правило, реакторы работают в режиме, близком к режиму полного перемешивания, разумеется, применительно к жидкой фазе. Тем не менее нe следует считать, что в системе действительно осуществляется идеальное перемешивание, пока не проанализированы все возможные причины появления неоднородности (например, из-за пристеночного роста и т. п.). Вероятно, самым лучшим приближением к реактору с полным вытеснением был бы каскад последовательных реакторов с идеальным перемешиванием без дополнительных поступлений питательных веществ, однако для этого число биореакторов, составляющих такой каскад, должно быть бесконечным. Неидеальный поток с полным вытеснением можно получить, лишь когда работает более шести последовательных биореакторов.
- 10.3.2. Анализ размерностей и масштабирование
Анализ размерностей и моделирование с помощью безразмерных величин широко применяются в химической технологии и не менее важны для конструирования биореакторов и их масштабирования. C анализом размерностей и с безразмерными величинами хорошо знакомы лишь немногие микробиологи. Это прежде всего метод, с помощью которого можно получить, какую-то информацию о взаимосвязях между переменными, характеризующими определенные физические системы. Ценность такого подхода состоит в том, что его можно применять в тех случаях, когда мы располагаем неполной информацией о системе, и тогда получаемая частичная информация нередко имеет большую ценность, позволяя уменьшить число экспериментов, необходимых для получения полной информации.
Рассмотрим, например, физическую абсорбцию кислорода1 в аэрируемом биореакторе. Очевидно, что для полного описания системы с физической точки зрения необходимо вывести сложные гидродинамические уравнения, описывающие перемещение газообразной и жидкой фаз и диффузию в жидкой фазе. Количество поглощенного кислорода будет сложным образом зависеть от скорости поступления газа и от всех других переменных, входящих в уравнения, которые описывают перемещение фаз. Определить точный вид зависимости между скоростью подачи газа и другими переменными практически невозможно; однако анализ размерностей позволяет установить ряд важных соотношений, которые должны выполняться для любой такой зависимости. Это связано с тем, что корректные способы измерений удовлетворяют требованию, согласно которому число, равное отношению между результатами измерений двух объектов, не зависит от того, какая единица используется для измерений, а корректные системы уравнений имеют такой вид, который не зависит от системы единиц.
Решение той или иной технологической проблемы обычно начинают с очень приближенного анализа, учитывая как можно меньше деталей. В результате исходные характеристики процессов, протекающих в реакторе, могут быть представлены в виде простого соотношения между двумя или тремя безразмерными величинами и соответствующими эмпирическими константами. Существует около трехсот безразмерных величин, представляющих интерес с точки зрения технологии, но на самом деле большинство биотехнологов имеют дело только с двумя десятками.
Наиболее широко используемая безразмерная величина — это число Рейнольдса N-Re, которое применяется при описании потока жидкости: 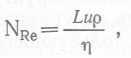 (64).
(64).
где L — характеристический размер, и — скорость потока, р — плотность жидкости, η — ее вязкость. При конструировании биореакторов числа Рейнольдса используются при описании потока жидкости в трубопроводах, движения капель, частиц и пузырьков газа, а также вращающихся мешалок. Для потока жидкости в трубопроводе
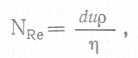 (65),
(65),
где d — диаметр трубопровода, и — скорость потока. Для частиц, пузырьков или капель, погружающихся в жидкости или всплывающих в ней,
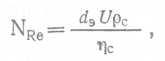 (66),
(66),
где d3 — эквивалентный диаметр частиц, пузырька или капли, т. е. диаметр сферы, равной по объему частице, пузырьку или капле, U — скорость частицы, всплывающей или погружающейся в жидкость, ,ре — плотность среды, ηc — ее вязкость. Для вращающихся мешалок
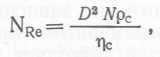 (67) ,
(67) ,
где D — диаметр перемешивающего устройства, N — скорость вращения.
Перечислим некоторые другие безразмерные величины, обычно используемые химиками-технологами: число Нуссельта Nnu, число Прандтля Npr, число Гразгофа Ngγ, число Фруда Nfγ, число Пекле NPe, число Стэнтона Nst, число Шмидта Nsc число Шервуда Nsh, число Вебера Nwe. Как и число Рейнольдса, некоторые из этих величин имеют по нескольку определений, а, например, числа Пекле, Прандтля и Нуссельта записываются в одинаковом виде в случае теплопередачи и переноса массы. Кроме того, одни из этих безразмерных величин, например число Стэнтона, представляют собой комбинации других величин, а некоторые имеют более одного названия.
В качестве примера использования безразмерных величин можно рассмотреть процесс теплопередачи. Когда имеет место только естественная конвекция, теплопередача зависит исключительно от структуры потока, определяемой числом Гразгофа, а число Рейнольдса может быть исключено из безразмерных уравнений, описывающих этот процесс. В условиях же принудительной конвекции эффектами структуры потока обычно можно пренебречь и исключить из уравнений число Гразгофа. Следовательно, уравнение, использующееся в случае естественной конвекции, имеет вид
![]() (68), а в случае принудительной конвекции —
(68), а в случае принудительной конвекции — ![]() (69).
(69).
При увеличении масштаба возникают проблемы, связанные с экстраполяцией данных, полученных в лаборатории или на полупроизводственной установке, на случай промышленной установки. Оборудование для биотехнологической промышленности можно успешно создавать и эксплуатировать только при условии правильного масштабирования. Ясно, что с проблемой увеличения масштаба мы сталкиваемся при конструировании всех установок, используемых в биотехнологических процессах, включая теплообменники, центрифуги, испарители, сушилки и т. д., но здесь мы рассмотрим в основном биореакторы.
Любой материальный объект или физическая система характеризуются тремя параметрами: размером, формой и составом. Все эти параметры меняются независимо друг от друга, так что два объекта могут различаться по размеру, но иметь одинаковую форму и состав или быть одинаковыми только по форме, но существенно различаться по размерам и составу. Принцип подобия устанавливает взаимосвязь между физическими системами разных размеров; на нем основано увеличение или уменьшение масштабов процессов и оборудования. Согласно этому принципу, пространственная и временная конфигурации системы определяются отношением между соответствующими величинами внутри систем и не зависят от того, в каких единицах эти величины измеряются. Принцип подобия нередко путают с методом анализа размерностей, хотя логически они совершенно различны. Первый из них — это общий принцип природы, тогда как второй — всего лишь один из методов его реализации.
Биотехнолог имеет дело со сложными системами, включающими твердые тела и жидкости, в которых происходит пеоенос энергии и вещества и протекают различные реакции; для таких систем принцип подобия связан в основном с понятием формы. Когда понятие формы применяется к сложным биотехнологическим системам, оно включает помимо геометрических пропорций и такие факторы, как структура потока жидкости, температурные градиенты, зависимость концентрации от времени и т. д. Системы, обладающие одинаковой конфигурацией πo, одному или более из этих параметров, можно рассматривать как подобные.
Подобие можно определить двумя способами: устанавливая отношение результатов различных измерений для одного и того же объекта, т. е. внутренние пропорции, или отношения между результатами соответствующих измерений разных объектов, т. е. масштаб. Геометрическое подобие лучше всего определяется через масштабные соотношения, а подобие по таким переменным, как скорость, сила или температура, — через внутренние соотношения для каждой системы. Эти внутренние соотношения представляют собой безразмерные величины, характеризующие подобие в различных условиях.
Для систем, в которых протекают биотехнологические процессы, существуют четыре типа подобия: 1) геометрическое, 2) механическое, 3) тепловое и 4) химическое, причем каждый из этих типов подобия связан со всеми остальными. Для полного химического подобия необходимо наличие геометрического, механического и теплового подобия, но часто приходится ограничиваться приближенным химическим подобием, например, когда имеет место лишь приближенное механическое подобие?. На самом деле такой элемент приближения имеется всегда, поскольку в реальных системах обязательно существуют возмущения и идеальное подобие становится недостижимым. Так, рассматривая потоки жидкости в геометрически подобных системах, мы не можем считать их идентичными, поскольку нет гарантии, что все неровности поверхностей геометрически подобны.
Из рассмотрения четырех типов подобия, перечисленных выше, следует, что геометрическое подобие между двумя объектами имеет место тогда, когда каждой точке одного из них соответствует определенная точка другого. Однако каждой точке первого объекта может соответствовать более одной точки второго; кроме того, масштаб может быть одинаковым не по всем •осям. О подобии объектов с такими различиями в масштабе говорят как об искаженном.
Механическое подобие включает подобие статическое, кинематическое и динамическое; каждое из них можно рассматривать как распространение понятия геометрического подобия на стационарные или движущиеся системы, на которые действуют силы. Статическое подобие относится прежде всего к деформации структур и представляет для биотехнологов лишь небольшой интерес. Напротив, кинематическое и динамическое подобие очень важны и касаются систем, для которых характерно движение. В случае геометрического подобия используется декартова система координат, при кинематическом подобии вводится дополнительная переменная — время. О геометрически подобных движущихся системах говорят как о кинематически подобных в тех случаях, когда соответственные частицы описывают за соответственные интервалы времени подобные траектории. Когда две геометрически подобные жидкие •системы подобны кинематически, свойства потоков геометрически подобны, а процессы переноса массы и тепла в этих двух системах связаны друг с другом простыми соотношениями. Кинематическое подобие в жидкостях влечет за собой геометрическое подобие как турбулентных систем, так и пограничных (пристеночных) слоев жидкости. Динамически подобны силы (гравитационные, центробежные и т. п.), под действием которых осуществляется ускоренное или замедленное движение тел в динамических системах. В жидких и дисперсионных системах кинематическое подобие предусматривает и динамическое подобие, поскольку характер движения в таких системах определяется приложенными силами. Динамически подобные системы —- это геометрически подобные движущиеся системы, в которых соотношения между всеми соответственными силами одинаковы. Динамическое подобие в потоке жидкости очень важно для предсказания изменения давления или потребления энергии; в случае переноса массы и теплопередачи оно имеет только косвенное значение как способ установления кинематического подобия.
Понятие теплового подобия применяется в случае технологических систем, в которых происходит теплопередача; в этом случае к единицам длины, силы и времени добавляется температура. Тепло может передаваться от одной точки системы к другой с помощью разных механизмов: излучения, теплопроводности, конвекции или переноса вещества под действием градиента давления. Первые три процесса осуществляются за счет разницы в температурах, а четвертый определяется характером потока в системе. Тепловое подобие имеет место в геометрически подобных системах, когда отношения соответственных разностей температур постоянны, а когда такие системы находятся в движении, они также и кинематически подобны. Тепловое подобие должно учитываться при разработке режима стерилизации биореакторов, особенно в плане теплового повреждения материала, а также при охлаждении биореакторов.
Понятие химического подобия относится к системам, в которых протекают различные реакции и состав которых меняется от точки к точке либо — в случае периодических или циклических процессов — во времени. При этом никаких новых фундаментальных единиц не вводится, однако должны быть заданы один или более концентрационных параметров в зависимости от числа независимо изменяющихся химических компонентов, no- которым должно быть установлено подобие. Химическое подобие имеет место в геометрически подобных системах и системах с тепловым подобием, когда отношение между соответственными разностями концентрации остается постоянным и когда эти системы, если они находятся в движении, кинематически подобны. Внутренним критерием, который характеризует химическое подобие, в дополнение к тем критериям, которые- необходимы для кинематического и теплового подобия, является отношение скорости образования продукта к скорости всего потока или к скорости молекулярной диффузии.
Механическое, тепловое или химическое подобие между геометрически подобными системами определяется такими критериями, как соотношения размеров, сил или скоростей внутри этих систем. Поскольку эти критерии представляют собой отношение между одинаковыми величинами, они безразмерны и могут быть получены с помощью анализа размерностей.
Безразмерные критерии подобия представляют собой отношения физических величин, являющихся функциями или различных движущих сил, или сил сопротивления, которые лимитируют процесс. В реальных системах часто существуют множественные лимитирующие факторы. Например, сопротивление движению жидкости может быть обусловлено вязкостью, гравитационными силами или силами поверхностного натяжения, для которых соответствующими безразмерными величинами являются числа Рейнольдса, Фруда и Вебера. Для самого простого случая гомологичных систем с разными абсолютными размерами эти три критерия несовместимы, поскольку для них имеет место разная функциональная зависимость скорости движения жидкости от линейных размеров; так, для одинаковых чисел Рейнольдса скорость=длине-1, для одинаковых чисел Фруда скорость=длине0’5, для одинаковых чисел Вебера скорость=длине-0’5. При увеличении масштаба сложного биотехнологического процесса лучше всего было бы найти такие условия, при которых скорость процесса в целом определялась в основном каким-то одним безразмерным критерием, но, как правило, приходится использовать как минимум два критерия.
Для биореакторов с вращающимися мешалками, благодаря которым воздух диспергируется в толще культуральной среды, очень часто основным экономическим фактором при масштабировании является потребление энергии при перемешивании. В общем виде безразмерное уравнение для двухфазного потока жидкости в емкости с вращающейся мешалкой выглядит следующим образом: ![]() (70)
(70)
или 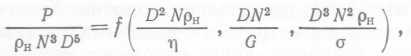 (71),
(71),
где P — потребляемая энергия, рн— плотность жидкой (непрерывной) фазы, N — скорость вращения мешалки, D — диаметр мешалки, η∏ — вязкость жидкой (непрерывной) фазы, G — гравитационная постоянная, σ — поверхностное натяжение.
Для систем газ — жидкость зависимость от чисел Ройнольдса и Вебера в уравнении потока жидкости можно с достаточной точностью представить как степенные функции этих чисел, хотя показатели степени и не являются постоянными для всех условий. Далее, зависимость от числа Фруда возникает только при наличии вихрей на поверхности жидкости, а в биореакторах с вращающимися мешалками образование вихрей предотвращается с помощью перегородок. Следовательно, для аэрируемых биореакторов с вращающимися мешалками
Np = ∕(Nβe)α (Nwe)V, (72),
где показатели степени а и у зависят от условий процесса, в частности от структуры потока.
Анализ размерностей массопередачи в аэрируемых геометрически подобных биореакторах с мешалками дает ![]() (73)
(73)
или 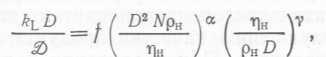 (74),
(74),
где kL — коэффициент массопередачи, D — коэффициент молекулярной диффузии кислорода в жидкой (непрерывной) фазе. Хотя у нас нет оснований сомневаться в применимости уравнений (72) и (73) к случаю биореакторов с вращающимися мешалками, следует помнить о тех трудностях, которые возникают при оценке влияния перемешивания на биологическую активность; эти трудности вполне могут привести к несостоятельности обсуждаемого подхода. Скорость вращения лопастей мешалки πND задает максимальную скорость сдвига в аэрируемых биореакторах, от которой зависит вероятность повреждения жизнеспособных клеток, особенно нитевидных бактерий или образующих хлопья микробов. При увеличении размеров биотехнологических установок необходимо уделять особое внимание связям между механическими и физическими факторами, с одной стороны, и биологическими — с другой. В противном случае задача увеличения масштаба вряд ли будет решена корректно.
- 10.3.3. Перенос кислорода
Одна из основных задач, которые приходится решать химикам-технологам при конструировании биореакторов, — это обеспечение эффективного переноса кислорода в промышленных биореакторах, где осуществляются аэробные микробиологические процессы. Независимо от того, в каком режиме осуществляется аэробный микробиологический процесс — периодическом, полунепрерывном или непрерывном, — в установку должен непрерывно подаваться кислород для достижения достаточно высокой производительности. Потребность аэробной культуры в кислороде зависит от концентрации микроорганизмов в реакторе, скорости их роста и соответствующего коэффициента выхода. В некоторых случаях могут играть роль и другие факторы, например необходимость удаления из культуры двуокиси углерода, особенно для процессов, в которых в качестве источника кислорода используется воздух, который как раз и служит источником кислорода в подавляющем большинстве аэробных микробиологических процессов. При тех температурах, при которых обычно протекают микробиологические процессы (10—400C), и при атмосферном давлении равновесная концентрация растворенного кислорода крайне мала по сравнению с концентрациями в растворе почти всех основных питательных веществ или субстратов, хотя именно концентрация последних лимитирует рост микроорганизмов в непрерывном проточном хемоста- те. Такой недостаток кислорода приводит к снижению производительности, к ухудшению качества продукта или к образованию побочных продуктов. При реализации большинства аэробных микробиологических процессов расходы на снабжение кислородом составляют значительную часть общей стоимости производства.
В равновесии растворимость газа в жидкости представляет собой весьма небольшую, вполне определенную величину, зависящую от природы этих газа и жидкости, от температуры и давления в системе. В случае газовых смесей, например воздуха, растворимость компонентов зависит от парциального давления каждого из них. При прочих равных условиях, чем выше температура, тем меньше растворимость, и чем выше давление (или парциальное давление), тем растворимость выше. Зависимость между растворимостью газа и давлением известна как закон Генри, согласно которому при постоянной температуре масса газа, растворенного в данном объеме жидкости, пропорциональна давлению газа, с которым эта жидкость находится в равновесии. Большинство культуральных сред представляют собой разбавленные водные растворы, и для простоты их можно считать сходными с водой. Концентрация кислорода, растворенного в воде, находящейся в равновесии с воздухом, т. е. в состоянии насыщения, при постоянной температуре и постоянном суммарном давлении равна 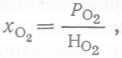
где po2 —парциальное давление кислорода в воздухе, Ho2 — постоянная Генри для данной системы при соответствующей температуре. Значения этих постоянных приводятся в физических и химических справочниках, и нужно только правильно выбрать единицы измерения.
Для описания переноса (абсорбции) газов в жидкостях обычно используются три гидродинамические модели: 1) модель двух пленок Льюиса — Уитмена; 2) модель проницаемости с систематически обновляемой поверхностью (модель Хигби); 3) модель проницаемости со случайно возобновляемой поверхностью (модель Данквертса).
Для описания физической абсорбции газов системами аэробных микробных культур обычно применяют модель Льюиса —Уитмена, поэтому только ее мы здесь и рассмотрим. Перенос кислорода из жидкой фазы в бактериальную клетку также часто рассматривают с позиций, аналогичных модели двух пленок.
Согласно модели Льюиса — Уитмена, на поверхности раздела фаз газ — жидкость образуются две тонкие пленки, тесно прилегающие к этой поверхности. Пленки являются в основном неподвижными, а в толще газовой и жидкой фаз происходит турбулентное движение. Абсорбция газа осуществляется в ходе стационарных процессов молекулярной диффузии в этих двух неподвижных пленках. Считается, что на поверхности раздела фаз газ — жидкость мгновенно устанавливается равновесие, а скорость абсорбции определяется относительными скоростями диффузии в пленках.
Направление транспорта кислорода
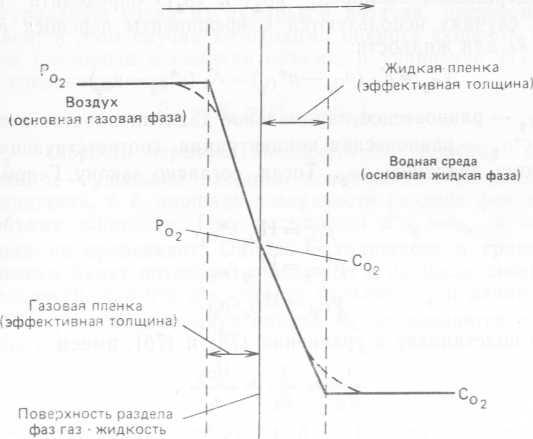
Рис. 10.10. Модель двух (ламинарных) пленок, предложенная Уитменом для процесса физической абсорбции (транспорта) кислорода из воздуха в водную среду (обозначения см. в тексте).
Предположим, что абсорбция осуществляется из пузырьков воздуха, диспергированных в жидкости; радиус кривизны пузырьков на несколько порядков превышает толщину гипотетической пленки, и транспорт кислорода из пузырьков воздуха в жидкость можно представить так, как это сделано на рис. 10.10. В газовой пленке парциальное давление кислорода меняется от po2 — парциального давления во всем объеме газовой фазы до po21 — парциального давления в газовой пленке непосредственно у границы раздела фаз; соответст¬венно в жидкой пленке концентрация растворенного кислорода меняется от Co2ι — равновесной концентрации при насыщении, соответствующей po21, до Co2 — концентрации во всем объеме жидкости. Поскольку кислород на поверхности раздела не накапливается, скорость переноса кислорода на единицу площади в газовой и жидкой пленках будет одинакова и равна ![]() (76),
(76),
где kG и kL — коэффициенты массопереноса соответственно для газовой и жидкой пленок. Для воздуха и других газовых смесей, содержащих кислород, po2i и Co2ι определить нельзя; в этих случаях используются коэффициенты переноса Ka для газа и kL для жидкости: фазы kG практически равен коэффициенту для газовой пленки ka;
![]() (77),
(77),
где p*o2 — равновесное парциальное давление, соответствующее Co2, a c*o2 —равновесная концентрация, соответствующая парциальному давлению po2∙ Тогда, согласно закону Генри, получаем
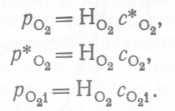 (78,79,80)
(78,79,80)
Сделав подстановку в уравнения (75) и (76), имеем
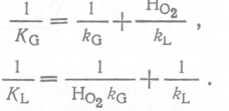 (81,82)
(81,82)
Величины, обратные коэффициентам массопереноса, называются коэффициентами сопротивления транспорту, т. е. 1∕kG и 1∕kL — соответственно коэффициенты сопротивления в газовой и жидкой пленках, a 1/KG И 1/KL— соответственно коэффициенты сопротивления для всего объема газа и всего объема жидкости. Их относительные значения зависят от растворимости газа. При абсорбции очень хороню растворимого газа, например аммиака в воде, постоянная Генри HNH3 очень мала, и последним членом в уравнении, аналогичном (81), можно пренебречь, так что коэффициент массопереноса для газовой абсорбциb лимитируется процессами, происходящими в газовой пленке. При абсорбции (транспорте) кислорода, который растворяется в воде слабо, постоянная Ho2 очень велика, так что в уравнении (82) член 1∕Ho2⅛g очень мал и им можно пренебречь. Коэффициент массопереноса для жидкой фазы Kl практически равен коэффициенту массопереноса для жидкой пленки kL; абсорбция кислорода лимитируется процессами, протекающими в пленке жидкости. Когда газовая фаза содержит кислород, PosI = Po2 и ka — бесконечно большая величина, так что абсорбция в этом случае также лимитируется процессами в жидкой пленке.
В большинстве аэробных биореакторов кислород поступает в культуральную среду из пузырьков воздуха, диспергированных в ней; в этом случае необходимо оценить скорость массопередачи кислорода в единице объема, и уравнение (77) принимает следующий вид:
![]() (83),
(83),
где Ro2 — скорость переноса кислорода на единицу объема жидкости, а — удельная площадь поверхности раздела фаз газ — жидкость, т. е. площадь поверхности раздела фаз на единицу объема жидкости. При насыщении c*o2=Co2 и перенос кислорода не происходит. Однако находящиеся в среде микроорганизмы будут потреблять кислород в процессе своей жизнедеятельности, так что c*o2 станет больше Co2 и начнется перенос. В случае модели двух пленок Kl определяется следующим образом:
![]() (84) , где KL — коэффициент диффузии, δ — толщина пленки жидкости.
(84) , где KL — коэффициент диффузии, δ — толщина пленки жидкости.
Для другой модели поглощения газа Kl определяется иным способом. В модели Хигби ![]() (85),
(85),
а в модели Данквертса![]() (86).
(86).
где t* — это время нахождения элементарного объема жидкости на поверхности раздела, a ⅛ — эквивалентное время диффузии.
Транспорт кислорода из пузырька в жидкую среду — это лишь часть общего процесса переноса кислорода к бактериальным клеткам. Как было показано для переноса кислорода из пузырьков в жидкость, транспорту препятствуют разного рода факторы, один из которых является лимитирующим. Понятие сопротивления переносу можно распространить и на последующие стадии процесса. Кислород, поступив в культуральную среду, должен затем транспортироваться к месту его использования в микроорганизме. Сопротивление переносу складывается из сопротивления со стороны жидкой фазы, которым для невязких, ньютоновских жидкостей в условиях полной турбулентности можно пренебречь, из сопротивления со стороны жидкой пленки, прилегающей к поверхности бактериальной клетки, хлопьям, осадку или к поверхности мицелия либо внутриклеточного сопротивления в случае дисперсионных культур, либо межклеточного (включая и внутриклеточное) в- случае хлопьев, осадков и мицелия.
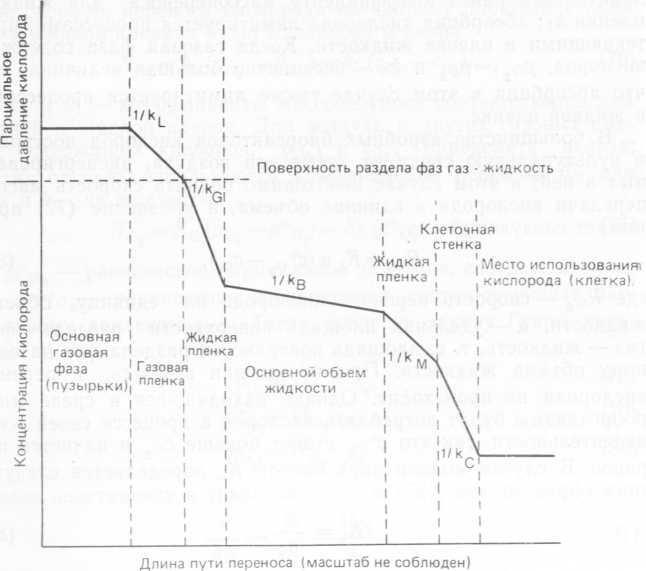
Рис. 10.11. Различные типы сопротивления транспорту кислорода из пузырька газа к месту его использования микроорганизмом (обобщение модели Уитмена; обозначения см. в тексте).
Все типы сопротивления переносу кислорода представлены на рис. 10.11. В случае дисперсионных культур перенос кислорода лимитируется сопротивлением в жидкой пленке пузырька. Когда же микроорганизмы растут в виде хлопьев, осадков или мицелиальной массы, в некоторых случаях роль лимитирующего фактора играет не сопротивление в жидкой пленке газового пузырька, а внутримежклеточное сопротивление или сопротивление конгломерата.
В связи с очевидностью роли переноса кислорода из пузырьков газа в жидкость попытаемся с помощью уравнения (83) оценить возможности увеличения скорости транспорта кислорода. В принципе можно варьировать все три члена этого уравнения: Kl, а и (c*oj-Co2) (последний член характеризует движущую силу процесса). Однако Kl является характеристикой системы в целом и не может изменяться независимо, поэтому обычно ее считают константой, хотя под действием поверхностно-активных веществ, присутствующих в микробиологических установках, она все-таки изменяется. Удельную площадь поверхности раздела фаз газ — жидкость и член, характеризующий движущую силу, легко увеличить, изменяя контролируемым образом условия проведения процесса. Обычно первая из этих величин возрастает при интенсификации перемешивания, а вторая — при увеличении суммарного или парциального давления.
Удельная площадь поверхности раздела фаз газ — жидкость определяется следующим образом: ![]() (87),
(87),
где ε — задержка газа на единицу диспергируемого объема, U — средний диаметр пузырьков (в случае пузырьков неодинакового размера). Обычно для определения среднего диаметра пузырька используют формулу Саутера:
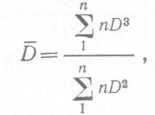 (88),
(88),
где п — число пузырьков, D — диаметр эквивалентной сферы. Ясно, что для интенсификации транспорта кислорода путем увеличения а необходимо либо повысить содержание газа в .диспергируемой среде (т. е. ε), либо уменьшить средний диаметр пузырьков.
Диспергирование пузырьков газов в жидкостях — сложный процесс. Независимо от способа получения пузырьков для нихвсегда наблюдается некое распределение по размерам. Размер любого диспергированного пузырька определяется равновесием между двумя основными типами напряжений: напряжением сдвига и поверхностным натяжением. На размер пузырьков заметно влияет присутствие в среде растворенных неорганических и органических веществ, при этом изменяется либо коалесценция, либо поверхностное натяжение.
В биореакторах коалесценция и поверхностное натяжение не могут изменяться независимо друг от друга и произвольным образом, однако несомненно они изменяются в ходе процесса или в результате добавления соединений, контролирующих ценообразование. Теоретически уменьшение среднего размера пузырьков при диспергировании газов в жидкостях может происходить при интенсификации перемешивания. Однако на самом деле при обычных удельных мощностях перемешивания средний размер пузырьков остается примерно постоянным, зато заметно увеличивается содержание газа, т. е. другой компонент величины а; это связано с рециркуляцией жидкости, благодаря которой в свою очередь снижается потеря пузырьков газа. Механизм разрушения пузырьков в изотопическом турбулент¬ном потоке мы обсуждать не будем. Отметим лишь, что в результате рассмотрения этих механизмов для случая отсутствия коалесценции было получено уравнение, удовлетворяющее множеству имеющихся экспериментальных данных для систем с очень высокой энергоемкостью: 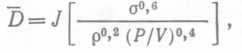 (89), где J — константа, σ — поверхностное натяжение, р — плотность жидкости, P/V — энергоемкость на единицу объема в условиях насыщения газом. При наличии коалесценции уравнение (89) принимает вид
(89), где J — константа, σ — поверхностное натяжение, р — плотность жидкости, P/V — энергоемкость на единицу объема в условиях насыщения газом. При наличии коалесценции уравнение (89) принимает вид 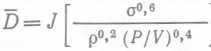 (90),
(90),
Здесь показатель степени а, в который возводится величина ε, характеризует степень коалесценции.
Итак, очевидно, что задержка газа и средний размер пузырьков прямо связаны между собой; при этом задержка газа зависит от интенсивности перемешивания и от объемной скорости потока газа. Соответствующее эмпирическое уравнение для жидкости с постоянными реологическими характеристиками имеет вид:
![]() (91), где J', β и γ — константы, зависящие от системы и оборудования, a Vn — поверхностная скорость газа, т. е. отношение объемной скорости газового потока к площади поперечного сечения биореактора. В биореакторах с вращающимися мешалками и высокой энергоемкостью происходит рециркуляция значительной части газовой фазы и соответственно уменьшается влияние поверхностной скорости газа на величину ε. В то же время в барботажных биореакторах относительная роль Vn сильно возрастает.
(91), где J', β и γ — константы, зависящие от системы и оборудования, a Vn — поверхностная скорость газа, т. е. отношение объемной скорости газового потока к площади поперечного сечения биореактора. В биореакторах с вращающимися мешалками и высокой энергоемкостью происходит рециркуляция значительной части газовой фазы и соответственно уменьшается влияние поверхностной скорости газа на величину ε. В то же время в барботажных биореакторах относительная роль Vn сильно возрастает.
Оценивая транспорт кислорода из газовой фазы в жидкость в микробиологических реакторах, Эндрью (Andrew, 1982) высказал мнение, что при конструировании любых промышленных аэробных биореакторов, в том числе больших тэнков с мешалками, их можно рассматривать как аппараты колонного типа со свободным прохождением пузырьков газа по высоте аппарата. Крупные биореакторы-тэнки с мешалками относят к категории вышеупомянутых биореакторов, основываясь на явлении массопереноса, а также в связи с тем, что при обычной промышленной энергоемкости мешалка не способна создавать, рециркуляцию жидкости, достаточную для возврата пузырьков, стремящихся выйти на поверхность жидкости.
Рассмотрим теперь вопрос о возможности изменения скорости транспорта кислорода путем изменения того члена уравнения (83), который характеризует движущую силу процесса, т. е. (c*o2—co2). Здесь имеется несколько возможностей. В первую очередь уменьшение до минимума рабочей концентрации растворенного кислорода в среде, т. е. Co2. Однако, когда эта величина приближается к нулю, дальнейшее увеличение Движущей силы становится невозможным. Максимально достижимая, постоянная скорость транспорта кислорода До2.ш равна ![]() (92).
(92).
Уменьшать содержание растворенного кислорода в культуральной среде следует с осторожностью, поскольку микроорганизмы при этом вынуждены будут расти в условиях недостатка кислорода, что может отрицательно сказаться на их росте и/или образовании продукта. Если микроорганизмы растут в виде хлопьев, образуют осадок или мицелий и величина l∕⅛c становится фактором, лимитирующим весь процесс транспорта кислорода, концентрация Co2 должна поддерживаться на уровне значительно выше нуля, если мы хотим, чтобы во всем объеме микробной биомассы, находящейся в реакторе, поддерживался аэробный метаболизм.
Прежде чем говорить об изменении c*o2, следует сначала определить, какое именно парциальное давление кислорода соответствует c*o2 в тех или иных типах биореакторов. Для биореакторов с высокой интенсивностью перемешивания, т. е. реакторов, которые обычно используются в лаборатории, было показано, что газовая и жидкая фазы полностью перемешиваются. Следовательно, парциальное давление кислорода в диспергированных пузырьках равно парциальному давлению кислорода в газе, выходящем из жидкости, т. е. в свободном пространстве биореактора. Для биореакторов колонного типа со свободным прохождением пузырьков по высоте биореактора, в том числе и для промышленных биореакторов с перемешиванием, работающих в условиях обычной энергоемкости, в первом приближении можно считать, что жидкая фаза перемешивается полностью, а газовая находится в режиме идеального вытеснения, т. е. существует градиент парциального давления кислорода в направлении от дна биореактора к его верху. Для этих двух крайних случаев уравнение (83) можно переписать следующим образом:
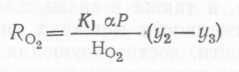 (93)
(93)
(для случая полного перемешивания) и
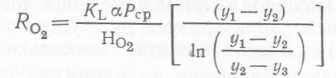 (94)
(94)
(для случая полного вытеснения). Здесь P — давление в свободном пространстве, Pcp — среднее рабочее давление в реакторе (давление в рабочем пространстве+гидростатическое давление) z∕ι, ι∕2 и уз — мольные доли кислорода во входящем и выходящем газе и в газовой смеси, соответствующей равновесной концентрации растворенного кислорода.
Из уравнений (93) и (94) с очевидностью следует, что с увеличением давления в свободном пространстве биореактора повышается скорость транспорта кислорода в обоих рассмотренных случаях, а с увеличением парциального давления кислорода путем обогащения им газовой смеси, продуваемой через биореактор, или полной замены ее кислородом повышается скорость транспорта кислорода в случае полного вытеснения. В реакторах с идеальным перемешиванием парциальное давление кислорода в пузырьках, а следовательно, и скорость транспорта кислорода должны увеличиваться с уменьшением кон- .версии кислорода; однако это вряд ли можно считать экономически целесообразным.
Поскольку микроорганизмы имеют тенденцию скапливаться у поверхности раздела между воздухом и жидкостью, видимо, правильнее было бы записать уравнение (82) следующим образом:
![]() (95).
(95).
Ясно, что в отсутствие такого накопления £'=1, однако обычно, особенно в случае бактерий значительно меньшего размера,, чем толщина пленки (~20 мкм), концентрация их у поверхности раздела фаз будет гораздо больше, чем в толще жидкости. Влияние этого явления на транспорт кислорода, вероятно, в; какой-то степени сходно с эффектами, наблюдаемыми при поглощении газа в условиях одновременного протекания химической реакции; тем не менее прямая аналогия здесь вряд ли возможна, поскольку концентрация бактерий внутри пленки меняется нелинейно, а текучесть пленки уменьшается из-за присутствия в ней бактериальных клеток.
- 10.3.4. Теплопередача и охлаждение'биореактора
К числу наименее разработанных проблем биотехнологии относятся разнообразные проблемы осуществления процессов теплопередачи, которые обеспечивают поддержание температуры аэрируемой культуральной среды на уровне, соответствующем оптимуму анаболической и катаболической активности данных микроорганизмов. Для большинства из них диапазон температур, оптимальных для роста или образования продукта, очень- узок, нередко всего несколько градусов. При температурах ниже оптимальной скорость роста любого микроорганизма повышается в ответ на повышение температуры относительно медленно, а при температурах, лишь, на несколько градусов превышающих этот оптимум, происходит резкое снижение скорости роста до нуля. Подавляющее большинство микроорганизмов,, используемых в биотехнологических процессах, — мезофилы: температурный оптимум для них лежит между 15 и 40 °C. Температурный оптимум термофильных микроорганизмов значительно превышает 40oC, а у облигатных психрофильных микроорганизмов он лежит ниже IO0C.
При производстве любого валового микробиологического продукта аэробным способом охлаждение биореактора представляет собой серьезную технологическую проблему. Если температурный оптимум, при котором достигается максимальный выход продукта и производительность, лежит ниже 40 0C, на; охлаждение приходится основная часть производственных расходов. Обычно в практике биотехнологических процессов промышленного масштаба используют в качестве охлаждающей среды воду, а не какой-либо хладагент. При определении размеров охлаждающей поверхности, необходимой для поддержания температуры любого процесса, особое значение имеет максимальная температура охлаждающей воды, а производственные расходы на системы охлаждения определяются средней температурой охлаждающей воды, используемой на разных этапах процесса. Следует подчеркнуть, что при очистке валового продукта требуется значительно меньшее охлаждение, чем при осуществлении обычных биологических процессов. Однако некоторые из недавно разработанных физических методов разделения протекают при температурах, близких к обычным, и представляются весьма перспективными в плане использования их в биотехнологии.
Температура охлаждающей воды зависит от многих факторов. К ним относятся происхождение этой воды, климатические условия и различия в местоположении установки, а также тип используемой системы охлаждения: это может быть проточная система или система с рециркуляцией. В будущем для охлаждения, вероятно, все больше будут применяться замкнутые системы (с рециркуляцией), с тем чтобы исключить тепловое и возможное химическое загрязнение окружающей среды в результате сброса воды из проточных систем охлаждения. В условиях умеренного климата и при использовании мезофильных организмов в крупных, интегрированных производствах оптимальная температура процесса будет лишь немного отличаться от температуры охлаждающей воды.
Хотя калориметрические методы измерения количества тепла, выделяющегося при росте и дыхании микроорганизмов, разработаны уже давно, использованию этого процесса посвящено сравнительно немного работ. Измерения количества выделяющегося тепла производили обычно для оценки интенсивности роста микроорганизмов. В аэробных микробиологических процессах количество тепла, выделяющегося в единицу времени, прямо пропорционально скорости потребления кислорода, которая в свою очередь связана с ростом с помощью соответствующего коэффициента выхода. Считается, что это эмпирическое соотношение между скоростью потребления кислорода и количеством .выделяющегося тепла можно применять для оценки последней величины, и прямые ее измерения проводят только в редких случаях. Это соотношение имеет вид
![]() (96).
(96).
Здесь Q — количество тепла, выделяющегося при росте аэроб- щых микробов в единицу времени на единицу объема, Ro2 — скорость потребления кислорода на единицу объема (равная «скорости транспорта кислорода), k—константа, равная 124, «если Q выражено в ккал• м~3-ч-1., a Ro 2—в моль-m~3∙4^1. Оценки, получаемые с помощью этого уравнения, близки к таковым при расчете количества тепла исходя из теплоты сжигания субстратов и микробной биомассы соответствующего состава.
Большинство промышленных биореакторов снабжено охлаждающим кожухом и/или внутренними охлаждающими змеевиками. В последнее время для интенсификации процессов в биореакторах как обычной конструкции, так и новых конфигураций стали использовать наружные охлаждающие контуры. В некоторых реакторах новых конфигураций внутренняя охлаждающая система настолько нарушает основные гидродинамические рабочие характеристики, что исключает такое охлаждение. При увеличении размера реактора создание необходимой внутренней охлаждающей поверхности становится все более трудной задачей. Для геометрически подобных емкостей увеличение объема пропорционально кубу линейных размеров, при этом площадь увеличивается только пропорционально квадрату линейных размеров. Эффективность охлаждения аэробных биореакторов зависит от следующих факторов: 1) переноса тепла от отдельных клеток в культуральную среду; 2) переноса тепла от культуральной среды, содержащей диспергированные пузырьки газа и микроорганизмы, к охлаждающим поверхностям; 3) поступления тепла за счет рассеяния механической энергии, затрачиваемой на перемешивание среды с целью ее аэрации; 4) охлаждения при испарении, выравнивания температур и работы при расширении, связанной с прохождением воздуха через среду; 5) изменения коэффициента теплопередачи вследствие загрязнения охлаждающих поверхностей накапливающимися на них микроорганизмами. Потенциальную значимость этих факторов необходимо рассматривать отдельно для каждой технологической системы.
Когда микроорганизмы диспергированы в толще водной среды, как бывает обычно в процессах, где культивируют бактерии и дрожжи, скорость теплопередачи лимитируется переносом тепла от культуральной среды к охлаждающим поверхностям.
Содержимое аэробного биореактора, работающего в условиях интенсивного перемешивания, можно представить как массу пузырьков, но нужно еще учесть, что жидкая фаза содержит суспендированные микроорганизмы, оказывающие влияние на ее вязкость. Эта последняя зависит от размера микроорганизма, его морфологии и концентрации, а также от способности синтезировать внеклеточные полимерные продукты.
Одна из основных задач аэрации содержимого биореактора — это получение мелких пузырьков газа и тем самым максимальное увеличение площади поверхности, через которую происходит перенос газа в среду. Во многом благодаря свойствам культуральной среды образующиеся в ней пузырьки имеют сферическую форму и относительно слабо деформируются. Фактически они представляют собой упругие сферы, гидродинамические свойства которых сходны со свойствами твердых сферических частиц. Хотя плотность и теплопроводность твердых частиц, с одной стороны, и пузырьков — с другой, явно различны,, поведение пузырьков в некоторых аспектах сходно с поведением частиц в псевдоожиженном слое, хотя в последнем случае- содержание диспергированных частиц обычно выше.
Плотность клеток микроорганизмов очень близка к плотности водной среды, в которой они растут, и при анализе теплопередачи в дисперсионных культурах бактерий и дрожжей, обычно имеющих диаметр эквивалентной сферы меньше 10 мкм, культуральную среду можно рассматривать как однородную водную фазу. В аэрируемых биореакторах перенос тепла от культуральной среды к охлаждающим поверхностям осуществляется путем принудительной конвекции. Чтобы судить о потенциальной эффективности охлаждения, необходимо оценить соответствие характеристик водно-газовых смесей, образующихся при оптимальном транспорте кислорода, факторам, способствующим увеличению теплопередачи от этой смеси к поверхности.
Благодаря хорошим характеристикам теплопередачи реакторы с псевдоожиженным слоем применяются для проведения реакций, которые требуют тщательного контроля температуры. Из-за ожижения частиц увеличивается коэффициент теплопередачи между образуемым ими слоем и теплопередающими поверхностями. Это увеличение определяется в основном тремя факторами: 1) высокой теплоемкостью на единицу объема частиц, благодаря чему они выполняют функцию теплопереносящих агентов; 2) разрушением частицами ламинарного слоя на теплопередающей поверхности и вследствие этого уменьшением эффективной толщины этого слоя; 3) нестационарностью процесса теплопередачи, обусловленной тем, что частицы движутся к теплопередающей поверхности и от нее в виде «пакетов».
Проанализируем значимость этих факторов в применении к процессу диспергирования газа в жидкости. Если главную роль играет первый фактор, то коэффициент теплопередачи между пузырьками и теплопередающей поверхностью будет существенно меньше из-за низкой теплоемкости пузырьков. Если основным является второй фактор, то коэффициент теплопередачи будет больше, а если третий, то может наблюдаться повышенная коалесценция и образование сгустков. В псевдоожиженных системах задержка твердых частиц нередко достигает 0,4, тогда как в реакторах с обычным потреблением энергии задержка газа вряд ли превышает 0,12. При задержке выше 0,2 начинается образование газовых «пробок».
В барботажных колоннах пробулькивание газа через жидкость приводит к двум типам перемещений: 1) циркуляции всего содержимого, вызываемой всей массой пузырьков; 2) локальным микроперемещениям, вызываемым отдельными пузырьками. Экспериментальные данные для суммарного коэффициента теплопередачи в условиях охлаждения жидкости, в которой диспергированы пузырьки газа, за счет теплопередачи к стенке колонны описываются уравнением ![]() (97),
(97),
а за счет теплопередачи к охлаждающему змеевику — уравнением
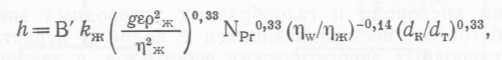 (98),
(98),
где h — суммарный коэффициент теплопередачи, В и В' — константы для системы, kж — теплопроводность жидкости, g — гравитационная постоянная, ε — задержка газа, рж — плотность жидкости, η>κ — вязкость жидкости, Npr — число Прандтля, ηw — вязкость жидкости при температуре теплопередающей поверхности, dκ — диаметр колонны, dτ — диаметр трубки охлаждающего змеевика. Ни одно из этих уравнений нельзя прямо использовать в случае биореактора с интенсивным перемешиванием с помощью мешалки. Из-за значительной рециркуляции в реакторах подобного типа показатели степеней этих уравнений должны быть другими.
Для интенсификации переноса кислорода в биореакторах системы аэрации должны обеспечивать образование как можно более мелких пузырьков. Однако при уменьшении размера пузырьков уменьшается теплопередача. C другой стороны, теплопередача увеличивается при увеличении задержки газа. Из этого следует, что в биореакторах с высокой скоростью переноса кислорода будет, при прочих равных условиях, наблюдаться и более интенсивная теплопередача.
- 10.3.5. Конверсия и рециркуляция
Как мы уже говорили, основным технологическим фактором, от которого зависит экономичность любого микробиологического процесса, является производительность биореактора. Однако в случае нерастворимых или несмешивающихся с водой субстратов и нелимитирующих рост питательных веществ существенную роль начинает играть и величина конверсии. Удельную конверсию субстрата или какого-либо питательного вещества можно определить как отношение массы использованного субстрата к массе субстрата, исходно введенного в систему. Для микробиологических процессов удельная конверсия полностью растворимого, лимитирующего рост субстрата практически равна единице, т. е. остаточная концентрация субстрата, зависящая от сродства участвующих в процессе микроорганизмов к лимитирующему субстрату, близка к нулю. Для нерастворимых или несмешивающихся с водой субстратов и для нелимитирующих рост питательных веществ удельная конверсия часто бывает значительно меньше единицы. Для таких систем коэффициент конверсии, определяемый как вес сухой микробной биомассы или продукта, получаемых на единицу веса введенного субстрата или питательного вещества, будет меньше соответствующего коэффициента выхода. В одних случаях величина конверсии кислорода и газообразных углеродных энергетических субстратов, несмешивающихся с водой и нерастворимых в ней углеродных энергетических субстратов, а также растворимых нелимитирующих рост питательных веществ определяется режимом работы биореактора, в других более важными факторами являются массоперенос, геометрия биореактора и технологические параметры.
Хотя стоимость сырья при аэробной переработке и не повышается из-за использования воздуха в качестве источника кислорода, капитальные и эксплуатационные расходы значительно возрастают в связи с необходимостью получения сжатого воздуха и его стерилизации. В процессах промышленного масштаба важно снизить такие расходы до минимума, максимально увеличивая степень конверсии кислорода, при условии, что расходы на это не приведут к снижению экономичности процесса в целом.
Если в качестве источника кислорода используется воздух, то удельная конверсия кислорода в высокоэффективных лабораторных биореакторах редко превышает 0,2, а в обычных промышленных биореакторах она обычно составляет ~0,1. Даже при таких низких величинах конверсии кислород нередко является лимитирующим рост фактором, поскольку скорость его транспорта не соответствует скорости потребления. Из рассмотрения уравнения (83), описывающего физическую абсорбцию кислорода культуральной средой, следует, что в системах с полностью перемешиваемой газовой фазой высокие значения удельной конверсии кислорода несовместимы с увеличением скорости транспорта кислорода до максимума. Очевидно, при решении этой проблемы следует учитывать технические и экономические факторы. Что касается биореакторов, в которых газовая фаза перемещается в режиме полного вытеснения, то по сравнению с полностью перемешиваемыми системами для них следует ожидать значительно более высоких величин конверсии кислорода при данной скорости транспорта.
Для увеличения удельной конверсии в технологических системах чаще всего используют рециркуляцию. В случае микробиологических процессов такой подход применим в равной мере и к газовой, и к жидкой фазам, впрочем, с некоторыми модификациями.
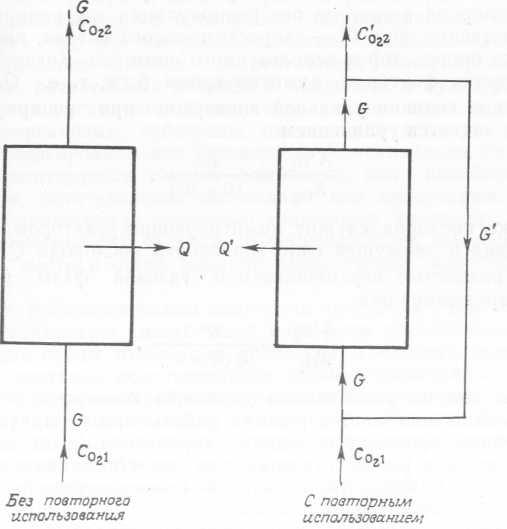
В случае повторного использования газовой фазы их можно рассмотреть на примере двух схем потоков, приведенных на рис. 10.12, — работы в однократном проточном режиме и при рециркуляции газовой фазы в предположении, что переносимый компонент газовой фазы (например, кислород воздуха) является минорным и поэтому газовые потоки, направленные внутрь биореактора и из него, практически одинаковы. Без рециркуляции удельная конверсия кислорода в воздухе Хо„ может быть представлена в виде 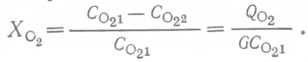 (99)
(99)
В условиях рециркуляции соответствующая величина X'o равна
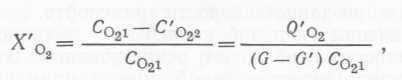 (100)
(100)
где Co21 —концентрация кислорода в потоке газа, поступающего в обе системы, Co22 и C'o22 — концентрации кислорода в потоке газа, выходящем из систем без рециркуляции и с рециркуляцией соответственно, Qo2 и Q,o2 — скорости утилизации кислорода в системе без рециркуляции и с рециркуляцией соответственно, GhG' — скорости газового потока, проходящего через биореактор и используемого повторно. Когда кислород не является фактором, лимитирующим рост, т. е. Qo2 = Q'o2, отношение величин удельной конверсии при рециркуляции и без нее задается уравнением
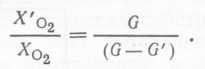 (101),
(101),
Если же кислород служит лимитирующим фактором, то из-за изменения в движущей силе транспорта кислорода Qo2>Q'o2, и для полностью перемешиваемой газовой фазы уравнение (101) принимает вид
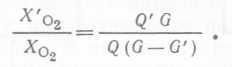 (102).
(102).
Как бы мы ни увеличивали удельную конверсию кислорода, при условии постоянства режима работы при рециркуляции газовой фазы производительность биореактора будет неизбежно уменьшаться в результате снижения движущей силы транспорта кислорода. Ясно, что конверсию нельзя оптимизировать независимо от производительности.
Когда в биореакторы добавляют газообразные или летучие углеродные энергетические субстраты, конверсия рассматривается с совершенно иных позиций. В отличие от кислорода воздуха подобные субстраты представляют собой дорогостоящее сырье, и процессы, в которых они используются, должны быть направлены на достижение очень высокой конверсии либо на полное их использование в системах безотходной технологии с привлечением других процессов. По-видимому, из газообразных углеродных энергетических субстратов наиболее известен метан, хотя в качестве промышленных субстратов можно использовать и другие газообразные алканы. При условии, что метан как сырье для микробиологических процессов можно использовать непосредственно в виде природного газа и вернуть стоимость неутилизованного метана, используя его в таких энергоемких процессах, как сушка, в биореакторе могут быть достигнуты относительно высокие значения удельной конверсии — 0,7—0,8. При этом необходимы реакторы с полным вытеснением газовой фазы и высоким давлением, а также, возможно, с повторным использованием газовой фазы. В качестве альтернативы можно использовать несколько последовательных реакторов высокого давления с полным перемешиванием.
Обратимся теперь к жидкой фазе и рассмотрим потенциальные возможности ее повторного использования. Следует подчеркнуть, что все микробиологические процессы протекают при относительно низких концентрациях микроорганизмов, субстратов, питательных веществ и продуктов в культуральной среде. В них расходуется большое количество воды, в которой эти микроорганизмы, субстраты, питательные вещества и продукты диспергированы или растворены. Концентрация микробов обычно лимитируется такими факторами, как ингибирование субстратом, питательными веществами или продуктами, а в аэробных процессах — скоростью транспорта кислорода. Однако в технологических системах с рециркуляцией биомассы могут иметь место и очень высокие концентрации микроорганизмов.
При микробиологическом получении продуктов с высокой или средней стоимостью имеет смысл повторное использование или регенерация среды только для процессов, в которых задействовано уже частично использованное очень дорогостоящее сырье. В случае крупномасштабного производства повторное использование среды очень выгодно как в плане экономии большого количества высококачественной воды и питательных веществ, так и уменьшения объема сточных вод.
В любой технологической схеме рециркуляции воды/среды ключевым моментом является установление механизма взаимодействия между различными элементарными операциями, образующими данный цикл. При повторном использовании среды возникают следующие проблемы: 1) накопление в среде ингибиторов из-за метаболической активности, сопровождающейся образованием побочных продуктов, или за счет лизиса в процессе рециркуляции; 2) накопление ингибиторов за счет метаболической активности, лизиса или разрушения клеток в биореакторе; 3) накопление в сырье нежелательных, неиспользуемых примесей; 4) рециркуляция неиспользованных субстратов или питательных веществ, вызывающих нарушение физического и химического равновесия и динамическую неустойчивость в биореакторе.
В случае смешанных культур рециркуляция может приводить к избирательному возвращению в биореактор микроорганизмов, составляющих эту смешанную культуру, с неизбежным нарушением популяционного равновесия в биореакторе.
Повторное использование микробной биомассы — это скорее способ интенсификации микробиологических процессов, чем средство увеличения конверсии. В отличие от немногих примеров повторного использования газовой или жидкой фазы в промышленных микробиологических процессах повторное использование микробной биомассы представляет собой хорошо разработанную процедуру, применяемую уже около 70 лет при очистке сточных вод с помощью активного ила.
В математическом представлении непрерывный микробиологический процесс с повторным использованием микроорганизмов эквивалентен непрерывному микробиологическому процессу, в котором происходит преднамеренная или случайная задержка микробов в реакторе. Возможно, такая операция найдет широкое применение в промышленности. Повторное использование и задержка микроорганизмов дают существенное преимущество в тех случаях, когда участвующие в процессе микроорганизмы медленно растут или синтезируют не связанный с ростом продукт. Отметим, что при использовании такого способа интенсификации процесса производительность реактора нельзя будет повысить до тех пор, пока его характеристики, относящиеся к теплопередаче и массопереносу, не будут соответствовать рассчитываемому повышению производительности. Если теплопередача или массоперенос в биореакторе в рабочем режиме без рециркуляции или задержки микробов являются лимитирующими факторами, то производительность реактора можно повысить, только улучшив тем или иным способом эти параметры.
- 10.3.6. Характеристики микробных и мицелиальных суспензий
Состав микробов обычно выражают в виде процентного содержания углерода, водорода, кислорода, азота и золы в расчете на сухую массу. На самом деле жизнеспособные микроорганизмы состоят в основном из воды: на ее долю приходится примерно 70% массы клеток.
Форма и размеры разных микроорганизмов описаны в таксономической литературе, однако следует помнить, что они могут изменяться в зависимости от условий культивирования. При анализе массопереноса и теплопередачи в биореакторах, а также процессов отделения микроорганизмов от конечного продукта часто пользуются понятием «эквивалентный размер» («диаметр эквивалентной сферы»). Этот термин применяется для
культур, в которых клетки растут в виде дискретно диспергированных суспензий. Понятие эквивалентного размера является полезным упрощением, позволяющим в более простой форме описывать динамическое поведение клеток в суспензии. Кроме того, следует принимать во внимание и плотность суспензии. Обычно она составляет 1,07—1,09 г-см3, хотя иногда бывает и ниже—1,03 г∙cм3. Таким образом, плотность водных культуральных жидкостей обычно несколько выше, чем плотность воды.
Единственный случай, для которого было получено выражение для силы сопротивления движению сферических частиц в жидкости, — это погружение частицы с малой скоростью в жидкость бесконечного объема. Для такой частицы Стокс получил уравнение
![]() (103),
(103),
где F — сила сопротивления, η — вязкость жидкости, d — диаметр сферической частицы, и — скорость жидкости относительно частицы. На самом деле условия, в которых выполняется закон Стокса, реализуются редко. В большинстве систем частицы непрерывно испытывают ускорение или замедление; кроме того, даже в условиях ламинарного потока частицы редко бывают изолированы друг от друга, обычно они взаимодействуют между собой.
Конечную скорость погружения частицы и0 можно получить, приравняв силу сопротивления к эффективной силе тяжести, т. е.
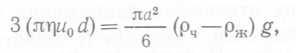 (104)
(104)
где рч и рж — соответственно плотности частицы и жидкости. Отсюда
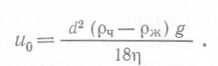 (105).
(105).
Закон Стокса для скорости оседания ис суспензий мелких частиц одинакового размера имеет вид
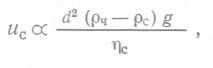 (106)
(106)
где рс — средняя плотность суспензии, ηc — кажущаяся вязкость. Это уравнение учитывает влияние концентрации частиц как на вязкость, так и на плотность жидкости. В случае неоднородных частиц в уравнение (106) можно ввести член, учитывающий изменение их формы и размера.
Что касается биологических процессов, то для них наиболее важным параметром является вязкость соответствующих жидкостей. Она определяется как мера внутреннего трения в жидкости, и в условиях ламинарного потока, т. е. потока с низкими числами Рейнольдса, равна отношению напряжения сдвига к соответствующей скорости сдвига,
т. е.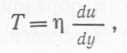 (107), где T — напряжение сдвига, η — вязкость жидкости, du∣dy — скорость сдвига, выраженная через градиент скорости в жидкости.
(107), где T — напряжение сдвига, η — вязкость жидкости, du∣dy — скорость сдвига, выраженная через градиент скорости в жидкости.
Вязкость можно представить либо как произведение силы на время и на величину, обратную квадрату длины, либо как произведение массы на величины, обратные времени и длине. Во всех системах единиц численные значения абсолютной вязкости одинаковы. В технической литературе нередко используется термин «кинематическая вязкость», которая представляет собой произведение абсолютной вязкости на величину, обратную плотности жидкости.
Любую жидкость, вязкость которой при постоянных давлении и температуре постоянна и не зависит от скорости сдвига, называют ньютоновской. Свойствами ньютоновской жидкости обладают все газы и многие гомогенные жидкости. Однако большинство жидкостей не являются гомогенными; так, у многих культуральных жидкостей вязкость меняется с изменением скорости сдвига. Подобные жидкости называют неньютоновскими. Для них отношение напряжения сдвига к скорости сдвига равно кажущейся вязкости, которая, разумеется, зависит от скорости сдвига. Неньютоновские жидкости можно классифицировать по форме соотношения между напряжением сдвига и скоростью сдвига.
Очень многие культуральные среды для выращивания бактерий и дрожжей по существу являются ньютоновскими жидкостями даже при очень высокой плотности клеток, если только в среду не экскретируются в значительном количестве синтезируемые этими микроорганизмами биополимеры. Напротив, культуральные жидкости, в которых растут плесневые грибы или актиномицеты, часто являются неньютоновскими, причем степень отклонения их от поведения ньютоновских жидкостей зависит как от концентрации мицелия, так и от его морфологии. При удалении мицелия из большинства культуральных жидкостей плесневых грибов и актиномицетов они становятся ньютоновскими.
Многие культуральные среды для выращивания плесневых грибов и актиномицетов ведут себя как псевдопластические жидкости, т. е. с увеличением скорости сдвига их кажущаяся вязкость сначала уменьшается. График зависимости напряжения сдвига от скорости сдвига для псевдопластической жидкости сначала имеет форму выпуклой кривой, а затем становится линейным. При экстраполяции линейного участка до пересечения с осью напряжений сдвига мы получим точку, отвечающую предельному напряжению сдвига. Для пластических жидкостей предельное напряжение сдвига соответствует предельной точке.
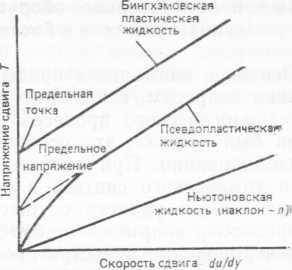
Рис. 10.13. Связь между напряжением сдвига и скоростью сдвига для жидкостей с разными реологическими свойствами.
На рис. 10.13 приведены типы зависимостей между напряжением сдвига и скоростью сдвига. Иногда мицелиальные культуральные жидкости оказы¬ваются тиксотропными, т. е. кажущаяся вязкость уменьшается не только с увеличением скорости сдвига, но и по мере переме¬шивания при данной скорости сдвига.
В общем виде зависимость между напряжением сдвига и скоростью сдвига для неньютоновских жидкостей имеет вид
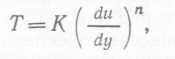 (108), где К и п — константы.
(108), где К и п — константы.
Псевдопластическую жидкость можно в первом приближении охарактеризовать величиной предельного напряжения сдвига и пластической вязкости, т. е. наклоном прямолинейного участка зависимости между напряжением сдвига и скоростью сдвига в линейных координатах. Однако, если построить зависимость напряжения сдвига от скорости сдвига в логарифмических координатах, то линейный участок с наклоном п и точка пересечения К будут определяться начальным участком графика. В истинных бингхэмовских пластических жидкостях движение начинается только после того, как напряжение сдвига превышает предельное значение. В псевдопласти ческих жидкостях некоторое движение возникает даже при низких напряжениях сдвига. При одинаковой энергоемкости и одинаковой геометрии реакторы с псевдопластической жидкостью заметно отличаются от реакторов с ньютоновской средой по задержке газа, распределению пузырьков по размеру и времени перемешивания.

