Главной, определяющей все другие звенья системы питания, является та ее часть, которая отвечает за поступление в наш организм белков. Это происходит из важности и многообразия функций, выполняемых белками. Белки (протеины) – органические соединения, структурной основой которых является полипептидная цепь, состоящая из аминокислотных остатков, соединенных связями (-CO-NH-) в определенной последовательности. Белки – это главные компоненты тканей всех организмов; структурная, защитная, сократительная, регуляторная, рецепторная, транспортная, ферментативная, энергетическая, - это часть из функций белков.
Протеиногенные аминокислоты пищи участвует в образовании многих важных биологических соединений: пуриновых (глн, гли, асп) и пиримидиновых нуклеотидов (глн, асп); серотонина (трп), меланина (фен, тир), гистамина (гис), адреналина, норадреналина, тирамина (тир), полиаминов (арг, мет), холина (мет), порфиринов (гли), креатина (гли, арг, мет), коферментов, сахаров, липидов и т.д. Первостепенная важность выполняемых белками функций велика, однако, не меньшая, по значимости, и роль аминокислот (АМК) в жизнедеятельности организма, следовательно, имеет смысл говорить о «почтительном» отношении к белкам, как к главным компонентам пищи. Такое «почтение» должно выражаться в понимании процессов взаимоотношений: «белок пищевых продуктов – организм». В современных науках о питании рассмотрение этих процессов сводится к оцениванию пищевого протеина на предмет его биологической ценности и степени усвоения, чем они выше, тем белок качественно лучше для употребления в пищу. Однако, исходя из свойств протеинов и АМК, эти понятия не могут быть исчерпывающими, так как кроме пластического и энергетического источника, пища является источником специфической информации - это исходит из регуляторной функции и ряда иных свойств белков и АМК. В этой работе предлагается оговорить определение полезности пищевого белка, критерия, который учитывает «информационную нагрузку» протеина пищи.
Полезность белка – качество, которое должно способствовать максимально точной реализации наследственной информации, заложенной в хромосомах (ДНК), иными словами, качество, способствует формированию условий для гармоничного взаимодействия нашего организма и окружающей среды, для сохранения баланса взаимных влияний. Выбор объекта рассмотрения (продукта) сформировался на базе большого количества противоречивых работ, в основном указывающих на предпочтительную полезность (а не ценность) белка мяса рыбы. В связи с отмеченным отсутствием систематизации информации в указанной сфере знаний, возникла необходимость провести распределение имеющихся данных по смысловым группам, определяющим понятие полезность для пищевого белка: усвояемость, антигенная безопасность, аминокислотный состав белка рыбы. Такая переработка информации должна ясно отобразить основания выдвинутого предположения о наибольшей полезности рыбы. Таким образом, целью работы является доказательство предпочтительной полезности рыбы в качестве источника пищевого протеина в сравнении с другими продуктами, поставляющими в организм человека преимущественно белки, опираясь в оценивании на критерий пищевой полезности.
Биологическая ценность белков. Клетки всех организмов и тканей тела человека постоянно ресинтезируют собственные белки. Для осуществления этого процесса в наш организм должны поступать вместе с пищей протеины экзогенного происхождения, в результате превращения которых мы получаем АМК – «строительный материал» для организма. Из двадцати протеиногенных АМК восемь (трп, лей, иле, мет, фен, вал, лиз, тре) для взрослого человека являются незаменимыми (НАМК), а остальные могут синтезироваться (при условии длительного недостатка поступления так же могут перейти в разряд несинтезируемых). Степень использования белка пищи значительным образом зависит от соотношения в нем НАМК и близости аминокислотного состава потребляемого протеина к таковому белков тела хозяина – этот показатель называется «биологической ценностью». Различные по происхождению растительные и животные белки отличаются по биологической ценности. Протеины растений содержат мало НАМК, в частности, лизина, метионина, треонина – их недостаток приводит к отсутствию полного использования аминокислотного пула растительных белков для процессов синтеза в нашем организме.
Поступивший с пищей белок должен в начале усвоиться, и степень эффективности этого процесса зависит от ферментной атакуемости пептидных связей протеина. Ряд белковых веществ (напр.: волосы, шерсть, перья и др., рис. 18), несмотря на их близкий аминокислотный состав к белкам тела человека, почти не утилизируется, вследствие неспособности протеиназ желудка и кишечника человека гидролизовать их.
Таким образом, имеется условие, влияющее на степень усвоения пищевого протеина помимо его аминокислотного состава – структурная организация белковых молекул, детерминирующаяся, в свою очередь, генетически, которая при соответствующей обработке может быть изменена так, чтобы утилизация белка повысилась.

Для продуктов различного происхождения разнообразная кулинарная обработка с целью повышения диетологических свойств, дает неравнозначный выход полезных качеств продукта: повышение ферментной атакуемости, сохранность нутриентов (витаминов, минералов и др.). Обработка перегретым паром значительно в большей степени повышает ферментативную атакуемость протеинов указанного продукта по сравнению с традиционным жарением. Это утверждение уравновешивает показатели на весах биологической ценности мяса и рыбы (рис. 19).

Наличие воды является главным фактором снижающим тепловое повреждение белка. Обратно (противоположно) влияющими факторами являются время (чем длительнее процесс обработки, тем больше тепловое повреждение), редуцирующие сахара (глюкоза, фруктоза, лактоза) и самоокисленные жиры (чем их больше, тем больше протеина вступает в малорастворимые соединения, например, реакция Майяра с образованием фруктозолизина); наибольшее сохранение питательных веществ обеспечивается приготовлением паровых котлет с наполнителем (овощи, хлеб или крупы). В целом современная наука о питании рекомендует щадящие температурные режимы обработки пищи.
По сравнению с жирами и углеводами белки являются наиболее важными и дорогостоящими ингредиентами мясопродуктов, оказывающими существенное влияние на их качество. Поэтому белки, добавляемые в мясную систему, должны иметь качество, близкое белкам мяса или превосходить его.
С точки зрения физиологии питания, белок - один из основных компонентов, предназначенный для удовлетворения потребности организма человека в аминокислотах, участвующих в обменных процессах и построении тканей организма. Пищевая ценность белков характеризуется, прежде всего, их биологической ценностью или аминокислотным составом, в зависимости от которого различают белки полноценные, содержащие полный набор незаменимых аминокислот, и неполноценные.
Данные о содержании аминокислот в идеальном или гипотетическом белке приведены в справочной шкале ФАО/ВОЗ. Белок обладает высокой биологической ценностью, если расчетные значения скоров аминокислот больше 100%. Значение скора хотя бы одной из незаменимых кислот меньше 100% свидетельствует о наличии лимитирующей аминокислоты в белке.
Химический анализ показал наличие во всех белках углерода (50-55%), кислорода (21-23%), азота (15-17%), водорода (6-7%), серы (0,3-2,5%). В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
Содержание основных химических элементов в белках может различаться, за исключением азота, концентрация которого характеризуется наибольшим постоянством и в среднем составляет 16%. Кроме того, содержание азота в других органических веществах мало. В соответствии с этим было предложено определять количество белка по входящему в его состав азоту. Зная, что 1 г азота содержится в 6,25 г белка, найденное количество азота умножают коэффициент 6,25 и получают количество белка. Для определения химической природы мономеров белка необходимо решить две задачи: разделить белок на мономеры и выяснить их химический состав.
Усвоение белка зависит не только от соотношения аминокислот, но и от доступности его пищеварительным ферментам и наличия антипитательных соединений. Технологическое качество белка проявляется в процессе формирования структуры пищевых систем и зависит от его функционально - технологических свойств (ФТС). В таблице 4 приведен аминокислотный состав и химический скор некоторых видов сырья.
Таблица 4 – Аминокислотный состав (г/100г белка) и химический скор (АС, %) некоторых видов сырья
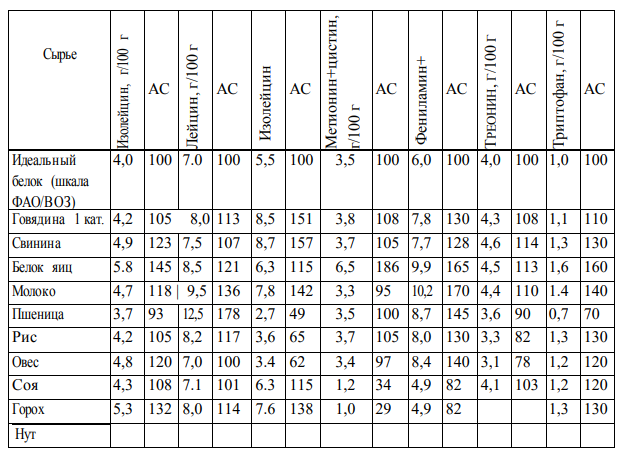
Среди ФТС основным является растворимость, которая определяет гелеобразующие и поверхностно-активные свойства белка, то есть эмульгирующую способность, ценообразование, адгезию, когезию и так далее. Оптимальным по качеству является белок, сочетающий высокие питательные и функциональные свойства и безопасный для потребителя.
Белки подразделяются на две большие группы: простые белки, или протеины, и сложные белки, или протеиды. При гидролизе протеинов в кислом водном растворе получают только α-аминокислоты. Гидролиз протеидов дает кроме аминокислот и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.); это соединения белковых веществ с небелковыми. Альбумины хорошо растворяются в воде. Встречаются в молоке, яичном белке и крови.
Глобулины в воде не растворяются, но растворимы в разбавленных растворах солей. К глобулинам принадлежат глобулины крови и мышечный белок миозин. Глутелины растворяются только в разбавленных растворах щелочей.
Склеропротеины – это нерастворимые белки. К склеропротеинам относятся кератины, белок кожи и соединительных тканей коллаген, белок натурального шелка фиброин. Протеиды построены из протеинов, соединенных с молекулами другого типа (простетическими группами).
На рисунке 20 показаны виды белковых соединений.
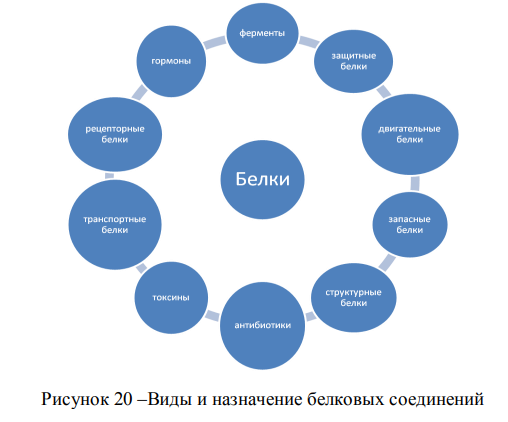
Фосфопротеиды содержат молекулы фосфорной кислоты, связанные в виде сложного эфира у гидроксильной группы аминокислоты серина. К ним относится вителлин–белок, содержащийся в яичном желтке, белок молока казеин. Гликопротеиды содержат остатки углеводов. Они входят в состав хрящей, рогов, слюны. Хромопротеиды содержат молекулу окрашенного вещества, обычно типа порфина. Самым важным хромопротеидом является гемоглобин - переносчик кислорода, окрашивающий красные кровяные тельца.
Нуклеопротеиды – протеины, связанные с нуклеиновыми кислотами. Они представляют собой очень важные с биологической точки зрения белки–составные части клеточных ядер. Нуклеопротеиды являются важнейшей составной частью вирусов – возбудителей многих болезней.
При соединении двух или нескольких аминокислот образуется более сложное соединение - полипептид. Полипептиды, соединяясь, образуют еще более сложные и крупные частицы и в итоге - сложную молекулу белка. Белки (рис. 21) подразделяются на группы.
Первая группа включает: белки животного происхождения от переработки продуктов животноводства, то есть белки мяса и молока; природной фауны, например, мяса диких животных; а также от переработки рыбы, рыбопродуктов и белки растительного происхождения от переработки продукции растениеводства, такой как зерновые и бобовые (пшеница, рис, овес, просо, кукуруза, соя, горох, рис. 21).

Вторая группа включает большую совокупность сырья, которое условно можно классифицировать следующим образом: белки от переработки вторичного сырья, широко применяемые в технологии различных пищевых продуктов, в том числе мясных. В эту группу включены продукты от переработки крови - плазма и сыворотка; переработки молоки - молочная сыворотка, обрат, пахта; помола зерна, шрот от переработки масличных культур (рис. 22); белоксодержащее сырье, не получившее пока широкого применения, но представляющее ближайшую перспективу.

К этой группе следует отнести продукты переработки зерновых или масличных культур, например, муку зерновых и зернобобовых пшеничную, ячменную, овсяную, шрот масличных культур таких как арахис, кунжут, подсолнечник, изолированные белковые препараты чечевицы, нута, вики; белоксодержащее сырье, представляющее практическую ценность, но пока мало изученное, например, шрот от переработки рапса, амаранта, а также такие растения, как люцерна, люпин, стевия, стахис.
Третья группа - новые, малоизученные с точки зрения безопасности виды белкового сырья, например, белки водорослей (рис. 23), высших грибов, микробиальный белок, в том числе белок дрожжей и низших грибов.

Белки активно вступают в химические реакции. Это свойство связано с тем, что аминокислоты, входящие в состав белков, содержат разные функциональные группы, способные реагировать с другими веществами. Важно, что такие взаимодействия происходят и внутри белковой молекулы, в результате чего образуется пептидная, водородная дисульфидная и другие виды связей. К радикалам аминокислот, а следовательно и белков, могут присоединяться различные соединения и ионы, что обеспечивает их транспорт по крови.
Белки являются высокомолекулярными соединениями. Это полимеры, состоящие из сотен и тысяч аминокислотных остатков – мономеров. Соответственно и молекулярная масса белков находится в пределах 10 000 – 1 000 000. Так, в составе рибонуклеазы (фермента, расщепляющего РНК) содержится 124 аминокислотных остатка и ее молекулярная масса составляет примерно 14 000. Миоглобин (белок мышц), состоящий из 153 аминокислотных остатков, имеет молекулярную массу 17 000, а гемоглобин – 64 500 (574 аминокислотных остатка). Молекулярные массы других белков более высокие: -глобулин (образует антитела) состоит из 1250 аминокислот и имеет молекулярную массу около 150 000, а молекулярная масса фермента глутаматдегидрогеназы превышает 1 000 000.
В последнее время в отдельную группу выделены белки с рецепторной функцией. Есть рецепторы звуковые, вкусовые, световые и др. рецепторы. Следует упомянуть и о существовании белковых веществ, тормозящих действие ферментов. Такие белки обладают ингибиторными функциями. При взаимодействии с этими белками фермент образует комплекс и теряет свою активность полностью или частично. Многие белки - ингибиторы ферментов выделены в чистом виде и хорошо изучены. Их молекулярные массы колеблются в широких пределах; часто они относятся к сложным белкам - гликопротеидам, вторым компонентом которых является углевод. Если белки классифицировать только по их функциям, то такую систематизацию нельзя было бы считать завершенной, так как новые исследования дают много фактов, позволяющих выделять новые группы белков с новыми функциями. Среди них уникальные вещества – нейропептиды (ответственные за жизненно важные процессы: сна, памяти, боли, чувства страха, тревоги).
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна третичная структура белка, которая формируется в процессе фолдинга (от англ. folding, «сворачивание»). Третичная структура формируется в результате взаимодействия структур более низких уровней.
Выделяют четыре структуры белка:
первичная структура это последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы - сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка;
вторичная структура - локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков: α-спирали - плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали. β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин;
третичная структура- пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие: -ковалентные связи (между двумя остатками цистеина – дисульфидные мостики); -ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; -водородные связи; -гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
четверичная структура (или субъединичная, доменная) - взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.

