В январе 1980 г. Гилберт и Вейссман из Бостона сообщили, что им удалось получить интерферон человека в генетически сконструированных клетках кишечной палочки. Оба исследователя сотрудничали в компании «Биоген», ученые которой (сам Вейссман, а также Нагата, Таира, Холл, Джонсруд, Стреули, Эшёди и Болл) были первыми наряду с Кантеллом из Центральной лаборатории здравоохранения в Хельсинки, кому удалось продемонстрировать такой синтез. Исходная трудность, с которой они столкнулись, заключалась в том, что матричной РНК а-интерферона мало даже в лейкоцитах, стимулированных заражением вирусом.
Используя современную технику, исследователи получили из матричной РНК, выделенной из лейкоцитов (из 17 л крови в одном опыте), двуспиральную ДНК-копию, которую встроили в плазмиду, и получили клоны. Они испытали свыше 20 000 клонов, подвергая гибридизации содержащиеся в них плазмиды с мРНК из лейкоцитов, выделяли РНК, которая связывалась с каждым из клонов, и проверяли ее способность кодировать интерферон, причем не в системе in vitro, а в ооцитах (синтезирующегося интерферона было достаточно, чтобы провести испытание биологической активности). После этого Вейссман и его коллеги установили, что отдельные клоны кишечной палочки, которые содержали ген лейкоцитарного интерферона, были способны синтезировать лишь крайне незначительные количества этого белка: всего 1-2 молекулы на клетку (бактериальные белки представлены в клетке 1000-100 000 молекул).
В июле 1980 г. группа исследователей из японского института, возглавляемая Танигучи, подобным же способом получила фибробластный интерферон, однако выход белка был выше, чем в опытах американскцх исследователей: он составлял до 100 молекул на одну бактериальную клетку. По мнению Танигучи, выход можно было довести до 10 000 молекул на бактериальную клетку. До того, в ноябре 1979 г., японские ученые сконструировали гибридные плазмиды с геном фибробластного интерферона. Третья группа исследователей под руководством Ревеля в Вейцманновском институте и Тиолле в Институте Пастера пришла к аналогичному результату: в генетически сконструированных клетках кишечной палочки синтезировались следовые количества фибробластного интерферона.
Важным шагом в этом «соревновании» за интерферон было установление в 1980 г. нуклеотидных последовательностей генов лейкоцитарного (IFN-α) и фибробластного (IFN-β) интерферона. Танигучи с сотр. (Токио), Хоутон с сотр. (лаборатории «Сёрл» в Великобритании) и Деринк с сотр. (Гентский университет и Институт медицинских исследований Рега, Католический университет, Лувен) определили последовательность нуклеотидов в гене фибробластного интерферона, а Вейссман с сотр. и Матеи с сотр.в гене лейкоцитарного интерферона.
Матричная РНК IFN-13 состоит из 836 нуклеотидов, из которых 72 и 203 нуклеотида приходятся соответственно на 5'и 3'-нетранслируемые области, 63 нуклеотида кодируют пептид, ответственный за секрецию интерферона из клеток, и 498 нуклеотидов кодируют 166 аминокислотных остатков собственно интерферона. Молекула этого белка, точнее гликопротеида, имеет массу 20 000 дальтон.
Матричная РНК IFN-a состоит из 865 нуклеотидов, из которых 242 приходится на 3'-нетранслируемую область. Имеется также участок, кодирующий пептид из 23 аминокислот, не.обходимый для секреции, за которым располагается последовательность из 498 нуклеотидов, кодирующих 166 аминокислот.
Лейкоцитарный и фибробластный интерфероны довольно близки по структуре, и, как сообщил Вейссман на промежуточном симпозиуме по химии и биологии интерферонов (проходившем в Калифорнии в марте 1982 г.), у человека известно 14 различных генов, кодирующих IFN-α. Вейссман картировал ген IFN-α мыши и предположил, что если гены IFN-α и IFN-β дивергировали от предкового гена приблизительно 400 млн. лет назад, то гены IFN-α мыши и человека дивергировали около 70 млн. лет назад.
Деринк и его коллеги (1980) сконструировали гибридные плазмиды, содержащие комплементарную ДНК фибробластного интерферона человека, и обратили внимание, что экспрессия такой ДНК в клетках Е.coli зависит от ориентации ее в плазмиде и от индукции транскрипции с промотора фага λ. Физико-химические, биологические и иммунологические исследования белков, синтезированных бактериальными клетками, позволили заключить, что биосинте ический интерферон по свойствам очень близок к подлинному фибробластному интерферону. Однако выход его был низким: около 100 единиц на 5•108 клеток. Исследователи надеялись повысить выход за счет более эффективных плазмид.
В марте 1981 г. сотрудники факультета генетики Университета Вашингтона в Сиэтле сообщили, что им совместно с исследователями «Генентек» (Сан-Франциско) удалось синтезировать лейкоцитарный интерферон, используя генетически сконструированные клетки дрожжей. Это был первый случай синтеза человеческого белка в дрожжевых клетках. Хитцман, Хэги, Левин и Гёддель («Генентек») и Аммерер и Холл (Университет Вашинпона) (1981) соединили в клетках Saccharomyces cerevisiae последовательность ДНК, кодирующую лейкоцитарный интерферон человека (LelF-D), с геном алкогольдегидрогеназы дрожжей в плазмиде, способной к автономной репликации как в клетках Е. coli, так и в клетках S. cerevisiae, и ввели полученную плазмиду в клетки S. cerevisiae. Замена промотора и 5'-лидерного участка гена интерферона на соответствующие последовательности гена алкогольдегидрогеназы дрожжей и встраивание обоих генов в плазмидный вектор позволили добиться эффективной экспрессии гена LeIF. При этом синтезировалось до 106 молекул лейкоцитарного интерферона на клетку. Такой выход, полученный в предварительных экспериментах, исследователи считали высоким; это служило доказательством стабильности молекул интерферона в дрожжевых клетках. По мнению Б. Холла, возглавляющего факультет генетики в Университете Вашингтона (занимавшегося генетикой дрожжей с 1950 г.), при замене бактерий клетками дрожжей производство интерферона может возрасти до 10 раз. Клетки Saccharomyces cerevisiae действительно обладают особыми преимуществами при синтезе гликопротеидов высших организмов (например, интерферонов), поскольку присоединение углеводных групп (гликозилирование) в них осуществляется по тому же механизму, что и в клетках животных.
Соревнование в клонировании последовательности ДНК, кодирующей ϒ-интерферон, снова выиграли молекулярные биологи из «Генентек». На втором ежегодном международном конгрессе по исследованию интерферона, проходившем в конце октября 1981 г. в Сан-Франциско, Гёддель сообщил, что ему и его коллегам удалось определить последовательность ДНК, кодирующую ϒ-интерферон, и показать, что если эту последовательность ввести в геном бактерий, дрожжей или клеток млекопитающих, они становятся способными синтезировать ϒ-интерферон. Исследователи из «Генентек» выделили смесь молекул матричной РНК из лимфоцитов человека, после чего получили молекулы соответствующих ДНК-копий и ввели их в клетки Е. coli. Затем были отобраны бактерии, продуцирующие иммунный интерферон; при этом использовалась относительно меньшая устойчивость ϒ-интерферона к кислотам (рН 2) этим -он отличается от более стабильных α- и β-интерферонов. Количества интерферона, синтезирующегося в культурах клеток, были следующие: в 1 л культуры Е. coli синтезировалось 25 000 единиц; в 1 л культуры клеток дрожжей (S. cerevisiae) - 1 млн. единиц; в 1 л культуры клеток обезьяны - 100 000 единиц ϒ-интерферона.
По нуклеотидной последователности ген ϒ-интерферона отличался от генов α-интерферона, но размеры их были близки. Гены, кодирующие α- и β-интерфероны, не содержали нитронов и поэтому без помех -экспресеировались в клетках бактерий, тогда как ген ϒ-интерферона содержал три нитрона и четыре экзона и располагался на 12-й·.хромосоме человека. Исследователи из· «Генентек» (а также Вейссман из «Биоген», Вильчек из Медицинской школы Нью-Йоркского университета и Худ из Калифорнийского. технологического института) попытались установить, не содержит ли клетка более одного вида ϒ-интерферона, как в случае а-интерферона.
В апреле 1982 г. Фалькофф и его коллеm из лаборатории по исследованию интерферона (INSERМ U 196, Институт Кюри в Париже) совместно с исследователями компании «Трансжен» (Страсбург) и фармацевтической компании «Руссель Юклаф» выделили и клонировали ген, способный кодировать ϒ-интерферон в ооцитах лягушки. Клонирование этого гена в клетках бактерий и в культурах клеток было уже следующим этапом, необходимым для начала широкомасштабного производства препарата.
В июне 1982 г. исследователи японской компании «Сантори» добились успеха в клонировании гена, кодиру ющего ϒ-интерферон, в клетках Е. coli; предварительно они химически синтезировали этот ген, включая его нитроны (некодирующие последовательности).
Важный шаг на пути к производству интерферона в достаточных количествах был сделан в августе того же года, когда группа из дев.яти английских исследователей из фармацевтического отделения компании «Империал кемикал индастриз» (ICI) и из Школы биологических наук Лестерского университета опубликовала результаты своей работы·по полному синтезу гена, кодирующего лейкоцитарный интерферон человека. Эти эксперименты были начаты, когда в результате получения ДНК-копии мPHK интерферона были установлены нуклеотидные последовательности генов интерферона. Эксперименты продолжались полтора года. На основе нуклеоmдной последовательности ДНК-копии лейкоцитарного интерферона (IFN-a1), опубликованной Вейссманом с сотр. в 1980 г., английским исследователям удалось сконструировать близкую к ней полную последовательность ДНК, способную кодировать а1-интерферон.
Ранее уже создавались синтетические гены, в том числе ген соматостатина человека (Итакура, 1977), гены обеих полипептидных цепей инсулина человека (Гёддель и др., 1979) и ген Nα деацетилтимозина α1, (Ветцель с сотр., 1980), однако α1,-интерферон представляет собой крупную молекулу, состоящую из 166 аминокислот, и соответствующий ген (длиной 514 нуклеотидов) был самым крупным геном, синтезированным до тех пор. Поскольку нуклеотиды в комплементарных цепях ДНК должны быть прочно связаны друг с другом, Эдж и его коллеги синтезировали последовательность ДНК длиной в общей сложности свыше 1000 нуклеотидов.
Оригинальный подход английских исследователей положил начало новому методу синтеза олигонуклеоmдов, который позволил существенно ускорить синтез гена. Они начали с присоединения нуклеотида к полиакриламидной смоле, после чего проводили присоединение пар нуклеотидов, используя конденсирующий агент в безводном пиридине. Каждый цикл завершался за полтора часа, так что за год можно было синтезировать последовательность длиной в 5000 нуклеотидов. Благодаря такому методу ученые синтезировали 67 олигонуклеотидов, которые с помощью лигазы были соединены с образованием двунитевой ДНК, состоящей из 514 пар нуклеотидов. Этот химический синтез был проведен за время, сравнимое с тем, которое необходимо для выделения гена из клеток человека.
В статье, опубликованной в журнале Proceedings of the National Academy of Science (19, № 14, 1982) де Майером и десятью другими исследователями из Института Кюри (Орсэ, Франция), Больницы детских заболеваний (Онтарио, Канада), Лестерского университета и ICI, бьmа доказана экспрессия синтетического гена. После встраивания в плазмиду ген в ее составе вводили в клетки двух видов бактерий Е. coli и Methylophilus methylotrophus. Последний выращивается в среде, содержащей метанол, с тем, чтобы получить клеточную биомассу и белок на одном из заводов ICI. Как полагают, этот вид имеет преимущества при производстве интерферона и менее опасен по сравнению с кишечной палочкой. По мнению де Майера и его коллег, белок, синтезированный в генетически сконструированных бактериальных клетках, по биологическим свойствам не отличается от природного α1 -интерферона.
Важность методики исследователей из Лестерского университета подчеркивалась представленными группой де Майера доказательствами экспрессии синтетического гена и биологической активности его продукта. Подобный синтез мог бы послужить отправной точкой в серии экспериментов, ставящих целью изменение структуры молекул интерферона посредством модификаций в структуре его гена. Он мог бы пролить свет на функцию различных частей молекулы интерферона и даже позволил бы конструировать «гибридные молекулы», содержащие элементы двух или более различных интерферонов. Методическое достижение английских исследователей наверняка откроет широкую дорогу экспериментальным работам, направленным на увеличение эффективности различных типов интерферона (α, β и ϒ) и совершенствование их производства, а также на установление взаимосвязи структуры молекул и их физиологической функции.
В ряде исследовательских учреждений и промышленных компаний для получения различных классов интерферона были применены методы генной инженерии: так, в США получением α 2-интерферона занималась компания «Биоген» (в сотрудничестве с «Шеринг-Плау» ), β-интерферона (компания «Цетус» в сотрудничестве с «Шелл»), синтезом β-интерферона в клетках дрожжей «Коллаборейтив генетикс» (в сотрудничестве с «Интерферои сайенс, инк.»), получением α-, β- и ϒ-интерферона в клетках Е. coli и дрожжей-«Генентек», производством α- и β-интерферонов по технологии «Генентек» (без права продажи в США)-фирма «Хофман-Ла Рош»; в Японии над получением ϒ-интерферона по технологии «Генентек» (исключительно для японского рынка) работала компания «Дайичи сейяки», над синтезом β-интерферона«Киёва хакко когио» и «Мицуи тоацу кемикал» (в сотрудничестве с «Генентек»), над получением β- и ϒ-интерфероновкомпания «Торей индастриз» совместно с «Генентек»; во Франции синтезом β-интерферона занимался Институт Пастера, ϒ-интерферона-компания «Трансжен»; в Великобритании β-интерферон разрабатывала компания «Сёрл»; в Швеции компания «Каби витрум АБ» занималась синтезом ϒ- и β-интерферонов в клетках Е. coli; в Израиле в Вейцманновском институте получали β-интерферон.
В ряде лабораторий была осуществлена очистка интерферонов, без которой немыслимы ни установление структуры его молекул, ни проведение клинических испытаний. Пестка из Института молекулярной биологии Роша (шт. Нью-Джерси) очистил интерферон из сыворотки больного хроническим миелоидным лейкозом и получил кристаллы рекомбинантного лейкоцитарного интерферона; то же сделала группа Вейссмана. И хотя третичную структуру этого белка еще предстояло определить методом рентгеноструктурного анализа, по локализации гидрофильных и гидрофобных аминокислотных остатков Ветцель из «Генентек» предположил, что лейкоцитарный интерферон принадлежит к глобулярным белкам с гидрофобной сердцевиной, причем более 65% молекулы находится в форме а-спиралей, разделенных β-слоями. И Ветцель, и Пестка отметили, что последние 11 аминокислот молекулы рекомбинантного лейкоцитарного интерферона не обязательны для его противовирусного действия. Так, Пестка с сотр. выделили три природные формы а-интерферона длиной всего в 155 аминокислот, тогда как длина большинства молекул составляет 165 или 166 аминокислот. Природный ϒ-интерферон был очищен Вильчеком (Медицинская школа Нью-Иоркского университета), который установил, что этот интерферон присутствует в двух формах с молекулярными массами 20 000 и 25 000 дальтон. Используя ϒ-интерферон, молекулы которого были помечены 125I, вильчек показал, что для лейкоцитарного и фибробласnюго интерферонов используется один и тот же клеточный рецептор, а для иммунного интерферона - совершенно иной.
В целом усилия, направленные на получение интерферонов с использованием генетически сконструированных микроорганизмов и на снижение затрат на их производство по сравнению с методом культуры клеток до 100 раз, не исключают исследований по совершенствованию этого метода, которые необходимы для получения этих препаратов в количествах, достаточных для клинических и терапевтических испытаний. Для проведения испытаний на безопасность интерферона потребуется время, только после этого можно будет приступить к выпуску препарата, синтезируемого клонами микроорганизмов. С другой стороны, разнообразие молекул интерферона диктует необходимость проведения физиологических и клинических исследований для установления различий между классами интерферонов, поэтому их производство и массовый выпуск следует ожидать не ранее середины 80-х гг. и даже 1990 г. В табл. 2 суммированы различные методы получения интерферонов, состояние клинических испытаний, а также предполагаемые сроки начала коммерческого производства.
Таблица 2. Методы получения лейкоцитарного, фибробластного и иммунного интерферонов, клинические проверки и перспективы коммерческого производства (по состоянию на 1980 г.)

Клинические и терапевтические испытания интерферонов
Для установления противоопухолевых и противовирусных свойств интерферона требуется подход, который существенно отличается от общепринятого: во-первых, интерферон доступен лишь в крайне ограниченных масштабах, во-вторых, он настолько видоспецифичен, что клинические испытания приходится проводить на людях, так как опыты на животных оказываются по существу бесполезными. И хотя запасы интерферона увеличиваются, это не сопровождается убедительными и контролируемыми клиническими и терапевтическими испытаниями, которые включали бы установление безопасных доз и адекватного контроля.
К числу наиболее совершенных следует отнести испытания, проводимые в настоящее время Американским онкологическим обществом, в которых используется лейкоцитарный интерферон (смесь интерферонов), поставляемый лабораториями Финляндии. Эксперименты проводились на запущенных опухолях молочной железы. Аналогичные испытания того же препарата в Больнице М. Д. Андерсона в Хьюстоне (шт. Техас) дали следующие результаты: после лечения из 43 случаев рака молочной железы в 12 случаях наблюдалось уменьшение размеров опухоли вдвое, еще в шести случаях наблюдались менее выражщшые эффекты. Терапевтические тесты, проводимые Американским онкологическим обществом при лечении злокачественной меланомы, оказались менее обнадеживающими: из 43 случаев только в одном случае наблюдались благоприятные изменения, еще в пяти случаях эффект был значительно меньше. Только у четырех из 23 больных, страдающих множественной миеломой, наблюдалось улучшение состояния. Ученые Американского онкологического общества приняли решение впредь испытывать интерферон в комбинации с другими противоопухолевыми агентами. В случае карциномы молочной железы выяснилось, что интерферон может быть столь же эффективен, как и любое другое отдельное терапевтическое средство, но, вероятно, он менее эффективен по сравнению с сочетанием нескольких противораковых препаратов.
В 1981 г. под эгидой Национального института рака (США) были организованы клинические испытания лейкоцитарного интерферона в трех центрах и испытания лимфобластоидного интерферона в двух других центрах. Результаты первого этапа терапевтических испытаний рекомбинантного α 2-интерферона и лимфобластоидного интерферона выявили некоторую противораковую активность при ряде раковых заболеваний человека.
16 января 1981 г. в Хьюстоне группа медиков из Техасского университета, возглавляемая Дж. Гаттерменом, сообщила, что для лечения больных раком был применен рекомбинантный лейкоцитарный интерферон, производимый компаниями «Генентек» и «Хофман Ла Рош». Это было ограниченное терапевтическое испытание, однако оно показало, как и в случаях инсулина и соматостатина, что от момента получения биологически активного вещества в генетически сконструированных клетках до его испытания на людях проходит все меньше времени. Двумя годами раньше та же группа, как и ряд других медицинских групп во всем мире, провела испытания лейкоцитарного интерферона, получаемого из культуры клеток. Планируя новые испытания на восьми добровольцах, Гаттермен наметил первую стадию продолжительностью от четырех месяцев до полугода, с тем чтобы выявить побочные эффекты, индуцируемые при повторных введениях препарата, и установить размер эффективных доз. Биосинтетический интерферон получали лишь восемь добровольцев, в том числе молодая женщина, страдающая лимфомой. Эти испытания не были согласованы с Национальным институтом рака и Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA), тем не менее Комитет по надзору за медицинскими учреждениями заверил, что этические правила были соблюдены. И все же эксперимент подвергся критике со стороны ряда специалистов, поскольку, по их мнению, испытания были связаны с серьезными этическими проблемами, а риск, на который пошла американская группа, представлялся им высоким.
С другой стороны, терапевтические испытания ϒ-интерферона, который Лабораторци Мэлой поставляли группе Гаттермена и в больницу М. Д. Андерсона в Хьюстоне, начались 9 февраля 1982 г. с одобрения FDA. В том же году Гаттермен сообщил о лечении 19 больных с карциномой почки; у семи пациентов лечение интерфероном привело к ослаблению заболевания.
В апреле 1982 г. на ежегодной конференции Американского общества клинической онкологии в Сент-Луисе (шт. Миссури) Национальный институт рака (США) распространил список терапевтических испытаний различных классов интерферонов, проводящихся в стране. Испытания нативных белков касались интерферонов классов β и ϒ, а в перспективе испытания (вторая стадия) связаны с изучением рекомбинантного α-интерферона. Одним из условий для разрешения подобных испытаний FDA ставила более высокую степень очистки испытываемых интерферонов. Хотя, по мнению американских специалистов, предстояла очень большая работа с интерферонами из клеток крови и фибробластов, главная роль в среднесрочных планах отводилась получению рекомбинантного интерферона. Это должно было привести к усилению конкуренции между компаниями, поставляющими интерфероны в медицинские учреждения.
В Швеции компания «Каби витрум АБ» и университетские лаборатории с 196 г. активно ведут исследования интерферонов человека. С 1979 г. они проводятся ее генно-инженерным филиалом «Кабиген АБ». В 1971 г. были предприняты терапевтические испытания лейкоцитарного интерферона, получаемого по методу Кантелла (3,6 млн. единиц в ·месяц). В 1980 г. в Королевской больнице под надлежащим контролем была начата серия испытаний лейкоцитарного интерферона для лечения 50 больных остеосаркомой. Судя по результатам испытаний, интерферон оказался эффективнее обычных терапевтических средств. В Великобритании на клинические испытания, проводимые на 80 больных, был выделен 1 млн. ф. ст. Исследовались четыре типа опухолей. Испытания преследовали своей целью получение быстрых результатов, чтобы не препятствовать в дальнейшем лечению испытуемых и обычнь1ми средствами. Остальные клинические исследования во всем мире проводились не более чем на 10 больных, за исключением испытания фибробластного интерферона в Университете Тюбингена для лечения 26 случаев нейробластомы.
В сентябре 1982 г. врачи больницы Сент-Луи в Париже провели оценку результатов первых противораковых испытаний полуочищенных интерферонов и пришли к заключению, что эти вещества, несомненно, обладали противоопухолевым действием в исследованных случаях (острого лейкоза, хронического лимфоидного лейкоза, лимфомы, отличной от болезни Ходжкина, карциномы молочной железы и остеосаркомы). Вместе с тем они установили, что во всех случаях результаты оказались не лучше, чем при· обычной противораковой полихимиотерапии. Наблюдались побочные эффекты: усталость, лихорадка, отсутствие аппетита, разрушение клеток крови, но их признали «не имеющими драматического характера». По мнению. французских врачей, подобные предварительные результаты должны повлечь за собой новые испытания более специфичных интерферонов, которые будут тщательно очищены и применение которых будет более адекватным.
В Китае, в Народном госпитале Гуанси-Чжуанского автономного района (в Наньнине), проводились клинические испытания а-интерферона для лечения карциномы носоглотки на второй стадии заболевания. Испыт.ани.я проводились в сотрудничестве с лабораторией эпидемиологии и иммуновирусологии Медицинского факультета Алексиса Карреля в Лионе 1, с Исследовательским институтом Гюстава Русея в Вильжюифе (Франция), а также с Центральной лабораторией здравоохранения в Хельсинки. 30 больных прошли курс кобальтотерапии, столько же пациентов перед кобальтотерапией получали лейкоцитарньIЙ интерферон, который поставляла Лаборатория Кантелла. В течение 5 нед. больным ежедневно вводили внутримышечно по 3 млн. международных единиц интерферона; следующие 5 нед. эквивалентное количество препарата вводили три раза в неделю. В итоге каждый больной получил по 150 млн. международных единиц интерферона. Неделю после курса пациенты отдыхали, а затем проходили курс лучевой терапии, в ходе которого получали дозу в 7000 рад в область шеи. В апреле 1982 г. у трех пациентов было зарегистрировано явное ослабление заболевания, оно продолжалось еще несколько недель; более того, в двух из пяти случаев метастазов в шейные лимфатические узлы наблюдалось их сокращение. Исследование тканевых проб показало дегенерацию или некроз раковых клеток. Чтобы закрепить достигнутые успехи, исследователи предусмотрели введение больших доз интерферона.
В Японии с конца 1981 г. проводятся клинические испытания лейкоцитарного интерферона, вьшускаемого компаниями «Хофман-Ла Рош» и «Такеда кемикал индастриз», а интерферон, вырабатьmаемый японской компанией «Хоясибара биокемикал лэборатриз, инк.», должен был испытываться во Франции Институтом Пастера и Национальным институтом здоровья и медицинских исследований (INSERM). Планировалось исследование эффекта этого препарата при лечении лейкоза. Французские институты должны были получать 50 млн. единиц интерферона, 24 августа 1981 г. компании «Киёва хакко когио» и «Торей индастриз» получили лицензию на использование метода широкомасштабного производства рекомбинантного фибробластного интерферона, разработанного Лабораторией исследования рака в Японии. Клинические испытания этого препарата для лечения опухолей предполагали начать в 1982 г.
Биосинтез ϒ-интерферона в генетически сконструированных бактериальных клетках вселил в исследователей надежду на то, что этот класс интерферона для терапии рака окажется более многообещающим, чем другие. Эта надежда основывалась на том, что, согласно современным представлениям, противоопухолевое действие интерферона опосредовано иммунной системой, а ϒ-интерферон и вырабатывается, и действует в клетках этой системы. Противоопухолевое действие интерферонов можно объяснить стимуляцией естественных защитных механизмов организма, в частности влияиием на лимфоциты, которые убивают раковые клетки или образуют антитела. Противоопухолевое действие можно также объяснять непосредственным влиянием интерферона на рост клеток и его регуляцию.
Если бы удалось решить проблему побочных эффектов, то применение значительно больших доз интерферона, чем те, что были использованы в клинических испытаниях в 1981 г. (106 единиц ежедневно в течение первых 30 дней курса), можно было бы считать средством повышения эффективности препаратов: некоторые пациенты получили уже по нескольку доз в 100•106 единиц и хорошо их перенесли. Исследования лейкоцитарных α-интерферонов, проводимые Королевским фондом исследований рака в Великобритании, а также исследования α2-интерферона, синтезированного в клетках бактерий, в Станфордском университете (Калифорния) показали, что больные способны переносить в 20 раз большие дозы интерферона, чем в прежних испытаниях, во всяком случае краткосрочно. Однако мы не знаем, сколь долго следует применять высокие дозы, возможно, правильнее вводить интерферон меньшими дозами, но дольше, чтобы усилить собственные защитные механизмы организма. Клинические испытания в Станфордском университете показали близкое сходство в противораковой активности и в побочных эффектах рекомбинантного α2-интерферона и смеси α-интерферонов из лейкоцитов. Вместе с тем у некоторых больных против α2-интерферона вырабатывались антитела, что значительно снижало терапевтическое действие препарата. У одного больного, которому делали инъекции фибробластного интерферона, против него также вырабатывались антитела.
Относительно скромные результаты испытаний интерферона, проведенных к настоящему времени, можно объяснить незначительной, даже в мировом масштабе, выборкой больных раком, прошедших курс терапии интерфероном в 1980-1982 гг., недостаточной чистотой испытываемых препаратов, а также существованием индивидуальной, генетически детерминируемой чувствительности к интерферону, обнаруженной де Майером (Институт Кюри, Франция).
Не просто оказалось сделать четкие выводы и по результатам испытаний противовирусных свойств интерферона, хотя, по мнению Кантелла, настало время планировать стандартное лечение кератита, индуцированного вирусом герпеса, а также папилломы гортани юношеского возраста. Как сообщили исследователи из Университетов Фрейбурга и Утрехта, сочетание трифтортимидина с интерфероном значительно более эффективное средство против индуцированного вирусом герпеса кератита, чем один трифтортимидин. В 1981 г. в Стокгольме проводились испытания лейкоцитарного интерферона, полученного по методу Кантелла, при лечении папилломы гортани юношеского возраста (доброкачественной опухоли, дающей, однако, рецидивы). Испытания дали отличные результаты.
Судя по всему, интерфероны действуют непосредственно не на вирус, а на клетки хозяина. Обработанные интерфероном клетки образуют по меньшей мере шесть новых белков, два из которых идентифицированы; как оказалось, они влияют на рост вируса: в случае одних вирусов подавление функций вируса начинается сразу после проникновения его в клетку, другим удается размножиться в клетке, однако они не способны выйти из нее и заразить новые клетки. Интерферон способен подавлять работу гена тимидинкиназы-фермента, который in vivo необходим для размножения вируса герпеса. Оцука и его коллеги в Медицинском колледже Бэйлора в Хьюстоне (шт. Техас) выделили этот ген и ввели его в клетки животного, растущие в культуре. После удаления части гена тимидинкиназы методами генной инженерии была отобрана мене вирулентная форма вируса герпеса обезьян. Это позволило создать вакцину против вируса, вызывающего хронические инфекции, для которых характерна локализация на слизистой рта и гениталиях, и устойчивого к ряду химиотерапевтических средств.
В США по инициативе Национального общества по изучению рассеянного склероза была предпринята серия клинических испытаний лейкоцитарного интерферона, полученного Кантеллом, для лечения рассеянного склероза у 24 больных. Испытания проводились в Станфордском университете в Пало-Алъто (Калифорния), в Калифорнийском университете в Сан-Франциско, в Клинике Скриппса и в Исследовательском фонде (Ла-Джолла). Результаты ожидались к началу 1984 г. Терапевтические испытания лейкоцитарного интерферона, очищенного с помощью моноклональных антител, против рассеянного склероза проводились в нейрщюгическом отделении больницы Дандери в Стокгольме; они рассчитаны на два года. В ноябре 1981 г. институт дентонейрологии в Буффало (шт. Нью-Йорк) опубликовал результаты испытаний фибробластного интерферона: введение препарата в осевой канал снижало частоту вирусной инфекции.
После того как в 1972 г. была доказана эффективность лейкоцитарного интерферона, полученного Кантеллом, против риновируса, отделение простудных заболеваний Медищшского исследовательского совета в Солсбери (Великобритания) возобновило в 1982 г. его испытания, от которых ранее пришлось отказаться из-за чрезмерно высокой стоимости препарата. Возобновление испытаний было связано с надеждой на то, что рекомбиншпный шперферон будет очень дешевым. В испытаниях использовался значительно более чистый интерферон, чем препа.рат, который применялся десятью годами ранее; как природный, так и биосинтетический лейкоцитарный интерферон (последний был получен компаниями «Генентек» и «Хофман-Ла Рош») в высоких дозах оказались эффективными против риновируса. Исследования на 180 добровольцах должны были показать, насколько можно снижать дозу препарата и на каких поздних стадиях инфекции его еще можно применять. Широкое использование этого вещества в эффективных дозах будет зависеть от розничной цены -фармацевтического препарата.
Больным, страдающим от вирусных инфекций и не способным самостоятельно вырабатывать интерферон, введение препарата может принести облегчение. Балкуэлл (1982) описал труппу из 22 больных острым гепатитом, пять из которых находились в состоянии комы, их жизнь была в опасности; в организме этих больных интерферон не вырабатывался. Встречаются люди, у которых система естественного интерферона нарушена; они особенно подвержены вирусным заболеваниям и нуждаются в лечении интерфероном.
Расширение и углубление клинических испытаний интерферона определяется прогрессом в его очистке. Препараты, которыми пользовались в 1980-1981 гг., были очищены на 80% и обладали удельной активностью более 107 международных единиц на 1 мг белка. Чистота препарата означает, кроме того, и отделение одной формы интерферона от сложной смеси, при этом единственный способ получения одного из восьми подклассов а-интерферона заключается в вьщелении его из клона бактериальных клеток, содержащих плазмиду с соответствующим геном. Испытания этих подклассов ставили целью установить, обладают ли они различными или взаимодополняющими активностями, а также выяснить возможные побочные эффекты. По наблюдениям Меригэна из Станфордского университета, интерферон подкласса α2 (полученный фирмами «Генентек» и «Хофман-Ла Рош») вызывал в организме человека побочные явления, тогда как датские исследователи утверждали, что этот же подтип интерферона (получен фирмой «Биоген») не вызывал лихорадки у макаки-резуса; у этого вида животных лейкоцитарный интерферон α2 оказался эффективным для профилактики инфекции вирусом осповакцины.
Заметный прогресс в очистке различных классов и подклассов интерферона ученые ожидаютот применения моноклональных антител; последние могут быть использованы для аффинной хроматографии, при которой нужные белки задерживаются на колонке с антителами. В 1980-1981 гг. получены моноклональные антитела против лейкоцитарного (Монтанье в Институте Пастера) и фибробластного интерферонов (Эрлих в «Цетус», Трапман в Университете Эразмуса; Хохкеппель в GBF, Брауншвейг). С этой целью клоны гибридом помещают в капсулы, окруженные пористой мембраной, сквозь которую к ним проникают питательные вещества; при этом клетки не соприкасаются непосредственно с культуральной средой. Через 7 дней (а не через 15-21 день, что типично для современных методов выращивания гибридом in vivo) кцпсулы вскрывают с помощью гепарина и клетки гибридом отделяют от моноклональных антител, которые используются для очистки рекомбинантного интерферона. Такая техника микроинкапсуляции была разработана американской биотехнологической компанией «Деймон», которая в 1982 г. подписала с «Хофман-Ла Рош» соглашение на ее использование для очистки лейкоцитарного интерферона.
Итак, в результате клинических испытаний, предпринятых в 1980-1982 гг., возникли многочисленные проблемы и надежды некоторых ученых на чудодейственность интерферона не сбылись. Вместе с тем сложилось общее мнение, что подобное вещество должно занять свое место среди средств лечения и профилактики вирусных заболеваний, а возможно, и лечения рака.
Получение иммуногенных препаратов и вакцин
Другая область применения генной инженерии связана с получением новых эффективных, безопасных и дешевых вакцин.
В мае 1980 г. несколько научно-исследовательских институтов во Франции (Институт Пастера, INSERM и CNRS) получили генетически сконструированные клетки бактерий и клетки мышей, способные синтезировать белок вируса гепатита В, который вызывал иммунитет к вирусу. Такой белок активный антиген - можно выделить из плазмы крови вирусоносителей, у которых не проявляются симптомы заболевания. Однако если в клетки микроорганизма введен ген, кодирующий вирусный антиген, то его синтез и выделение из таких клеток дают преимущества, поскольку при этом отпадает необходимость в использовании убитых или ослабленных вирусов и отсутствует токсичный или инфекционный материал, который часто загрязняет антиген, полученный из клеточных культур. Кроме того, такие лишенные токсичности продукты могли бы значительно сократить чрезвычайно длительные и дорогостоящие испытания на токсичность.
Гепатит В представляет собой одну из важнейших проблем здравоохранения, поскольку это заболевание, которым в 1980 г. во всем мире переболело 200 млн. человек, передается от матери плоду во время перинатального периода, может протекать в виде скрытой инфекции и приводит к опасным нарушениям функций вплоть до рака печени.
В плазме крови зараженных людей содержатся различные количества частиц разного размера и формы: сферические и нитевидные частицы диаметром около 22 нм, которые лишены ДНК и являются оболочками вируса; частицы Дэйна диаметром 42 нм (они встречаются реже) представляют собой вирионы и состоят из оболочки и нуклеокапсида диаметром 27 нм, содержащего молекулы ДНК. Препараты очищенных нуклеокапсидов служат источником материала для приготовления вакцины; их иммунохимические свойства интенсивно изучаются, причем особое внимание привлек к себе поверхностный антиген вируса HBsAg.
Вирусная оболочка содержит характерные липиды и белки, некоторые из них гликозилированы. Два полипептида, PI и PII, обнаруживаются в эквимолярных количествах; их первичная структура, вероятно, одинакова, но РII гликозилирован и имеет молекулярную массу около 29 000 дальтон. Участки этих полипептидов между 114-м и 143-м аминокислотными остатками, по-видимому, обеспечивают гетерогенность антигенных детерминант поверхностного антигена HBsAg. Вирусная оболочка, вероятно, состоит из бислоя липидов, содержащего димеры полипептидов PI и РII, в которых имеются межмолекулярные и внутримолекулярные дисульфидные связи, определяющие третичную и четвертичную структуру белка, а также антигенные и иммуногенные свойства HBsAg.
Нуклеокапсид, содержащий сердцевидный антиген, или HBcAg, образован главным-образом полипептидом с молекулярной массой 19 000 дальтон. Этот антиген выявляется после обработки неионным детергентом (NP40) вирионов, выделенных из крови хронических больных. Плазма---зараженных людей содержит также другой антиген, HBeAg.
Вирусная ДНК содержит 3200 нуклеотидов и, как предположили Саммерс и его сотр., она состоит из двух цепей, одна нз которых длинная, с фиксированной длиной L, другая короткая S с изменяющейся длиной. Эта структура подтверждена в работах и других исследователей. Определение полной нуклеотидной последовательности клонированной вирусной ДНК доказало, что антигены ИBsAg и НВсАg закодированы в ДНК частиц Дэйна и что соответствующие им гены локализованы на одной и той же молекуле ДНК.
Передача вируса гепатита В в естественных условиях или в эксперименте происходит только у шимпанзе и у человека. Вирус не удается размножать в культуре ткани, а эксперименты с несколькими видами лабораторных животных оказались безуспешными. Таким образом, изучение биологии вируса бы.но затруднено его узкой специфичностью в отношении круга хозяев и отсутствием системы in vitro для его размножения. Геном вируса клонировали и вводили (весь геном или его фрагменты) в линии клеток, после чего изучалась экспрессия генов вируса. Так, в 1980 г. Дюбуа с коллегами добились успеха при введении вирусной ДНК в L-клетки мышей. Они обнаружили, что вирусная ДНК интегрировалась в клеточную ДНК и что частицы HBsAg секретировались в культуральную среду без лизиса мышиных клеток; другие вирусные антигены выявлены не бьли. В 1981 г. Мориарти с сотр. создали гибридную молекулу ДНК, содержащую ДНК вируса SV40 и фрагмент ДНК вируса гепатита В, которая при введении в клетки почек обезьян обусловливала синтез частиц HBsAg. Годом раньше груп· па исследователей во главе с Хиршменом инфицировала клетки HeLa клонированной ДНК вируса и оонаружила, что в клетках синтезировались оба антигена-HBsAg и·HBcAg; при этом клетки, вероятно, образовывали полные вирионы.
Ряд исследователей продемонстрировали интеграцию вирусного генома или его части в геном гепатоцитов; если бы такая интеграция имела общий характер, роль вируса в этиологии рака печени была бы яснее.
Клонирование вирусной ДНК вклетках В. coli и ее последующее введение в линии клеток млекопитающих позволили преодолеть часть трудностей, обусловленных · отсутствием системы in vitro для размножения вируса. Однако обнаружение вируса у амерmсапских· сурков· и белок, а также уток, по-видимому, открывает новые перспективы для исследования размножения вируса и· изучения взаимоотношениймежду вирусом и организмомхозЯIDlом. С другой стороны, синтез HBsAg в прохариотических и эукариотических клетках с использованием клонированной вирусной ДНК, вероятно, помог бы получить другие типы антигенов, возможно более экономичные и безопасные при производстве вакцин. В 1981 г. Эдман и его коллеги добились успеха при клонировании ДНК вируса гепатита В и получении значительных количеств поверхностного антигена. Раттер из Калифорнийского университета в Сан-Франциско получил клетки дрожжей·, образующих гликозилированный поверхностный антиген. Это был важный шаг на пути к повышению продукции иммуногенных веществ in vitro.
Исследователи из французской компании «Трансжен» также стремились к получению вакцины, на сей раз против бешенства. В 1981-1982 гг. они предприняли попытку заставить генетически сконструированные клетки Е. coli.синтезировать поверхностньlЙ белок вируса·бешенства. В июле 1982 г. в сотрудничестве с Уистарским институтом анатомии и биологии (Филадельфия) они выделили клон Е. coli, образующий вирусный белок с молекулярной массой 58 000 дальтон, ДНК которого была введена в бактерии. Ученые Уистарского института синтезировали эту ДНК, используя в качестве матрицы мРНК, кодирующую вирусный белок и выделенную из клеток, инфицированных вирусом бешенства.
Исследователи из «Трансжен» пытались синтезировать вирусный белок в культурах клеток млекопитающих с тем, чтобы улучшить его качества и установить, обладает ли он нужными иммуногенными свойствами, позволяющими на его основе создать новую вакцину против бешенства.
Бешенство представляет собой зооноз, который, будучи эндемичным заболеванием, поражает животных и людей в ряде стран Африки, Южной Америки и Азии. Число случаев бешенства у диких и домашних животных возросло даже в некоторых европейских странах. Серьезным препятствием профилактической вакцинации является высокая стоимость имеющихся в настоящее время вакцин, что обусловлено сложностью технологии размножения вируса в клетках человека и трудностями процессов выделения, инактивации вирусных частиц и очистки вакцины. Поэтому получение дешевой вакцины на основе вирусного белка с необходимыми иммуногенными свойствами имело бы большое значение как для медицинской промышленности, так и для здравоохранения. Французская компания «Трансжен» и Институт Мерьё подписали контракт о совместном производстве на основе методов генной инженерии гликопротеида оболочки вируса бешенства и изучении его иммуногенных свойств; это начинание подчеркивает важное практическое значение производимых компанией исследований.
Возбудителя сифилиса - Treponema pallidum - нe удается выращивать в искусственной среде. Невозможно также получить вакцину против него с помощью общепринятых методов, основанных на экстракции и очистке антигенов. ДНК этой спирохеты была выделена из яичек специально зараженных кроликов, после чего ее клонировали в клетках В. coli с использованием бактериофага в качестве вектора. Ловетт с коллегами (Медицинская школа Калифорнийского университета) в 1982 г. клонировал ДНК трепонемы и отметил, что один из штаммов генетически сконструированных бактерий содержит не менее семи специфических антигенов трепонемы. Это исследование должно увенчаться разработкой более специфичных тестов для диагностики сифилиса и производства эффективной вакцины. Необходимость в такой вакцине особенно важна, так как штаммы трепонемы имеют склонность становиться резистентными к антибиотикам, используемым в настоящее время для лечения сифилиса. Две другие группы американских исследователей также сконцентрировали свои усилия на изучении сифилиса: группа Норгарда в Научном центре здоровья Техасского университета в Далласе (получившая в течение трех лет субсидию в размере 240 000 долл. от Национальных институтов здоровья) и группа Стамма из Медицинской школы Университета шт. Северная Каролина в Чепел-Хилле.
В ветеринарии следствием получения вакцин с помощью методов генной инженерии могло бы быть искоренение ящура и лихорадки свиней заболеваний, представляющих наибольшую угрозу для сельскохозяйственных животных.
Ящур-высококонтагиозное заболевание, поражающее около 30 видов парнокопытных во всем мире; особую угрозу он представляет для крупного рогатого скота, овец и свиней. И хотя погибает небольшой процент заболевших животных, большинство страдает от сильнейшего истощения, и их продуктивность падает почти до нуля. Борьба с ящуром заключается прежде всего в локализации и уничтожении очагов инфекции путем поголовного забоя заболевшего скота. Проводятся также карантинные мероприятия в отношении мяса и молока, производимых в районах поражения заболеванием, при этом животноводство несет очень большие убытки.
Начиная с 1940 г. в районах, эндемичных по ящуру, проводится более или менее систематически вакцинация, однако, несмотря на то что ежегодно используется свыше 1 млрд. доз вакцины, это заболевание все еще широко распространено. Вакцины получали инактивацией вируса, который выращивали в клетках почек новорожденных хомячков или в эпителиальных клетках бычьего языка. Эти вакцины в целом были эффективны, но при их использовании обнаружилось несколько недостатков: например, некоторые штаммы вируса не удацалось вырастить в количествах, достаточных для получения необходимого для вакцинации антигена; кроме того, вирусные частицы бьmи очень нестабильны, особенно при значении рН ниже 7, поэтому, чтобы сохранить активность вакцины, ее приходилось держать при низкой температуре, а это не всегда возможно в тропических странах, где ящур особенно распространен. Недавние вспышки в Европе·(в Джерси и на о-ве Уайт) были связаны с использованием вакцин, содержащих остатки неубитого вируса. К тому же многообразие типов (7) и подтипов (свыше 60) вируса обусловливает необходимость разработки поливалентных вакцин или вакцин, подходящих к определенным областям, которые можно было бы быстро менять, подбирая наиболее эффективнее против вновь возникающихвирулентных штаммов. Перечисленные недостатки побудили исследователей к изучению структуры вируса и его компонентов, отвечающих за проявление иммуногенных свойств, чтобы разработать безопасные и более·эффективные вакцины. Их получение необходимо для проведения систематической вакцинации скота. В странах Западной Европы в 1955-1980 гг. было вакцинировано более 60 млн. голов крупного рогатого скота, в результате заболевание почти полностью исчезло. В Южней Америке, где ящур является эндемичным заболеванием, ежегодно производилось 500 млн. доз поливалентной вакцины (1980).
Вирус ящура принадлежит к роду Aphthovirus семейства Picornaviridae. Он содержит однонитевую молекулу РНК с молекулярной массой приблизительно 2,6·106 дальтон, окруженную капсидом, образованным 60 молекулами четырех различных полипептидов: VP1, VP2, VP3 и VP4. Обработка вируса трипсином приводит к расщеплению VP1 и явному снижению инфекционности, а также, в зависимости от штамма, к потере иммуногенности (Уайлд·, Бэрроуз и Браун, 1969). Полипептид VP1 обладает очень низкой иммуногенной активностью, а три других вирусных полипептида вовсе ее лишены. Лапорт (1973) во Франции и Бахрах с сотр. (1975) в США показали, что введение больших доз VP1, морским свинкам и свиньям может защитить этих животных от заражения вирусом.
Вакцина, для получения которой инфекционный материал используется только на начальной стадии выделения вирусной РНК, обладает очевидными преимуществами, тем более что она состоит из вирусного белка, вызывающего стойкий иммунитет, и может быть получена в количествах, недоступных при производстве.вакцин.обычными методами. Для производства такого белка можно воспользоваться методами генной инженерии, как это и было сделано в США (министерство сельского хозяйства совместно с «Генентек»), ФРГ, (отделение микробиологии Гейдельбергского университета, Федеральный институт вирусологии животных, Тюбинген, и Институт биохимии Макса Планка, Мюнхен) и в Великобритании (Институт вирусологии животных и компания «Белкам фаундейшн»).
Западногерманские исследователи успешно клонировали двунитевую ДНК-копию вирусной РНК в плазмиде pBR322 Escherichia coli. Последовательность нуклеотидов, кодирующая бело-к VP 1, была идентифицирована и встроена в плазмиду с тем, чтобы синтезировать этот белок в клетках Е. coli. Согласно оценке, проведенной с помощью серологических методов, в одной бактериальной клетке синтезируется не менее 1000 молекул VP 1. Проблема повышения выхода белка имела решающее значение, ибо, как было показано ранее, для иммунизации животных чистым белком VP I его требуется в тысячу раз больше, чем при иммунизации инактивированным вирусом. Помимо этого количественного аспекта, вероятно, было полезно синтезировать полипептид предшественник VP 1 - и использовать его в качестве белка, обеспечивающего стойкий иммунитет.
Группа Клайда получила выход в (1÷2)·106 молекул белка VP I на одну клетку Е. coli.
Активность белка VP 1, полученного методами генной инженерии, по-видимому, не превышает активности (в пересчете на равную массу) белка VP 1, выделенного из вирусных частиц. Предстоит еще многое выяснить о структурных особенностях белка, способствующих успешной вакцинации, прежде чем отказаться от использования инактивированных вирусных частиц в качестве вакцины против ящура и перейти к вакцинации чистым белком VP 1. Важным этапом было определение аминокислотной последовательности VP 1 по последовательности нуклеотидов вирусного генома. В 1981-1982 гг. для двух штаммов, принадлежащих к серотипу А, и одного, принадлежащего к типу О, были установлены аминокислотные последовательности VP 1. В молекуле VP 1 штамма типа О участки, вызывающие образование антител, были локализованы в С-концевой части.
В июне 1981 г. Бахрах и его коллеги из Центра исследований заболеваний животных в Плам-Айленде (шт. Нью-Йорк) сообщили о разработке вакцины против ящура, полученной на основе белка VP 3, синтезированного с помощью генетически сконструированных бактерий. Испытания вакцины на коровах и свиньях прошли успешно, но вакционированные животные оказались устойчивыми только к одному определенному штамму вируса. Министерство сельского хозяйства США занималось исследованиями ящура с 1953 г., однако лишь после развития методов генной инженерии (при тесном сотрудничестве с «Генентек») появились серьезные успехи. В -1984 г. «Генентек» приступила к выпуску новой вакцины, безопасной и менее дорогой; к тому же ее необязательно следовало хранить при низкой температуре.
Голландская ветеринарная фармацевтическая компания «Интервет интернэшнл», входящая в группу «Акзо», в конце марта 1982 г. начала продажу в Нидерландах, а в июне того же года-в Великобритании двух вакцин, полученных методами генной инженерии и предназначенных для предупреждения у свиней и крупного рогатого скота инфекционной диареи, вызываемой патогенными штаммами Е. coli. Понос в этих случаях обусловлен бактериальными антигенами, которые представляют собой факторы адгезии К88 и К99 соответственно у свиней и коров. Эти факторы, как правило, выделяют из диких штаммов бактерий. Исследователи из «Интервет» успешно клонировали ген, кодирующий эти антигены, в штамме Е. coli К-12 в надежде выделить белок в количествах, достаточных для получения вакцин. Эти антигены в комбинации с адъювщпом были использованы для получения вакцины, которая при введении коровам и свиньям вызывала образование защитных антител, передаваемых потомству с молозивом и молоком. Работа была начата в 1979 г. совместно с Институтом здоровья Нидерландов (Билтховен) и фирмой «Органон», также принадлежащей группе «Акзо».
В США компания «Цетус» совместно с «Норден лэборатриз» (при финансовой поддержке корпорации «Смит Клайн оф Филадельфия»), а также «Тек Америка груп» разработала сходные вакцины, которые должны были поступить в продажу в 1983 или 1984 г. после одобрения министерством сельского хозяйства США. В 1982 г. фирма молекюлар генетике» получила моноклональные антитела против одного из токсичных бактериальных антигенов (К99), которые защmцали молодняк крупного рогатого скота от инфекции.
Дэнфорт и его коллеги из министерства сельского хозяйства США в 1982 г. вывели линии гибридом, секретирующие моноклональные антитела против особенно вирулентного вида кокцидий, Eimeria tenella, которые вызывают острый энтерит у цыплят, нанося птицеводам ущерб в 300 млн. долл. Американские исследователи намеревались выделить с помощью моноклональных антител антигены кокцидий для использования при производстве вакцины.
Китамура с сотр. в своих исследованиях полиовируса применили подход, разработанный для вируса ящура. Эта группа исследователей из Института рака в Токио, Калифорнийского технологического института, Медицинской школы Нью-Йоркского университета в Стоуни-Брук и Института Пастера определила первичную структуру РНК полиовируса. Еще в 1908 г. Ландштейнер и Поппер установили, что этот вирус является возбудителем полиомиелита. В середине 1950-х г. были получены убитая и ослабленная вакцины против полиовируса, что значительно снизило заболеваемость в промышленно развитых странах. Однако серьезная опасность по-прежнему сохраняется, особенно в развивающихся странах, и, несмотря на интенсивные исследования, тонкие механизмы репликации вируса в клетках хозяина, его цитопатическое действие и молекулярные основы ослабления живого вируса остаются малоизученными.
Исследователи во главе с Китамурой в 1981 г. определили структуру РНК-вируса, которая состоит из 7433 нуклеотидов, полиаденилирована на 3'-конце и на 5'-конце связана с белком VPg, имеющим низкую молекулярную массу. Это было первое завершенное описание первичной структуры генома рибовирусов. Эти же ученые определили участки РНК, кодирующие различные вирусные белки, и тем самым установили их аминокислотные последовательности. Так была выяснена химическая структура всего вириона (суммарная молекулярная масса 8,25•106). Оказалось, что для полиовируса типа 1 (штамм Mahoney) характерен уникальный тип экспрессии генетической информации: на его РНК синтезируется единый полипротеид, который затем расщепляется на несколько полипептидов, обладающих различными свойствами.
Для разработки новой противополиомиелитной вакцины важно знать структуру генома и организацию генов полиовируса. Один из путей получения вакцины состоит в выделении ослабленных вирусных штаммов, которые не способны восстанавливать вирулентность, или в получении вирусных антигенов с помощью генетически сконструированных бактериальных клеток. Другой путь - создание на основе данных об активности вирусных протеиназ специфических ингибиторов этих ферментов; тем самым можно заметно расширить спектр веществ, используемых для химиотерапии вирусных заболеваний.
Заслуживает внимания еще один способ получения инактивированной вакцины против вируса полиомиелита. Вирус выращивают в клетках обезьян с аномальным набором хромосом (в гетероплоидных клетках vero). Вплоть до 1982 г. эти клетки использовали только в ветеринарии, поскольку предполагалось, что с ними связан риск возникновения рака. Однако многочисленные испытания показали ошибочность такой точки зрения, и Институту Мерьё (Франция) была поручена разработка противополиомиелитной вакцины, предназначенной для человека, с использованием этой техники. Она обладала несомненным экономическим преимуществом, ибо гетероплоидные клетки можно было выращивать нa микроскопических гранулах в ферментерах большого объема (до 500 л). Что же касается диплоидных клеток, то их выращивали в небольших емкостях, это было сопряжено с многочисленными манипуляциями и требовало привлечения значительного обслуживающего персонала. Стоимость вакцины должна была существенно снизиться, что особенно важно для развивающихся стран. С помощью этой же техники в Институте Пастера в Париже намеревались производить вакцину против бешенства.
Использование техники рекомбинантных ДНК для получения вакцин шаг на пути к разработке синтетических вакцин. Производство последних уже давно привлекает внимание исследователей, поскольку синтетические вакцины могли бы заменить имеющиеся бактериальные и вирусные вакцины, часто содержащие посторонние антигенные детерминанты, белки и другие вещества, которые загрязняют основной иммуноген и вызывают вредные побочные эффекты.
Впервые об активной иммунизации против бактериального токсина - дифтерийного токсина - с использованием синтетического антигена сообщили Одиберт с сотр. Дифтерийный токсин состоит из одной полипептидной цепи с молекулярной массой 62 000 и содержит две дисульфидиые связи. Петля на N-конце молекулы, состоящая из 14 аминокислот, удерживается дисульфидным мосmком и обусловливает токсичность и иммуногенную специфичность молекулы. Синтетический тетрадекапептид, ковалентно связанный с двумя различными носителями, вызывал у морских свинок образование антител, которые специфически связывались с токсином и предотвращали его дермонекротическое и летальное действие.
Индукции специфического иммунитета удалось также добиться при введении синтетического пептида, соответствующего части белка М Streptococcus pyogenes длиной всего в 20 аминокислот. Такие иммуногенные олигопептиды могли бы стать основой для разработки безопасных вакцин против инфекций стрептококков, которые вызывают ревматизм и связанные с ним поражения сердца.
Несколько групп исследователей, в частности Дрисман с коллегами (1982), еинтезировали иммуногенные пептиды, которые, возможно, послужат началом разработки синтетической вакцины против гепатита В. Группа Дрисмана синтезировала два циклических петида, содержащие дисульфидные связи, аналогичные таковым на участке между 117-м и 137-м аминокислоmыми остатками полипептидной цепи поверхносmого антигена вируса, который построен из 226 аминокислотных остатков. Два пептида с последовательностями от 117-й до 137-й и от 122-й до 137-й аминокислоты вводили мышам внутрибрюшинно, используя разные адъюванты. В каждой группе у половины мышей через 7-14 дней после иммунизации были выявлены антитела к поверхносm вируса гепатита В (т. е. против поверхностного антигена вируса). Такой иммунный ответ индуцировался однократной инъекцией полипептида, который не был связан с белком-носителем. У большинства животных титры антител через три недели уменьшились. Необходимо было убедиться, что эти синтетические полипептиды создают эффективную защиту и длительный иммунитет, для чего требовались эксперименты вначале на шимпанзе, а затем на людях.
Американские ученые (Биттл с сотр. из Исследовательского института клиники Скриппса и Института вирусологии животных), а также английский исследователь Пирбрайт (Суррей) синтезировали полипептиды, соответствующие нескольким участкам белка VP 1 вируса ящура, и обнаружили, что один из них, включающий участок от 141-й до 160-й аминокислоты белка VP 1, при введении с адъювантом и в комплексе с гемоцианином улиткиблюдечка (KLH) вызывает у морских свинок и кроликов появление антител к вирусу. Эти животные были защищены против последующего заражения вирусом. Полученные этому времени результаты позволили авторам утверждать, что если учесть разницу в молекулярной массе пептида (содержит аминокислоты 141-160) и целого полипептида VP1, то иммуногенная активность пептида составляет 1-10% активности инактивированного вириона, а титры антител в несколько раз выше, чем в наиболее удачных опытах с очищенным белком VP1 (независимо от того, выделен ли он из вирусных частиц или получен в генетически сконструированных клетках бактерий). Другое преимущество синтетического пептида заключалось в том, что однократное введение вызывало иммунный ответ (в полевых условиях чрезвычайно важно, чтобы стойкий иммунный ответ вырабатывался после первого же введения вакцины). Синтетический пептид, содержащий аминокислоты 141-160, был способен вызывать образование антител в количестве, достаточном для защиты от инфекции свиней и крупного рогатого скота. Другой пептид, соответствующий участку VP1 от 200-й до 213-й аминокислоты, вызывал образование антител против вируса ящура.
Как показали исследования Биттла с сотр., синтетические пептиды, содержащие специфические аминокислотные последовательности, которые имеются в молекуле антигена, могут реагировать с антителами, вырабатываемыми против интактного природного антигена. Лангбехейм, Арнон и Села обнаружили, что пептид из 20 аминокислот с последовательностью, идентичной участку от 89-й до 108-й аминокислоты капсидного белка фага MS2, вызывает у животных образование антител, не только способных нейтрализовать фаг, но и эффективных против интактного фага или капсидного белка.
Эти результаты также свидетельствовали, что пептиды с определенными иммуногенными свойствами могут быть использованы для получения вакцин. В случае ящура подобный подход мог бы устранить проблемы, возникающие в связи с недостаточной инактивацией вируса и нестабильностью имеющихся в настоящее время вакцин при рН ниже 7 и температурах внешней среды. Он позволил бы использовать в качестве иммуногенов синтетические пептиды, соответствующие различным серотипам вируса, и, возможно, создавать длительный иммунитет после однократного введения вакцины.
По мнению Биля (1982), решающими окажутся экономические соображения, ибо, несмотря на ранее перечисленные недостатки, инактивированные вирусные вакцины против ящура относительно дешевы. Поэтому вакцина на основе синтетических пептидов должна быть конкурентоспособной. С другой стороны, вакцина против гепатита В оказалась весьма дорогостоящей. Другой не менее важный аспект получения синтетических вакцин связан с использованием носителей. В случае с пептидами VP 1 в качестве носителя был выбран гемоцианин улитки-блюдечка (KLH), который считается высокоиммуногенным белком. Применение подобных веществ чревато развитием гиперчувствительности, если необходимы повторные инъекции, и может свести на нет преимущества синтетической вакцины. Необходимо подобрать другие носители, которые были бы более универсальными, лучше переносились организмом животного и не искажали непосредственного действия вакцины. Важным направлением исследований являются анализ природы адъюванта и поиски оптимального соотношения между носителем и адъювантом. В имеющихся вакцинах против ящура в качестве адъюванта используется гидроокись алюминия; она также была успешно использована в опытах по вакцинации синтетическими пептидами, проведенных Биттлом с сотр. Однако, по мнению Биля, «представления об адъювантах в настоящее время являются слабым местом в иммунологии».
Результаты всех перечисленных исследований показали, что, несмотря на неясности и множество нерешенных проблем, получение поливалентных синтетических вакцин против ряда патогенов и индукция образования антител определенной структуры перспектива не слишком отдаленная.
Возможности генной инженерии микроорганизмов
Опыты с рекомбинантными ДНК выполнялись на кишечной палочке (Escherichia coli), которая в 1950-х гг. была избрана в качестве модели для исследований в области молекулярной биологии. Биохимические и генетические данные, накопленные более чем за три десятилетия, позволяют считать этот вид бактерий наиболее подходящим· кандидатом для первых экспериментов по генной инженерии.
Поскольку кишечная палочка-естественный обитатель кишечного тракта человека, с самого начала ученых беспокоил возможный риск заражения штаммами, полученными в экспериментах. Чтобы исключить возможность заражения, исследователи планировали использовать штаммы В. coli, не способные существовать в кишечнике человека, или только те плазмиды, которые не могут передаваться другим видам бактерий. Однако такие опасения были расценены как преувеличенные, и Национальные институты здоровья США, а также группа по контролю за генно-инженерными исследованиями в Великобритании установили предельный объем культуры в 10 л при выращивании сконструированных штаммов, для работы с которыми не требуется специального разрешения.
Во избежание любых неожиданностей эксперименты по генной инженерии было решено проводить на других видах микроорганизмов, непосредственно не связанных с организмом человека. Клеточная стенка В. coli содержит эндотоксин-липополисахарид, который с трудом отделяется от веществ, получаемых методами генной инженерии. Выделение и очистка таких соединений значительно облегчаются, если они секретируются из бактериальной клетки. Однако по сравнению с другими видами микроорганизмов кишечная палочка секретирует в среду относительно мало белков.
Поэтому внимание исследователей привлекли бактерия Bacillus subtilis и дрожжи Saccharomyces cerevisiae. Пищевые потребности В. subtilis при массовом культивировании хорошо известны, поскольку этот вид используется для получения антибиотиков, инсектицидов и ферментов, в частности α-амилазы. В. suhtilis не образует токсинов, и хотя эти бактерии присутствуют на коже человека, они не патогенны и не заражают ни животных, ни растения. Бацылы способны секретировать белки и вторичные метаболиты, которые· можно выделять из культуральной жидкости 20 различных видов бацилл синтезируют в общей сложности более 40 ферментов с внеклеточной локализацией.
Хотя изучение молекулярной генетики В. subtilis значительно отстает по сранению с Е. coli, сконструированы плазмиды, способные реплицироваться в обоих видах клеток-хозяев. Это позволило швейцарским исследователям к-омпании «Биоген» и ученым из Центра прикладной микробиологии и исследований в Портон-Дауне использовать подобные гибридные плазмиды в качестве векторов для введения в клетки В. subtilis гена лейкоцитарного интерферона человека и других генов. Компонент плазмиды, специфичный для бацилл, принадлежал Bacillus stearothermophilus-бaктepии, которая растет при температурах выше 50° С. Плазмида содержит ген, определяющий устойчивость к тетрациклину, и «репликои», или фрагмент ДНК, обеспечивающий инициацию репликации и также стабильный при высоких температурах. Плазмида может служить вектором для переноса генов в термофильные бактерии, которые не способны размножаться в организмах животных или растений; тем самым устраняется риск заражения. Делались попытки ввести чужеродные гены непосредственно к хромосому бацилл, а не в плазмиды, чтобы получить штаммы, способные расщеплять целлюлозусодержащие отбросы и превращать их в спирт.
Генетическая конституция дрожжей Saccharomyces cerevisiae гораздо сложнее, чем Е. coli и В. suЬtilis, поскольку дрожжи принадлежат к эукариотам. Этот вид дрожжей наиболее полно исследован с генетической точки зрения: в составе хромосом (имеется по 17 хромосом в гаплоидных и по 34 в диплоидных клетках; ядерная ДНК содержит около 30 млн. пар нуклеотидов) идентифицировано несколько сотен генов; точно картированы гены в митохондриальной ДНК (в митохондриях имеется по нескольку молекул ДНК, каждая длиной в 75 000 пар нуклеотидов); в клетке дрожжей имеется до 100 плазмид с контурной длиной 2 мкм, полностью определена последовательностъ их ДНК в 6000 пар нуклеотидов. Но хотя необходимая информация для репликации и рекомбинации этих плазмид сосредоточена в них самих, никакой специфической физиологической функции для них не найдено. Удается проводить рекомбинацию этих плазмид с чужеродными генами и использовать их в качестве векторов для переноса и клонирования этих генов в клетках дрожжей или Е. coli. Налажена трансформация протопластов клеток дрожжей, или клеток, лишенных стенок.
В марте 1981 г. сотрудники отдела генетики Вашингтонского университета в Сиэтле, а также исследователи из «Генентек» добились введения генов лейкоцитарного интерферона человека в клетки дрожжей, используя для этого плазмиду, способную реплицироваться в клетках как Е. coli, так и S. cerevisiae. Поскольку клетки S. cerevisiae, подобно клеткам млекопитающих, обладают способностью синтезировать углеводные группы и присоединять их к молекулам белков, а молекулы интерферона содержат такие группы, которые, возможно, существенны для его биологической активности, получение подобных веществ в дрожжевых клетках, вероятно, будет иметь преимущества, связанные с возможностью биосинтеза полных молекул. В 1982 г. Хитцмэн и Лёнг получили генетически сконструированный штамм дрожжей, который выделял в культуральную среду почти чистые α-, β и ϒ-интерфероны. Тем самым отпала необходимость в разрушении клеток для выделения из них интерферонов, а также в проведении сложной очистки, чтобы отделить их от других белков дрожжевых клеток. Исследователи в сотрудничестве с «Генентек» намеревались увеличить выход интерферона в кулътуральной среде и значительно снизить себестоимость его получения.
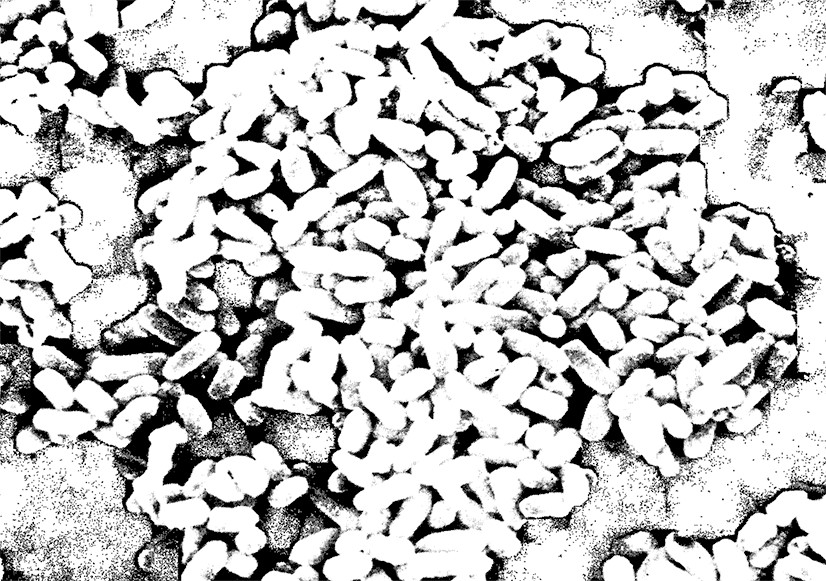
Клетки Escherichia coli (кишечной палочки).
Микрофотография клеток Е. coli получена
на сканирующем электронном микроскопе.
Длина каждой клетки около 2 мкм.х 6700.
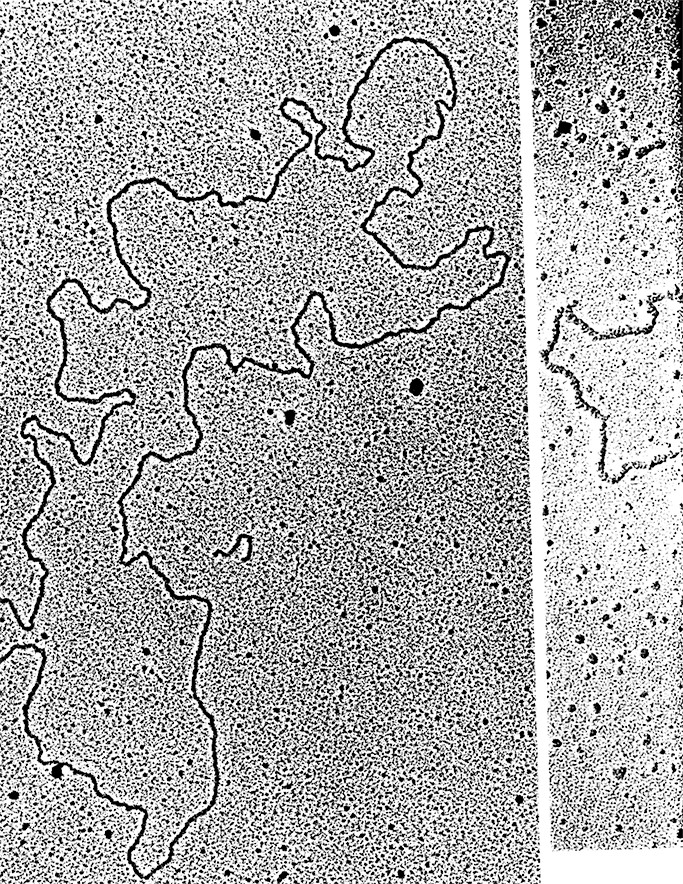
Бактериальная плазмида. Электронная
микрофотография плазмиды из термофильной бактерии.
Плазмида представляет собой кольцевую молекулу ДНК
длиной 14,2 мкм. х 40 000.
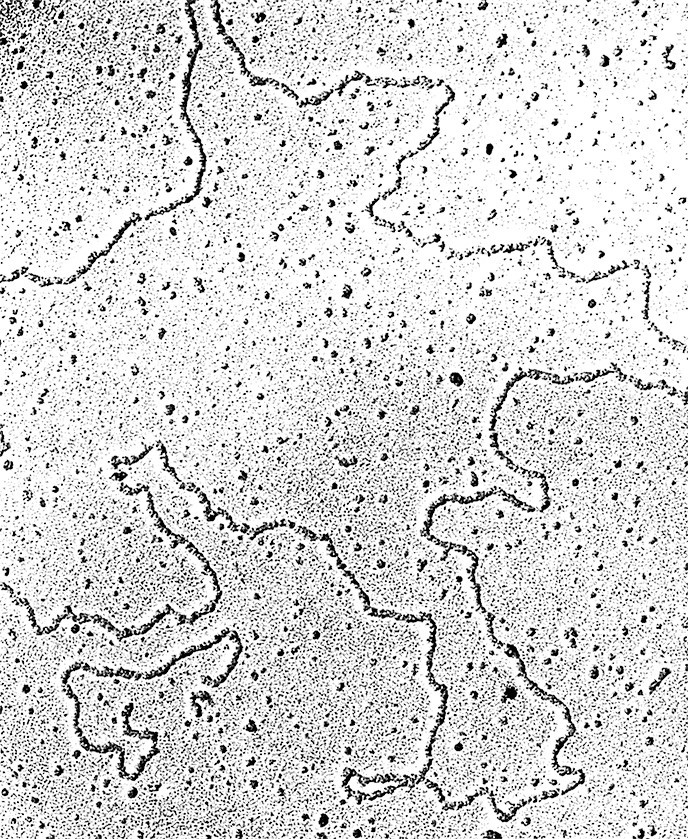
Плазмида, выделенна из Streptomyces coelicolor.
Электронная микрофотография плазмиды, выделенной
из стрептомuцета. Плазмида представляет собой
двуспиральную молеулу ДНК длиной около 10 мкм,
содержащую около 30 000 пар оснований; этого
достаточно приблизительно для 30 генов.
Плазмида напылена платиной, в результате
ее толщина увеличена. х 84 000.

Биосинтез инсулина человека в генетически
сконструированных клетках кишечной палочки.
Две изображенные клетки содержат включения,
занимающие до 20% обьема клетки. Они представляют
собой молекулы инсулина человека, синтезированные
в клетках кишечной палочки, в которые методами
рекомбинантных ДНК введен ген, кодирующий гормон.

Микрофотография лимфоцита, расположенного
перед макрофагом, получена с помощью
сканирующего электронного микроскопа.
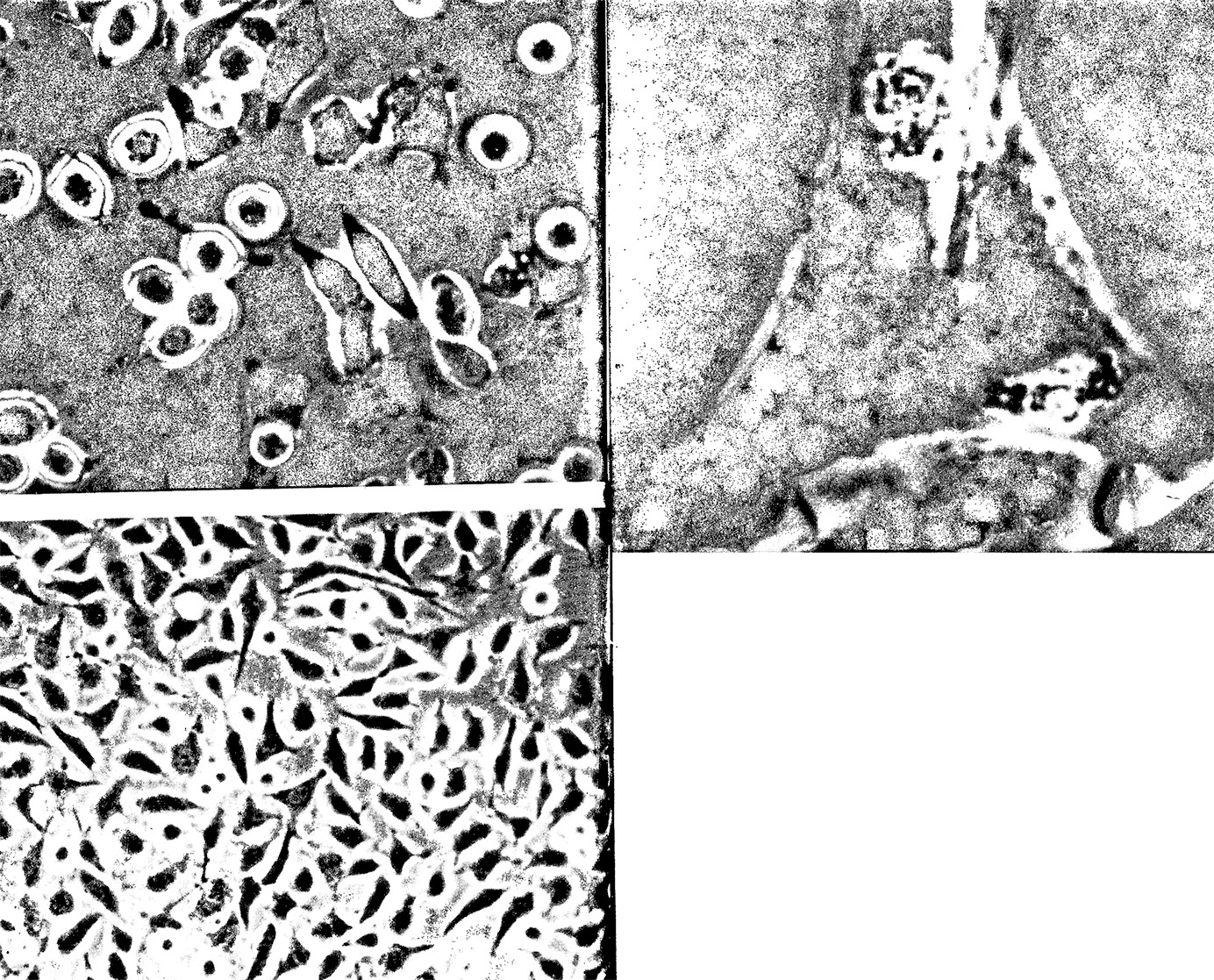
Действие интерферона.
Вверху: зараженная вирусом культура клеток.
Внизу: та же культура, обработанная перед заражением интерфероном.
Справа: Генная инженерия в клетках млекопитающих. Микроинъекция ДНК в фибробласт мыши.
Клетка подвешена на стекле под фазово-контрастным микроскопом, микропипетка, с помощью которой в клетку вводится чужеродная ДНК, видна сверху, ее конец погружен в ядро клетки. Внешний диаметр пипетки 1 мкм, внутренний 0,5 мкм. Пипетка заполняется солевь м раствором с рекомбинантной плазмидой, несущей ген, который требуется ввести в геном клетки. В ядро вводится обьем раствора, содержащий, по расчетам, одну копию этого гена.х 6500.
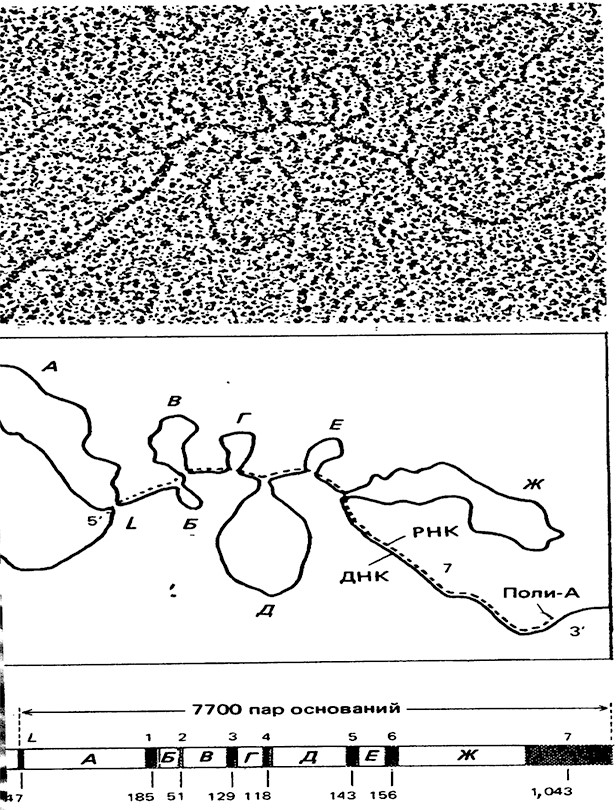
Структура гена овальбумина. Микрофотография,
полученная с помощью электронного микроскопа (вверху),
и ее схема (в центре) показывают результат эксперимента,
в котором одну из цепей ДНК гена белка яйца овальбумина
гибридизовали с мРНК овальбумина. х 180 000.
Участки ДНК и РНК (пунктирная линия), комплементарные друг другу,
ассоциируют, образуя двунитевые области.
Последовательности ДНК восьми этих областей являются экзонами (L, 1 - 7).
Сегменты ДНК, для которых в последовательности РНК
нет комплементарных участков, образуют в составе гибридной
молекулы петли и представляют собой семь интронов (А - Ж) гена овальбумина.
Указаны два конца мРНК (5' и 3') и короткая последовательность
из адениновых нуклеотидов, или поли-А, на З'-конце РНК.
На схематическом изображении гена (внизу) показаны семь интронов (А - Ж)
и восемь экзоное (L, 1-7), для которых указана длина в парах оснований.
Размеры интронов варьируют от 251 (Bj) до 1600 пар нуклеотидов (Ж).
Общая длина гена составляет 7700 пар нуклеотидов (оснований).
Ген, кодирующий овальбумин, первоначально транскрибируется
с образованием молекулы РНК, из которой затем вырезаются интроны,
а последовательности экзонов соединяются вместе, образуя мРНК,
с которой транслируется белок.
Клонирование in vitro масличной пальмы (Elaeis guineensis).
Исходно каллюсы (скопления недифференцированных клеток)
были получены из кусочков молодых листьев пальмы в культуральной среде (А).
Размножаясь во второй среде, в третьей среде каллюсы образуют эмбриоиды,
внешне напоминающие эмбрионы (S). По завершении такого
соматического эмбриогенеза эмбриоиды размножались,
давая начало кластерам (В), а позднее молодым побегам
с листочками (в пятой среде, Г).
Слева: Побеги переносили в шестую среду, в которой происходила
индукция образования корешков; в седьмой среде формировались целые растения.
Их переносили на подходящий субстрат для окончательного роста.
Для получения из эмбрионов побегов длиной 12 см (надземная часть)
требовалось около трех месяцев.
Справа: Клеточные протопласты Acer pseudoplatanus.
Представленные на фотографии протопласты получены из культуры
клеток Acer pseudoplatanus во время экспоненциальной фазы роста (на 11-й день).

Каллюс Nicotiana sylvestris. Целое растение может быть
регенерировано из этого каллю са в культуральной среде
определенного состава.

Регенерация молодого растения Nicotiana Iongiflora
из колонии клеток, полученных из протопласта этого вида.
Регенерация растений картофеля (3-5) из каллюса (2),
полученного из протопластов листа (1).
Образование зачаточного побега (3) наблюдалось через три недели
культивирования каллюса в специальной среде.

Вверху: Azotobacter chroococcum - свободноживущая
диазотрофная бактерия, которая может быть выделена
из почвы и обнаружена в больших количествах по соседству
с корнями (в ризосфере) культивируемых растений.
На микрофотографии видны клетки штамма Azotobacter chroococcum,
выделенного из садовой почвы и затем культивируемого
на агаризованной среде Бейеринка.
Окрашивание бактериального мазка эритрозином выявляет
внутриклеточные метахроматические гранулы,
типичные для этого вида бактерий, Х 1200.
Внизу: На микрофотографии видны клетки другого штамма
Azotobacter chroococcum, выделенного из засушливой почвы (серозем)
в Марокко и затем культивированного на агаризованной среде Эшби
в течение 72 ч. Бактериальный мазок окрашен эритрозином. Х 2500.

Электронная микрофотография клетки цианобактерии
Anabaеnа variabilis.
С - слизь; Кл. ст.- многослойная клеточная стенка, под которой
расположена цито- плазматическая мембрана, или плазмалемма;
T - тилакоиды (уплощенные мешочки, в которых локализованы
ферментативные системы, катализирующие реакции аэробного
фотосинтеза этой цианобактерии);
H - нуклеоплазма (ДНК не ограничена мембраной,
как в ядре эукариотической клетки; Anabaena variabilis -
прокариотический микроорганизм, подобный бактерии);
в нуклеоплазме могут быть видны очень тонкие нити (Ф)
Цг - цианофициновые гранулы (белковые гранулы);
Пт - полиэдральное тело;
Л. - вкл.- липидные включения.
Слияние протопластов. Фотография показывает
слияние протопласта-альбиноса (слева) из листа растения
картофеля Paccem Бербанк с нормальным протопластом
из листа томата (зеленый протопласт).
Цель слияния протопластов состоит во включении генов томатов,
ответственных за устойчивость к болезням, в геном картофеля.
Осуществлена также интеграция плазмид в одну или более хромосом клеток дрожжей. Планировалось даже введение в клетки дрожжей ряда генов с тем, чтобы они могли синтезировать несколько белков.
Методы генной инженерии можно применять для изменения определенных метаболических реакций. Например, если ввести ген, кодирующий фермент аминоглюкозидазу, в штаммы дрожжей, используемые в пивоварении, это, возможно, снизит необходимую концентрацию сахара в сусле. Возможно, удастся также изменить эффективность спиртового брожения, изменяя методами генной инженерии соотношение между ферментами гликолиза. Одним из проявлений интереса к использованию дрожжей в опытах по генной инженерии стало учреждение в США компании «Коллаборейтив рисёрч, инк.», специализирующейся на использовании дрожжей.
Другие генно-инженерные подходы разрабатываются для некоторых микроорганизмов, например для ряда видов Pseudomonas и Streptomyces spp., которые занимают видное место в биоиндустрии.
В 1982 г. Хеннэм с сотр. из Объединенной исследовательской лаборатории ICI и Лестерского университета осуществили экспрессию и клонирование генов овальбумина курицы и дигидрофолатредуктазы (ДГФР) мыши в клетках Methylophilus methylotrophus. Эта бактерия растет в средах с метанолом в качестве источника углерода и используется на заводах ICI для получения белковой биомассы. Гены, кодирующие эти два белка, были встроены в плазмиды и введены в клетки бактерий; уровень их экспрессии был ниже, чем в клетках Е. coli, однако английские исследователи намерены повысить его. Экспрессия гена дигидрофолатредуктазы получена теми же учеными в клетках Methylomonas methylovora и Alcaligenes eutrophus.
Генная инженерия в клетках млекопитающих и в эмбрионах
Еще до создания методов генной инженерии гибридизация соматических клеток, или слияние двух соматических клеток, позволяла осуществлять перенос генов. Если две линии клеток инкубировать вместе в присутствии полиэтиленгликоля или инактивированного вируса Сендай, слияние клеток двух линий приведет к слиянию ядер, которые содержат хромосомы родительских клеток и проявляют характерные для них признаки. Такие гибридные клетки можно отобрать в селективной среде. При этом можно установить соответствие между определенными признаками и определенными хромосомами; в результате удается картировать все новые и новые гены. В ходе размножения гибридная клетка может терять хромосомы одной или обеих родительских клеток; может также начаться экспрессия гена, репрессированного в течение многих поколений. Иногда ген, который в родительской линии клеток обычно не проявляется, начинает «работать» в гибридной клетке. Например, гены α- и β-цепей гемоглобина, которые не проявляются в фибробластах, начинают функционировать, если фибробласт сливается с эритроидной клеткой (по-видимому, регуляторный фактор эритроидной клетки активирует гены глобина в хромосоме фибробласта).
Встраивание и перенос вирусных генов
В 1976 г. Ениш (из Института Генриха-Петта при Гамбургском университете), работавший в то время в Институте Солка в Калифорнии, впервые успешно ввел чужеродные гены в мышиные клетки и осуществил их встраивание в геном мыши, так что они передавались потомству. Однако методы рекомбинации и клонирования еще не бьши так развиты, и вирусы, которые могли быть использованы в качестве векторов для введени.я генов, обладали преимуществом, будучи доступными для детального изучения на молекулярном уровне.
Ениш заразил эмбрионы мыши, находящиеся на стадии морулы, вирусом лейкоза мышей (M-MuLV) и имплантировал их самкам-реципиентам. Через несколъко месяцев он наблюдал проявление болезни у 10-40% взрослого потомства. Ениш также показал, что заболевание, которое·напоминало лейкоз, индуцированный инъекцией мышам вируса, бьло вызвано интеграцией генома вируса в клетки эмбриона, в том числе в клетки зародышевого пути, а не только в клетки тимуса и селезенки, как при экспериментальном заражении взрослых животных.
В большом числе случаев в эмбрионах, из которых выросли· взрослые самцы, вирус интегрировал в клетки зародышевого пути, поскольку при скрещивании со здоровыми самками они давали в потомстве самцов, передающих вирус половине животных следующего поколения (чтобы не осложнять исследование проблемой переноса вируса in utero, изучались только самцы). Хотя для самцов, развивавшихся из зараженных эмбрионов, была характерна изменчивая и уменьшающаяся со временем способность к передаче вируса, все соматические клетки самцов во втором поколении содержали вирусную ДНК, которая в качестве нормального доминантного гена· передавалась половине их потомков.
Енишу удалось получить линию мышей, в которой взрослые животные страдали от лейкоза и в отсутствие источника заражения; эти животные приобрели новый генетический признак после встраивания вирусного генома в 6-ю хромосому. В разных линиях эта интеграция происходила в разных участках хромосомы; линии различались также по типу лейкоза. В некоторых случаях вирусные гены не проявлялись, их экспрессия до некоторой степени определялась участком встраивания в геном клетки. При заражении эмбрионов не перед самой имплантацией, а в средней фазе их развития повышалась скорость интеграции вируса во все ткани, а не только в тимус и селезенку (которые являются органами-мишенями при этом заболевании).
Своими исследованиями Ениш и его коллеги впервые доказали, что можно добиться стабильного встраивания чужеродного генетического материала в геном клеток млекопитающих, более того, этот материал может экспрессироваться и передаваться потомству. Проведенные эксперименты наметили также путь для изучения основополагающей проблемы дифференцировкипричины включения конкретных генов в определенных тканях,-иными словами, проблемы тканеспецифической экспрессии генов.
Вирусы из группы, к которой относится вирус лейкоза мышей, рассматривались рядом специалистов в качестве эффективных векторов для переноса генов. Геном этих ретровирусов построен из двух молекул однонитевой РНК; при заражении клетки вирусом обратная транскриптаза синтезирует молекулу ДНК, комплементарную РНК вируса, возникшая при этом ДНК-копия встраивается в ДНК клетки в виде «провируса». Последний может оставаться стабильным или отделяться от ДНК клетки и давать начало новым вирусным частицам, тем самым приводя к заболеванию.
Несколько исследовательских групп изучали интеграцию этого ретровируса в геном зараженных клеток. В 1979 г. группа во главе с Вармусом показала, что при синтезе ДНК копируются оба конца вирусной РНК; при этом на концах располагаются особые последовательности нуклеотидов-длинные концевые повторы (LTR), ДНКкопия вирусной РНК, ограниченная LTR, интегрирует в ДНК клетки в участках, специфичных для вида животного и ткани. Последовательности LTR вируса молочной железы мышей (MMTV) длиной 1328 пар нуклеотидов были выделены и клонированы в бактериях. Будучи присоединены с двух концов к гену методами генной инженерии, они индуцировали интеграцию этого гена в ДНК клеткихозяина. Именно таким способом в эукариотические клетки был введен ген тимидинкиназы вируса герпеса и была продемонстрирована его экспрессия, т. е. синтез фермента. Последовательности LТR не только обеспечивали интеграцию гена, но и индуцировали синтез продукта гена в больших количествах. Так, в клетках молочной железы мышей, растущих в культуре, число интегрированных копий LTR достигало 70; после стимуляции кортикоидом клетки содержали до 1% белка (от массы клетки), который кодировался вирусным геном, интегрированным в геном клетки. Как показал анализ последовательности LTR вируса MMTV, несколько пар нуклеотидов на ее конце непосредственно принимают участие в процессе интеграции за счет связывания с гомологичной последовательностью ДНК клетки. Выяснилось, что длинный прилежащий участок ДНК кодирует белок с молекулярной массой 36 000 дальтон; промотор, с которого РНКполимераза инициирует транскрипцию гена, обрамленного двумя LTR, содержит характерную последовательность нуклеотидов (ТАТАА); между промотором и последовательностью, кодирующей белок, располагается участок связывания рецептора гормона (кортикоида), состоящий примерно из 50 пар нуклеотидов. Чтобы установить роль vчастков LTR, эти различные элементы можно разделить использовать в нужных комбинациях, прибегая к методам генной инженерии.
Последовательности LTR со структурой, близкой к LTR ретровирусов, были использованы для интеграции соединенного с ними гена β-глобина мыши. Подобная интеграция возможна в клетках, растущих в культуре, но не в эмбрионах; при этом частота интеграции значительно ниже: 1•10 –3 1•10 –6 вместо 1-2% в случае эмбрионов.
В ядерной ДНК клеток мыши и человека найдены последовательности, напоминающие по структуре LTR; они могут препятствовать экспрессии вирусов, заражающих клетки, а также экспрессии соседних генов, приводя в последнем случае к перетасовке генов и ряду нарушений в клетке.
Введение генов в клетки и их экспрессия
Введение генов в популяцию клеток может быть достигнуто посредством заражения этих клеток вирусом, например вирусом обезьян SV40, в ДНК которого встроен нужный ген.
Вирионы SV40 представляют собой сферические частицы; в организации слагающих их капсомеров наблюдается икосаэдрическая симметрия. Они содержат три полипептида и одну молекулу двуспиральной ДНК, ассоциированной с четырьмя видами гистонов: Н2а, Н2в, НЗ и Н4. ДНК вируса содержит 5243 пары нуклеотидов (т. е. имеет длину 5,24 килобазы). Полная ее последовательность была определена Вейссманом (1978) и Фирсом (1978) и их сотрудниками. ДНК вируса содержит информацию о структуре пяти или шести белков вируса, три из которых являются составными частями структурных компонентов капсида, а один связан с ДНК и выполняет регуляторную функцию. Два белка, не входящие в состав вирусной частицы, но кодирующиеся вирусной ДНК, локализованы в ядре клетки-хозяина (Т-антиген) и в ее цитоплазме (tантиген); они играют роль в репликации вирусной ДНК и в трансформации клетки соответственно.
Попав при заражении в ядро клетки примата, минихромосома SV40 транскрибируется в направлении против часовой стрелки с образованием мРНК, соответствующих по длине половине Е-цепи ДНК и кодирующих Т- и t-антигены. Если SV40 заражает клетки грызуна, репликация первоначально протекает как и в клетках обезьян, но завершения ее не происходит и вирусные белки не синтезируются. Большинство зараженных клеток выживает, а менее 10% из них способны размножаться в условиях культуры, при которых рост нормальных клеток обычно подавлен. Такие трансформированные клетки всегда содержат полную ДНК вируса или ее часть, интегрированную в ДНК клетки, и синтезируют мРНК и белки, соответствующие транскрибирующимся генам.
В 1970 г. Берг предполагал сконструировать гибридные молекулы ДНК, построенные из ДНК SV40 и невирусной ДНК. Проведение подобной операции облегчили работы Джексона, Саймонса и Берга в 1972 г. и Лоббэна и Кайзера в 1973 г. по изменению концов молекул ДНК для их последующего комплементарного связывания. Свои исследования Берг завершил в 1980 г., создав рекомбинантные молекулы ДНК, содержащие помимо ДНК SV40 ДНК плазмид Е. coli (pSV2, pSV3 и pSV4). Эти молекулы могут быть использованы в качестве векторов для введения генов в клетки млекопитающих. В ДНК SV40 был встроен ген β-глобина кролика, который затем зкспрессировался в линии клеток обезьяны, зараженных рекомбинантным вирусом: в клетках синтезировались как мРНК гена глобина, так и собственно глобин.
Другой метод введения генов в популяцию клеток заключается в следующем: фрагмент ДНК, содержащий ген, смешивают с ДНК-носителем и осаждают из раствора фосфатом кальция. Такой осадок может проникать в некоторые клетки, а внесенный в клетки ген способен зкспрессироваться и передаваться потомству. Пользуясь этим методом, Аксель, Пеллисер, Силверстейн и Уиглер из колледжа терапии и хирургии Колумбиiiского университета сумели исправить генетический дефект клеток мыши. Они взяли фрагмент ДНК, содержащий ген тимидинкиназы (ТК), который получен из вируса герпеса; смешав эту ДНК с несколькими мил.лиграммами ДНКносителя из спермы лосося, они осадили ДНК на культуру L-клеток мыши, в которых ген ТК отсутствовал (ТК -), с частотой 1 на 106 клетки приобрели ген ТК, поэтому на селективной среде, которая не позволяла расти ТК–-клеткам, росли и нормально размножались ТК+ -клетки. Так был исправлен генетический дефект.
В начале 1970-х п. Андерсон и Диакумакос разработали метод микроинъекций ДНК в клетки, тем самым продолжив метод инъекций ядер в лишенные ядер ооциты лягушки. Они намеревались ввести копию гена ТК и гена β-глобина в ТК– L-клетки мьши (в которых глобин не синтезируется). Ученые остановились на таком сочетании генов потому, что, как было показано, ген ТК может переноситься совместно с другими генами.
Энквист из Национального института рака (США) и Саммерс из Йельскоrо университета произвели расщепление ДНК вируса герпеса эндонуклеазой BamНI и выделили фрагмент ДНК длиной 3,5 килобазы, который содержал ген ТК. Кречмер (Национальный институт сердца, легких и крови) использовал ту же эндонуклеазу для расщепления плазмиды pBR322 В. coli; затем посредством лигазы соединили фрагмент вирусной ДНК и плазмиду. Так была получена рекомбинантная плазмида, названная pX1. Поскольку эндонуклеаза расщепила ген устойчивости к тетрациклину, но не затронула ген устойчивости к ампициллину, который содержится в той же плазмиде, бактерии с плазмидой можно было отобрать на агаризованной среде, содержащей ампициллин. Таким же способом Кауфман, Ниенхуис и Кречмер получили рекомбинантную плазмиду с геном β-глобина. В качестве исходного материала QНИ выбрали фрагмент ДНК человека длиной 15,9 килобазы, содержащий ген β-глобина, который был выделен исследователями Калифорнийского технологического инсmтута во главе с Маниатисом. С использованием эвдонуклеазы Pstl они получили из него более короткий фрагмент и встроили его в плазмиду pBR322. Полученная плазмида pRК1 придавала клеткам устойчивость к тетрациклину, но не к ампициллину. Обе плазмиды были по отдельности клонированы в клетках В. coli, а затем выделены и очищены.
Киллос (лаборатория Андерсона и Диакумакоса) с помощью микропипетки внутренним диаметром 0,5 мкм инъецировал обе плазмиды в популяции ТК– L-клеток мыши. Анализ ДНК блот-гибридизацией по методу Саузерна (разработанному ученым в Эдинбургском университете) этих L-клеток показал, что при микроинъекции ген ТК проник в клетки, после чего нормально в них реплицировался. В свою очередь ген β-глобина был успешно введен в клетки микроинъекцией и реплицировался.
Саммерс и Саммерс из Йельского университета научились отличать тимидинкиназу, кодируемую геном ТК вируса герпеса, от фермента, образуемого в нормальной клетке мыши.
Фермент вируса способен превращать молекулыпредшественники в цитидиловую кислоту, тогда как тимидинкиназа мыши не может катализировать такой реакции. Однако в клетках мыши имеется деаминаза, способная превращать молекулы-предшественники в цитидиловую кислоту; этот фермент ингибируется веществом, обозначаемым THU. Превращение молекул-предшественников в цитидиловую кислоту в присутствии THU служит доказательством присутствия тимидинкиназы вируса герпеса. Американские исследователи наблюдали в двух колониях клеток присутствие гена, введенного микроинъекцией. Таким образом, им впервые удалось осуществить генную инженерию в отдельной клетке млекопитающего, введя в ядро вирусный ген.
Результаты, полученные в случае гена β-глобина, показали, что в каждой L-клетке мыши присутствовало 2-10 молекул мРНК глобина, т. е. примерно столько же, сколько и в опытах Акселя и его коллег по введению ДНК с носителем. Более того, Аксель и Вейссман (Цюрихский университет), проводившие сходные эксперименты, заметили, что в клетках мыши в мРНК глобина отсутствовал 5'-конец, поэтому полные молекулы не могли синтезироваться. Возможно, в L-клетках мыши, которые не являются эритроидными, отсутствуют некоторые последовательности нуклеотидов, существенные для регуляции активности гена глобина. Даже в том случае, когда ген β-глобина вводили в эритролейкозные клетки мыши (MEL), которые способны синтезировать до 10 000 молекул мРНК глобина мыши, экспрессии человеческого гена не происходило.
Ген β-глобина является частью протяженной области генома, в которой закодировано несколько полипептидных цепей глобинов. Гены глобинов включаются или репрессируются в эритроидных клетках по мере того, как организм в своем развитии проходит стадии эмбриона, плода, а также после рождения. На экспрессию генов глобина (вся область занимает 65 килобаз) влияют несколько регуляторных последовательностей, и чтобы добиться полной экспрессии гена -глобина, необходимо вместе с мим ввести все участки генома, требующиеся для регуляции его активности. Клонирование таких протяженных фрагментов ДНК представляет собой технически сложную задачу. Альтернативный путь заключается в выделении регуляторных нуклеотидных последовательностей, соединении их вместе и присоединении к гену -глобина для последующего введения в клетки всей рекомбинантной молекулы.
Опыты по слиянию эритроидных клеток мыши с эритроидными клетками человека свидетельствуют о важной роли стадии дифференцировки клетки, из которой выделяли гены глобина. Чтобы ген глобина экспрессировался, его необходимо поместить в особые условия, которые в значительной степени являются результатом дифференцировки клеток. Во время промежуточных этапов клонирования гена глобина в бактериях его структура может измениться, что явится помехой для последующей экспрессии гена после введения в клетки млекопитающих.
Введение генов в эмбрионы и их экспрессия
Введение чужеродных генов в клетки эмбриона, в том числе в клетки зародышевого пути, позволяет изучать определенные аспекты эмбрионального развития, поскольку при этом возникает возможность проследить, что происходит с введенным геном (генами) у молодых трансформированных, или «трансгенных», животных. От работы с довольно крупными яйцами амфибий (часто порядка миллиметра), обычно доступных в больших количествах, исследователи перешли к изучению яйцеклеток и эмбрионов мыши, которая представляет собой наиболее изученное в генетическом отношении млекопитающее. Первые эксперименты на яйцеклетках и эмбрионах мышей были выполнены в начале 1960-х гг. главным образом Бринстером и Минц в Ветеринарной школе Пенсильванского университета (Филадельфия). С тех пор метод был усовершенствован, что позволило исследователям контролировать все стадии развития яйцеклетки мыши in vitro и послужило основой для экспериментов, направленных на изучение механизмов клеточной и эмбриональной дифференцировки.
Эмбриональное развитие мыши начинается после того, как около десятка ооцитов выходят в яйцеводы. Там спустя 12 ч с момента их освобождения из фолликулов они оплодотворяются сперматозоидами. Один сперматозоид проникает в ооцит, где подвергается биохимическим изменениям: ядро набухает и превращается в мужской пронуклеус, который легко различим вблизи мембраны ооцита; он сливается с женским пронуклеусом, и возникшее в результате этого ядро содержит 40 хромосом. В последующие 48 ч яйцо делится внутри защитной оболочки, образуя 16 или 32 клетки (объем яйца меняется мало); достигается стадия морулы, при этом яйцо внешне напоминает ягоду шелковицы. По мере того как образуется бластоцель, заполненный маточной жидкостью, морула становится полой; бластоциста имплантируется в стенку матки через 108 ч с момента оплодотворения. После закрепления оплодотворенного яйца в стенке матки (нидации) происходит развитие эмбриона.
Ученым удалось стимулировать овуляцию и индуцировать образование большого количества ооцитов, которые можно выделить на разных стадиях их развития в яйцеводе и выращивать в лабораторных условиях до стадии бластоцисты. Оплодотворение iп vitrо-операция весьма тонкая; как ни парадоксально, осуществить ее значительно сложнее, чем в случае ооцитов человека. С помощью микропипетки яйца, выращиваемые in vitro, можно вновь ввести в матку самки-рецmшента, где они продолжают развиваться после имплантации в маточную стенку. Чтобы операция прошла успешно, самка должна находиться в соответствующем физиологическом состоянии, иными словами, стенка матки должна быть подготовлена гормональными выделениями для приема оплодотворенного яйца (обычно проводят спаривание самки со стерильным самцом, в результате индуцируется секреция гормонов желтого тела). Около 80-90% имплантированных яиц развивается, и рождаются нормальные мыши.
После растворения защитной оболочки протеолитическими ферментами с яйцом можно проводить различные манипуляции и вводить в нее микроколичества нуклеиновой кислоты. Яйцо диаметром около 0,1 мм помещают на конец микропипетки, и экспериментатор с помощью микроскопа и стеклянного капиляра с внешним диаметром не более нескольких десятых микрона вводит в яйцо объем в несколько пиколитров (10–12 л). Инъекциянаиболее ответственный этап эксперимента, поскольку в этот момент можно нанести необратимые повреждения яйцу или эмбриону. Имплантируются только выжившие яйца; результаты эксперимента можно наблюдать либо в развивающихся эмбрионах, либо в потомстве.
Микроинъекции чужеродных генов в яйца проводили сразу после оплодотворения, т. е. до начала дифференцировки, с тем чтобы проследить изменения этих генов в клетках и затем в развившемся из яйца организме. Наилучшая интеграция и экспрессия генов достигаются при инъекции в ядро; более того, инъекция в мужской пронуклеус позволяет свести к минимуму повреждение ооцита, так как пронуклеус располагается вблизи мембраны ооцита.
В августе 1980 г. Раддлу и его коллегам из Йельского университета впервые удалось ввести в геном клетки мыши ген тимидинкиназы вируса герпеса. Выбор этого гена объяснялся тем, что тимидинкиназу вируса легко отличить от тимидинкиназы мыши. В мужской пронуклеус до его слияния с женским пронуклеусом были введены 30 000 копий гена ТК. Чужеродная ДНК оказалась стабильно интегрированной в хромосомную ДНК и была обнаружена во всех клетках яйца. Однако из семи новорожденных мышей только у двух в клеточных ядрах содержалась чужеродная ДНК.
В 1981 г. Вагнер и Стюарт, работавшие в лаборатории Минц в Филадельфии, также произвели инъекцию гена тимидинкиназы вируса герпеса в комбинации с геном β-глобина человека. Экспрессия этого гена обычно происходит в клетках эритроидного ряда, ее несложно обнаружить, поскольку синтезирующийся f3-глобин включается в состав молекул гемоглобина мыши. Результаты, полученные после введения обоих генов в мужской пронуклеус, оказались более успешными, чем в опытах Раддла; из 33 новорожденных мышей у пяти в геноме имелись копии обоих генов-либо интактные, либо подвергшиеся перестройкам. У одного новорожденного мышонка была обнаружена также тимидинкиназа вируса герпеса.
Вагнер (Университет шт. Огайо) на основании исследований оплодотворения и изменений сперматозоидов после проникновения в ооциты пришел к следующему заключению: для достижения оптимальной интеграции чужеродную ДНК следует вводить непосредственно перед слиянием мужского и женского пронуклеусов.
Вагнер и Хопп (лаборатория Джексона в Бар-Харборе, шт. Мэн) инъецировали чужеродную ДНК, содержащую ген β-глобина кролика, в мужской пронуклеус яйца мыши. Яйца выращивали до стадии бластоцисты и имплантировали в матки самок-реципиентов. Источником ДНК служила гибридная плазмида, состоящая из бактериальной ДНК и гена кролика (эту плазмиду американским исследователям предоставили Флавелл из Национального института медицинских исследований в Лондоне и Вейссман из Цюрихского университета). Яйца мыши инъецировали либо интактной гибридной плазмидой, либо геном β-глобина с присоединенными к нему нуклеотидными последовательностями, необходимыми для его экспрессии. В каждое яйцо мыши проникло до 20 000 копий гена β-глобина. В общей сложности инъекции были проведены в 312 яиц, 211 полученных эмбрионов были имплантированы 21 самке-реципиенту; 11 из них забеременели и родили 46 мышат. В пробах крови пяm новорожденных мышей исследователи обнаружили β-глобин кролика, однако он был найден только в клетках-предшественниках эритроцитов, в других типах клеток или тканях его не оказалось. Пять новорожденных мышей были несколько анемичными, это позволило предположить, что присутствие чжеродного гена могло влиять на синтез гемоглобина. Было проведено спаривание самца и самки из пяти подопытных животных, среди восьми мышат в потомстве пять содержали ген β-глобина и синтезировали β-глобин в красных кровяных клетках, хотя его концентрация была еньше, чем у матери. Описываемые эксперименты проводились в декабре 1980-начале 1981 г.; их результаты были опубликованы в сентябре 1981 г.
В 1981 г. Костантини и Лэси из зоологического факультета Оксфордского университета инъецировали в яйца мыши фрагмент хромосомной ДНК кролика длиной 19 килобаз, содержащий ген β-глобина и псевдоген (Ψβ2). У 24 мышей, родившихся в результате развития инъецированных клеток, была проведена частичная гепатэктомия; для обнаружения гена β-глобина кролика проводился анализ ДНК из клеток печени. У девяти мышей этот ген был найден, число его копий составляло 1-20 на клетку. После спаривания четырех трансформированных самцов с нормальными самками было получено потомство из 18 животных, у шести из них был обнаружен ген β-глобина. Английские исследователи установили, что введенные гены интегрируют в один участок в середине 1-й хромосомы, ген β-глобина мыши располагается в другом локусе. Это позволило сделать вывод, что чужеродные гены стабильно интегрируют, но не в гомологичные локусы.
Итак, удается достичь интеграции одного или нескольких генов в эмбрионы млекопитающих, они могут экспрессироваться и передаваться потомству. Однако следует подчеркнуть трудности и неясности, с которыми попрежнему связана такая процедура. Интеграция гена в клетки млекопитающего-результат слабо изученного механизма; как показали проведенные исследования, эта интеграция происходит случайным образом и не связана с конкретной областью хромосомы. Другая сложность обусловлена нестабильностью клеток, в которые вводится ген (или гены): он может быть утрачен или видоизменен и в результате стать неактивным. Наконец, активность генов определяется не только последовательностями нуклеотидов, которые обеспечивают транскрипцию гена с образованием мРНК (промоторы, или сигналы инициации), но также другими последовательностями нуклеотидов, которые зачастую далеко отстоят от собственно гена, и, если требуется достичь полной экспрессии гена, эти последовательности необходимо вводить вместе с геном. Например, ген, кодирующий а-глобулин-белок, синтезируемый клетками печени в различных количествах в зависимосm от концентрации кортизона в окружающей клетки среде, регулируется последовательностью ДНК, расположенной перед ним; сходным образом может регулироваться ген β-глобина.
Генная инженерия в клетках или эмбрионах млекопитающих позволит углубить наши знания о регуляции экспрессии генов; в перспективе это облегчит перенос генов и более полную их экспрессию в реципиентных клетках.
Встраивание чужеродного гена в тот локус генома клетки, в котором в норме располагается гомологичный ген, возможно, откроет путь для лечения генетических заболеваний, поскольку это позволит помещать акmвный ген на место отсутствующего или поврежденного гена. Подобные исследования станут более доступными после отбора линий мышей, страдающих α-талассемиейзаболеванием крови, которым во всем мире поражены несколько тысяч человек. После этого можно будет серьезно говорить о генотерапии человека, целью которой станет лечение 2000 генеmческих заболеваний, вызванных отсутствием или дефектами генов.

