В ряде стран ведутся интенсивные исследования биологической фиксации атмосферного азота. Изучаются возможности повышения эффективности этого процесса, играющего важную роль в круговороте азота в биосфере, пути повышения продуктивности растений, а также возможность создания новых азотфиксирующих симбиотических ассоциаций помимо существующих между бобовыми растениями и бактериями рода Rhizoblum. Создание таких ассоциаций между хлебными злаками и азотфиксирующими бактериями, несомненно, будет иметь большое сельскохозяйственное значение. В более отдаленной перспективе не меньшую роль сыграет введение в растения бактериальных генов, обеспечивающих фиксацию азота.
Диазотрофные микроорганизмы
Фиксация атмосферного азота (диазотрофность)свойство прокариотических микроорганизмов. В 1980 г. японские ученые Ямада и Сакагучи якобы наблюдали это явление у эукариотических одноклеточных зеленых водорослей, выделенных из горячего источника, но их данные, не были подтверждены другими исследователями. В табл. 4-6 приводятся виды, роды и семейства свободноживущих и симбиотических диазотрофных микроорганизмов; в табл. 7 представлены виды бактерий, в которые были перенесены гены, ответственные за азотфиксацию, в результате чего они приобрели способность фиксировать азот.
Таблица 4. Свободноживущие гетеротрофные диазотрофы

Таблица 5. Своборноживущие фотосинтетические диазотрофы
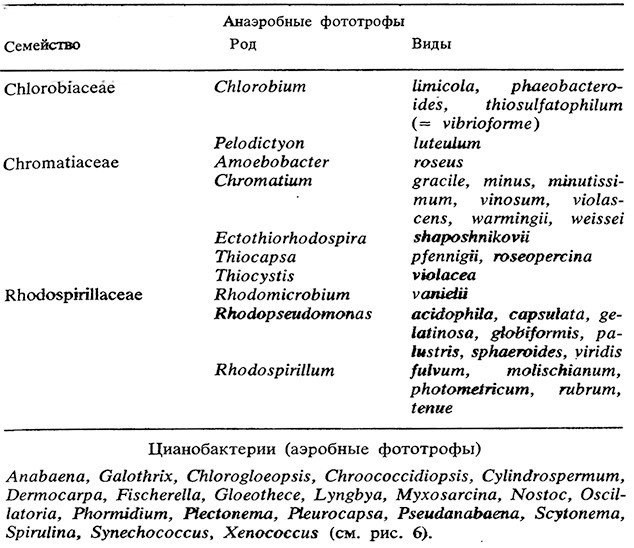
Таблица 6. Симбиотические диазотрофы

Таблица 7. Бактерии, в которые были перенесены гены nif азотфиксации
и которые приобрели способность фиксировать азот

Список азотфиксирующих микроорганизмов пополнился. Кроме того, были пересмотрены (либо подтверждены, либо опровергнуты) доказательства азотфиксации для всех изученных микроорганизмов; для этого использовался тест на восстановление диазотрофными микроорганизмами ацетилена в этилен. Действительно, Дилворт (1966), а затем Шёльхорн и Баррис (1967) независимо друг от друга продемонстрировали, что ферментативный комплекс (нитрогеназа), который восстанавливает газообразный азот с образованием аммиака, способен также восстанавливать ацетилен в этилен. Позднее другие исследователи показали, что нитрогеназа способна к восстановлению ряда веществ, однако процесс восстановления ацетилена происходит быстро и дает удовлетворительные результаты.
Восстановление циклопропена более специфично и дает возможность подтвердить данные о способности Фиксировать азот или, напротив, отвергнуть сомнительные случаи, когда восстановление ацетилена происходит без участия нитрогеназы. Таким образом, эта техника позволила не только во многом уточнить список азотфиксирующих микроорганизмов и получать новую важную информацию, но и обогатила исследователей инструментом для количественного определения фиксированного азота.
Примерно такой же толчок к дальнейшему изучению свойств ряда азотфиксирующих бактерий дало другое открытие в области биохимии. Оно касается чувствительности нитрогеназы к кислороду. Как было установлено, некоторые группы микроорганизмов фиксируют азот в присутствии крайне малых количеств кислорода. К числу этих микроаэробных фиксаторов относятся бактерии, которые окисляют метан, Spirilla (Aquaspirillum и Azospirillum), Xanthobacter autotrophicus и Х. flavus (прежние названияCorynebacterium autotrophicum и С. flavum), Thiobacillus ferrooxidans, микроаэробные цианобактерии, не содержащие гетероцист (Oscillatoria, Plectonema), бактерии кишечной группы, фиксирующие азот только в анаэробных условиях (Citrobacter, Enterobacter, Erwinia). Исследования таксономической и физиологической природы показали, что свойство фиксировать и ассимилировать атмосферный азот (диазотрофность) редко является универсальным внутри данного рода или даже вида микроорганизмов. Микроорганизмы, рассматриваемые как симбиотические фиксаторы (например, Rhizoblum, Frankia), способны фиксировать азот и вне растений, но только в особых условиях внешней среды (другие определенные виды являются, по-видимому, облигатными симбиотическими диазотрофами, как большинство штаммов Rhizoblum leguminosarum и R. meliloti). Хотя диазотрофный статус рода Pseudomonas еще не установлен, по мнению специалистов, это отличительное свойство метаболизма может быть с очень большой долей вероятности приписано семейству Pseudomonauaceae.
Список азотфиксирующих микроорганизмов может быть изменен и в дальнейшем по мере накопления результатов новых достижений биохимических и физиологических исследований. Уточнения, внесенные с начала 1960-х до конца 1970-х гг., свидетельствуют об успешном развитии фундаментальных знаний, что имеет важное значение как для теории, так и для практики.
Биохимические аспекты диазотрофности
Доказательство нитрогеназной активности в бесклеточных экстрактах Clostridium pasteurianum исследователями американской фирмы «Дюпон» положило начало работам по биохимии азотфиксации, в частности изучению фермента, участвующего. в этом процессе, а также механизма его действия. Крайне высокая чувствительность нитрогеназы к кислороду требовала проведения экспериментов в отсутствие воздуха. В начале 1960-х гг. только немногие микробиологи, специализировавшиеся в изучении строго анаэробных микроорганизмов, и ряд химиков, работавших с соединениями, чувствительными к кислороду, имели необходимый опыт для проведения исследований такого типа. При работе с чувствительными к кислороду веществами или клетками считалось вполне допустимым повреждение в результате действия нескольких наномолей кислорода, нескольких наномолей того или иного химического соединения с молекулярной массой 100 - 1000 дальтон или гибель до 1000 клеток из 1010 анаэробных микроорганизмов. Однако такая норма была сонершенно неприменима в случае нитрогеназы, молекулярная масса которой находится в пределах 2•104-2•105 и для которой последствия действия кислорода даже в следовых количествах являются катастрофическими. Усовершенствование методов электрофореза, хроматографии и фракционирования белков и их применение в анаэробных условиях позволили проводить работы по изучению структуры и активности нитрогеназы.
Вслед за Clostridium pasteurianum нитрогеназа была легко получена из других анаэробных азотфиксаторов; более сложным оказалось выделение ее из аэробного вида Azotobacter vinelandii. Этого добились Бален с сотр. из Фонда Чарлза Кетгеринга, которые показали, что нитрогеназа способна получать электроны от дитионита натрия, устойчива к воздействию кислорода и образует водород в отсутствие азота. Последнее наблюдение позволило биохимикам разработать быстрый и надежный метод определения ферментативной активности по выделению водорода в присутствии дитионита и АТФ, в результате чего отпала необходимость в использовании азота 15N2 и манометра Варбурга.
В 1981 г. нитрогеназа была выделена в виде грубого экстракта почти из 30 видов микроорганизмов и очищена из шести видов. Свойства этого ферментативного комплекса практически идентичны для всех азотфиксирующих микроорганизмов. Входящие в состав нитрогеназы два белка при смешивании обычно способны к образованию активного фермента даже тогда, когда они принадлежат к различным родам микроорганизмов. Фактически нитрогеназа-не что иное, как бинарный фермент, состоящий из двух металлопротеинов, совместная активность которых существенна для восстановления азота в ионы аммония. Среди всех известных энзимологам ферментов нитрогеназа считается одним из сложнейших ферментов, использующих простые субстраты. Следует также отметить, что такой же сложностью отличаются ферменты, катализирующие реакции с участием метана, двуокиси углерода, кислорода или ионов сульфата.
Молибденоферропротеин (МоРе-протеин) имеет молекулярную массу около 2,2•105; он содержит молибден (2 атома на молекулу), железо (32 атома на молекулу) и серу (30 атомов на молекулу) и является тетрамером со структурой α2β2. Ферропротеин (Ре-протеин) имеет молекулярную массу около 5·104; он содержит железо (4 атома на молекулу) и серу (4 атома на молекулу) и является димером (α2).
По мнению специалистов, азот связываете.я МоРеnротеином. Некоторые исследователи (например, Бёррис и др.) называют его диснитрогеназой (от англ. disnitrogen-cтpoгoe химическое название азота). Fе-протеин называют редуктазой диснитрогеназы (однако эта номенклатура пока не получила официального утверждения). Азот, вероятно, связьшается с атомами молибдена внутри обособленного фрагмента белка, который называется FеМо-кофактором. Вступая в контакт с кислородом, двухкомпонентные белки нитрогеназы быстро и необратимо разрушаются.
Помимо азота и ацетилена нитрогеназа способна восстанавливать и другие субстраты, включая ионы водорода. В этом случае выделяется водород:

Восстановление ацетилена в этилен позволило разработать и усовершенствовать лабораторный тест и полевой метод надежного обнаружения азотфиксации и количественного определения фиксированного в этом процессе азота.
В клетке участвующие в восстановлении азота в аммиак электроны переносятся на нитрогеназу особыми транспортными белками: ферредоксинами и флаводоксинами. Необходимая энергия поставляется в форме АТФ независимо от восстанавливаемого субстрата, будь то азот или одно из упомянутых выше веществ. Потребление нитрогеназой АТФ было продемонстрировано Карнаханом и его сотрудниками, когда они выделили этот фермент из Clostridium pasteurianum; точное измерение количества потребляемого АТФ было проведено с применением системы, регенерирующей АТФ (например, креатинфосфата или креатинкиназы). Это потребление оказалось высоким, порядка 12-15 АТФ/N 2; причины столь высокого потребления пока не вполне выяснены.
Что касается выделения водорода, то оно сопряжено со значительным расходом энергии и рассматривается как реакция, снижающая эффективность общего процесса азотфиксации. Тем не менее некоторые виды азотфиксирующих аэробных бактерий имеют гидрогеназу, которая in vitro способна использовать водород, образованный нитрогеназой; в результате реутилизации водорода образуется больше АТФ и эффективность фиксации азота увеличивается. Диксон предположил, что активность этой гидрогеназы предотвращает инактивацию нитрогеназы кислородом, дает возможность восполнить посредством окислительного фосфорилирования часть энергии, утраченной в результате образования водорода нитрогеназой, и предотвращает ингибирование водородом восстановления азота. Первые два предположения были подтверждены в случае Azotobacter chroococcum, бактероидов RhizoЬium japonicum и АпаЬаепа cylindrica. Изучая роль водорода в ингибировании восстановления азота, Уокер и Йейтс показали, что водород, образуемый нитрогеназой Azotobacter chroococcum, рассеивается слишком быстро, а потому не в состоянии ингибировать процесс восстановления азота.
Род Azospirillum включает азотфиксирующие бактерии, гидрогеназа которых способствует активности нитрогеназы (восстановлению ацетилена) только в том случае, если бактериальные клетки испытывают недостаток в источнике углерода. Тем не менее эти углеродные субстраты не ингибируют дыхание, зависимое от водорода. С другой стороны, реутилизация водорода гидрогеназой в случае Azospirillum brasilense, по-видимому, не способна защитить нитрогеназу от инактивации кислородом.
Тот факт, что мутанты RhizoЬium japonicum с дефектными генами hup (от англ. hydrogen uрtаkе-гены «поглощения водорода») образуют симбиотические ассоциации, у которых снижена фиксация азота (измеренная для растений, выращиваемых в горшках и теплицах), свидетельствует о важности «обратного захвата» водорода гидрогеназой. С другой стороны, штаммы hup+ R. japonicum способны к автотрофному росту, используя водород в качестве источника энергии. Многие штаммы RhizoЬium либо не содержат генов hup, либо экспрессируют их на крайне низком уровне. У R. leguminosarum эти гены локализованы в плазмиде.
Основные физиологические аспекты диазотрофности
Поскольку ннтрогеназа затрачивает большие количества АТФ, азотфиксирующие микроорганизмы расщепляют больше энергетических субстратов, чем организмы, ассимилирующие соединения аммиака. Вместе с тем потребление энергии в процессе восстановления и ассимиляции нитратов незначительно отличается от энергозатрат при фиксации азота. Повторное использование водорода, образуемого нитрогеназой, для выработки АТФ посредством окислительного фосфорилирования увеличивает общую эффективность фиксации и восстановления азота микроорганизмами, обладающими подобными системами.
При фиксации азота непременным физиологическим условием является защита нитрогеназы от разрушения под действием кислорода. В случае Azotobacter чувствительность к кислороду известна уже очень давно. Биохимики убедились, что эти аэробные бактерии «столкнулись» с теми же самыми проблемами, которые встали перед ними (биохимиками), когда, работая с нитроrеназой, они пытались защитить ее от кислорода. В случае цианобактерий необходимость в защите является даже более острой, поскольку эти фототрофы вырабатьmают кислород. Исследования, проводимые в этом направлении, должны были показать, что необходимость защиты универсальное свойство всех азотфиксаторов, в том числе и симбиотических организмов.
Известны несколько способов предохранения от ингибирования кислородом. Некоторые аэробные виды бактерий, фиксируя азот, ведут себя как микроаэрофилы или анаэробы; многие штаммы RhizoЬium (обычно медленно растущие виды), которые считаются облигатными симбионтами, фактически являются в условиях азотфиксации высокочувствительными микроаэрофилами, и в свободном состоянии они способны фиксировать азот (вне растений) только при очень низком парциальном давлении кислорода. Представители рода Azotobacter содержат защитный белок, который предохраняет нитрогеназу от действия кислорода, а интенсивное дыхание бактерий (быстрая биодеградация углеродных субстратов) вызывает усиленное потребление кислорода. У цианобактерий, обладающих гетероцистами, фотосинтез и азотфиксация пространственно разобщены; последняя происходит только в гетероцистах и не инmбируется кислородом, выделяемым при фотосинтезе. В азотфиксирующих корневых клубеньках бобовых диффузия кислорода замедляется мембраной клубеньков, а незначительное количество этого газа, проникшего внутрь, связывается леггемоглобином.
Кислород не только ингибирует активность нитрогеназы, но и регулирует ее биосинтез, поэтому в условиях, не благоприятных для азотфиксации, фермент не синтезируется.
Генетика свободноживущих и симбиотических диазотрофов
Организация генов, ответственных за азотфиксацию
Изучение генов азотфиксации проводилось в клетках Klebsiella pneumoniae (штамм М5α1), и в 1970-х гг. были достигнуты серьезные успехи. Хотя мутанты азотфиксирующих бактерий были выделены и биохимически охарактеризованы достаточно давно - в 1959 г., серьезные генетические исследования были начаты только в работах американского ученого Стрейчера и англичанина Диксона, в которых был продемонстрирован перенос генов азотфиксации, называемых nif, в клетки Klebsiella pneumoniae. Позднее Диксон и Постгейт успешно перенесли эти гены в Escherichia coli. Результатом этих экспериментов стала значительная активизация исследований по генетике Rhizoblum, направленных на изучение генов nif в различных диазотрофных микроорганизмах, а также взаимосвязи между генетикой бобовых и генетикой симбиотических бактерий.
Поскольку отпала нужда в генетических экспериментах в условиях полного отсутствия кислорода (только выращивание бактериальных штаммов должно было проводиться в анаэробных условиях), наряду с достижениями в области биохимии и физиологии фиксации азота были достигнуты значительные успехи и в изучении генетики этого процесса. Так, контроль фиксации азота и его ассимиляции при превращении аммиака с участием глутаминсинтетазы изучался в США одновременно на генетическом и биохимическом уровнях. В результате в 1976 г. три группы исследователей параллельно продемонстрировали участие глутаминсинтетазы в регуляции nif-генов. Следует отметить, что глутаминсинтетаза кодируется генами, не сцепленными с генами nif.
Для точного определения природы nif-генов и их организации в бактериальной хромосоме проводилось тонкое картирование генов с использованием новой техники рекомбинантных ДНК. Было установлено, что nif-гены сгруппированы в области, расположенной между генами ферментов биосинтеза гистидина (his) и генами, ответственными за усвоение шикимовой кислоты (shiA). Сцепление генов nif и his на хромосоме К. pneumoniae упростило конструирование самопереносящихся плазмид, содержащих his-nif-oблacть. Плазмида pRDl, например, содержала хромосомные гены gnd, rfb, his, hif и shiA; ее использовали наряду с некоторыми другими плазмидами со сходной структурой для проведения комплементационного анализа и картирования мутаций в nif-гeнax. Эта плазмида оказалась также полезной при изучении экспрессии генов nif Klebsiella pneumoniae в других родах бактерий и для получения ДНК с целью клонирования nif-генов.
Важным этапом такого клонирования стало конструирование малых плазмид, содержащих фрагменты ДНК, которые были получены при расщеплении эндонуклеазами ДНК nif-области. Пулер и его коллеги также выделили клоны, содержащие все гены nif-области, а Мак-Нил и Брилл идентифицировали серию трансдуцирующих фагов λ nif, которые в совокупности содержали все гены nif-области. В результате этих исследований была составлена физическая карта nif-области, которая, как выяснилось, полностью соответствовала генетической карте.
В 1981 г. было известно 17 nif-генов, организованных в семь-восемь оперонов (транскрипционных единиц), один из которых (J) был моноцистронным (pиc. 7). Брилл выявил еще два гена: nifR между L и F и nifW между F и М.
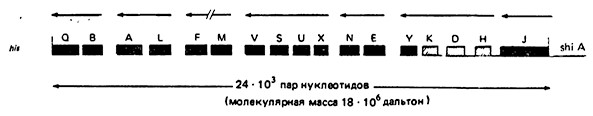
Рис. 7. Карта области nif-генов хромосомы Klebsiella рпеитопiае (1981).
Заглавными буквами обозначены гены (цистроны) пif-области, расположенной между генами, ответственными за биосинтез гистидина (his) и утилизацию шикимовой кислоты (shiA). Стрелками указано направление транскрипции отдельных оперонов. В 1981 г. организация М- и F-областей (в один или два оперона) была не ясна, однако размер большинства этих генов был известен.
Организация nif-генов других свободноживущих диазотрофов, в которых были получены мутации по генам nif (Azotobacter vinelandii, Azospirillum lipoferum, Clostridium pasteurianum, Rhodopseudomonas capsulata и некоторые цианобактерии), оказалась сходной с организацией nif-генов у Klebsiella pneumoniae.
Продукты генов азотфиксации
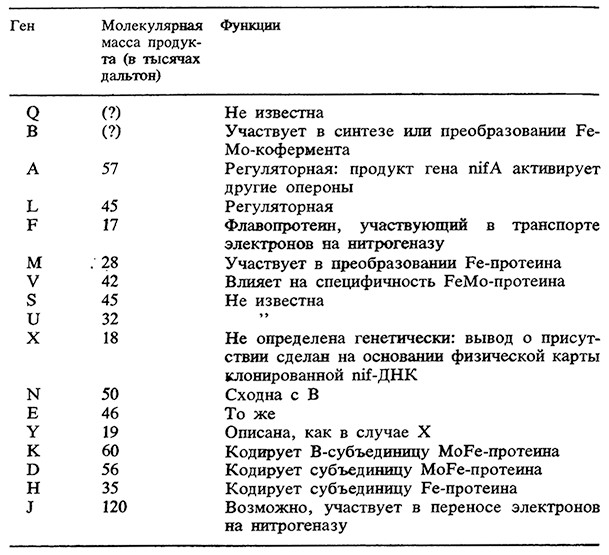
Позднее исследователи сосредоточили усилия на изучении функционирования nif-генов и природы их продуктов. Основное внимание уделялось биохимической генетике, поскольку требовалось выделить соответствующие полипептиды или белки и выяснить их функции. В установлении природы продуктов nif-генов важную роль сыграли многочисленные мутации, полученные во всех nif-reнax (точковые мутации, делеции, полярные мутации и вставки). Исследование регуляции nif-оперонов значительно упростилось после того, как с каждым из них был соединен неродственный ген lacZ. В табл. 8 приведены сведения о продуктах nif-генов и их функциях по данным на 1981 r. Оперон HDKY кодирует белки нитрогеназы, а гены А и L являются регуляторными.
Таблица 8. Продукты nif-генов и их функции в Klebsiella pneumoniae
Регуляция генов азотфиксации
Регуляция nif-reнoв сложна. Ионы аммония и другие соединения азота, в том числе нитраты и аминокислоты, ингибируют экспрессию нитрогеназной активности. Интенсивная аэрация культуры также ингибирует экспрессию генов нитрогеназы. Присутствие азота не является необходимым условием индукции nif-reнoв, поскольку эти гены могут экспрессироватъся при выращивании в атмосфере аргона. Экспрессия nif-генов-скорее результат дерепрессии генов, а не их индукции.
Все продукты генов nif отсутствуют в культурах, выращенных в присутствии ионов аммиака, а соответствующие им мРНК (nif) не обнаруживаются в этих культурах методом гибридизации (отжига) с комплементарной ДНК. Если в по.цностью дерепрессированную культуру добавить ионы аммония, произойдет быстрое подавление экспрессии nif-генов и нитрогеназная активность, как и сами ферменты, исчезнет примерно за 40 мин.
В присутствии ионов аммония глутаминсинтетаза взаимодействует с АТФ и, по-видимому, теряет свои ферментативные и регулярные функции. Глутаминсинтетаза кодируется геном (glnA), удаленным от nif-генов; два других гена, glnL и glnG, сцеплены с glnA, и, возможно, истинными регуляторами nif-генов являются продукты генов gln, а не глутаминсинтетаза.
Кислород, растворяясь в культуральной среде, репрессирует биосинтез нитрогеназы в клетках Klebsiella рпеитопiае и вообще в аэробных и анаэробных бактериях (однако аэробные бактерии обладают механизмами, которые защищают нитрогеназу от разрушения кислородом). Вероятно, во всех изученных организмах механизм кислородной репрессии не зависит от механизма репрессии с участием ионов аммония. Оперон nif HDKY, включающий структурные гены нитрогеназы, более чувствителен к репрессии кислородом, чем оперон nif LA (регуляторные гены). По мнению Хилла и его сотрудников, механизм, контролирующий ингибирование биосинтеза нитрогеназы под действием кислорода, может быть опосредован одним из продуктов регуляторных nif-генов.
После общего «включения» группы nif-reнoв продуктом или продуктами генов gln индивидуальные опероны внутри nif-области подвергаются влиянию регуляторных процессов, происходящих с участием продуктов генов nif А и nif L, а возможно, и других генов. Действительно, Бучанан-Уолластон и его коллеги показали, что продукты генов А и L являются соответственно активатором и репрессором инициации транскрипции всех оперонов nif-области, за исключением оперона nif LA. Эта исследовательская группа сконструировала плазмиды, в составе которых конститутивно экспрессируется ген nif А, трансформировала ими штаммы К. рnеитоniае и обнаружила, что в отсутствие продукта гена nif L экспрессии гена nif А достаточно для активации экспрессии остальных nif-генов даже в присутствии кислорода и соединений азота. Белок nif А относится к температурочувствительным, чем и объясняется отсутствие экспрессии nif-генов при 37° С.
Молибдаты сами по себе не являются регуляторами nif-генов, но Мо-протеины, вероятно, участвуют в регуляции по крайней мере одного из nif-оперонов Klebsiella (nif YKDH). В бактериях Clostridium pastenrtanum и в других диазотрофах имеются белки, ответственные за транспорт и накопление ионов молибдена. Более того, другие ферментативные системы (например, нитратредуктаза) содержат молибден, поэтому возможна конкуренция этих ферментов за ионы молибдена. В случае МоFе-протеина нитрогеназы атом молибдена встраивается во фрагмент «МоFе-ко», а продукты генов nif В, N и Е участвуют в образовании «МоFе-ко».
Итак, регуляция nif-генов Klebsiella pneumoniae контролируется как генами nif А и nif L, так и удаленными от nif-области генами (генами gln). Другие далеко отстоящие гены также, по-видимому, участвуют в экспрессии nifгенов: а именно ген nar D (участвующий в преобразовании молибдена), ген unc и ген в his-oпepoнe (влияющие на образование АТФ) и ген с неустановленной функцией, расположенный вблизи trp и названный nim.
Генетика симбиотических диазотрофов
Генетика быстро и медленно растущих видов RhizoЬium, как и генетика Klebsiella pneumoniae, принадлежит к интенсивно развивающимся направлениям исследований.
Составление генетических карт RhizoЬium с использованием традиционных методов показало, что RhizoЬium leguminosarum, R. phaseoli и R. trifolii имеют очень сходную организацию генов, а R. meliloti по структуре генома лишь незначительно отличается от этих видов. Кроль, Хонтелез, Роозендааль и Ван-Каммен показали, в частности, что гены белковых субъединиц компонентов нитрогеназы в случае Rhizohium leguminosarum, как и в случае Azotobacter vinelandii и Klebsiella pneumoniae, образуют единый оперон. Эти ученые, работающие на факультете молекулярной биологии Сельскохозяйственного университета в Вагенингене (Нидерланды), использовали в своих экспериментах рекомбинантную плазмиду pSA 30, содержащую гены, которые кодируют структурные компоненты нитрогеназы К. pneumoniae; эта плазмида применялась в качестве зонда для обнаружения в бактериальных клетках мРНК, кодируемых этими структурными генами.
Вслед за открытием крупных плазмид в клетках Rhizohium leguminosarum, R. meliloti и R. trifolii было установлено, что эти плазмиды содержат не только структурные гены нитрогеназы, но и гены, ответственные за развитие корневых клубеньков в определенных видах бобовых. Кроль и его сотрудники показали, что в шести штаммах Rhizohium leguminosarum nif-гены локализуются на одной плазмиде (в качестве зонда они использовали выделенную из R. meliloti ДНК, которая содержала эти nif-гены и гибридизовалась с комплементарной ДНК R. leguminosarum); молекулярные массы этой плазмиды у разных штаммов варьировали от 130•106 до 550·106 дальтон. Голландские исследователи обнаружили также, что при превращении бактерий в клубеньках в азотфиксирующие бактероиды экспрессируется только nif-плазмида, тогда как все гены остальных плазмид штамма PRE R. leguminosarum не экспрессируются. Последнее подтверждает важнейшую роль nifплазмиды в установлении симбиотических взаимоотношений между бобовыми и бактериями.
Определенные мутации Rhizohium japonicum изменяют систему узнавания бобового растения-хозяина, другие мутации нарушают продуктивность симбиоза, но не влияют непосредственно на гены nif. Так, неэффективность некоторых классов клубеньков объясняется отсутствием леггемоглобина. Этот белок закодирован в геноме растения-хозяина, однако синтез апопротеина (гло.бина) инициируется при проникновении бактерий рода Rhizohium в корни растений, а простетическая группа (гем) образуется в бактериях. Любая мутация, нарушающая этот синтез в микроорганизме, приводит к отсутствию леггемоглобина· в клубеньках, которые становятся бесцветными (вместо розовых) и не фиксируют азот.
Заключение
Тот факт, что биохимические характеристики белков нитрогеназы сходны у различных диазотрофов, свидетельствует о гомологичности ДНК (генов), кодирующих их синтез. Используя эту гомологию, можно локализовать nif-гены у новых диазотрофов. Так, структурные гены нитрогеназы Rhizoblum leguminosarum и других штаммов RhizoЬium были локализованы в крупных плазмидах, в то же время эти гены были обнаружены в хромосоме цианобактерии АпаЬаепа 7120, однако их порядок отличается от последовательности расположения nif-генов RhizoЬium, представленной на рис. 7. Гомология структуры ДНК служит также предпосылкой клонирования nif-генов из других микроорганизмов после их идентификации и локализации в клетках. Это упростит задачу картирования их генов. И наконец, по нуклеотидной последовательности клонированной nif ДНК можно определить аминокислотную последовательность белков нитрогеназы, как это сделали Сандаресан и Осюбель для Fе-протеина Klebsiella рпеитопiае.
Решающие успехи в изучении фиксации и ассимиляции атмосферного азота были достигнуты в результате применения методов физической химии (при исследовании структуры МоFе-протеина, установлении возможного существования промежуточного продукта фиксации азота в форме связанного с ферментом гидрата азота), биохимии (при изучении белка-протектора, защищающего нитрогеназу от кислорода) и генетики (при клонировании всех nif-генов К. pneumoniae и характеристике большинства их продуктов в полиакриламидном геле; при картировании генома Rhizoblum и локализации nif-генов этого рода в естественных плазмидах). С практической точки зрения развитие представлений об азотфиксирующих симбиотических ассоциациях привело к более эффективному направленному изменению и использованию бактерий для инокуляции бобовых, а понимание механизмов, регулирующих нитрогеназу, позволило оптимизировать применение удобрений (азотных, серусодержащих удобрений и соединений молибдена).
Эти достижения, подтвердившие эффективность исс.ледований, проводимых на стыке пограничных областей, открывают широкие перспективы для применения в сельском хозяйстве результатов фундаментальных исследований в будущем, которые прежде всего можно ожидать в следующих направлениях:
- использование потенциальных возможностей азотфиксирующих симбиотических ассоциаций, образованных тропическими бобовыми и вебобовыми видами кустарников, а также создание ризоценозов между злаками и диазотрофными микроорганизмами;
- повышение эффективности фиксации и ассимиляции азота путем воздействия на генетические механизмы, кшпролирующие этот процесс;
- создание новых азотфиксирующих систем на основе получения соматических гибридов между наиболее перспективными сортами растений и азотфиксирующими растениями или введения генов фиксации азота (nif) в симбиотические или свободноживущие микроорганизмы;
- придание способности к фиксации азота растениям при использовании вирусов или самопереносящихся плазмид в качестве векторов д.ля переноса генов nif или при введении этих генов в ДНК митохондрий или хлоропластов;
- введение nif-reвoв непосредственно в микроорганизмы, обитающие в желудочяо-IСИШечиом тракте, и использование диазотрофов в корме для скота.
Перенос nif-reнoв в микроорганизмы
Конструирование самопереиосящихся wmзмид, несущих nif-гены, позволило передать способность к фиксации азота нефиксирующим видам или нефиксирующим мутантам дназотрофов: Е. coli, Salmonella typhimurium, Serratia marcescens, Erwinia herЬicola, Pиudomonas Pиorescens и nif-мутантам Azotobacter vinelandii.
Легкость, с которой в лабораторных. условиях nif-гены удавалось переносить от одних видов другим или от одного рода микроорганизмов другому, позволила специ алистам предположить, что аналогичный перенос происходит и в природных условиях. Исследование распределения диазотрофности среди изученных видов и родов прокариот показывает, что это распределение является случайным. Так, фиксировали азот 30% всех выделенных штаммов Klebsiella рпеитопiае, 20% штаммов Erwinia herblcola, 82% штаммов Bacillus, 70% штаммов Desulfovibrio. 58% штаммов Pleurocapsa и 64% штаммов Plectonema. Следовательно, это свойство может быть достаточно легко приобретено или утрачено в результате обмена nif-генов. Выдвинутая гипотеза хорошо согласуется с установленным сходством структуры белков нитрогеназы различных диазотрофов; четыре Ре-протеина, для которых была определена последовательность аминокислот, обладали высокой степенью гомологии. На самом деле эти белки еще более родственны, чем цитохромы и гемоглобины, которые, как полагают, обладают весьма сходными биохимическими свойствами у эукариотических организмов.
Перенос nif-генов в естественных условИJIХ представляется еще более верояmым после того, как он был осуществлен в лаборатории методами переноса генов (конъюгацией, трансдукцией и трансформацией), и после того, как структурные гены нитрогеназы были идентифицированы в естественных плазмидах клубеньков.ых бактерий. Перенос nif-генов из плазмиды в хромосому, осуществленный в лаборатории, также мог происходить в естественных условиях; возможен и обмен генов, локализованных в плазмидах RhizoЬium, ответственных за симбиотические взаимооmошения и детерминирующих специфичность в отошении растения-хозяина в этих симбиозах. Группа nif-генов или некоторые ее опероны обладают характерными чертами транспозона.
Таким образом, сложийшуюся в настоящее время ситуацию в отношении распределения свойства диазотрофности у прокариотических организмов с большой верояmостью можно объяснить обменом и переносом генов азотфиксации, тогда как новые виды и роды, возможно, возникали в благоприятных условиях естественного отбора.
Но перенесенные nif-гены не всегда экспрессируются в реципиентных клетках. Например, при переносе nif-генов из Klebsiella pneumoniae в клетки Proteus mirabllis и Agrobacterium tumefaciens эти гены в обоих случаях не экспрессировались. Более того, диазотрофность свойственна исключительно прокариотическим микроорганизмам, и соответствующие гены, по-видимому, не смогли преодолеть барьер, разделяющий прокариоты и эукариоты. В самом деле, генная инженерия сделала возможной экспрессию генов человека (генов белковых гормонов, интерферонов) или генов млекопитающих в клетках Escherichia coli, а также экспрессию прокариотических генов в эукариотических клетках, однако обеспечение экспрессии группы полицистронных оперонов, которая имеется в случае Klebsiella pneumoniae, даже в самом простом эукариотическом организме чрезвычайно затруднено слишком сложной структурой и регуляцией такой группы. Так, Эльмериху и его сотрудникам удалось ввести группу nif-генов Klebsiella в клетки Saccharomyces cerevisiae в форме рекомбинантной космиды. Эти гены сохранились в течение 50 генераций, но не экспрессировались в клетках этого вида дрожжей. Однако перенос этой космиды в клетки Schizosaccharomyces ротЬе, повидимому, сопровождался транскрипцией, по крайней мере регуляторного оперона nif LA, которая активировалась белками, участвующими в экспрессии глутаминсинJетазы в этом виде дрожжей; эти белки являются близкими gln системе Klebsiella.
Генетические манипуляции, проводимые с целью переноса nif-генов в новые микроорганизмы-хозяева, могут приводить и к некоторым нежелательным эффектам. Например, перенос этих генов в штамм Erwinia (Еrwiпiабактерии, вызывающие гниение растений) может усилить его патогенное действие, поскольку он поражает растения обычно в условиях недостатка азота. Перенос nif-генов в клетки Е. coli, обычного обитателя кишечника, может иметь далеко идущие последствия, если гены дерепрессированы (в таком случае нитрогеназа синтезировалась бы на неизменном уровне и не могла бы быть репрессирована ионами аммония). Однако nif-гены часто входят в состав плазмид, несущих гены устойчивости к различным анmбиотикам. В экспериментах, проводимых с практической целью, эти гены следует исключить, так же как и любой другой вредный генетический материал, который может быть неумышленно перенесен с nif-reнaми. Во всяком случае, при исследованиях любого типа всегда существует некое соотношение риска и преимуществ, которое невозможно точно оценить заранее, но, насколько можно судить, в случае приобретения новым организмом способности фиксировать атмосферный азот преимущества сильнее недостатков.
Перенос nif-reнoe и создание новых азотфиксирующих растений
Перенос группировок генов более простых, чем целая nif-область, вероятно, осуществим, причем в качестве векторов могли бы быть использованы вирусы растений. Вирус мозаики цветной капусты дезоксирибовирус, к ДНК которого можно присоединить определенные nif-reны, которые могли бы интегрировать в геном растения или транскрибироваться в растительной клетке одновременно с ДНК вируса при его репликации. Другой возможный векторпатогенная бактерия Agrobacterium tumefaciens, которая содержит крупную плазмиду Ti, ответственную за индукцию опухолей в растительных тканях в месте заражения бактериями.
Исследования в области молекулярной генетики штаммов Agrobacterium tumefaciens, вызывающих опухоли, были начаты в 1974 г., когда Шелль с сотр. из Института растениеводства им. Макса Планка в Кёльне и ученые Гентского университета обнаружили плазмиды во всех этих штаммах. Эти плазмиды размером 150-230 килобаз (Ценен и др., 1974), существенные для индукции опухолей, были названы Тi-плазмидами (от англ. tumor-including). Гамилтон и Фоц в 1971 г. обнаружили, что бактериальный штамм теряет свойство индуцировать опухоли при температуре 37°С из-за денатурации плазмид (Шелль, 1974). Введение в штамм, который в результате стал безвредным, Тi-плазмид либо трансформацией, либо конъюгацией восстанавливало способность штамма к индукции опухолей (Гилтон и др., 1976; Шелль и др.-, 1976). В 1977 r. Чюттон (Вашинпонский университет) обнаружил, что 3% последовательности ДНК Тi-плазмиды присутствуют в числе нескольких копий в ДНК клеток опухолевой ткани табака. Тогда же он выдвинул rиnотезу, согласно которой особый фраrмент Тi-плазииды, названный Т-ДНК (от англ. transferred DNА-переносимая ДНК), шпеrрирует в геном растения. Шилпероорт со своими коллегами из Лейденского университета в 1979 г. показал, что протопласты, выделенные из клеток листьев табака, могли быть трансформированы ДНК Agrobacterium tumejaciens (использование протопластов noзвoлило этим исследователям преодолеть барьер, препятствующий проникновению бактериальной ДНК в клетки растения и обусловленный пектоцеллюлозной клеточной стенкой). В 1982 г. они продемонстрировали стабильную трансформацию этих протопластов Тi-плазмидой Agrоbacterium turrufaciens, которая и в самом деле оказалась агентом опухолевой трансформации.
ДНК Тi-плазмиды состоит из двух областей: большая содержит информацию, позволяющую бактерии усваивать производные основных аминокислот, или опины, синтезируемые опухолевыми клетками; другая область, которая соответствует Т-ДНК, включается в геном растительной клетки. Эта Т-ДНК индуцирует превращение здоровых клеток растений в раковые, как и трансформацию их метаболизма, направленную на образование опинов. По данным Шелля, Т-ДНК имеет молекулярную массу (10÷15)•106 дальтон и состоит по меньшей мере и трех функциональных единиц. Нуклеотидные последовательности, расположенные на .концах Т-ДНК, весьма сходны с последовательностью определенных участков нетрансформированной клеточной ДНК, и рекомбинация между этими двумя ДНК приводит к включению Т-ДНК в геном растения и к перерождению зараженных тканей.
Таким образом, образование опухолей в тканях растения, вызываемое Тi-плазмидой Agrobacterium tumefaciens, индуцируется переносом сегмента бактериальной ДНК (из прокариотической клетки) и его интеграцией в геном эукариотических клеток. Систематическое введение мутаций в каждый из семи генов Т-ДНК Тi-плазмиды, проведенное Шеллем и его сотрудниками, позволило установить, что пять генов участвуют в опухолевом перерождении клетки, которое проявляется в блоке дифференцировки клеток. В случае когда все пять генов были изменены мутациями, Т-ДНК по-прежнему была способна проникать в клетки табака, которые культивировали с целью регенерации целых растений. Присутствие Т-ДНК в последних было доказано обнаружением в клетках фермента, опинсинтазы, который кодируется другим геном Т-ДНК. Потомство растений, полученное при половом размножении, наследовало как Т-ДНК, так и способность к образованию опинсинтазы. Такая трансмиссия (перенос) генов через клетки зародышевого пути послужила предпосылкой для проведения экспериментов по генной инженерии с целью переноса специфических признаков.
Шеллю и его коллегам удалось встроить в Т-ДНК бактериальный ген, определяющий устойчивость к метатрексату, и показать, что клетки, в которые был введен этот ген; приобрели устойчивость к препарату. Тем самым регуляторные последовательности нуклеотидов бактериального гена могли выполнять свою роль и в растительных клетках. Однако экспрессия других генов, введенных в Тi-плазмиды, наблюдалась нерегулярно, и природу механизмов экспресии генов в условиях данной клетки еще предстоит выяснить. С другой стороны, поскольку при удалении генов, кодирующих опинсинтазу, функция индукции образования опухолей Т-ДНК не нарушается, гены опинсинтазы могли бы быть заменены другими, например nif-генами, с тем чтобы они интегрировали в геном клетки-хозяина. Необходимо, однако, отметить, что поскольку Agrobacterium tumefaciens заражает только двудольные растения, вероятно, будет непросто ввести Тiплазмиды для переноса специфических генов в клетки однодольных растений, таких, как хлебные злаки.
Помимо трудностей, характерных для переноса nifгенов в клетки эукариотического растения при использовании в качестве вектора, например, Т-ДНК Тi-плазмиды Agrobacterium tumefaciens, возникают новые проблемы, связанные с регуляцией экспрессии этих nif-генов. В частности, необходимо защитить нитрогеназу от ингибирующего действия кислорода.
Тем не менее методы клонирования и рекомбинации нуклеиновых кислот создали предпосылки для переноса генов в клетки растений и получения их экспрессии. В июне 1981 г. Кемп из корпорации «Агригенетикс» в Мэдисоне (шт. Висконсин) и Холл из Висконсинского университета (Мэдисон) сообщили об успешной попытке переноса гена, кодирующего у бобовых белок фазеолин, в растения подсолнечника. После этого был осуществлен синтез мРНК этого запасного белка в клетках подсолнечника, которые стали опухолевыми под действием Т-ДНК Agrobacterium tumefaciens, использованной в качестве вектора. Однако ни синтеза фазеолина, ни регенерации опухолевых клеток в целых растениях подсолнечника не происходило. Другой группе американских исследователей удалось ввести в геном клеток подсолнечника ген, ответственный за синтез запасного белка кукурузы, а также ген, кодирующий фермент дрожжейалкогольдегидрогеназу. Использование видов растений, у которых регенерация из клеток в культуре или из тканевых каллюсов протекает легче, наряду с модификациями Т-ДНК позволит добиться полноценной экспрессии генов, перенесенных в эти виды, и значительно углубит наши знания о механизмах такой экспрессии. Эти механизмы были предметом обсуждения на симпозиуме «Генная инженерия: применение в сельском хозяйстве», который проходил 16-19 мая 1982 г. в Белтсвилле (шт. Мэриленд) в Центре сельскохозяйственных исследований министерства сельского хозяйства США.
С помощью той же техники можно было бы клонировать и перенести ДНК определенных nif-генов. Гены nif можно было бы перенесm в эндотрофную микоризу, поскольку перенос в случае грибов осуществить, повидимому, легче, чем в случае высших растений.
Однако независимо от того, какие методы используются для переноса nif-генов, их экспрессия, т. е. их транскрипция в мРНК и трансляция последних в белок, должна осуществляться в растительной клетке. Механизмы этих процессов различаются в двух типах организмов. Тип регуляторных последовательностей, необходимых для их экспрессии, определяется конечной локализацией этих генов. В случае локализации в хромосоме для экспрессии nif-гeнa необходимо слияние его с эукариотическим промотором (для этой цели может оказаться полезньiм промотор из области Т-ДНК Тi-плазмиды Agrobaclerium tumefaciens ). С другой стороны, при локализации nif-генов в хлоропластах столь изощренной работы по генетическому конструированию не потребовалось бы; по-видимому, механизмы экспрессии генов в хлоропластах и в клетках прокариот близки; РНК-полимераза хлоропластов способна инициировать транскрипцию на промоторах nif-reнoв в присутствии активатора-продукта гена nif А.
Помимо трудностей генетического характера, встречающихся при переносе nif-reнoв, имеются и другие. Приобретение растением способности фиксировать атмосферный азот зависит от присутствия не только nif-reнoв, но и генов, ответственных за синтез переносчиков электронов, и кофакторов, существенных для функционирования нитроrеназы; должна бьrrь также обеспечена защита нитроrеназы от ингибирующего действия кислорода в новых, более или менее аэробных условиях, при которых ей придется функционировать.
Если создание растений, способных фиксировать азот независимо от симбиотических микроорганизмов, на данном этапе исследований остается сложной задачей, то вполне возможно достигнуть успехов в изучении факторов, индуцирующих установление симбиоза, обеспечивающего фиксацию азота, с тем чтобы повысить их эффективность. Штаммы Rhizoblum, полученные путем генетического отбора (например, имеющие гидрогеназу, которая эффективно реутилизирует водород), а затем генетически улучшенные, представляются более эффективным материалом для введения в культуру бобовых. Исследования в области генетики растений также внесут вклад в отбор более эффективных растений-хозяев (соматическая гибридизация, вероятно, позволит получить новые сорта растений, фиксирующие азот симбиотически). Не исключено также, что будет модифицирован и геном микроорганизмов, образующих ризосферу с небобовыми растениями (например, с хлебными злаками), с целью повышения эффективности таких ассоциаций.
Общее заключение
Фундаментальные исследования по переносу генов азотфиксации в клетки высших растений и их экспрессии приведут, по всей вероятносm, к многообещающим открытиям. Если это произойдет, потребуются новые исследования и испытания перед тем, как·станет возможным реальное применение новых результатов в сельском хозяйстве. В 1976 г. Харди предположил, что понадобится по крайней мере 10 лет, прежде чем в сельскохозяйственную практику будут внедрены результаты такого теоретического открытия, как, например, распространение симбиотической азотфиксации на хлебные злаки. Если бы в лаборатории удалось получить азотфиксирующие хлебные злаки, потребовалось бы несколько сезонов, прежде чем их можно было бы выращивать в широком масштабе и размножить, т. е. не менее 10-20 лет.
Как бы то ни было, эти исследовательские работы рассматриваются как имеющие все возрастающую важность. Министерство сельского хозяйства США, например, отдает наибольшее предпочтение исследованиям по биологической фиксации атмосферного азота, связанным с повышением продуктивности растений: в 1980 г. фонд, предназначенный для экспериментов в этой области, составил 25% всех ассигнований на исследовательскую работу по биологии растений.

