В начале 1960-х гг. ученые установили, что хлоропласты, выделенные из шпината, в присутствии искусственного донора электронов и бактериального экстракта, содержащего гидрогеназу, способны продуцировать водород:
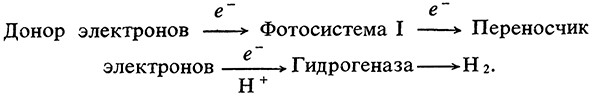
Гидрогеназа получает электроны от ферредоксина. В этом эксперименте фотолиз воды под действием хлоропластов был подавлен; источником водорода служили органические соединения, которые использовались как доноры электронов. В эксперимент была вовлечена только фотосистема I.
Спустя десятилетие американские исследователи обнаружили, что хлоропласты шпината и бактериальные экстракты, содержащие гидрогеназу (без дополнительных доноров электронов), могут после облучения видимым светом выделять водород, если переносчиком электронов выступает ферредоксин. В этом случае функционируют две фотохимические системы хлоропласта, I и II. Гидрогеназа, выделенная из Clostridium, оказалась очень чувствительной к кислороду, так что реакцию проводили в атмосфере азота с добавками раскислителей (например, тлюкозооксидаза + глюкоза) для удаления кислорода, который выделяется при фотолизе воды. По данным Холла с соавторами (1980), такая смесь при рН 7,0 и температуре 25° С продуцировала 50 мк/моль водорода в 1 ч на 1 мг хлорофилла в течение 6 ч. В других лабораториях этот процесс длился 10 ч и более. Основным лимитирующим фактором было наличие кислорода.
Важность такой формы получения энергии обусловлена следующим: наличием избытка субстрата фотолиза (воды); нелимитированным источником энергии (солнечный свет); продукт (водород) можно хранить, он не загрязняет атмосферу и обладает очень высокой теплотворной способностью (29 ккал/г по сравнению с 3,5 ккал/г для углеводородов); процесс может возобновляться, так как после удаления водорода субстрат (вода) регенерирует; наконец, он происходит при нормальной температуре без образования токсичных промежуточных веществ.
Чтобы повысить выход водорода, необходимо найти гидрогеназы, менее чувствительные к кислороду. Гидрогеназа из бактерии Alcaligenes катализирует медленное продуцирование водорода смесью, содержащей мембраны хлоропластов и метилвиологен, в качестве переносчика электронов; при этом добавления раскислителей не требуется. По мнению Холла и др. (1980), должны соблюдаться три важных условия: тесное сопряжение между переносчиком электронов и катализатором получения водорода; эффективное взаимодействие между мембранами хлоропласта и переносчиком электронов; переносчик электронов не должен легко окисляться (как ферредоксин, так и метилвиологен в восстановленной форме способны реагировать с кислородом, поэтому, если происходит фотолиз воды, их применение нецелесообразно).
Однако продолжительность процесса получения водорода зависит главным образом от стабильности выделенных хлоропластов. Выделение водорода можно стимулировать, добавив в реакционную смесь свежие хлоропласты, но положительных результатов можно ожидать и от изучения фотохимических систем, которые катализируют фотолиз воды. Так, Портеру с сотр. из Королевского института в Лондоне удалось выделить комплексы порфирина марганца и фталоцианина, которые продуцируют кислород и гидрохинон из воды. Кэлвин (лаборатория Калифорнийского университета, Беркли) показал, что комплексы полупроводниковых кристаллов окиси цинка с красителем вызывают сходную реакцию. Обе группы исследователей пытались добиться искусственного фотосинтеза, включая эти комплексы в липосомы и создавая реакции разобщения транспорта заряда через мембрану. Стремясь наблюдать фотосинтез in vitro, Кэлвин решил сконструировать две системы: одна в процессе фотолиза генерирует кислород и восстановленный переносчик электронов, другая вызывает выделение водорода с восстановленного переносчика при помощи фотохимической реакции. Искусственный фотолиз воды (аналог реакций типа фотосистемы II, в которых участвует хлоропласт), повидимому, реально происходит.
Специалисты-фотохимики, работающие во Франции, Швейцарии и СССР, показали, что водород можно получать в присутствии искусственного донора электронов (вместо воды) и поглощающих свет пигментов (а не мембран хлоропластов). С другой стороны, фотолиз воды, происходящий под воздействием света, проводили в реакционных смесях, содержащих соединения рутения и другие катализаторы, и в одном случае получили водород.
Цианобактерии, которые являются аэробными фототрофами, также способны выделять водород. Ученые Калифорнийского университета (Беркли) установили, что культуры АnаЬаеnа sp. выделяют кислород и водород в течение 19 дней, но, по-видимому, трудно превратить такие культуры в непрерывную систему по продуцированию водорода.
Если удастся разработать стабильную систему для получения водорода путем фотолиза воды, расходуя 106 Дж/м2 солнечной энергии в сутки (100 Вт/м2), она сможет производить в день 90-л водорода: на 1 м2 (около 3 кг водорода на 1 м2 в год с энерrосодержанием около 4006 Дж). Стоимость 3 кг водорода, по ценам 1980 г., составляет около 1 ф; ст.; за 30-летний период доход от такой системы составит 30 ф. ст. с каждого квадратного метра, подвергшегося энергоконверсии.
В заключение следует сказать, что разработка стабильной и эффективной фотохимической системы, имитирующей функции фотосистемы II хлоропластов (такие, как фотолиз воды и восстановление переносчика электрона), будет важным этапом в процессе превращения солнечной энергии в водород. Выделение водорода с восстановленного переносчика или катализатора не является непреодолимой проблемой, однако чувствительность переносчика к кислороду может ограничивать его практическое применение. Идеально было бы иметь «под рукой» вещество, играющее роль гидрогеназы, т. е. кислородстабильный окислитель-восстановитель и переносчик протонов.
Для биотехнологии можно было бы воспользоваться и другими механизмами превращения энергии, обнаруженными у микроорганизмов. Галофильная бактерия Halobacterium haloblum обладает способностью использовать световую энергию, улавливаемую пурпурным пигментом, бактериородопсином, который находится в мембране клетки. Пигмент состоит из одной белковой цепи, к которой прикреплена молекула ретиналя. Последняя, как и светочувствительные пигменты глаза, является производным витамина А и представляет светочувствительную часть пигмента. Под влиянием солнечного излучения в молекуле бактериородопсина происходят физические и химические изменения, которые в конечном итоге приводят к переносу протонов с одной стороны мембраны на другую.Пигмент выступает как бы в роли приводимого в действие светом протонного насоса; изменения, происходящие в молекуле бактериородопсина, осуществляются за 10 мс. После каждого «фотоцикла» молекула снова готова к тому, чтобы активироваться светом и перекачать другой протон. Молекулы бактериородопсина располагаются в клеточной мембране группами по три, каждая группа образует часть гексагональной решетки в пределах каждой группы· три молекулы работают синергично. Молекулы бактериородопсина способны функционировать даже при разрушении бактериальных клеток, но структуру молекул следует поддерживать.
Перекачивание протонов через мембрану как в живых клетках, так и на изолированных мембранах обеспечивает градиент концентрации протонов: концентрация протонов выше на внутренней стороне мембраны и ниже на наружной стороне. Градиент можно измерить по перепаду рН или по разности потенциалов, которая показывает, что мы имеем дело с электрохимическим градиентом протонов.
Биохимики и биофизики нескольких стран (ФРГ, Венгрии, Израиля Нидерландов, Великобритании, США и СССР) пытались встроить группы молекул бактериородопсина в искусственные системы. Но эффективность их оказалась· низкой по сравнению с другими методами использования солнечной энергии. По мнению некоторых исследователей, эффективность мембранных систем Halobacterium haloblum необходимо повысить на четыре порядка, чтобы они смогли конкурировать с физическими солнечными коллекторами.
В лабораторных масштабах уже созданы мембранные системы, способные производить электрический ток. В отличие от элементов, основанных на кремнии, арсениде галлия или сульфиде кальция, они не требуют ни развитой технологии, ни значительных капиталовложений.
Растущие Н. haloblum можно перенести в мелкие водоемы с высокой концентрацией хлористого натрия и других минеральных солей. Поскольку это очень селективная среда, микробное загрязнение маловероятно. У бактерий Н. haloblum потребность в кислороде невелика; биосинтез родопсина осуществляется в условиях низкой концентрации кислорода в окружающей среде. У некоторых штаммов половина клеточной мембраны покрыта пурпурным пигментом; из 10 л бактериальной культуры можно получить 0,5 г пурпурных мембран. Фрагменты мембран содержат до 100 000 молекул бактериородопсина, их необходимо фиксировать на подложке, чтобы не нарушить синергизма их действия. Подложка должна обладать физическими, химическими и электрическими свойствами, нужными для обеспечения тока протонов, но не других ионов. Весьма многообещающей кажется фиксация пурпурных мембран на пористых подложках, пропитанных липидами: липиды сливаются с мембраной, образуя сплошной слой на поверхности фильтра. Мембранные фрагменты можно также смешать с акриловой кислотой и акриламидом; образующаяся смесь полимеризуется в гель. Нормальное функционирование любой из этих систем зависит от ориентации молекул бактериородопсина, которые должны перекачивать протоны в одном направлении. Вместо создания плоских слоев молекул, молекулы бактериородопсина и липиды могут образовать протеолипосомы, которые затем можно встроить в структуры, обеспечивающие эффективное перекачивание протонов.
У Н. haloblum имеется и другой тип насоса, отличный от протонного. Его обеспечивает галородопсин, который использует световую энергию непосредственно для перекачивания ионов натрия. Если такую систему удастся очистить, она найдет применение в устройствах для обессоливания.
Даже если использование пурпурных мембран Н. haloЬium для производства энергии потребует длительных исследований и решения многих технических проблем, несомненно, что изучение систем энергоконверсии позволит лучше понять участвующие в них молекулярные механизмы, а это в свою очередь приведет к разработке искусственных устройств, столь же или более эффективных, чем естественные. В этом смысле исследования, проводимые на фотосинтетических пигментах, сравнимы с работами, посвященными фотопроизводству водорода в более или менее искусственных реакционных смесях.

