4.3.1. ПОЛУЧЕНИЕ ТРАНСГЕННЫХ ЖИВОТНЫХ
Исторически улучшение генетического потенциала домашних животных достигается методами отбора и подбора при разведении. Несмотря на то, что этот метод оказался достаточно эффективным для улучшения продуктивных качеств (например, молочной продуктивности), в течение длительного периода времени потребности повышения продуктивности между поколениями постоянно возрастают. Успехи в технологии получения рекомбинантных ДНК открыли возможность получения новых полезных свойств у животного уже в первом поколении, а также создания новых генотипов путем введения, удаления или других изменений генома в первом поколении.
j Gordon с сотр. (1980) впервые показали, что гетерогенное ДНК может быть введено путем инъекции в пронуклеус зиготы мыши, ингоировано в хромосомы, реплифицировано и затем обнаружено в тканях потомства. J. Gordon назвал этих новых, генетически модифицированных животных «Трансгенными». Другие исследователи в копоткие сроки повторили эти эксперименты, и метод инъекции ДНК в пронуклеус зиготы стал длительное время основным методом для создания трансгенных мышей, а затем и других видов животных.
Благодаря разработки метода введения ДНК в пронуклеус зародыша появилась возможность более эффективного использования животных для повышения их продуктивности и качества продукции, резистентности к болезням и в производстве биомедицинских препаратов.
Ввиду низкой эффективности получения трансгенных животных путем микроинъекции гена в пронуклеус зиготы к настоящему времени предложен целый ряд других методов введения чужеродного гена в организм животного. Ниже приведены основные из них.
Методы введения чужеродного гена в организм животного
Микроинъекция гена
Получение трансгенных животных путем микроинъекции гена включает извлечение эмбрионов на стадии пронуклеуса хирургическим путем или после убоя доноров. Для получения оплодотворенных яйцеклеток, необходимых для микроинъекции, у животных гормональной обработкой вызывают суперовуляцию по определенной для каждого вида схеме, а затем извлекают яйцеклетки, промывая яйцеводы у наркотизированных или убитых животных.
Для микроинъекции эмбрионов необходим стабильный рабочий стол, на который устанавливают инвертированный микроскоп, два микроманипулятора для управления удерживающей и инъекционной пипетками и прибор для регулирования инъекционного давления. На столике микроскопа устанавливают инъекционную камеру со средой, покрытой парафиновым маслом. В среду помещают эмбрионы. Для инъекции эмбрионы по мере надобности посредством пониженного давления фиксируют на удерживающей пипетке так, чтобы инъецируемый пронуклеус был хорошо виден. Кончик инъекционной пипетки (внутренний диаметр около 1 мкм) наполняют раствором ДНК. Для инъекции пипетку через прозрачную оболочку и клеточную мембрану вводят в пронуклеус, после чего в него инъецируют 1–2 пкл раствора ДНК. О точности операции судят по набуханию пронуклеуса. Только такое визуальное увеличение объема ядра свидетельствует о том, что раствор ДНК был действительно введен в пронуклеус. После инъекции эмбрионы освобождаются от удерживающей пипетки и культивируют до момента пересадки реципиентам.
В оплодотворенных яйцеклетках мыши и кролика, извлеченных в соответствии со стадией их развития, пронуклеусы очень хорошо видны и могут быть легко инъецированы. У эмбрионов сельскохозяйственных животных в цитоплазме имеются темные липидсодержащие гранулы, которые затрудняют визуализацию пронуклеусов. В результате центрифугирования при 15 000 g в течение 3–5 мин (RJ. Walletal., 1984) гранулы смещаются к одному пол юсу яйцеклетки, а лежащие недалеко от центра пронуклеусы становятся видимыми и доступными для микроинъекций. Для эмбрионов овцы, как правило, не требуется центрифугирования: для визуализации пронуклеусов достаточно применить оптику Номарского с интерференционным контрастом. Несмотря на такую обработку, микроинъекция эмбрионов сельскохозяйственных животных все же сложнее и не может быть выполнена с такой же надежностью и эффективностью, как у мышей и кроликов.
После короткого (до нескольких часов) культивирования in vitro эмбрионы трансплантируют в яйцевод синхронизированных реципиентов.
Исключение составляет крупный рогатый скот, которому пересаживают инъецированные эмбрионы только после длительного культивирования (7–8 дней), на более поздней стадии их развития, так как эмбрионы на ранних стадиях развития у этого вида животных не приживляются после пересадки.
Синхронизация полового цикла реципиентов и доноров, от которых получают эмбрионы, является необходимым условием для успешного выполнения программ по переносу генов (эмбрионов), так как яичники, яйцеводы и матка должны находиться в соответствующей стадии, чтобы физиологически обеспечить дальнейшее развитие пересаженных эмбрионов.
Коровам и кобылам эмбрионы вводят нехирургическим методом.
Каждому реципиенту мыши, кролика и свиньи пересаживают 20–30 инъецированных зигот, причем у свиней все эмбрионы трансплантируют в один яйцевод, а у мышей и кроликов – раздельно по яйцеводам. У овец, коз и крупного рогатого скота каждому реципиенту пересаживают два-четыре эмбриона.
Животных, родившихся из инъецированных эмбрионов, индивидуально метят, берут у них пробу тканей или крови для доказательства интеграции ДНК. Интеграцию ДНК проверяют PCR-диагностикой, дот-, блот-гибридизацией по Саузерну.
Несмотря на то, что этот метод работает достаточно надежно, эффективность получения трансгенных животных очень низкая: у крупного рогатого скота менее 0,1 % трансгенных животных к числу пересаженных зигот. К примеру, в исследованиях Eystone (1999) на получение одного трансгенного теленка использовано 1600 инъецированных зигот. Это обусловливает и высокие затраты на получение одного исходного трансгенного животного.
В связи с низкой эффективностью получения трансгенных животных методом микроинъекции гена и, как следствие, их высокой стоимостью, исследования были направлены на разработку альтернативных методов повышения эффективности создания трансгенных сельскохозяйственных животных.
Существенное повышение эффективности получения трансгенных животных и возможность снижения затрат на их получение стало возможным с разработкой метода клонирования животных.
Пересадка генетически трасформированных клеток
в энуклеированные яйцеклетки
В отличие от микроинъекции гена в пронуклеус зиготы этим методом ген вводят в соматические клетки путем обычной трансфекции в культуре клеток. В этой технологии в качестве соматических клеток используют фетальные фибробласты, генетически модифицированные разными методами (липофекция, электропарация и др.). Модифицированные фетальные фибробласты подсаживают к энуклеированным ооцитам и соединяют их с цитоплазмой, как правило, электрослиянием.
Реконструированные ооциты вступают в эмбриональное развитие и трансплантируются животным-реципиентам. Таким образом осуществляется клонирование животных путем пересадки не обычной, а генетически трансформированной соматической клетки в энуклеированную яйцеклетку.
Высокая эффективность получения трансгенных животных этим методом достигается тем, что реципиентам трансплантируются только трансгенные эмбрионы. А достигается это тем, что в соматическую клетку в процессе трансфекции вводят одновременно со структурным геном, который впоследствии у трансгенного животного будет синтезировать и выделять определенный лекарственный белок, ген устойчивости к неомицину. Последний позволяет выживать, только генетически модифицированным клеткам в присутствии генитицина G-418. Таким образом, происходит селекция генетически модифицированных клеток, которые затем и подсаживают в энуклеированные ооциты.
Трансгенные овцы, продуцирующие с молоком человеческий фактор IX для лечения гемофилии, были получены Schnicke А. Е. etal (1997) путем пересадки трансфецированных соматических ядер в энуклеированные яйцеклетки. Аналогичным методом были получены трансгенные козы (Keefer С. L. et al., 2000).
С использованием метода клонирования в опытах I.B. Cibelli et al. (1998) пересадка девяти реконструированных эмбрионов коровам-реципиентам сопровождалась получением одного трансгенного теленка, тогда как по сообщению Wall et al (1992) при использовании техники микроинъекции гена должно быть проинъецировано и пересажено коровам-реципиентам около 500 эмбрионов, чтобы получить одного трансгенного потомка. На фирме «Инфиноген» (США) на получение одного трансгенного теленка, продуцирующего с молоком человеческий сывороточный альбумин, было использовано 18 клонированных эмбрионов.
Таким образом, использование метода клонирования эмбрионов для получения трансгенных животных существенно сокращает время и стоимость получения трансгенных животных.
Этот прием позволяет получать только самок уже в первом поколении, так как существующие генетические методы позволяют отобрать только плоды самок для получения фетальных фибробластов. В результате не требуется дополнительное время на процесс разведения исходных лактирующих трансгенных животных.
С использованием метода пересадки ядер стадо, например, из 5–10 трансгенных коров, достаточное для обеспечения потребности фармацевтического рынка в лекарственном препарате, может быть создано уже в первом поколении, тогда как при инъекции гена потребовалось бы получение как минимум двух и более поколений, чтобы получить продуктивное стадо. Это позволяет сэкономить два года д ля каждого поколения.
Гормонально вызванная лактация у трансгенных телят позволяет получить по 50 л молока от каждого трансгенного теленка уже через 15 мес после трансплантации трансгенного эмбриона корове-реципиенту. Такого количества молока достаточно для отработки техники его выделения и очистки, предклинического и клинического испытания, а к моменту получения первой естественной лактации (через 33 мес от начала проекта) начать его коммерческое производство.
Разработана технология получения клонированных птиц путем извлечения зародышевых клеток из эмбрионов на стадии 0–6 дней и пересадка их в ранние эмбрионы. Это позволяет получать половые химеры, от которых уже в первом поколении можно получить копии (клоны) исходных доноров. Разработка этой технологии открыла новые возможности в создании трансгенных птиц. Это достигается тем, что ген вводят в зародышевые клетки донора путем обычной трансфекции в культуре клеток, как это делается на животных. Трансфеципованные зародышевые клетки снова пересаживают в зародыш реципиента, который продолжает развиваться до вылупления. Таким образом получают кур, продуцирующих с яйцом различные лекарственные белки.
Продуктивная группа трансгенных кур может быть создана через 12–18 мес, а лекарственный белок с яйцом получен уже через 6–7 мес после переноса гена.
Пересадка гена с использованием ретро- вируса
Одним из первых лабораторных приемов пересадки гена у млекопитающих была пересадка посредством использования вируса. Этот метод был успешно применен на различных видах животных: куры (M.J. Briskin et al., 1991); G. Sargent, 1999), мыши (С. Spadafora,1998), а позднее пересадка гена с использованием ретровируса была применена и на крупном рогатом скоте (A.V. Chan et al., 2001). В последних исследованиях было получено четыре из четырех трансгенных телят путем введения гена в ооцит на стадии метафазы И. Это является экстраординарным результатом для получения трансгенного крупного рогатого скота. Однако авторы не сообщили об экспрессии гена у трансгенных животных.
Несмотря на высокую эффективность интеграции гена посредством использования ретровируса этот прием имеет и значительные недостатки. Одним из наиболее серьезных ограничений применения ретровирусов для пересадки гена является относительно маленькое количество генетической информации (< 10 кв), которое может быть перенесено ввиду малого объема вирусных частиц. Это создает проблему получения низкой экспрессии гена, что ограничивает практическое использование этого приема.
Другим потенциальным недостатком этого метода является его сложность. Несмотря на то, что введение вирусных частиц в ооциты требует наименее сложных манипуляций с эмбрионами, упаковка трансгенов в вирус осложняется техникой изготовления генной конструции, введения ее в геном ретровируса и последнего в упаковочные клетки, которые выращивают для производства вирусов. После того как вирусы будут сконцентрированы, они могут быть введены в ооциты.
Несмотря на то, что многие лаборатории включались в производство трансгенных сельскохозяйственных животных, они не воспользовались этим методом. Нерешительность в отношении этих исследований по использованию ретровирусов для переноса гена в значительной степени обусловлена общественным мнением. Это вызвано возможным проявлением рекомбинантных явлений между вирусными векторами и эндогенными ретровирусами, создающими новые патогенные агенты, в частности онкогены.
Пересадка гена путем введения его в сперму
Что может быть более заманчивым, чем создание трансгенных животных путем простого погружения спермиев в раствор, содержащий трансген, и затем использование этих спермиев для искусственного осеменения?
После первой демонстрации пересадки гена путем введения его в сперму (B.G. Brackett et al.,1971) лишь некоторые исследователи обратили внимание на этот эксперимент. Однако М. Lavitrano et al (1989), сообщившие о получении трансгенных мышей путем пересадки гена со спермой, снова привлекла внимание исследователей. Первоначальные попытки повторить работу М. Lavitrano были безуспешными (R.L. Brinster et al.,1989). Несмотря на большое число исследований в отношении фундаментального изучения механизма переноса гена через спермин продолжали поддерживать возможность переноса трансгена в ооциты путем использования спермиев. С. Spadafora с сотр. (1998) разработали основные положения, которые позволяют объяснить, как может работать пересадка гена через спермин. Пересадка гена с использованием спермиев в настоящее время продемонстрирована на нескольких видах животных: крупный рогатый скот и куры (М. Shenesh et al., 2000), свиньи (F. Capello et al., 2000; J. Qian et al., 2002; I. Sciamanna et al.,2000), лосось (F.Y. Sin et al., 2000).
Ученые в Израиле (M. Spemesh et al., 2000) использовали комбинацию интеграции гена, разрезанного при помощи ферментов, с пересадкой гена при помощи спермиев для получения трансгенного крупного рогатого скота и кур. Эффективность интеграции у крупного рогатого скота достигала 100 % (у 4 из 4 родившихся телят) и подобная эффективность у кур (17/19 цыплят). Эти предварительные исследования очень интригующие. Однако они требуют подтверждения.
Другая группа исследований на фирме BioAgri и UCLA сообщила, об успешном получении трансгенных мышей, свиней и птиц путем использования моноклональных антител, для соединения трансгена со спермиями до осеменения (К. Chang et al., 2001; J. Qian et al., 2001). Уровень интеграции гена был 20 %, и авторы предоставили убедительные доказательства интеграции, экспрессии и передачи трансгена следующему поколению. Однако моноклональные антитела пока не доступны для коммерческого применения.
Создание разных типов трансгенных животных
Мечтой многих исследователей-селекционеров мира является разработка возможности не просто отбора животных с измененной хозяйственно-полезной изменчивостью, а преднамеренное изменение генотипа и направленное создание желаемого типа животных. Это оставалось мечтой до тех пор, пока не были сделаны выдающиеся открытия – выявление ДНК как носителя генетической информации, пока не были заложены основы рекомбинантной техники (открытие рестракционных энзим, клонирования ДНК и т. д.), или генной инженерии. В относительно короткие сроки были разработаны методы выделения из генома отдельных генов, создания эффективно функционируемых генных конструкций. В последующие годы были разработаны методы введения чужеродных генов в геном животных – реципиентов. Селекционеры получили в распоряжение могучий инструмент для создания животных с совершенно новыми свойствами. Что касается применения переноса генов у сельскохозяйственных животных, то надежды ученых в настоящее время связаны с улучшением продуктивности и качества животноводческой продукции, резистентности к болезням и создания так называемых «генных форм» или трансгенных животных-биореакторов ценных биологически активных веществ.
Трансгенные животные с новыми хозяйственно-полезными свойствами
Одним из основных направлений генной инженерии на первом этапе было изменение наследственности животных в отношении увеличения скорости роста, повышения надоев и улучшение качества продукции.
Рост животного является сложным процессом, который зависит от действия генов, условий питания и факторов окружающей среды. С генетической точки зрения особенно интересны гены, кодирующие протеины каскада гормона роста, а именно, непосредственно гормон роста (ГР), рилизинг фактора гормона роста (РФ – ГР) и инсулинподобный фактор гормона роста (ИФ ГР).
Еще в 40-е годы XX в. было установлено стимулирующее действие гипофизарного ГР на молочную продуктивность коров. Однако ввиду высокой стоимости препаратов гипофизарного ГР и невозможности его получения из гипофизов животных в больших количествах они не нашли практического применения.
К концу 70-х годов, с началом эры генной инженерии и появлением дешевых гормональных препаратов, полученных путем микробиального синтеза на основе технологии рекомбинантной ДНК, был синтезирован ГР. Было показано, что ГР микробного происхождения оказывает такое же стимулирующее действие на лактацию и рост животного, как и гипофизарный ГР.
При крупномасштабном применении рекомбинантного ГР (13 мг в день) увеличение удоев составляет 23–31 %. Разработаны формы препарата пролонгированного действия, позволяющие проводить обработку один раз в две недели и даже в месяц.
Ежедневные инъекции ГР молодняку крупного рогатого скота, свиней и овец вызывают увеличение суточных привесов на 20–30 % и сопровождаются сокращением расхода кормов на единицу прироста. У молодняка свиней ускорение роста сопровождается увеличением содержания белка и уменьшением содержания жира в тканях, что повышает ценность мясопродукции.
Первые надежды по применению транспорта генов у сельскохозяйственных животных были связаны с положительным влиянием на продуктивность. Были получены трансгенные мыши по гормону роста с четырехкратным увеличением скорости роста и удвоением конечной живой массы (R.D. Palmifier et al, 1982). Однако у трансгенных свиней (V.G. Purseletal., 1988) и овец (С.Е. Rexroodetal., 1990) не наблюдалось соответствующего ускорения роста.
Различия между трансгенными мышами, с одной стороны, и свиньями и овцами, с другой стороны, по гормону роста обусловлены тем, что в используемых для транспорта генов линиях мышей не велась предварительная селекция по их скорости роста, в то время как большинство использованных овец и особенно свиней происходили из популяций, в которых уже в течение десятилетий велась селекция по оптимизации параметров роста. По-видимому, в имеющихся популяциях сельскохозяйственных животных генетический потенциал роста находится недалеко от потенциального плато. Поэтому путем введения гена гормона роста в организм сельскохозяйственных животных нельзя добиться сколько-нибудь значительного эффекта.
Известно, что для ускорения роста свиней при инъекции ГР необходимо скармливать животным корма с повышенным содержанием протеина (18 % сырого протеина) и с дополнительным количеством лизина. У потомства трансгенных свиней, получавших соответствующий модифицированный кормовой рацион, наблюдались на 16,5 % более высокие среднесуточные привесы (Г. Брем и др., 1991).
Трансгенные овцы с геном ГР и РФ ГР имели повышенный уровень ГР, но не обладали повышенной скоростью роста.
Вместе с тем, все авторы единодушно отмечают, что трансгенные свиньи имеют более чем двукратное уменьшение толщины шпика (18–20 мм у контрольных свиней против 7–8 мм у трансгенных). Аналогичным образом трансгенные овцы имели 5–7 % жира по сравнению с 25–30 % у контрольных животных.
Все исследователи отмечают увеличение содержания белка и уменьшение содержания жира в тканях трансгенных животных с генами гормона роста, что заметно повышает качество и товарную ценность получаемых мясопродуктов. По сообщению В.Г. Пурселя и др. (1989), толщина шпика у трансгенных линий свиней на спине в области 10-го ребра составила (7,4 ± 2,3) мм по сравнению с толщиной шпика у контрольных животных (сибсов) (21 ± 1,7) мм.
Эти исследования дают основание предполагать, что молекулярные методы повышения продуктивности и особенно улучшения качества продукции будут играть важную роль в зоотехнической науке и в развитии животноводства в целом.
Трансгенные животные с устойчивостью к заболеваниям
Потери, вызванные заболеваемостью у сельскохозяйственных животных, составляют более 10 % стоимости продукции. Поэтому все более важное значение приобретает селекция животных по резистентности к заболеваниям. Резистентность – это наследственная генетически обусловленная восприимчивость животных к определенным микроорганизмам, вирусам, паразитам или токсинам.
К сожалению, попытки вести селекцию на устойчивость к разным заболеваниям не дали радикальных результатов, хотя известны отдельные положительные примеры. Созданы, в частности, популяции крупного рогатого скота с примесью крови зебу, которые устойчивы к ряду кровепаразиторных заболеваний. Резистентность к ряду заболеваний является полигенным признаком, как, например, трипанотолерантность определенных африканских пород крупного рогатого скота, которые, кроме резистентности к заболеваниям, отличаются хорошей жаровыносливостью и нетребовательностью к условиям содержания и кормления. Вместе с тем, имеются механизмы резистентности, которые основываются на единичных генах, как, например, резистентность к диарее у новорожденных поросят, обусловленная Е. coli К88, или резистентность к гриппу у мышей.
Это послужило основанием для получения трансгенных животных с чужеродными генами, которые, возможно, обеспечат невосприимчивость таких животных к отдельным заболеваниям.
Защитные механизмы от инфекционных заболеваний функционируют путем препятствия вторжению возбудителя или путем изменения рецепторов. Вторжению или размножению возбудителей препятствуют, главным образом, иммунные механизмы и экспрессия генов главного комплекса гистосовместимости, а также иммунологические способности различных молекул, таких, как интерферон, нейропептиды, гормоны и интерлейкины.
Одним из примеров гена резистентности является ген Мх мыши. Этот ген, найденный в модифицированной форме у всех видов млекопитающих, вырабатывает у Мх+-мышей иммунитет к вирусу гриппа А. Этот ген был выделен, клонирован и использован, в частности, для получения трансгенных свиней, которые экспрессировали ген Мх на уровне РНК (Г. Брем и др., 1991). Однако пока не получено данных об экспрессии у трансгенных свиней Мх-протеина и доказательства резистентности трансгенных свиней к вирусу гриппа.
В Голландии исследуется возможность получения трансгенных животных, способных повысить содержание лактоферина в тканях молочной железы с целью повышения резистентности к маститу.
Большой интерес представляют исследования по получению трансгенных животных с генами антисмысловой (ас) РНК. Экспрессия антисмысловой РНК в клетках приводит к последующей гибридизации со смысловой РНК и, следовательно, к ингибированию репликации вирусального генома.
Т.И. Тихоненко была создана конструкция гена антисмысловой РНК против аденовируса и в Биотехцентре (М.И. Прокофьев) получены трансгенные кролики. На культуре клеток из почек этих животных было показано, что клеточные линии, содержащие трансгенную антисмысловую РНК, имели на 90–98 % более высокую резистентность против Ads по сравнению с контрольными линиями клеток.
В других экспериментах этой же группы ученых продемонстрирована устойчивость трансгенных животных с геном антисмысловой РНК против лейкоза крупного рогатого скота к заражению вирусом лейкоза. У трансгенных кроликов с геном антисмысловой РНК против лейкоза крупного рогатого скота, зараженных антигеном р24, уровень антител был значительно ниже и не превышал титр 1 : 500 по сравнению с контрольными, у которых он изменялся в пределах 1 : 6000 – 1 :8000.
Показана возможность создания внутриклеточной иммунизации против инфекционных вирусов. Эндогенные вирусные белки, в особенности их мутационные формы, могут служить защитой от соответствующих вирусов. В частности, получены трансгенные куры, устойчивые к вирусу лейкоза, у которых в клетках экспрессировался белок вирусной оболочки.
Приведенные выше данные открывают реальные перспективы повышения резистентности трансгенных животных к заболеваниям.
Применение техники трансгеноза для улучшения состава молока
Одним из наиболее эффективных путей расширения рынка и кардинального снижения стоимости производства молочных продуктов может быть улучшение состава молока путем получения трансгенных животных. В результате генетической селекции в последние десятилетия молочная промышленность достигла значительного улучшения качества молочной продукции.
Однако новые генетические успехи, основанные на традиционных методах селекции, слишком медленны вследствие длительного интервала между поколениями. Это ограничивается также низкой наследуемостью этих качеств, взаимоотношениями между ними и потому, что различные молочные продукты могут быть получены от селекции в различных направлениях.
Более реальные перспективы улучшения качества или состава продуктов животноводства достигают введением соответствующих генных конструкций в организм животного. Рассматривается, например, возможность уменьшения лактозы в молоке путем создания трансгенных овец или крупного рогатого скота, которые несут специфический для молочной железы промотор, сцепленный с геном лактозы. При этом становится возможным расщепление лактозы (молочного сахара) на глюкозу и галактозу уже в молоке коров. Молоко таких животных может использоваться теми людьми, у которых отсутствует фермент лактозы.
Традиционно стоимость молока оценивалась по содержанию жира, но эта концепция меняется и отдается предпочтение таким компонентам молока, как протеин.
Ценные изменения в составе молока могут быть достигнуты количественно, путем изменения соотношения компонентов молока или качественно, т. е. добавлением других компонентов, не присутствующих в составе натурального молока, которые усилят его питательную ценность.
Изменения в составе белка молока. С экономической точки зрения представляет интерес увеличение содержания казеина в молоке в связи с его влиянием на производство сыра. Казеиновые мицеллы вовлекают жир и воду во время формирования сыра, играя, таким образом, важную роль в уменьшении к-казеина в молоке трансгенных мышей (Gutierrez – A. Adan et al., 1996), сопровождаясь значительным увеличением силы створаживания молока и уменьшением диаметра мицелл. Уменьшение диаметра мицелл должно привести к увеличению их поверхности, что в свою очередь способствует образованию более плотного творожного сгустка, скорости его формирования и увеличению выхода сыра. Эти измененные свойства молока представляют большую пользу и интерес для молочной промышленности.
Считается, что молочная железа имеет ограничения в способности синтеза белка. Любое дополнительное производство белка компенсируется уменьшением количества эндогенных белков молока.
Основываясь на этом, имеется другой возможный путь увеличения уровня казеинов, а именно, торможение производства других белков, представляющих меньший интерес. Для этой роли подходит β-лактоглобулин. Этот белок присутствует только в молоке жвачных и является основным аллергеном молока коров, поэтому уменьшение его количества могло бы улучшить состав молока. В целях уменьшения или торможения активности определенного гена были использованы антисенсы к РНК или рибосомы (D.L. Sokol et al., 1996).
Уменьшение уровня лактозы в молоке. Лактоза является основным сахаром в молоке и ответственна за нарушения пищеварения у большого процента популяции взрослых, когда уменьшаются уровни фермента лактозы во время отъема. Этот фермент гидролизует лактозу на моносахариды. Несколько промышленных приемов были направлены на получение молока с уменьшенным содержанием лактозы в молоке после доения. Это было бы полезно не только для человека, но и в молочной промышленности. Оно способствовало бы увеличению эффективности производства сыра (D.H. Hettinga, 1989).
Трансгенная технология пытается решить эту задачу несколькими путями. Во-первых, некоторые эксперименты основывались на производстве молока с низким содержанием лактозы. С этой целью α-лактальбумин-дефицитные мыши были получены через гомологенную рекомбинацию (M.G. Stinnakreetal., 1994), так как этот белок является одним из компонентов комплекса синтеза лактозы. Вследствие этой генетической манипуляции мыши производили молоко с низким содержанием или с отсутствием лактозы. Однако этот сахар играет роль в регуляции осмотического давления молочной железы и поэтому проявлялся отрицательно – мало молока с высокой вязкостью и лактирующие животные были не способны прокормить потомство.
Другой подход уменьшения концентрации лактозы в молоке основан на вызывании ее гидролиза in vivo подобно тому, как это достигается в молочной промышленности in vitro, чтобы адаптировать молоко нетолерантным человеческим потребителям. Лактоза гидролизуется путем экспрессии в тканях молочной железы. При этом одним приемом решаются две проблемы, а именно, не нарушается продукция молока, так как осмотическая активность лактозы сохраняется, а концентрация этого сахара значительно уменьшается в молоке, не оказывая побочного влияния на молочные соски (В. Jost et al., 1999).
Качественные изменения в составе молока. Молоко наряду с присущей ему ценностью может быть использовано в качестве транспортного средства для других веществ, которые усиливают не только его питательные, но также и функциональные свойства. Например, продуцируется лактоферрин, кислый белок человеческого молока с бактериостатическими свойствами, который усиливает адсорбцию железа. Этот белок присутствует на очень низком уровне в молоке коров и увеличением его концентрации могут быть достигнуты несколько целей. Например, получены трансгенные мыши, экспрессирующие человеческий лактоферрин (G.J. Platenburg et al., 1994). В этих опытах показано, что лактоферрин увеличивает адсорбцию железа и защищает сохранность потомства, так как ограничивает наличие свободного железа в межклеточном пространстве тракта, контролируя тем самым размножение бактерий.
Этот подход позволяет получать гуманизированное молоко, легче переводить его в молоко для новорожденных. С учетом этого получен трансгенный бык, несущий человеческий ген лактоферрина (P. Krimpenfort et al., 1991).
Бактериостатическое влияние может быть также достигнуто другими белками, направленными непосредственно в молочную железу и вызывающими уменьшение заболевания маститами. Например, лизоцим (Е.А. Maga et al., 1995) оказывает не только антибактериальное влияние, но также способствует увеличению выхода сыра вследствие его связи с казеинами. Возможно, он также вызывает специфический пассивный иммунитет у новорожденных с секрецией специфических антител. Высокие титры нейтрализующих антител были получены в молоке трансгенных мышей против специфических вирусных агентов, вызывая экспрессию специфических иммуноглобулинов в молочную железу (J. Castilla et al., 1998).
Таким образом, в результате секреции человеческих белков в молоко коров возможно его гуманизировать и сделать более адекватным для потребления человеком. Включения человеческого лактоферрина, человеческого лизоцима или человеческих иммуноглобулинов являются примером такой гуманизации молока коров. Но эти включения имеют дополнительную терапевтическую пользу. Можно также заменить животный белок его человеческим аналогом, не оказывая влияния на физиологическую активность животного.
Трансгенные животные, продуцирующие биологически активные вещества
медицинского и технологического назначения
Большинство наиболее важных изменений в составе молока были инициированы фармацевтической промышленностью. Коммерческий рынок для биореакторов, оцененный в размере 3 млрд долларов в год, в США привлек интерес фармацевтической промышленности. Они вскоре реализовали потенциальную возможность синтеза и секреции молочной железы, и несколько фармацевтических продуктов были синтезированы в молоке. Эффективность молочной железы в качестве биореактора настолько высока, что стоимость продукции может быть многократно снижена даже если процесс очистки еще недостаточно эффективный.
Однако не только фармацевтические белки могут быть эффективно произведены в молочной железе. Биологически активные пептиды могут быть также получены с достаточно высокой эффективностью. Недавно у трансгенных кроликов был получен с молоком кальцитонин-пептид, ответственный за регуляцию обмена кальция и используемый при oesteoporosis (Мс Кее С. et al., 1998). Важным непрямым эффектом биофарминга, который ожидается в ближайшем будущем, могут быть изменения в области получения трансгенных продуктов с молоком, которые бы могли стать источником заботы о человеческом здоровье.
Основа стратегии использования трансгенных животных как биореакторов состоит во включении в клетки организма генов, которые вызывают у них синтез новых белков, как правило, медицинского и технологического назначения.
Раньше такие белки были выделены из тканей и биологической жидкости тканей человека, таких как кровь (фактор свертываемости крови и другие белки крови) и гипофиз (гормон роста). Вследствие дороговизны и трудности получения человеческих тканей эти белки могут производиться в малых количествах и к тому же являются объектом контаминации патогенных организмов, таких как вирус гепатита и др.
На первом этапе практического применения молекулярной генетики были созданы рекомбинантные микроорганизмы, а позднее трансгенные клеточные линии млекопитающих, которые выращиваются в системах биореакторов и способны производить белки, закодированные экзогенными (чужеродными) генами. Эти системы были успешно использованы в получении ценных продуктов фармакологического и медицинского назначения, таких как инсулин, некоторые кровесвертывающие факторы, человеческий гормон роста и др.
Трансгенные животные как продуценты ценных биологических активных белков имеют ряд преимуществ перед микроорганизмами и клеточными системами.
Белки млекопитающих, продуцируемые микроорганизмами, не могут быть нормально гликолизированы, гидроксилированы или карбоксилированы. В простых рекомбинантных системах микроорганизмов это в большинстве случаев или невозможно, или возможно, но с недостаточной точностью, что приводит к изменению структуры протеинов и, как следствие, к снижению их биологической активности.
Получаемые новые белки в линиях генно-инженерных клеток млекопитающих могут быть в некоторых случаях правильно модифицироканы с активностью, сравнимой с нативными протеинами, но выход белка из культуральных клеток в основном низкий. К тому же создание клеточных культур является сложной и дорогой процедурой.
Промышленные реакторы, в которых выращиваются клетки, также являются дорогими. Трансгенные животные могут быть трудно создаваемыми и дорогими, но однажды созданная линия таких животных воспроизводит себе подобных, они легко размножаются и их содержание сравнительно дешево и, в принципе, они могут продуцировать чрезвычайно большое количество белков с низкой стоимостью.
Гетерогенные белки могут быть получены большинством тканей тела животного. Путем сочетания структурных генов со специфическими регуляторными элементами можно добиться экспрессии трансгена в определенных органах.
Наибольший прогресс в производстве трансгенных биоректоров был достигнут в целенаправленной трансгенной экспрессии в эпителиальные клетки молочной железы и производстве белков с молоком. Структурный ген, связанный с промотором гена молочного протеина, в первую очередь будет экспрессироваться в клетках молочной железы.
Выделение рекомбинантного белка с молоком, с одной стороны, удобный прием его получения от животного с применением естественного приема, обычного доения, а с другой стороны, безопасен для животного, так как удаление из организма чужеродных белков, как правило биологически активных, не позволяет им оказывать какое-либо вредное влияние на физиологическое состояние животного.
Одним из основных этапов в получении трансгенных животных, продуцирующих гетерогенный белок с молоком, является идентификация промотора, который будет направлять экспрессию в секреторный эпителий молочной железы. В настоящее время выделены промоторы aSl-казеина, β-казеина, α-лактоальбумина, β-лактоглобулина и сывороточного кислого протеина (WAP).
Использование молочной железы для производства чужеродных протеинов обосновывается ее огромной синтетической белковой продуктивностью. Общая концентрация эндогенных молочных белков в зависимости от вида составляет 2–10 % (табл. 4.6), т. е. на уровне 20–100 г на 1 л. Если еще нет возможности получать такое же количество рекомбинантного белка из 1 л молока, то выделение одного и более граммов такого белка уже достаточно для коммерческого производства фармацевтически важных белков.
Таблица 4.6. Содержание белка в молоке разных видов животных (по В.И. Георгиевскому)

Среди рекомбинантных белков, полученных из молока трансгенных животных, известны следующие: человеческий белок С, антигемофильный фактор IX, альфа-1-антитрипсин, тканевый плазминогенный активатор, лактоферин, человеческий сывороточный альбумин, интерлейкин-2, урокиназа и химозин. За исключением альфа-1 -антитрипсина и химозина работы по получению большинства других белков не достигли стадии, которая бы представляла коммерческий интерес. В большинстве проектов эта работа на стадии экспериментов, когда генная конструкция оценивается лишь на трансгенных мышах.
Что же касается человеческого альфа-1-антитрипсина и химозина, то получение этих рекомбинантных протеинов уже находится на стадии, близкой к коммерческой. В 2006 г. разрешено производство и реализация на фармацевтическом рынке сентритромбина, полученного из молока трансгенных коз (фирма «GTC Терапевтию»).
Одним из основных преимуществ трансгенной технологии является ее высокая экономическая эффективность.
Потребность мирового рынка в рекомбинантных белках в 1999 г. оценивалась в 13 млрд долларов, а рынок антител в настоящее время составляет более 1 млрд долларов. Производством белков фармакологического назначения с помощью трансгенных животных занимаются более 20 фирм во всем мире (Das, 2001). Если стоимость производства одного грамма рекомбинантного белка в культуре клеток биореактора колеблется в пределах 100–1000 долларов в зависимости от выхода белка и мощности биореактора, то затраты на его производство с молоком сельскохозяйственных животных могут быть 40–50 долларов.
Другим преимуществом этой технологии является высокая производственная емкость молочной железы трансгенных животных.
Если принять во внимание, что концентрация рекомбинантного белка в молоке будет по меньшей мере 1 мг/мл, то можно подсчитать число животных, необходимых для обеспечения количества того или иного фармацевтического белка (табл. 4.7).
Таблица 4.7. Расчетное число трансгенных животных, необходимых
для обеспечения мировой потребности рынка отдельными фармацевтическими белками (по Wall, 1999)
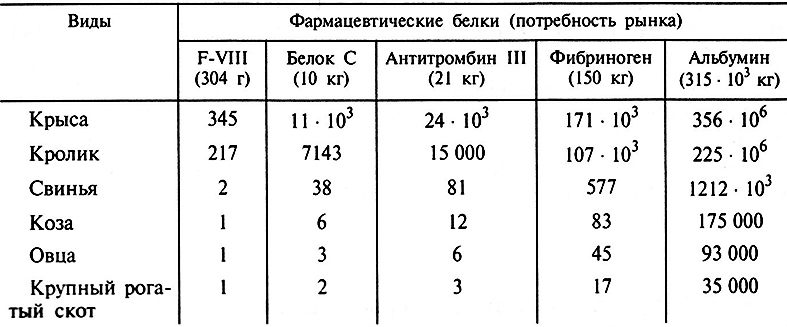
Из табл. 4.7 видно, что шести коз или пары коров достаточно, чтобы обеспечить годовую потребность мирового рынка в белке С, тогда как для такого же его производства потребуется 5 млн л донорской крови. Или возьмем другой белок – альбумин. Для обеспечения в нем мирового рынка потребуется большое стадо коров, 35 000 голов, чтобы получить 400 т человеческого сывороточного альбумина. Однако это позволит избежать сбора 16 млн л донорской крови. При этом надо учесть, что использование трансгенных животных позволяет избежать переноса вирусной инфекции.
Группа ученых в Эдинбурге (Великобритания) в 1992 г. получила трансгенных овец с человеческим геном альфа-1-антитрипсина и бета-глобулиновым промотором. У четырех овец содержание этого белка составляет более 1 г/л, а одна овца сначала продуцировала 60 г/л, а затем стабилизировалась на 35 г/л, что соответствует половине всех белков в молоке. Все овцы здоровы и не имеют каких-либо нарушений лактации. При таком уровне может быть получено более 10 кг белка от одного животного в год, что достаточно для 50 пациентов при лечении эмфиземы легких.
Группа ученых в Москве (Л.K. Эрнст, Г. Брем, М.И. Прокофьев, И.Л. Гольдман и др.) получила трансгенных овец с геном химозина, которые продуцируют с молоком в среднем 200–300 мг фермента химозина в 1 л молока. Этот источник получения химозина – основного компонента для производства сыра – может заменить традиционный способ его получения из сычугов молочных телят и ягнят, но его стоимость будет в 5–10 раз ниже.
Однако у трансгенных овец наблюдалась закупорка молочных протоков вследствие створаживания молока внутри вымени, что сопровождалось выдаиванием лишь ничтожно малого количества молока. Это обстоятельство исключило коммерческое использование этих животных.
Огромный интерес к новой технологии производства фармакологических белков обусловлен, прежде всего, экономическими выгодами. Себестоимость производства фармакологических белков с использованием трансгенных животных в 100–1000 раз ниже по сравнению с использованием существующих генно-инженерных микроорганизмов и рекомбинантных линий клеток млекопитающих.
Трансгенные животные как продуценты ценных лекарственных белков имеют целый ряд преимуществ по сравнению с микроорганизмами и клеточными системами. Белки млекопитающих, продуцируемые рекомбинантными микроорганизмами, не могут быть нормально синтезированы, т. е. гликозилированы или карбоксилированы. В простых системах микроорганизмов это в большинстве случаев или невозможно, или возможно с недостаточной точностью, что приводит к изменению структуры белков и, как следствие, к снижению их биологической активности, стабильности и т. д.
Лекарственные белки, получаемые в генно-инженерных клетках млекопитающих, могут быть правильно синтезированы, с активностью, сравнимой с природными белками, но выход белка из культуральных клеток очень низкий. К тому же создание клеточных линий является сложной и дорогой процедурой. Поэтому стоимость полученных рекомбинантных белков, продуцируемых с помощью клеточных систем, в 1000 раз превышает стоимость при их производстве с использованием трансгенных животных.
Огромный интерес к получению лекарственных белков с использованием трансгенных животных вызван также тем, что традиционная технология их получения из крови доноров сопровождается переносом человеческих инфекций (гепатит, СПИД и др.). Это исключается при получении рекомбинантных белков при помощи трансгенных животных.
В мире получены трансгенные животные, продуцирующие с молоком целый ряд лекарственных веществ: VIII и IX факторы свертываемости крови против гемофилии; тканевый плазменно-генный активатор, применяемый при лечении венозных тромбов и эмболии легочной артерии; человеческий белок С для предотвращения образования тромбов; моноклональные антитела для лечения различных форм рака и др.
И недалек тот день, когда привычные технологии получения лекарственных препаратов из донорской крови человека или при помощи биореакторов с использованием генно-инженерных микроорганизмов и клеточных линий будут в основном заменены трансгенными животными. В этом можно убедиться при посещении крупнейших, занимающихся этой проблемой: «Джинзайм» (США), «ППЛ Терапевтике» (Англия – США), «Ред. Кросс» (США), «Фарминг» (Голландия). По заказу фармацевтических фирм работает фирма «Инфиген» (США) по получению трансгенных животных, продуцирующих с молоком ценные лекарственные вещества.
По данным Гематологического научного центра (г. Москва), общий объем закупок лекарственных препаратов из крови человека на мировом рынке составляет 60 млрд долларов.
Биотехцентр занимается получением трансгенных животных в течение последних лет. Получены трансгенные кролики, овцы, козы.
В последнее время Биотехцентр направляет основные усилия на получение трансгенных животных, продуцирующих с молоком ценные лекарственные вещества, используемые, главным образом, в онкологии и кардиологии. При использовании трансгенных кроликов препарат может быть получен в достаточном количестве для клинических испытаний через 10–12 мес после начала работы.
Получены трансгенные кролики, продуцирующие с молоком гранулоцитарный колониестимулирующий фактор, который используется для лечения рака после применения химиотерапии и радиотерапии, при пересадке костного мозга, а также при острой лейкемии у больных СПИДом (рис. 4.7).

Рис. 4.7. Трансгенный кролик, продуцирующий с молоком гранулоцитарный колониестимулирующий фактор (ГКСФ),
полученный в Биотехцентре РАСХН
Начата работа по получению крупных трансгенных животных, в частности коров, продуцирующих с молоком человеческий альбумин, так как потребность в мире в этом препарате огромная, около 100 000 кг. Поэтому такое количество человеческого альбумина могут обеспечить только коровы. Для обеспечения этого количества требуется 5400 трансгенных коров. На российском рынке потребность в этом препарате занимает первое место и оценивается в 1 млрд долларов в год.
Разрабатывается программа получения трансгенных животных, продуцирующих с молоком моноклональные антитела. С использованием технологии получения моноклональных антител можно тонко регулировать множество важных биологических процессов организма, определять присутствие широкого спектра возбудителей с высокой точностью, избирательно воздействовать на определенные группы клеток организма, в частности раковые. Такие системы позволяют революционизировать клиническое лечение раковых заболеваний.
Начаты работы по получению трансгенных животных–доноров органов и тканей по пересадке человеку. Путем пересадки соответствующих генных конструкций в зародыши животного могут быть получены трансгенные животные, у которых могут быть подавлены реакции отторжения органов и тканей при трансплантации их человеку. Ученые считают, что на первом этапе эта технология будет применяться для замены инсулинотерапии у больных диабетом пересадкой человеку тканей островков Лангенгарса (бета-клеток).
С учетом низкой себестоимости препаратов, полученных с использованием новой технологии, эти разработки будут иметь не только огромный экономический эффект, но и большое социальное значение, так как открывают доступность ценных лекарственных средств для широких слоев населения. Поэтому целесообразна поддержка этих разработок как частными фирмами, так и государством.
Большинство исследователей, получавших трансгенных животных с другими генами, как правило, не наблюдали каких-либо отклонений в здоровье животных. Необходимо отметить, что за трансгенными животными ведется индивидуальный контроль и те из них, у которых отмечены какие-либо отклонения, не используются в дальнейшем размножении (сразу же уничтожают). Поэтому появление таких отклонений у трансгенных животных не опасно для передачи их потомству.
Поданным американских исследователей (Pursel и др., 1990), положительное влияние гена гормона роста на трансгенных свиней, включая ускорение роста, повышение эффективности использования корма и снижение содержания жира в туше, у некоторых животных сопровождается хромотой и язвой желудка; метаболизм глюкозы у них был несколько нарушен, воспроизводительная способность трансгенных свиней, секретирующих рекомбинантный гормон роста, имела также некоторые отклонения от нормы. Авторы связывают эти изменения в состоянии здоровья трансгенных свиней с длительным воздействием повышенного содержания гормона роста в крови.
В наших исследованиях на трансгенных овцах введение гена прохимозина не сопровождалось отклонениями в проявлении воспроизводительной функции и в состоянии здоровья, но наблюдалось резкое снижение удоя вследствие закупорки молочных протоков. В других наших исследованиях на трансгенных кроликах с геном гранулоцитарного колониестимулирующего фактора у некоторых линий животных наблюдалось нарушение воспроизводительной функции у самок, но у других линий такие отклонения отсутствовали.
В настоящее время идет дискуссия по поводу безопасности применения в пищу генномодифицированных продуктов. Однако достаточной научно обоснованной методической достоверности этих работ нет.
Что же касается получения лекарств с использованием трансгенных организмов, то эта технология уже многие годы широко используется. Многие лекарственные белки, такие как инсулин, интерфероны, интерликины и др., получают только с использованием трансгенных микроорганизмов или клеток млекопитающих и их широко используют в медицине во всем мире.
В 2006 г. Европейский комитет по лекарственным препаратам дал разрешение на производство и использование в медицине лекарственных белков, полученных с молоком трансгенных животных. Фирма GTC «Биотерапевтик» получила лицензию на производство и использование антитробина из молока трансгенных коз.

