Получение кормовых белковых концентратов с повышенным содержанием незаменимых аминокислот позволяет балансировать корма сельскохозяйственных животных главным образом по уровню белка, тогда как оптимальный аминокислотный состав кормового белка при таком способе балансирования полностью не достигается. По некоторым аминокислотам почти всегда требуется для доведения их концентрации в кормовом рационе до оптимума добавление препаратов чистых аминокислот, полученных промышленным способом. В мире ежегодно производится не менее 300 тыс. т кормовых препаратов незаменимых аминокислот. Расширяется их производство и в нашей стране.
Возможны три способа промышленного получения незаменимых аминокислот: гидролиз белков растительного и микробного происхождения, микробиологический, а также химический синтез. Более 60 % всех производимых промышленностью чистых препаратов аминокислот получают путем микробиологического синтеза. На втором месте по объему производства находится химический синтез. Основным недостатком химического синтеза является получение смеси аминокислот, состоящей из изомеров, относящихся как к D-, так и к L-ряду, тогда как биологической активностью в организме человека и животных обладают лишь L-формы. D-Формы аминокислот не перевариваются ферментными системами этих организмов, а некоторые из них токсичны для человека и животных. Исключением в этом отношении является аминокислота метионин, у которой биологически активны как D-, так и L-формы, в связи с чем данная аминокислота производится преимущественно методом химического синтеза. Технологически получение аминокислот за счет гидролиза белков экономически менее выгодно, поэтому не получило широкого распространения.
Путем микробиологического синтеза образуются L-аминокислоты, являющиеся продуктами жизнедеятельности специально подобранных и отселектированных штаммов микроорганизмов, которые способны накапливать в культуральной жидкости до 150 г/л синтезируемой аминокислоты. Чаще всего для микробиологического синтеза аминокислот используются ауксотрофные мутантные штаммы, которые получают методами обычной селекции или генной инженерии. С помощью мутагенных факторов у таких ауксотрофных штаммов индуцируется мутация, в результате которой прекращается или ингибируется синтез одного из продуктов, оказывающих регуляторное воздействие на ферментные системы, катализирующие образование данной аминокислоты, в результате чего концентрация этой аминокислоты в клетках мутанта и в культуральной жидкости повышается.
На основе культивирования микроорганизмов с целью получения чистых препаратов аминокислот применяются промышленные технологии, включающие одно- и двухступенчатый синтез аминокислот. При одноступенчатом синтезе в промышленных культиваторах выращивают ауксотрофные мутанты, являющиеся сверхпродуцентами тех или иных аминокислот. После завершения рабочего цикла их выращивания производится отделение культу ральной жидкости от клеток микроорганизмов, сгущение культуральной жидкости и получение из нее товарного продукта с высокой концентрацией синтезированной микробами аминокислоты. В процессе двухступенчатого синтеза аминокислоты вначале получают ее предшественника (часто наиболее дешевым химическим синтезом), а затем с помощью ферментов, вырабатываемых микроорганизмами, производится превращение предшественника в аминокислоту, при этом образуется только L-форма. В качестве источника фермента могут быть использованы либо суспензия клеток микроорганизмов, либо полученный после разрушения этих клеток ферментный раствор.
Микробиологический синтез лизина
Белки семян зерновых культур (пшеницы, ячменя, кукурузы и др.) не сбалансированы по содержанию незаменимых аминокислот и прежде всего лизина. Поэтому для удовлетворения потребностей животноводства в нашей стране, как и в ряде других стран (Япония, США, Франция, Испания, Югославия), организовано крупнотоннажное производство этой незаменимой аминокислоты. В основу производства положены технологии с использованием одноступенчатого микробиологического синтеза, которые включают промышленное культивирование ауксотрофных мутантов бактерий из рода Corynebacterium, способных к сверхсинтезу этой аминокислоты. Обычно у диких штаммов, из которых получены ауксотрофные мутанты, сверхсинтеза лизина не наблюдается, так как у них действуют механизмы саморегуляции. В клетках бактерий аминокислота лизин синтезируется из аспарагиновой кислоты через ряд промежуточных этапов, связанных с образованием полуал ьдегида аспарагиновой кислоты, дигидропиколиновой кислоты и α, ε -диаминопимелиновой кислоты, являющейся непосредственным предшественником лизина. Полуальдегид аспарагиновой кислоты является также одним из предшественников в синтезе аминокислот – треонина, метионина и изолейцина (схема 1).
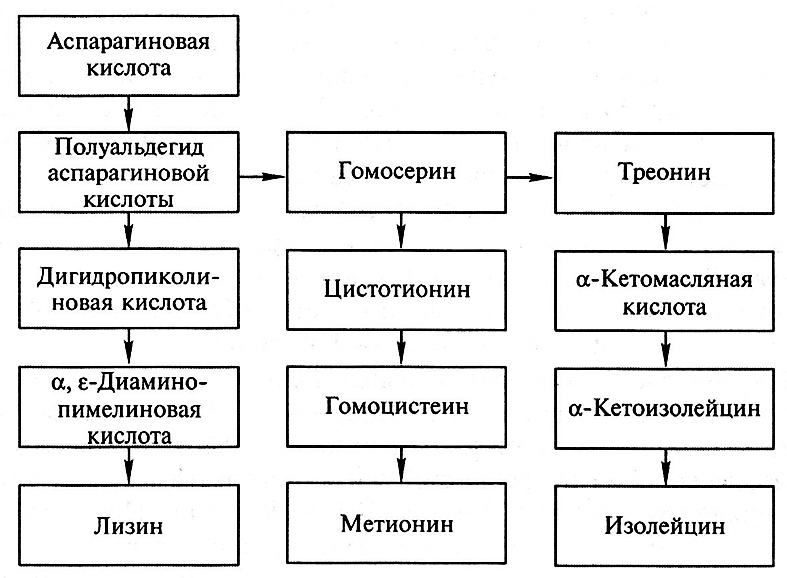
Схема 1. Синтез лизина метионина, треонина и изолейцина
Процесс синтеза всех указанных аминокислот (лизина, треонина, метионина и изолейцина) начинается фосфорилированием аспарагиновой кислоты с участием фермента аспартаткиназы, активность которого ингибируется совместным действием двух аминокислот – лизина и треонина, если они накапливаются в клетках бактерий в избыточной концентрации. Если каким-либо путем понизить концентрацию одной из этих аминокислот, то синтез другой будет осуществляться даже при условии, когда она накапливается в довольно высокой концентрации.
В соответствии со схемой превращения аминокислот (см. схему 1) для снятия регуляции синтеза лизина необходимо прекратить образование треонина на стадии превращения полуальдегида аспарагиновой кислоты в гомосерин, катализируемого ферментом гомосериндегидрогеназой. Последнее достигается посредством мутагенеза. Опыты показывают, что мутантные клетки, не образующие гомосериндегидрогеназы, при их культивировании на искусственной питательной среде обеспечивают высокий выход лизина. Дефицитные аминокислоты, которые не синтезируются мутантными клетками (гомосерин, треонин, метионин), вводятся в состав питательной среды в таком количестве, чтобы они не были регуляторами синтеза лизина.
В процессе приготовления питательной среды для культивирования производственных штаммов ауксотрофных мутантов, обладающих способностью к сверхсинтезу аминокислоты лизина, в качестве источника углерода обычно используют смеси, включающие уксусную кислоту и свекловичную мелассу, в качестве источника азота – соли аммония, мочевину, кукурузный экстракт, гидролизаты дрожжей. Кроме дефицитных аминокислот, которые не синтезируются клетками мутантов, в питательную среду также добавляют необходимые для жизнедеятельности микроорганизмов макро- и микроэлементы (Р, Mg, Fe, Са, Мn и др.) и витамины (витамины группы В, биотин и др.). В процессе культивирования микроорганизмов обеспечивается подача стерильного воздуха при помощи специальных турбинных мешалок, для предотвращения вспенивания субстрата и клеточной суспензии в среду культивирования добавляется пеногаситель. Схема технологической линии по производству лизина показана на рис. 6.4.
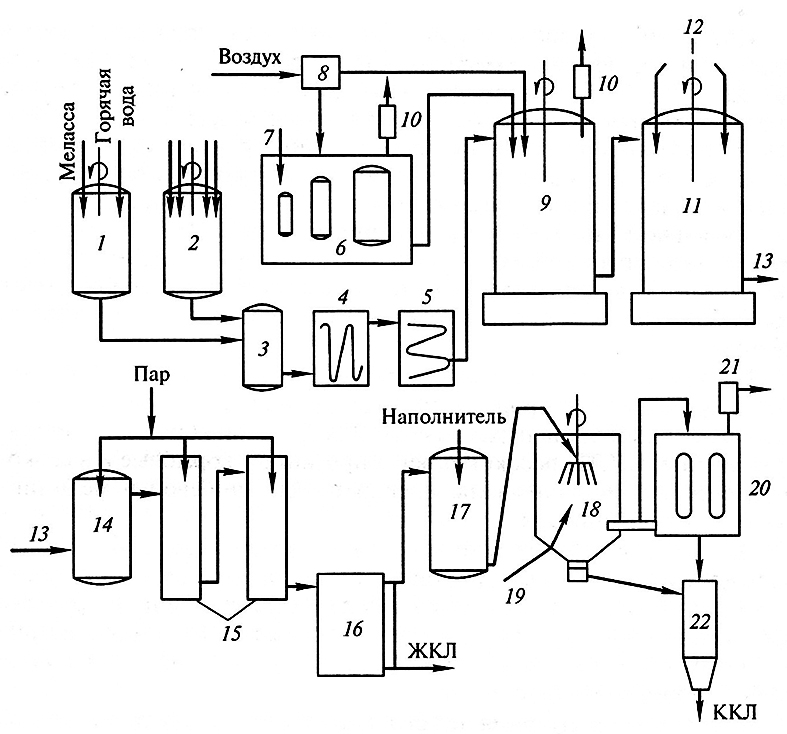
Рис. 6.4. Схема технологической линии по производству кормовых концентратов лизина:
1 – подогрев и растворение свекловичной мелассы; 2 – смешивание кукурузного экстракта, питательных солей и мела в волной суспензии;
3 – нагревательная колонка; 4 – выдерживатель; 5 – теплообменник для охлаждения;
6 – аппараты для размножения и стерилизации посевной культуры; 7– подача посевного материала;
8 – система фильтров для очистки и стерилизации воздуха; 9 – ферментер для выращивания промышленной культуры;
10 – фильтры экологической очистки выходящих газов; 11 – получение монохлоргидрата лизина;
12 – подача в реактор соляной кислоты, бисульфита натрия; 13 – монохлоргидрат лизина;
14 – подогрев культуральной жидкости, содержащей монохлоргидрат лизина; 15 – выпарная установка;
16 – сборник жидкого концентрата лизина (ЖКЛ); 17 – смешивание ЖКЛ с наполнителем; 18 – распылительная сушилка;
19 – подача горячего воздуха; 20 – отделение частиц сухого концентрата лизина от воздуха;
21 – экологическая очистка воздуха перед сбросом в атмосферу;
22 – приемник сухого кормового концентрата лизина (ККЛ)
Посевной материал, предназначенный для производственной ферментации, вначале выращивают в посевных аппаратах при 28–32 °С, рН 7–7,2 в течение 18–24 ч, а затем полученная суспензия клеток подается в производственные ферментеры емкостью 50–100 м3, в которых поддерживается постоянный режим аэрации, необходимое давление, осуществляется контроль за всеми компонентами и параметрами среды. Время ферментации 55–72 ч. Накопление в культуральной жидкости лизина начинается после 25–30 ч выращивания промышленной культуры и к концу ферментации достигает 40–50 г/л. Культуральную жидкость отделяют от культуры клеток продуцента фильтрованием и используют для получения препаратов лизина.
На основе промышленной культуры синтезирующих лизин бактерий организовано производство нескольких видов товарной продукции: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ), высококонцентрированные кормовые и высокоочищенные кристаллические препараты для пищевой и медицинской промышленности.
Жидкий концентрат лизина получают путем упаривания культуральной жидкости на вакуумной установке до концентрации сухого вещества 40 %. Для предотвращения деградации лизина в процессе нагревания в культуральную жидкость добавляют бисульфит натрия и соляную кислоту до рН 4,5–5,0, в результате чего образуется соль – монохлоргидрат лизина.
В процессе получения сухого кормового концентрата лизина ЖКЛ высушивают горячим воздухом на распылительной сушилке при температуре 90 °С до влажности препарата 4–8 %. Высушенный таким образом препарат содержит 15–20 % монохлоргидрата лизина, 15–17 % белков, 14 % других аминокислот, витамины группы В, минеральные вещества. В целях снижения гигроскопичности препарата в него добавляют наполнители: костную муку, негашеную известь, бентонит, пшеничные отруби. Чаще всего в качестве наполнителя используют отруби, которые добавляются в ЖКЛ после упаривания. Полученную в результате тщательного перемешивания пасту высушивают на вальцово-ленточной сушилке и гранулируют. Гранулированный препарат ККЛ негигроскопичен, содержит 7–10 % лизина.
Для получения очищенного высококонцентрированного препарата лизина культуральную жидкость после фильтрования подкисляют соляной кислотой до рН 1,6–2,0. Образовавшийся в результате взаимодействия с соляной кислотой раствор монохлоргидрата лизина направляется на колонки с катионитом, где происходит сорбция аминокислоты и отделение ее от культуральной жидкости. Затем производится десорбция аминокислоты путем элюирования 0,5–5 %-м раствором аммиака. Элюат упаривается под вакуумом при 60 °С до концентрации сухого вещества 30–50 %, после чего подкисленный соляной кислотой раствор монохлоргидрата высушивается и используется как кормовой концентрат. Путем перекристаллизации полученной соли можно получить препараты лизина с содержанием монохлоргидрата 97–98 %.
В процессе производства лизина кроме основного продукта полезное применение находяттакже побочные продукты и отходы. Так, после отделения культуральной жидкости в осадке остаются клетки бактерий-продуцентов, фосфаты и другие компоненты питательной среды, которые после их высушивания могут быть использованы в качестве кормовой белковой добавки. С другой стороны, технологические стоки и промывные воды после выделения монохлоргидрата лизина, содержащие в растворенном состоянии аминокислоты, другие ценные компоненты культуральной жидкости, остаточный лизин, объединяют и полученную смесь упаривают, а затем высушивают с наполнителем до влажности 10 %, в результате получают кормовой препарат с высоким содержанием белков (до 40 %) и незаменимых аминокислот.
В ряде стран (Япония, США) для получения лизина применяется химико-энзиматический метод, позволяющий создать высокоэффективные технологии, сочетающие достоинства химического и микробиологического синтеза. Эти технологии основаны на ферментативной конверсии в лизин а-амино-е-капролактама, который получают путем химических реакций из циклогексана:
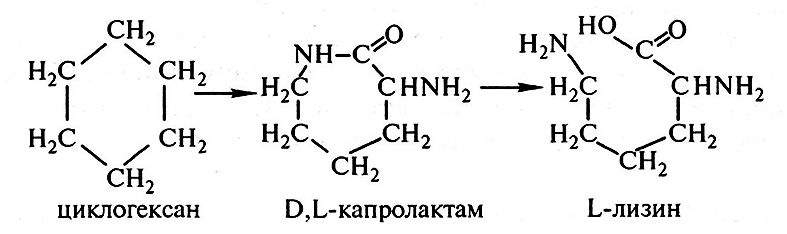
В результате химического синтеза образуется рацемическая смесь D- и L-капролактама. Эта смесь направляется в реактор с ферментом гидролазой α-амино-ε-капролактама, который катализирует превращение L-капролактама в L-лизин. D-Изомер капролактама далее подвергается превращению в L-форму с участием специфической рацемазы. При такой технологии получения лизина его содержание в реакционной смеси по завершении рабочего цикла достигает свыше 150 г/л.
Продуцентами гидролазы α-амино-ε-капролактама служат некоторые штаммы дрожжей из родов Cryptococcus, Candida, Trichosporon. Дрожжи выращиваются в щелочной среде на оптимизированной для синтеза фермента питательной среде, содержащей активаторы – Mn2+, Mg2+, Zn2+. Для ферментативной реакции превращения капролактама в лизин может использоваться клеточная суспензия дрожжевых клеток с активным ферментом, клеточный экстракт (после разрушения и отделения клеток) или очищенный фермент. Рацемазу, катализирующую превращение D-капролактама в L-изомер, получают из бактерий Achromobacter, Flavobacterium и др.
Процессы изомеризации D-капролактама в L-изомер и превращение L-капролактама в лизин можно проводить одновременно. Для этого в водный раствор D-, L-капролактама вводится необходимое количество дрожжевых и бактериальных клеток, задаются оптимальные режимы температуры, рН, аэрации. На выходе из реактора образуется преимущественно один продукт – L-лизин, который выделяют из смеси и далее очищают и сушат. Кроме изложенной выше технологии получения чистых препаратов лизина разрабатываются и другие методы, сочетающие в себе использование химического синтеза для получения предшественников лизина и энзиматическое превращение их в лизин на конечной стадии производства, что позволяет значительно интенсифицировать производственный процесс и снизить себестоимость продукции.
Микробиологический синтез триптофана
Наряду с лизином разработаны промышленные технологии получения кормовых и высокоочищенных препаратов другой незаменимой аминокислоты – триптофана. Для производства этой аминокислоты применяется как одноступенчатый синтез при помощи бактериальных ауксотрофных мутантов с нарушенной регуляцией, так и двухступенчатый синтез, включающий вначале получение предшественника триптофана, а затем его ферментативное превращение в конечный продукт – триптофан.
У бактерий и многих других организмов аминокислота триптофан образуется из эритрозо-4-фосфата и фосфоенолпировиноградной кислоты через ряд последовательных реакций, включающих образование шикимовой и хоризмовой кислот, а непосредственным предшественником триптофана в процессе его синтеза является антраниловая кислота (схема 2).
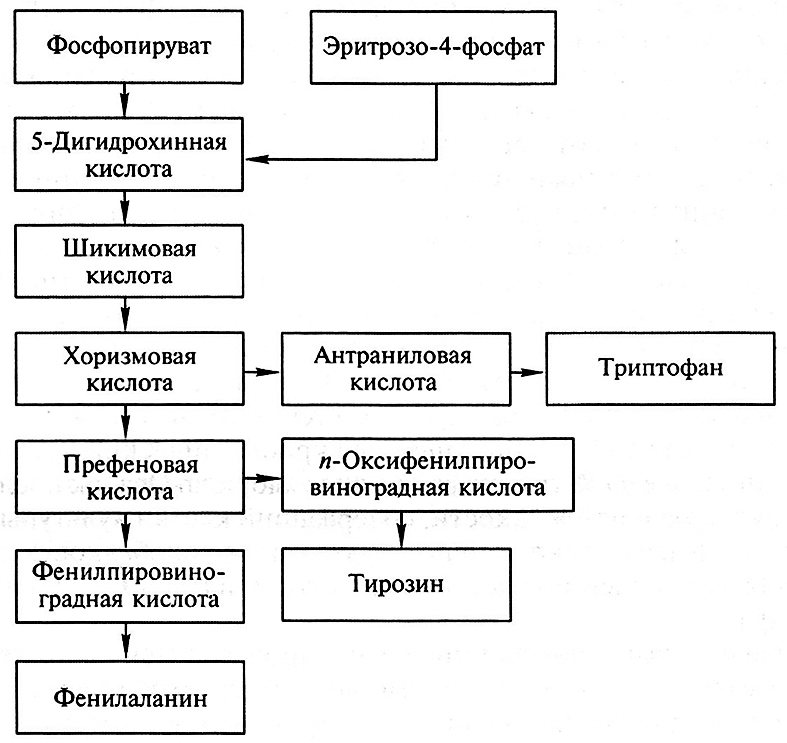
Схема 2. Синтез триптофана, феннлаланина и тирозина
Синтез указанных в схеме аминокислот ингибируется конечными продуктами, которые действуют на ферменты, катализирующие начальные этапы превращений, связанные с образованием хоризмовой кислоты. Из схемы 2 видно, что для смещения метаболических реакций по пути преимущественного образования триптофана необходимо блокировать превращение хоризмовой кислоты в префеновую. Такое блокирование достигается действием мутагенных факторов. У мутантов с пониженной активностью ферментов, катализирующих превращение хоризмовой кислоты в префеновую, наблюдается повышенный синтез аминокислоты триптофана, однако для нормального развития этих мутантов в питательную среду необходимо добавлять дефицитные аминокислоты – фенилаланин и тирозин в количествах, не вызывающих регуляторное ингибирование ферментов синтеза триптофана.
Для промышленного получения незаменимой аминокислоты триптофана разработаны технологии на основе использования ауксотрофных мутантов бактерии Bacillus subtilis с нарушенным синтезом фенилаланина и тирозина. Все технологические процессы организованы примерно по такой же схеме, как и получение лизина при помощи мутантов кори небактерий. Ферментация длится 48 ч при 37 °С, концентрация триптофана в культуральной жидкости достигает 10 г/л. После отделения культуральной жидкости от клеток бактерий она упаривается и высушивается при 110–120 °С. Высушенный продукт называют кормовым концентратом триптофана (ККТ).
При получении высококонцентрированных препаратов триптофана культуральную жидкость подвергают дополнительной очистк) Вначале ее подкисляют соляной кислотой до рН 1,0, затем центрифугированием отделяют образовавшийся осадок. Далее центрифугат, содержащий триптофан, пропускают через ионно-обменные колонки с катионитом, в результате чего происходит связывание аминокислоты катионитом и выделение ее из культуральной жидкости. После промывки колонок производится десорбция триптофан 5 %-м раствором аммиака в смеси изопропанола и воды. Элюат направляется в вакуумный выпариватель, после чего проводится кристаллизация аминокислоты при 4–8 °С. Выделенная в кристаллическом виде соль триптофана промывается этанолом и высушиваете под вакуумом при 60 °С. Высушенный кристаллический препарат cодержит не менее 99 % триптофана в виде хлорида. Осадок после отделения культуральной жидкости, содержащий клетки культуры бактерий, также высушивают и используют как высокобелковую кормовую добавку, содержащую, кроме того, повышенное количеству триптофана.
В нашей стране синтез триптофана производится по двухступенчатой схеме. Вначале методом химического синтеза получают предшественник триптофана – антраниловую кислоту, которую затем участием ферментов микробного происхождения превращают триптофан. Биохимическое превращение антраниловой кислоты в триптофан проходит в три этапа:
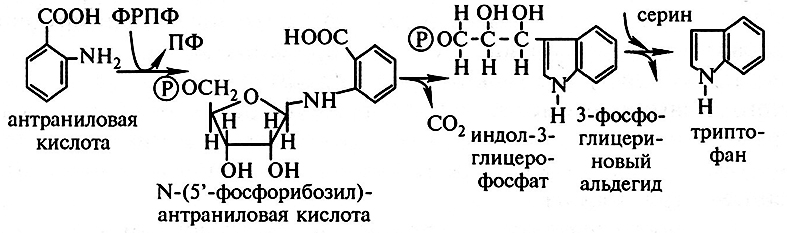
На первом этапе из антраниловой кислоты с участием фосфорибозилпирофосфата (ФРПФ) образуется аминогликозид-N-(5'-фосфорибозил)-антраниловая кислота, которая далее в результате внутримолекулярной перегруппировки и декарбоксилирования превращается в индол-3-глицерофосфат. На последнем этапе под действием фермента триптофансинтетазы из индолглицерофосфата и аминокислоты серина осуществляется синтез триптофана. В связи с тем, что в качестве активной группы у фермента триптофансинтетазы служит пиридоксальфосфат, от наличия в среде этого кофермента зависит скорость превращения антраниловой кислоты в триптофан. В качестве источника ферментов для указанных реакций используют дрожжи С. utilis.
Производственный процесс биохимического превращения антраниловой кислоты В триптофан проводится в две стадии. На первой стадии наращивается биомасса дрожжей, являющихся продуцентами ферментов. Питательная среда для выращивания дрожжей готовится из свекловичной мелассы, мочевины и минеральных солей. Ферментация продолжается в течение 24 ч при 30 °С. Далее в ферментер начинают вводить спиртовой 5 %-й раствор антраниловой кислоты и 50 %-й раствор мочевины. Через 3–4 ч после добавления антраниловой кислоты в ферментер дополнительно подается углеродный субстрат – меласса в виде 25 %-го раствора. На последующих этапах ферментации периодически производится подача антраниловой кислоты и мочевины через каждые 6 ч и раствора мелассы – через каждые 12 ч. Длительность ферментации около 120 ч, а с учетом времени наращивания биомассы дрожжей – 144 ч. Содержание триптофана в культуральной среде составляет 0,3–0,5 %, или примерно 6 г/л. После упаривания и сушки получают кормовой концентрат триптофана (ККТ), содержащий 90 % сухого вещества, 48–54 % белков, 1–3 % триптофана, 1,5–1,9 мг% витамина В1, 2,5–3,3 мг% витамина В2, 62–68 мг% витамина PP.
Для получения высококонцентрированных препаратов триптофана его выделяют из культуральной жидкости и очищают по методике, указанной выше (см. с. 376–377).
6.3. ПРОИЗВОДСТВО КОРМОВЫХ
ВИТАМИННЫХ ПРЕПАРАТОВ
Важным фактором повышения питательной ценности кормов сельскохозяйственных животных является наличие в них витаминов – биологически активных веществ разного химического строения, необходимых для поддержания жизнедеятельности организмов. Биологическая активность витаминов определяется тем, что они в качестве активных группировок входят в состав каталитических центров ферментов. Поэтому при недостатке этих веществ понижается активность соответствующих ферментов и, как следствие, ослабляются или полностью прекращаются биохимические процессы, происходящие с участием данных ферментов. Последнее является причиной ряда серьезных заболеваний, вызванных недостатком витаминов.
Как установлено, организмы человека и животных не способны синтезу витаминов, тогда как растения при нормальных условиям развития полностью обеспечивают себя необходимыми витаминами (за исключением витамина В12). Микроорганизмы также синтезируют большинство необходимых им витаминов. Исходя из этого видно, что продукты растительного и микробного происхождения представляют собой незаменимые источники витаминов как для животным так и для человека.
Удовлетворение потребности этих организмов в витаминах осуществляется двумя путями – поступление с пищей и синтез микрофлорой желудочно-кишечного тракта. Для организмов с однокамерным желудком, имеющим значительно меньше микрофлоры, главный путь обеспечения витаминами – потребление с пищей или непосредственно витаминов, или их метаболических предшественников – провитаминов, которые в организме человека и животных превращаются в витамины. В тоже время жвачные животные, имеющие в преджелудках обильную микрофлору, способную к синтезу витаминов, я значительной степени удовлетворяют свою потребность во многим витаминах за счет переваривания клеток отмерших микроорганизммов.
В связи с тем что основные компоненты кормов сельскохозяйственных животных – продукты растительного происхождения – имеют не оптимальный состав и постоянно меняющееся содержание необходимых животным витаминов, при составлении кормовых рационов возникает необходимость добавлять в корма препараты, обогащенные витаминами, которые получают из культур микроорганизмов. Микробиологическая промышленность нашей страны выпускаетдва вида кормовых витаминных препаратов – кормовой рибофлавин, содержащий витамин В2, и КМБ-12, имеющий в своем составе' витамин В12-
Кормовые препараты витамина В2
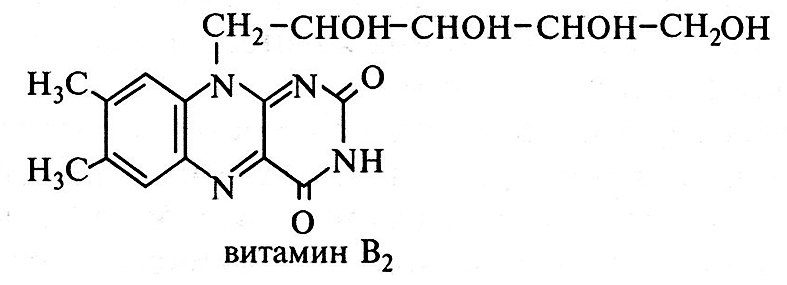
Витамин В2 (рибофлавин) по химической природе представляет собой азотистое основание 6,7-диметилизоаллоксазин, соединенное со остатком спирта D-рибита:
Этот витамин входит в состав активных групп окислительно-восстановительных ферментов – флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД). Поэтому при его недостатке наблюдается ослабление окислительно-восстановительных процессов в организме. По нормам кормления свиньям этого витамина требуется не менее 2–7 мг, лошадям и птице – 2–5 мг на 1 кг сухого корма. Однако в растительной продукции, используемой в кормопроизводстве, витамина В2 содержится недостаточно. Много рибофлавина могут синтезировать микроорганизмы – различные виды бактерий, актиномицеты, дрожжевые клетки, некоторые из них способны накапливать в культуральной среде до 1 мг/мл витамина В2.
В качестве промышленных продуцентов кормового рибофлавина используются отселектированные штаммы дрожжей Eremothecium ashbyii. Рибофлавин накапливается в вакуолях дрожжевых клеток и придает культуре характерную желтую окраску. Для производственной ферментации готовятся отдельно жидкая питательная среда и посевной материал культуры дрожжей, выращенный в специальном посевном аппарате.
Питательная среда в необходимых концентрациях включает соевую муку, кукурузный экстракт, мел, гидрол, сахар, К2НРО4, NaCl. Перед подачей в ферментер она подвергается стерилизации. В качестве посевного материала используются споры Е. ashbyii, выращенные на пшене.
Промытое пшено в течение 30–35 мин выдерживается в молочной сыворотке для набухания, затем оно подсушивается и расфасовывается по 50–60 г в простирилизованные флаконы. В флаконах пшено подвергается трехкратной стерилизации, после чего производится его засев водной суспензией спор культуры дрожжей. Флаконы с засеянной культурой в течение 7–8 дней инкубируют при 29–30 °С, после чего подсушивают в вакуум-сушильной установке и далее направляют для приготовления жидкого посевного материала, который после стерилизации подается в производственный ферментер.
Культивирование продуцентов кормового рибофлавина проводится при 28–30 °С в течение 72 ч. Через каждые 8 ч ферментации отбираются пробы для контроля за развитием микробных клеток, составом среды и накоплением целевого продукта. Готовая культуральная жидкость по окончании ферментации должна содержать до 5 % сухих веществ и 1,4 мг/мл рибофлавина.
В целях стабилизации витамина в процессе высушивания культуральную жидкость подкисляют соляной кислотой до рН 4,5–5,0, после чего она концентрируется в вакуум-выпарной установке. Полученный концентрат обычно содержит 5,6 мг/мл витамина и 20 % сухих веществ. После выпаривания избытка растворителя концентрат рибофлавина высушивается на распылительной сушилке до влажности 5–10 %, затем смешивается с отрубями или кукурузной мукой и расфасовывается по 20 кг в полиэтиленовые пакеты, которые упаковываются в крафт-мешки. В готовом продукте содержится не менее 1 % витамина. Срок хранения сухого препарата – 1 год.
Кормовые препараты витамина В12
Витамин В12 представлен группой биологически активных веществ, содержащих в своем составе трехвалентный кобальт, аминные и цианистые группировки, которые могут быть замещены другими радикалами – ОН, Сl, Вr. Этот витамин стимулирует образование крови в костном мозге, улучшает усвоение белков, участвует в синтезе аминокислот и азотистых оснований. Витамин В12 не содержится в продуктах растительного происхождения и его единственным источником для сельскохозяйственных животных являются микроорганизмы.
Для промышленного получения кормовых препаратов витамина В12 выращивается специально подобранный биоценоз микроорганизмов, осуществляющих термофильное метановое брожение, в который входят целлюлозоразлагающие, аммонифицирующие, углеводсбраживающие, сульфитвосстанавливающие и метанообразующие бактерии. На первом этапе ферментации этих микроорганизмов (в течение 10–12 дней) наблюдается бурное развитие термофильных аммонифицирующих и углеводсбраживающих бактерий, которое происходит в слабокислой среде (рН 5,0–7,0). Другие группы бактерий данного биоценоза достигают интенсивного развития при переходе брожения в щелочную фазу (рН 7,0–8,5). Преобладающими в этот период являются метанообразующие бактерии, которые синтезируют в 4–5 раз больше витамина В12, чем другие микроорганизмы биоценоза. Главные субстраты для развития метанообразующих бактерий – жирные кислоты и низшие спирты, поэтому их добавление в питательную среду значительно увеличивает выход витамина.
Для приготовления питательной среды обычно используется барда ацетоно-бутилового производства, которая декантацией очищается от твердых примесей, в нее добавляется хлорид кобальта (4 г/м3) и 0,5 % метанола.
В процессе промышленного культивирования бактерий вначале производится выращивание посевного материала (15–20 дней) в аппаратах емкостью 250 м3, затем посевной материал подается в железобетонные ферментеры емкостью 4200 м3, в которых происходит метановое брожение. Свежая барда подается в нижнюю часть ферментера в количестве 25–30 % от его объема за сутки. Отбор метановой бражки, содержащей витамин В12, производится в верхней части ферментера. В течение рабочего цикла в ферментере строго контролируется рН среды, концентрация летучих жирных кислот, содержание аммонийного азота, поддерживается оптимальная температура (55– 57 °С). В результате брожения образуется газовая смесь, состоящая равным образом из метана (65 %) и диоксида углерода (30 %), которая может быть использована как источник теплоты при сжигании.
Готовая культуральная жидкость, образующаяся как продукт ферментации, обычно содержит 2–2,5 % сухих веществ и 1,1–1,7 мг/л витамина В12. Для предотвращения разрушения витамина в процессе сушки культуральную жидкость подкисляют соляной или фосфорной кислотой до рН 6,3–6,5 и добавляют 0,2–0,25 % сульфита натрия.
Подготовленная таким образом культуральная жидкость дегазируется, упаривается на вакуум-выпарной установке, полученный концентрат затем высушивается в распылительной сушилке до влажности 5–10 %. В целях улучшения физических свойств сухой продукт смешивается с отрубями или кукурузной мукой, расфасовывается по 25–30 кг в полиэтиленовые пакеты и упаковывается в крафт-мешки. Содержание витамина В12 в готовом кормовом препарате составляет 2,5 мг%, срок хранения сухого препарата – 1 год. Препарат имеет коммерческое название – КМ Б-12 (концентратмикробный витамин). Кроме витамина В12 КМБ-12 содержит также другие витамины группы В, незаменимые аминокислоты.
6.4. КОРМОВЫЕ ЛИПИДЫ
Кроме белков, углеводов и витаминов неотъемлемым компонентом кормов сельскохозяйственных животных являются липиды, содержащие полиненасыщенные жирные кислоты – линолевую, линоленовую, арахидоновую, которые не могут синтезироваться в организме животных и, следовательно, должны поступать с пищей. Полиненасыщенные жирные кислоты, называемые незаменимыми, участвуют в построении клеточных мембран, входя в состав структурных липидов. При недостатке незаменимых жирных кислот снижается интенсивность роста сельскохозяйственных животных, угнетается их репродуктивная функция, понижается сопротивляемость организма инфекции.
Основной источник незаменимых жирных кислот для сельскохозяйственных животных – различные растительные продукты, входящие в состав кормов. Однако очень часто в растительных кормах содержится мало липидов или они имеют неблагоприятный состав жирных кислот, что ухудшает питательную ценность кормов. В целях балансирования кормовых рационов сельскохозяйственных животных по содержанию незаменимых жирных кислот осуществляется поиск новых источников биологически полноценных липидов, которые можно было бы использовать в качестве высококонцентрированных кормовых добавок. Опыты показывают, что наиболее перспективными промышленными продуцентами липидов, близкими по составу к растительным жирам и пригодными для использования в кормовых целях, являются дрожжи и микроскопические грибы, которые чаще всего накапливают внутриклеточные липиды, однако известны виды, способные выделять липиды в культуральную жидкость. В клетках этих микроорганизмов обычно содержится от 25 до 70 % липидов в расчете на сухую массу, которые на 40–90 % представлены триацилглицеринами и на 5–50 % – фосфолипидами. В них также содержится много стероидных веществ (до 1–1,5 % на сухую массу), представленных главным образом эргостерином, из которого в организме животных образуется витамин D2.
Таблица 6.4. Состав жирных кислот растительных масел
и липидов некоторых микроорганизмов (в % от суммы)
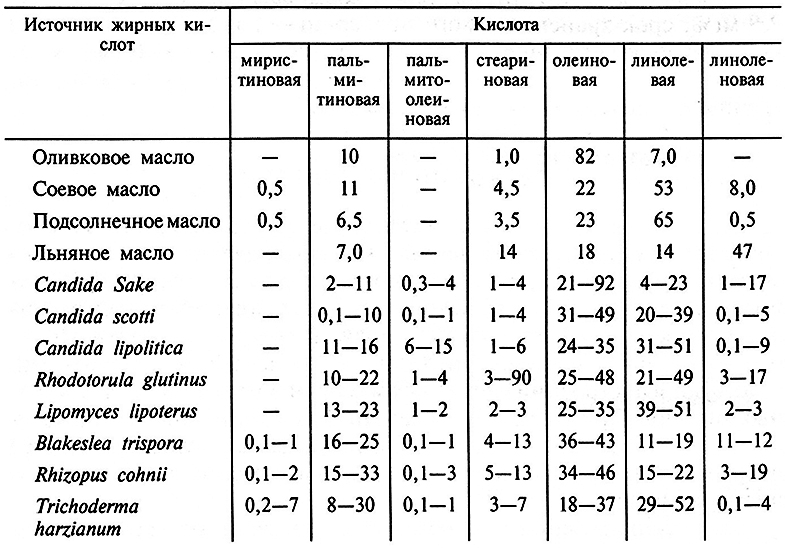
Липидные компоненты дрожжей и микроскопических грибов имеют довольно благоприятный состав жирных кислот (табл. 6.4), в них много содержится олеиновой (20–50 % от общего количества жирных кислот), линолевой (до 50 %),линоленовой(до 17–19 %) кислот и мало трудноусвояемых организмом животных кислот (окси-кислот, кислот с нечетным числом углеродных атомов или разветвленной цепью). Много липидов (50–60 % от сухой массы) способны накапливать некоторые штаммы дрожжей Rhodotorula, Lipomyces, Cryptococcus. Клетки дрожжей рода Candida синтезируют меньше липидов (20–40 %), однако отличаются высокой скоростью роста и способностью хорошо утилизировать разнообразные источники сырья. Микроскопические грибы могут синтезировать до 40–50 % высокоценных липидов, сходных по составу жирных кислот с растительными маслами.
Из-за образования в клетках микроорганизмов активных комплексов гидролитических ферментов они способны утилизировать в качестве источников углерода различные субстраты – гидролизаты растительных отходов, послеспиртовую барду, молочную сыворотку, мелассу, отходы зерноперерабатывающей промышленности, углеводороды нефти, низкомолекулярные спирты (метанол, этанол). В качестве источника азота в питательную среду добавляют дрожжевой или кукурузный экстракт, соли аммония, мочевину, но при этом строго контролируют соотношение углерода и азота, так как при избытке азота снижается образование липидов в клетках микроорганизмов (оптимальное соотношение С : N = 320–400).
Кроме источников углерода и азота в питательную среду также добавляют Р, К, Mg, Zn, Fe, Мn, витамины группы В, токоферол. В процессе выращивания на питательной среде вначале наблюдается интенсивный рост микроорганизмов и сравнительно небольшое накопление липидов. Усиленный синтез липидов отмечается в начале стационарной фазы развития микроорганизмов.
При выращивании продуцентов кормовых липидов поддерживается температура 20–30 °С, так как при более высокой температуре снижается выход липидов, а в липидах уменьшается доля полиненасыщенных жирных кислот. В процессе ферментации требуется поддерживать режим интенсивной аэрации, так как для окисления углеродных субстратов необходим кислород. Кислород также необходим для синтеза ненасыщенных жирных кислот, поэтому улучшение аэрации стимулирует увеличение выхода незаменимых жирных кислот.
По окончании ферментации микробная масса отделяется от остатков субстрата и высушивается примерно по такой же технологии, как кормовые дрожжи. Для улучшения физических свойств к высушенному продукту добавляют отруби или кукурузную муку.
Наряду с получением кормовых липидов на основе ферментации микроорганизмов разрабатываются также технологии производства комплексных микробных препаратов, содержащих белки, липиды, каротиноиды и другие ценные питательные вещества, которые позволяют балансировать корма одновременно по нескольким компонентам. Так, например, получен высокий эффект при введении в кормовой рацион птиц белково-липидной биомассы дрожжей Lipomyces lipoterus, содержащей 18–20 % белков и 27–29 % липидов, а также биомассы гриба Blakeslea trispora с содержанием белков 30 % и липидов 28 %. Следует отметить, чтолипиды микроорганизмов могут быть использованы не только в кормопроизводстве, но и как заменитель растительных пищевых жиров, используемых на технические нужды (лакокрасочная, химическая промышленность), так как примерно 20 % от производимых в мире растительных жиров расходуется на технические, непищевые цели.
6.5. ФЕРМЕНТНЫЕ ПРЕПАРАТЫ
Одним из важных направлений современной биотехнологии является получение на основе культивирования микроорганизмов и использование в сельском хозяйстве различных ферментных препаратов, которые могут применяться в процессе приготовления кормов для сельскохозяйственных животных как добавки к кормам для улучшения их усвояемости, а также в ветеринарии для профилактики и лечения желудочных и паразитарных заболеваний.
Основной компонент кормов сельскохозяйственных животных – растительная продукция (зерно, силос, грубые корма и др.), содержащая довольно много трудноперевариваемых веществ, – клетчатка, лигнин, гемицеллюлоза. Даже у жвачных животных, содержащих в преджелудке (рубце) активные штаммы целлюлозоразлагающих микроорганизмов, клетчатка переваривается на 40–65 %. Не полностью перевариваются также растительные белки (60–80 %), липиды (60–70 %), крахмал и полифруктозиды (70–85 %), пектиновые вещества.
Для улучшения перевариваемости и повышения эффективности использования растительных кормов в рационы сельскохозяйственных животных вводят ферментные препараты (0,1–1,5 % от сухой массы корма), полученные из микроорганизмов и содержащие активные комплексы гидролитических ферментов. Препараты микробных ферментов обычно получают из культур бактерий или микроскопических грибов (табл. 6.5). Некоторые виды бактерий (например, Вас. Subtilis) выделяют гидролитические ферменты в культуральную среду, поэтому их ферментные препараты производят путем концентрирования и высушивания при определенных условиях (лиофилизацией) культуральной жидкости. Если источником ферментов являются микроскопические грибы (Aspergillus, Trichoderma, Fusarium), то ферментный препарат готовят высушиванием поверхностной культуры этих микроорганизмов. Очищенные ферментные препараты получают экстракцией ферментов из клеток микроорганизмов подходящим растворителем и осаждением фермента этанолом.
Таблица 6.5. Важнейшие ферментные препараты, применяемые в сельском хозяйстве


Каждый ферментный препарат обозначается определенным буквенным и цифровым индексом. Буква «Г» в названии препарата указывает на то, что он получен из культуральной жидкости при глубинном способе выращивания микроорганизмов, тогда как буква «П» свидетельствует о том, что ферментный препарат получен из поверхностной культуры микроскопических грибов. Индекс «2» в названии препарата показывает, что это концентрированный сироп, «3» – сухой ферментный препарат, «10» – очищенный ферментный препарат. И ндекс «Пх» обозначает, что ферментный препарат представляет собой высушенную поверхностную культуру грибов.
В рационе крупного рогатого скота значительный удельный вес занимают сочные и грубые корма, богатые клетчаткой, пентозанами, пектиновыми веществами, которые медленно перевариваются микроорганизмами рубца, снижая усвояемость организмом других питательных веществ. Значительное улучшение перевариваемости этих веществ наблюдается при добавлении в корм ферментных препаратов с активным комплексом гидролитических ферментов, таких как пектофоетидин ГЗх и целловиридин ГЗх (в соотношении 1 : 1), амилосубтилин ГЗх и глюкаваморин Пх. При этом не только повышается общая продуктивность животных, но и существенно снижается расход кормов на создание одной единицы животноводческой продукции (на 8–10%).
При откорме свиней положительное действие оказывают ферментные препараты с амилолитической и протеолитической активностью – амилосубтилин ГЗх, протосубтилин ГЗх, амилоризин Пх, глюкаваморин Пх, протезим ГЗх.
Особенно важное значение имеет применение ферментных препаратов при кормлении молодняка сельскохозяйственных животных. Так, например, у телят формирование рубца происходит к 2–3-месячному возрасту, вследствие чего наблюдается слабое переваривание грубых и сочных кормов. Поэтому для замены молока растительными кормами и лучшего их использования в рацион телят целесообразно вводить ферментные препараты – пектофоетидин ГЗх, амилосубтилин ГЗх, протосубтилин ГЗх и глюкаваморин Пх, содержащие комплекс амилолитических и протеолитических ферментов.
У поросят-сосунов ферментные системы желудочно-кишечного тракта начинают нормально функционировать лишь в 3–4-месячном возрасте и для улучшения перевариваемости питательных веществ корма им рекомендуется добавлять в корм ферментный препарат протезим ГЗх. При кормлении ягнят в целях улучшения перевариваемости белков и углеводов в их кормовые рационы вводят глюкаваморин Пх и амилоризин Пх, в результате чего привесы увеличиваются на 11–15%.
Пищеварительные железы птиц не образуют ферменты, катализирующие гидролиз клетчатки и пектиновых веществ, а микрофлора кишечника у них малочисленна, поэтому в их кормовые рационы добавляют ферментные препараты с целлюлолитической, пектолитической и протеолитической активностью – пектофоетидин ГЗх, целловиридин ГЗх, амилосубтилин ГЗх, глюкаваморин Пх, пектаваморин Пх, протосубтилин ГЗх, гликозидазу ГЗх, лизоцим ГЗх, протезим ГЗх. В результате применения указанных препаратов яйценосность кур повышается на 5 %, привесы бройлеров увеличиваются на 7–15 %, тогда как расход корма на создание единицы продукции снижается на 4-7 %.
Применение ферментных препаратов также эффективно при кормлении рыб. При добавлении в кормовые рационы рыб протосубтилина ГЗх, амилосубтилина ГЗх, пектаваморина Пх в количестве 0,1–0,15 % значительно улучшается перевариваемость белков и других питательных веществ корма.
Ферментные препараты используются также в кормопроизводстве чаще всего при силосовании бобовых трав, соломы, картофеля и приготовлении соломоконцентратов. Зеленая масса бобовых трав содержит большое количество буферных веществ (белки, аминокислоты, щелочные соли), которые препятствуют понижению рН в процессе молочнокислого брожения, кроме того в ней имеется недостаточно Сахаров, являющихся субстратами молочнокислых бактерий. Если путем добавления ферментов обеспечить частичный гидролиз полисахаридов – клетчатки, крахмала, пектиновых веществ, гемицеллюлоз, то образуется больше Сахаров для жизнедеятельности молочнокислых бактерий, в результате в силосируемой массе повышается концентрация молочной кислоты, обеспечивая снижение потерь питательных веществ и улучшение питательных свойств полученного таким путем корма. Хорошую эффективность при силосовании бобовых трав показали следующие ферментные препараты: целловиридин ГЗх, пектофоетидин ГЗх, пектаваморин Пх, глюкаваморин Пх, целлокандин ГЗх, целлопигнорин Пх. При силосовании картофеля рекомендуется применять амилоризин Пх, глюкаваморин Пх, пектаваморин Пх, при этом кормовая ценность получаемой силосной массы повышается на 15–18 %.
Ферментные препараты имеют существенное значение в технологиях приготовления кормов из соломы злаковых культур. Солома характеризуется высоким содержанием трудноусвояемых веществ – целлюлозы, ксиланов, лигнина – и низким содержанием белков. В ней почти нет растворимых углеводов, необходимых для развития молочнокислых бактерий. Поэтому при силосовании соломы применяются целлюлозоразлагающие ферментные препараты – целловиридин ГЗх, целлолигнорин Пх, целлокандин ГЗх, пектаваморин Пх. В результате действия этих препаратов в силосируемой массе повышается концентрация растворимых Сахаров, за счетсинтеза микроорганизмами увеличивается содержание сырого протеина (на 50 %).
Для получения соломоконцентратов обычно применяется смесь двух ферментных препаратов пектофоетидина ГЗх и глюкаваморина Пх, которые обеспечивают гидролиз полисахаридов. Затем на продуктах гидролиза выращивают кормовые дрожжи. Для лучшего роста дрожжей в соломоконцентрат добавляют мелассу, мочевину, кальций монофосфат, хлорид натрия, необходимое количество воды. Получаемый таким способом корм имеет консистенцию силоса, а по питательной ценности приближается к хорошему луговому сену.
Соломоконцентраты могут быть получены в гранулированном виде и в этом случае могут сохранять свои питательные свойства длительное время – до 1 года. Переваримость клетчатки в таком корме повышается до 75–80 %, содержание белков достигает 10–12 % от сухой массы.
Ферментные препараты применяются в процессе получения заменителей цельного молока для молодняка крупного рогатого скота из кормовых дрожжей, которые подвергаются гидролизу. В результате гидролиза разрушается клеточная оболочка дрожжевых клеток и микробная биомасса переводится в легкоусвояемую форму, повышается содержание растворимых углеводов, незаменимых аминокислот и полиненасыщенных жирных кислот. Для гидролиза кормовых дрожжей обычно используют препараты – пектофоетидин ГЗх, дрожжелитин ГЗх, лизосубтилин Г10х.
Микробные ферментные препараты широко применяют в ветеринарии для лечения и диагностики многих заболеваний сельскохозяйственных животных и птиц. Например, ферменты, способные разрушать клеточную оболочку и обладающие лизирующим действием, используются в лечении бактериальных и других заболеваний (сальмонеллез и популлороз у птиц, эндометриты у коров и др.). Для этих целей применяются выпускаемые промышленностью ферментные препараты – лизоцим ГЗх, гликозидаза ГЗх, лизосубтилин Г10х, мальтаваморин Г10х, дрожжелитин ГЗх.
В результате того, что амилосубтилин ГЗх и протосубтилин ГЗх оказывают влияние на редукционную способность бактерий в желудочно-кишечном тракте животных, количество и подвижность инфузорий, переваривание целлюлозы и других трудноусвояемых углеводов, эти препараты используют для профилактики и лечения желудочных заболеваний, в частности алиментарных атоний преджелудков у жвачных животных. Ферменты, содержащиеся в этих препаратах, вызывают также гидролиз оболочек яиц гельминтов.
Наряду с производством ферментных препаратов, выделяемых из микробных клеток, разработаны технологии получения биопрепаратов на основе живых микроорганизмов – симбионтов желудочно-кишечного тракта животных, которые в процессе своей жизнедеятельности синтезируют различные ферменты, витамины, незаменимые аминокислоты, антибиотики, вещества, обладающие гормональным действием, и таким образом активно участвуют в процессах пищеварения и синтеза веществ, не образующихся в клетках животных, защите от микробной инфекции.
Эффективные микробные препараты, широко использующиеся в животноводстве, производятся на основе пропионовокислых (пропиовит) и ацидофильных (пропиацид) бактерий, а также азотобактерий (азотацид).
Пропиовит представляет собой порошок серовато-песчаного цвета, содержащий в 1 г препарата 4–6 млрд бактерий и 80–100 мкг витамина В12, применяется для профилактики и лечения болезней желудочно-кишечного тракта у телят, поросят, цыплят. При его применении нормализуется рост и развитие молодняка сельскохозяйственных животных, повышается их устойчивость к инфекционным заболеваниям.
Пропиацид и азотацид – сухие препараты комбинированного действия, способствуют образованию в желудочно-кишечном тракте животных уравновешенных биоценозов, особенно они эффективны против дисбактериозов.
Для борьбы с бактериальными и вирусными желудочно-кишечными заболеваниями применяются бактериальные препараты на основе Вас. subtilis, licheniformis, mucilaginosis, которые, вероятно, действуют как источники биологически активных веществ – ферментов, витаминов, антибиотиков, гормонов.
Важной задачей ученых и специалистов, работающих в области сельскохозяйственной биотехнологии, является создание и внедрение в природные экосистемы желудочно-кишечного тракта животных высокоактивных штаммов микроорганизмов, способных к лучшему перевариванию целлюлозы и других углеводов, растительных белков и липидов, сверхсинтезу незаменимых аминокислот и витаминов. Важное значение имеют исследования по изучению микробных популяций рубца (преджелудка) жвачных животных, в котором подвергается перевариванию 70–85 % всего сухого вещества корма, проходящего через желудочно-кишечный тракт этих животных.
Рубец представляет собой высокоэффективную природную систему непрерывного культивирования анаэробных микроорганизмов – бактерий (Ruminococus, Bacteroides, Butyrivibrio, Clostridium, Eubacterium и др.) и простейших (Diplodinium, Entodinium, Ophryoscolex, lsotricha и др.).
Слизистая оболочка рубца не образует собственных ферментов, и процесс переваривания пищи полностью происходит с помощью ферментных белков, вырабатываемых микроорганизмами. В результате жизнедеятельности микрофлоры в преджелудках жвачных животных гидролизуются практически все формы сложных углеводов (крахмал, пектиновые вещества, гемицеллюлозы, клетчатка, дисахариды), белки и липиды, подвергаются брожению моносахариды (глюкоза, фруктоза, манноза). Образующиеся в результате гидролиза сложных веществ моносахариды, аминокислоты и жирные кислоты используются животными в качестве источников энергии и в биосинтетических процессах. Сами микроорганизмы после их отмирания также перевариваются в рубце и становятся для животных источниками полноценных белков, незаменимых аминокислот, полиненасыщенных жирных кислот, витаминов.
Создание высокоактивных штаммов микроорганизмов и сбалансированных экосистем желудочно-кишечного тракта животных проводится как обычными методами генетики и селекции, так и с использованием мутагенеза и клонирования генов. Применение этих методов позволит целенаправленно изменять экосистемы желудочно-кишечного тракта животных в нужном направлении, добиваясь улучшения усвояемости корма, усиления синтеза полезных веществ, подавления патогенной микрофлоры.

