Азотфиксаторы не составляют какого-либо определенного таксона микроорганизмов. Они встречаются во всех основных группах прокариот: среди грамотрицательных и грамположительных эубактерий, цианобактерий, актиномицетов и архебактерий. Большинство азотфиксирующих микробов являются диазотрофами, т. е. могут использовать N2 в качестве единственного источника азота. В то же время некоторые азотфиксаторы могут фиксировать N2 лишь в симбиозе с растениями (Rhizobium, Frankia). И наконец, ряд микробов (Azorhizobium, Anabaena, Nostoc) совмещает способность к диазотрофии и к симбиозу с растениями.
Нитрогеназная реакция
Восстановление молекулярного азота катализируется ферментом нитрогеназой (рис. 7.1), которая состоит из трех типов белков (α, β и γ) и двух кофакторов: молибден-железо-(МоFе)-содержащего и железо-(Fе)-содержащего. Нитрогеназа состоит из двух субъединиц: большой – динитрогеназы, в состав которой входит MoFe-кофактор (ее называют также компонентом II), и малой – редуктазы динитрогеназы, содержащей Fe-кофактор (компонент I). Восстановление молекулы N2 происходит при ее взаимодействии с MoFe-кофактором, т. е. на динитрогеназе. Функция редуктазы заключается в передаче электронов на динитрогеназу. Ионы железа входят в состав обоих компонентов в геминовой (редуктаза динитрогеназы) или негеминовой (динитрогеназа) формах.
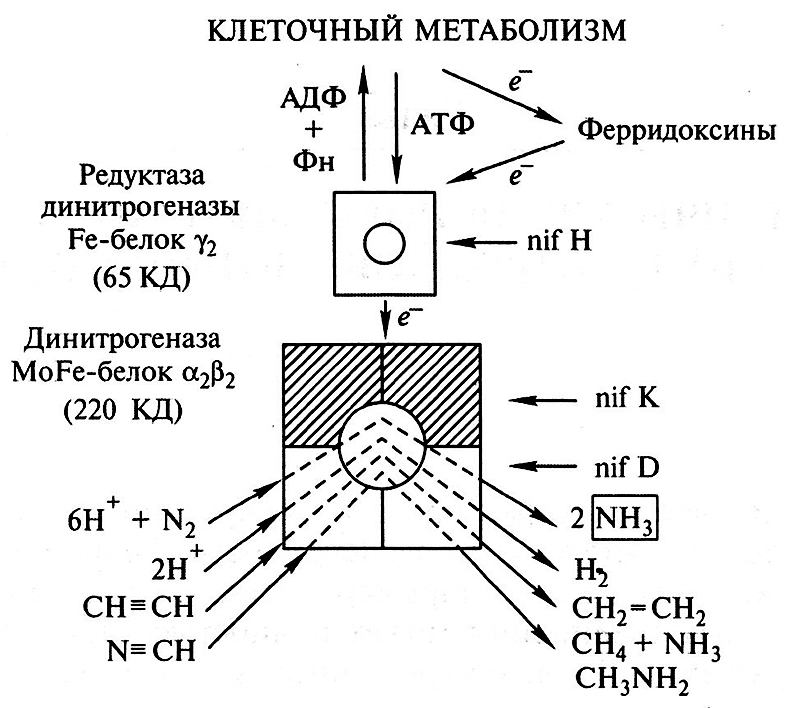
Рис. 7.1. Структура и функции нитрогеназы
Нитрогеназа обладает низкой субстратной специфичностью: она способна восстанавливать широкий спектр соединений с тройной связью, в том числе превращать ацетилен в этилен. Эта реакция лежит в основе «ацетиленового метода» определения нитрогеназной активности, основанного на легкости хроматографического разделения ацетилена и этилена. Несмотря на некоторые ограничения (изменение каталитических свойств нитрогеназы при взаимодейтвии с ацетиленом; в случае микробнорастительных симбиозов – влияние ацетилена на физиологические свойства растительных тканей), ацетиленовый метод широко используется в генетических и селекционных работах.
Суммарная реакция, катализируемая нитрогеназой, выражается уравнением:
N2 + 8H+ + 8e– + 16АТФ = 2NH3 + Н3 + 16АДФ + 16ФH
Из уравнения видно, что нитрогеназная реакция весьма энергоемка. Больших энергетических затрат требует также синтез нитрогеназы и обслуживающих ее ферментов (которые контролируют созревание белков нитрогеназы, синтез кофакторов, передачу электронов и ассимиляцию продуктов азотфиксации). Подсчитано, что для фиксации 1 г азота необходимо затратить 100–200 г глюкозы. Поэтому ясно, что микробы синтезируют нитрогеназный комплекс только в условиях резкого дефицита связанного азота и достаточного обеспечения энергией.
Наиболее эффективными источниками энергии для микроорганизмов являются окислительное фосфорилирование и фотосинтез. Однако сопряжение азотфиксации с этими процессами затруднено тем, что нитрогеназа очень чувствительна к свободному кислороду: она необратимо инактивируется даже при небольших концентрациях О2. Поэтому у микробов-азотфиксаторов имеются разнообразные механизмы, позволяющие решать возникающий «кислородный парадокс», т. е. защищать нитрогеназу от свободного кислорода, сохраняя высокую интенсивность получения энергии. У свободноживущих диазотрофов это достигается либо тем, что кодирующие нитрогеназу гены активируются только в анаэробных или микроаэрофильных условиях (свободноживущие эубактерии, архебактерии), либо тем, что азотфиксирующие клетки образуют плотную оболочку, которая очень медленно пропускает кислород (гетероцисты цианобактерий). При симбиозах между микробами-азотфиксаторами и растениями функцию защиты нитрогеназы от кислорода выполняет, как правило, хозяин.
Синтез и созревание нитрогеназы кодируются сложной системой nif-генов, многие из которых являются общими для всех азотфиксаторов. У наиболее изученного из них – энтеробактерии Klebsiella pneumoniae – эта система включает 25 генов, собранных в единый кластер и организованных в семь транскрипционных единиц. Гены nifH, nifD, nifK кодируют структуру γ-, α- и β-белков нитрогеназы; гены nifM, nifS, nifU, nifY – процессинг этих белков. Специальная группа генов (nifB, nifE, nifN, niJV) контролирует синтез Mo-Fe-кoфактора. Помимо генов, кодирующих структуру компонентов нитрогеназного комплекса, nif-оперон Klebsiella содержит два регуляторных гена. nifA кодирует белок, активирующий транскрипцию генов nifHDK и других nif-генов, а продукт гена nifL репрессирует транскрипцию nif-генов в присутствии кислорода или связанного азота. Однако у многих азотфиксаторов nifL отсутствует, и его функцию выполняют другие гены.
Симбиозы растений с азотфиксаторами
Одним из важных факторов, обеспечивающих широкое распространение способности к азотфиксации среди микробов, является образование симбиозов с организмами, лишенными этого свойства и вследствие этого испытывающими недостаток азота. Наибольшую потребность в симбиозе с азотфиксаторами испытывают растения, лишенные способности извлекать азотистые вещества из других организмов (как это делают животные) или из органических остатков (как грибы).
Способность к тесному взаимодействию с растениями выявлена во всех группах азотфиксаторов, за исключением архебактерий. Азотфиксирующие микробы, которые вступают в симбиоз с растениями, могут быть разделены натри группы: 1) внутриклеточные симбионты (Rhizobium, Frankia, Nostoc в симбиозе с Gunnera); 2) микробы, которые находятся внутри растений, но не проникают в клетки (Anabaena или Nostoc в симбиозе с Azolla; эндофитные бактерии Acetobacter и Azoarcus); 3) ассоциативные диазотрофы, живущие на корнях (Azospirillum, Flavobacterium). Взаимодействие партнеров в азотфиксирующих симбиозах характеризует общая стратегия: а) микроб экспортирует продукты азотфиксации в клетки (ткани) хозяина, экологический потенциал которого при этом существенно возрастает из-за ослабления зависимости от связанного азота; б) хозяин предоставляет микросимбионту экологическую нишу (в которой он «уходит» от конкуренции со свободноживущими микроорганизмами), а также покрывает энергетические расходы на азотфиксацию.
В симбиозах азотфиксирующих микробов с фототрофными организмами осуществляется симбиогенное сопряжение двух фундаментальных биохимических процессов – азотфиксации и фотосинтеза. Однако было бы не совсем точным представлять симбиотическое взаимодействие как «натуральный обмен» N-метаболитов на фотосинтаты. В процессе взаимодействия многих растений с азотфиксирующими бактериями наблюдается весьма тесная структурно-функциональная интеграция партнеров, которая основана на перекрестной регуляции и координированной экспрессии бактериальных и растительных генов. Она может сопровождаться глубокой дифференцировкой клеток партнеров, а также установлением между ними тесных регуляторных отношений.
7.2. БОБОВО-РИЗОБИАЛЬНЫЙ СИМБИОЗ
Симбиоз, образуемый бобовыми растениями (сем. Fabaceae) и клубеньковыми бактериями (ризобиями),– одна из наиболее изученных надорганизменных систем. Это обусловлено несколькими причинами. Ризобии (Azorhizobium, Bradyrhizobium, Mesorhizobium,Rhizobium, Sinorhizobium) являются факультативными симбионтами, которые легко культивируются explanta и доступны для изучения всеми современными молекулярно-генетическими методами. Клубеньки бобовых оказались очень удобной моделью для анализа ряда ключевых функций растения: сигнальных процессов и экспрессии генов, клеточной дифференцировки и органогенеза, азотного и углеродного обмена. И наконец, важным стимулом для изучения бобово-ризобиального симбиоза является его практическая значимость: многие бобовые относятся к числу важных сельскохозяйственных культур, повышение продуктивности которых весьма актуальная задача.
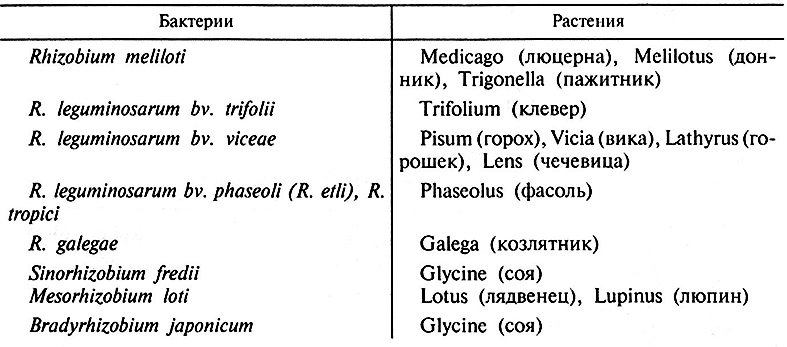
Взаимодействие ризобий и растений характеризуется высокой специфичностью (табл. 7.1). Она выражается, во-первых, в том, что образование симбиоза ограничено почти исключительно семейством бобовых; единственным небобовым, образующим клубеньки с ризобиями, является Parasponia (сем. Ulmaceae). Во-вторых, большинство ризобий вступают в симбиоз лишь с ограниченным кругом бобовых, относящихся к одному роду (R. galegae, R. leguminosarum bw.trifolii) или к нескольким таксономически близким родам (Rhizobium meliloti, R. leguminosarum bv. viceae).
Таблица 7.1. Специфичность взаимодействия клубеньковых бактерий и бобовых растений
Развитие бобово-ризобиального симбиоза – сложный многостадийный процесс, который включает четыре группы процессов: ранние (преинфекционные) взаимодействия; морфогенез клубеньков; регуляция развития эндосимбионтов; функционирование клубеньков как органов азотфиксации. Все эти процессы находятся под строгим контролем как бактерий, так и растения-хозяина.
Преинфекционные (сигнальные) взаимодействия
Обмен партнеров молекулярными сигналами происходит при любых симбиотических взаимодействиях. На ранних этапах симбиоза сигналлинг обеспечивает переход организмов из свободноживущего в симбиотическое состояние, на более поздних этапах – метаболические и морфогенетические процессы, обеспечивающие функционирование симбиоза. Сигналы часто действуют на уровне транскрипции и трансляции генов-мишеней, что делает симбиозы очень удобными моделями для изучения дифференциальной экспрессии генов высших организмов.
Синтез и выделение сигналов. Образование симбиоза клубеньковых бактерий и бобовых растений начинается с реакции ризобий на растительные флавоноиды, которые активируют бактериальные гены вирулентности (nod, от англ. nodulation – клубенькообразование). Под контролем этих генов ризобии синтезируют липо-хито-олигосахаридные Nod-факторы, которые инициируют ранние стадии развития клубеньков (рис. 7.2). К настоящему времени у ризобий найдено более 50 генов вирулентности. Одни из этих генов являются «общими» (структурно и функционально гомологичными) для всех ризобий, а другие – специфичны для каждого вида или даже штамма. Мутации в «общих» nod-генах (nodA, nod В, nodC) приводят к нарушению самой ранней стадии развития симбиоза – скручивания корневых волосков. При мутациях генов хозяйской специфичности (nodH, nodP, nodQ, nodZ, nodX) обычно нарушаются более поздние стадии взаимодействия, связанные с формированием инфекционных нитей и клубеньковых меристем. Важные различия между этими группами генов вирулентности выявляются и при переносе их между разными видами ризобий. Перенос генов хозяйской специфичности обычно приводит к тому, что штамм-реципиент приобретает способность формировать клубеньки у растений-хозяев штамма-донора. При переносе «общих» nod-генов такого эффекта не наблюдается, однако если реципиентом являлся авирулентный мутант с нарушением собственных «общих» nod-генов, то у него наблюдается восстановление способности формировать клубеньки на исходных растениях-хозяевах.
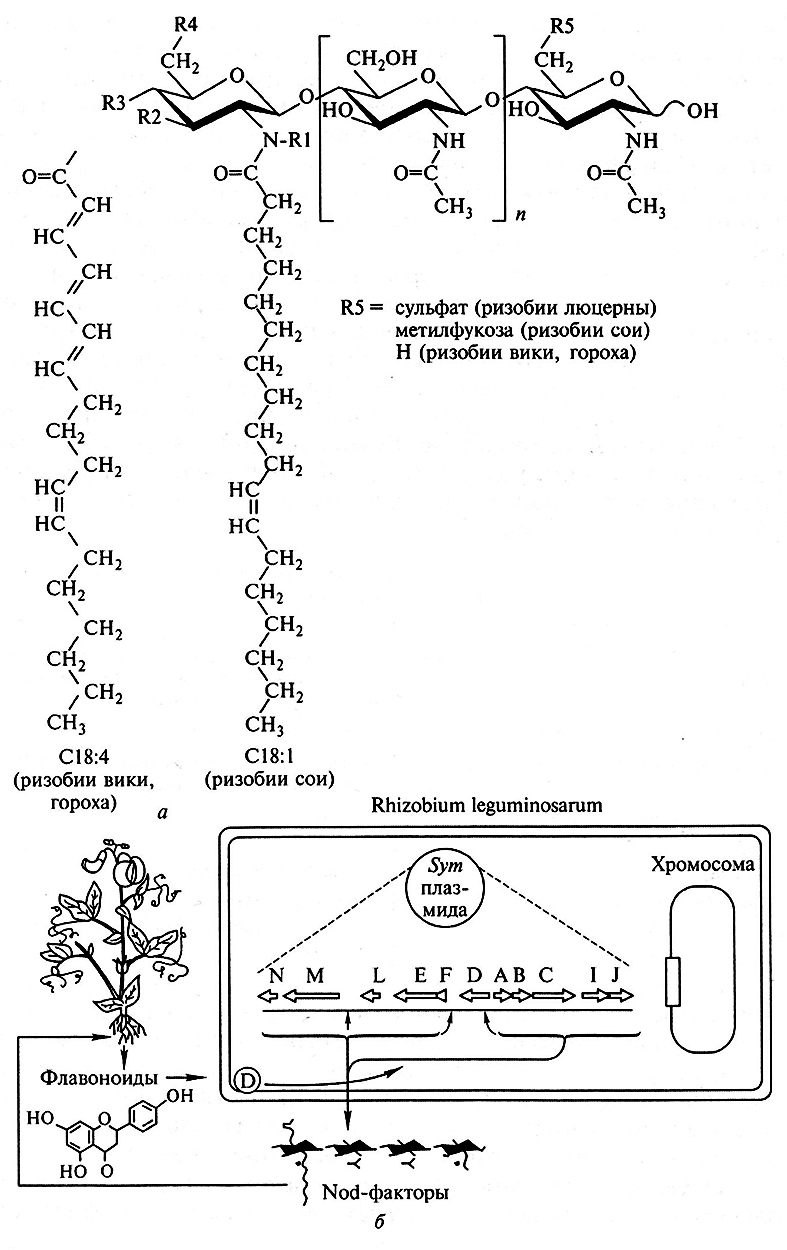
Рис. 7.2. Система сигнальных взаимодействий между бобовыми растениями и клубеньковыми бактериями:
а – структура Nod-факторов ризобий (показаны наиболее важные заместители:
ацильная группа на нередуцируюшем конце (C18 : 1 или С18 : 4) и варианты заместителей в позиции R5 на редуцирующем конце);
б – схема обмена сигнальными молекулами между горохом и бактерией Rliizobium leguminosarum
(корни растений выделяют специфические флавоноиды, которые в комплексе с бактериальным белком NodD
активируют синтез бактериальных сигнальных молекул – Nod-факторов.
Биосинтез последних кодируется norf-генами, расположенными на Sym-плазмиде)
Гены обеих групп являются индуцибельными: их активность первоначально удавалось зарегистрировать только после попадания ризобий в ризосферу растения. При этом флавоноиды, выделяемые в почву семенами или корнями бобовых, взаимодействуют с бактериальным белком NodD, который в результате приобретает способность активировать транскрипцию остальных nod-генов (nodD – единственный конститутивно работающий ген вирулентности ризобий). Ген nodD является представителем семейства регуляторов транскрипции, куда относятся такие хорошо изученные гены, как lysR и аrаС. В белке NodD выявлено два домена: наиболее консервативный N-концевой, который связывается с ДНК, и менее консервативный С-концевой, который предположительно взаимодействует с флавоноидами. Белок NodD связан с внутренней мембраной ризобиальной клетки, через которую проникают флавоноиды. Взаимодействуя с ними, белок NodD изменяет свою конформацию, в результате чего становится возможным его связывание с консервативной последовательностью «nod-box», расположенной в промоторах индуцибельных генов вирулентности. В результате повышается сродство этих промоторов к РНК-полимеразе и индуцируется их транскрипция.
Конечным продуктом действия генов вирулентности являются Nod-факторы, способность к синтезу которых – уникальное свойство ризобий. Эти факторы представляют собой модифицированные липо-хито-олигосахариды, которые состоят из 3–6 остатков N-ацетилглюкозамина и радикала ненасыщенной жирной кислоты, содержащего 16–20 атомов углерода (рис. 7.2, а). Биосинтез этих факторов включает следующие процессы (рис. 7.3):
1) полимеризация N-ацетилглкжозамина (синтезируемых из фукозы под контролем белка NodM) с образованием 1–4- β-гликозидных связей. Эта реакция, катализируемая белком NodC, приводит к образованию олигомеров хитина;
2) деацетилирование «нередуцирующего» концевого остатка глюкозамина в положении R1 (катализируется блоком NodB) и последующее присоединение к атому азота жирнокислотного остатка (катализируется белком NodA);
3) модификации образовавшегося липо-хито-олигосахарида (коровая часть Nod-фактора): атомы водорода на «редуцирующем» и «нередуцирующем» концах замещаются на различные радикалы (фукозил, сульфат, метил, ацетил и др.).
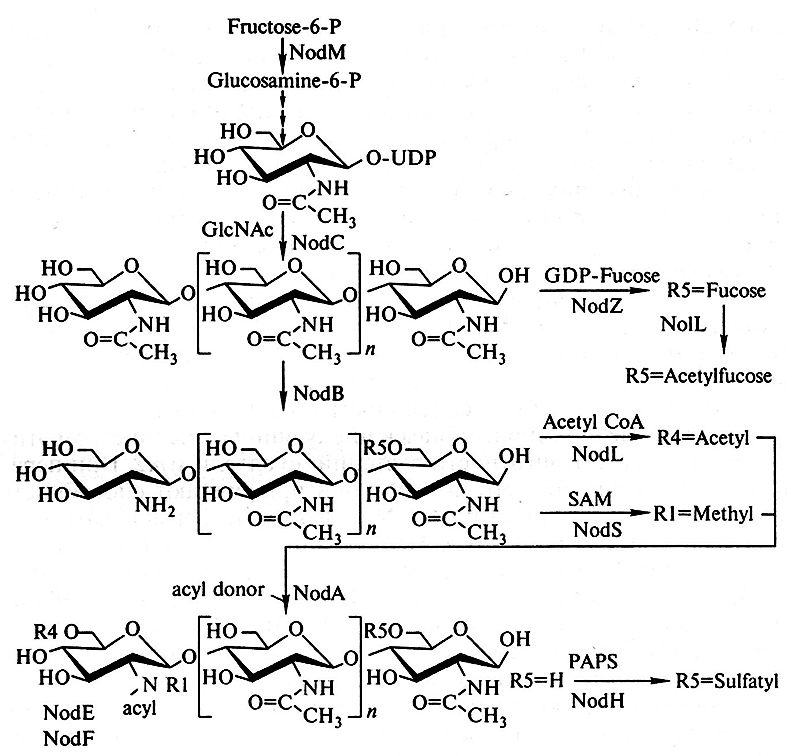
Рис. 7.3. Биосинтез Nod-факторов:
GlcNAc — N-ацетилглюкозамин; GDP-Fucose — гуанозиндифосфофукоза; Acetyl CoA — ацетилкофермент A;
PAPS — З1-фосфоаденозин-51-фосфосульфат; SAM — S-аденозилметионин
Важно отметить, что эти стадии биосинтеза Nod-фактора контролируются разными группами nod-генов: синтез коровой части происходит под контролем «общих» nod-генов, а его модификация – под контролем генов хозяйской специфичности.
Очищенные Nod-факторы в концентрации всего 10–8–10–12 М инициируют ранние стадии формирования симбиоза: скручивание корневых волосков, закладку клубеньковых меристем, а у некоторых бобовых (люцерна) – даже начальные стадии гистогенеза клубеньков. У Viciasativa уже 5–10 мин воздействия Nod-факторов достаточно для начала деформации корневых волосков, которая проявляется через 1 ч, а через 3 ч в восприимчивых зонах корня может деформироваться более половины волосков. Первыми биохимическими реакциями, которые вызывают Nod-факторы, являются деполяризация клеточной мембраны корневого волоска (происходит через 10 мин после инокуляции), а также модуляция ионных потоков в клетках эпидермиса.
Важно отметить, что Nod-факторы – это те сигналы, которые в значительной степени определяют специфичность всего симбиотического взаимодействия. Наибольшую роль в этом играют модификации Nod-факторов, осуществляемые под контролем генов хозяйской специфичности. Так, сульфатирование положения R6 на «редуцирующем конце», характерное для ризобий люцерны (R. meliloti), необходимо для индукции ранних симбиотических реакций у «гомологичного» хозяина (люцерны), тогда как в отсутствие сульфатной группы наблюдают индукцию этих же реакций у вики. При мутациях, инактивирующих белок NodH, который катализирует сульфатирование, R. meliloti утрачивает вирулентность по отношению к люцерне, но приобретает вирулентность к вике, симбионты которой (R. leguminosarum bv. viceae) лишены гена nodH.
Наиболее изученный пример участия модификации Nod-фактора в контроле хозяйской специфичности – это ацетилирование положения R6 на «редуцирующем конце», катализируемое геном nodX. Такая модификация обеспечивает клубеньковым бактериям гороха (R. leguminosarum bv. viceae) способность инфицировать «афганские» горохи, которые невосприимчивы к инокуляции большинством этих бактерий из-за гомозиготности растений по аллели sym2. При переносе nodX в лишенные его штаммы они приобретают способность синтезировать ацетилированный Nod-фактор и формировать клубеньки на «афганских» горохах. Неожиданным оказалось то, что способность преодолевать sym2-контролируемую устойчивость растений приобретается также при переносе в ризобии гена nodZ, который определяет фукозилирование положения R6. Этот ген был выделен из клубеньковых бактерий сои, которые не способны вызывать даже самые ранние симбиотические реакции у «афганских» Горохов.
Растения обладают хорошо развитой системой распознавания сигнальных молекул, выделяемых микроорганизмами – хитоолигосахаридов, полисахаридов, гликопептидов. Среди симбиотических сигналов наиболее изучены липо-хито-олигосахаридные Nod-факторы, которые продуцируются ризобиями в ответ на флавоноиды, экстретируемые семенами и корнями бобовых. Биологическая активность Nod-факторов проявляется при очень низких концентрациях (1–100 нМ), что подразумевает наличие у растений специфических рецепторов. По структуре Nod-факторы представляют собой олигомеры N-ацетилглюкозамина, соединенные β-1,4-гликозидными связями, содержащие остаток жирной кислоты и декорированные разными химическими группами. Углеводная природа Nod-факторов указывает на то, что их рецепторы должны обладать свойствами лектинов или хитин-связывающих белков, например хитиназ.
Первые попытки выявить рецепторы Nod-факторов были связаны с выделением связывающих их белков или мембранных фракций. Методом аффинной хроматографии из бобовых была получена лектиннуклеотидфосфогидролаза (LNP), обладающая способностью связывать Nod-факторы и расщеплять нуклеозидфосфаты. Другая стратегия в поиске рецепторов к Nod-факторам заключалась в выявлении у растений белков, гомологичных хорошо охарактеризованным рецепторам животных. Наиболее распространенными среди выявленных белков являются киназы, сходные с рецепторами (receptor-like kinases, RLK), в состав которых входит внеклеточный домен, трансмембранный участок и киназный домен. Эти рецепторы связывали хитоолигосахариды, которые по структуре похожи на Nod-факторы, что согласуется с гипотезой об участии хитиназоподобных RLK в их рецепции. У Mtdicago truncatula, Pisum sativum и Lotus japonicusбыл выявлен ряд генов, вовлеченных в рецепцию Nod-факторов и ранние симбиотические ответы. Мутации по данным генам приводят к Nod-фенотипам, анализ которых позволил определить последовательность включения генов в процессе инфекции. Недавно были клонированы гены, необходимые для наиболее ранней рецепции Nod-факторов: Sum 10 у Pisum sativum, NFR1 и NFR5 у Lotus japonicus. Гены MtDMII у М.truncatula и PsSym8 y гороха кодируют белки, сходные с лигандоперируемыми катионными каналами. Эти белки имеют трансмембранные домены и пролинбогатые участки связывания с другими белками, что позволяет рассматривать их как части многокомпанентных рецепторов. Одним из наиболее ранних ответов на действие Nod-факторов является быстрый вход ионов кальция в клетки корневых волосков и генерация в них «кальциевых волн» – колебаний концентраций Са2+ с определенной частотой и амплитудой.
Помимо активации растительных Sym -генов, Nod-факторы индуцируют собственную деградацию ферментами растений, и их устойчивость к гидролизу зависит от особенностей химического «декора». Параллельное варьирование структуры Nod-факторов и специфичности ферментов, отвечающих за их деградацию, еще более усложняет систему узнавания.
Развитие структурной основы симбиоза
Клубеньки бобовых выполняют комплекс взаимосвязанных функций, обеспечивая экологическую нишу для эндосимбионтов, структурную основу для обмена партнеров метаболитами, а также для контроля над численностью и физиологической активностью бактерий. Эти органы являются уникальной моделью для изучения генетики развития растений. Развитие клубеньков, как и других органов, базируется на сигнальных процессах, вызывающих дифференциальную экспрессию генов. Однако в случае симбиоза эти процессы связаны с экзогенными сигналами, поступающими в растения от партнера, а значит действие сигналов в ряде случаев может быть относительно легко изучено в лабораторных условиях, в том числе с использованием систем in vitro. Кроме того, формирование клубеньков является для растений факультативным, не обязательным для нормального развития и репродукции, что позволяет получать максимально широкую картину генетической изменчивости процесса развития. Основная генетическая информация, необходимая для морфогенеза клубеньков, находится в геноме растительного партнера симбиоза. Тем не менее, часть морфогенов содержится в геноме ризобий. Это еще больше расширяет возможности генетического анализа развития клубенька, так как позволяет модифицировать и изучать наследственную программу развития растительного органа, не вмешиваясь в геном самого растения.
Морфогенез клубеньков. Рассмотрим развитие структурной основы симбиоза на примере наиболее изученных клубеньков «недетерминированного стеблевого» типа, характерного для таких бобовых, как горох, клевер и люцерна (рис. 7.4).
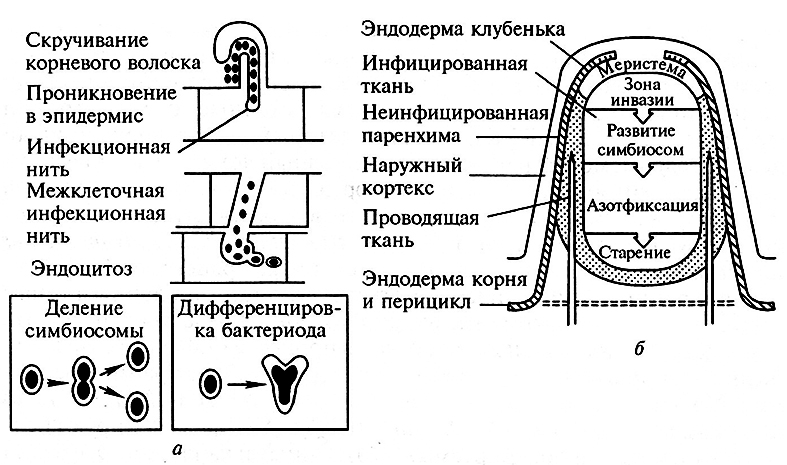
Рис. 7.4. Развитие и структура азотфиксирующего клубенька гороха:
а – основные этапы формирования системы эндосимбиотических компартментов;
б – гистологическая структура клубенька (недетерминированный тип)
Инфицирование этих бобовых ризобиями происходит через корневые волоски, которые при этом скручиваются, принимая форму «ручки зонтика» (стадия Нас, от англ. Hair curling). В месте наиболее резкого сгиба волоска происходит гидролиз клеточной стенки и глубокая инвагинация плазмалеммы, в которой участвуют мембранные структуры растительной клетки (аппарат Гольджи, эндоплазматический ретикулюм). Таким образом, наблюдается не активное внедрение бактерий в корневые волоски, а скорее захват последними микросимбионта. В результате вокруг бактериальных клеток образуется особый туннель – инфекционная нить (ИН), стенки которой сходны со стенками растительных клеток, а внутреннее пространство заполнено матриксом, в образовании которого участвуют оба партнера (стадия Itf, от англ. Infection thread formation).
Параллельно с развитием ИН происходит закладка клубеньковой меристемы, связанная с митотической реактивацией, дедифференцировкой и пролиферацией клеток кортекса, индуцируемой Nod-факторами (стадия Ced, от англ. Cortical cell division). В возникающем клубеньковом примордии начинаются процессы гистогенеза (стадия Ntd, от англ. Nodule tissue differentiation), в результате его формируются покровная, проводящая и азотфиксирующая ткани клубенька. ИН, которая через 2–3 суток после инокуляции достигает основания корневого волоска, проникает в кортекс, а затем и в растущий клубенек, где разрастается и ветвится.
Ключевой стадией развития эндосимбиоза является переход бактерий из ИН в растительные клетки, происходящий путем эндоцитоза (стадия Ваr, от англ. Bacterial release). В месте впячивания ИН в растительную клетку образуются временные структуры – инфекционные капли, от которых отшнуровываюгся мембранные пузырьки, содержащие бактерии. Таким образом, бактерии никогда не располагаются свободно в растительной цитоплазме: они заключены в «перибактероидные» мембраны (ПБМ), которые образуются с участием телец аппарата Гольджи и эндоплазматического ретикулюма, однако содержат и бактериальные белки. Бактериальная клетка (группа клеток), окруженная ПБМ, является основной субклеточной единицей симбиоза – симбиосомой.
Некоторое время после выхода из ИН ризобии сохраняют свои размеры и палочковидную форму, а затем дифференцируются в особые формы – бактероиды (стадия Bad, от англ. Bacteroid differentiation). Последние имеют значительно (в 3–5 раз) большие размеры, чем свободноживущие бактерии, а их форма варьирует от шаро- и грушевидной у клевера до Y- или Х-образной у гороха.
Важно отметить, что дифференцировка бактерий связана с репрессией многих генов, необходимых для автономного роста. Поданным ряда авторов, эта репрессия столь глубока, что бактероиды уже не могут превращаться в свободноживущие клетки и гибнут после отмирания клубеньков. В бактероидах активируется синтез нитрогеназы, катализирующей восстановление N2 в NH+4, а также других ферментов, обслуживающих нитрогеназную реакцию, после чего начинается фиксация атмосферного азота (стадия Nif, от англ. Nitrogen fixation). Таким образом, бактероиды могут рассматриваться как временные органеллы растительных клеток, ответственные за снабжение хозяина связанным азотом.
Параллельно с формированием симбиосом происходит и дифференцировка инфицированных растительных клеток. Она выражается в возрастании количества внутриклеточных мембранных структур, которые участвуют в формировании ПБМ и в биосинтетических процессах. Для инфицированных клеток характерна полиплоидизация и деконденсация хроматина, связанная с усилением транскрипционной активности. На биохимическом уровне их дифференцировка выражается в синтезе de novo ряда белков.
Описанный процесс завершается формированием сложно устроенного клубенька «недетерминированного» типа. Его основными структурами являются: а) инфицированная бактериями ткань, в которой происходит фиксация молекулярного азота; б) проводящие пучки, по которым поступают растительные фотосинтаты и выносятся продукты азотфиксации; в) апикальная меристема, за счет которой происходит рост клубенька. Последняя обеспечивает постоянное обновление азотфиксирующей ткани, в результате чего наблюдается дифференцировка центральной части клубенька на зоны, соответствующие разным этапам симбиоза. Основным результатом морфогенеза клубеньков является формирование интегрированной системы симбиотических компартментов, обеспечивающих переход бактерий из межклеточного (в инфекционных нитях) во внутриклеточное (в симбиосомах) состояние.
Генетический анализ. В настоящее время активно изучаются две группы «симбиотических» генов бобовых. Гены первой группы выявляют с использованием методов формальной генетики – путем получения и анализа мутантов с дефектами развития симбиоза. Гены второй группы выявляют при помощи методов «обратной генетики» – анализ генных продуктов (белков, мРНК), которые синтезируются при симбиозе.
Растительные мутанты, неспособные формировать клубеньки (Nod) или индуцировать в них азотфиксирующую активность (Fix–), отбирают по признаку угнетенного роста на безазотной среде. У бобовых (горох, соя, клевер, люцерна, фасоль, нут, кормовые бобы, донник) с использованием таких мутантов идентифицировано более 100 генов, участвующих в становлении и функционировании симбиоза (табл. 7.2). Более 40 генов выявлено у гороха посевного (Pisum sativum L.) – одного из наиболее удобных объектов для изучения генетики симбиоза. Мутантные аллели, контролирующие неспособность растений к образованию клубеньков, являются, за редким исключением, рецессивными. Аллели, контролирующие неспособность к азотфиксации, могут быть как рецессивными (горох, клевер, люцерна), так и доминантными (соя). Иногда мутации, нарушающие развитие симбиоза, влияют на морфологию, скорость развития и фертильность растений.
Таблица 7.2. Гены бобовых растений, контролирующие основные этапы развития симбиоза
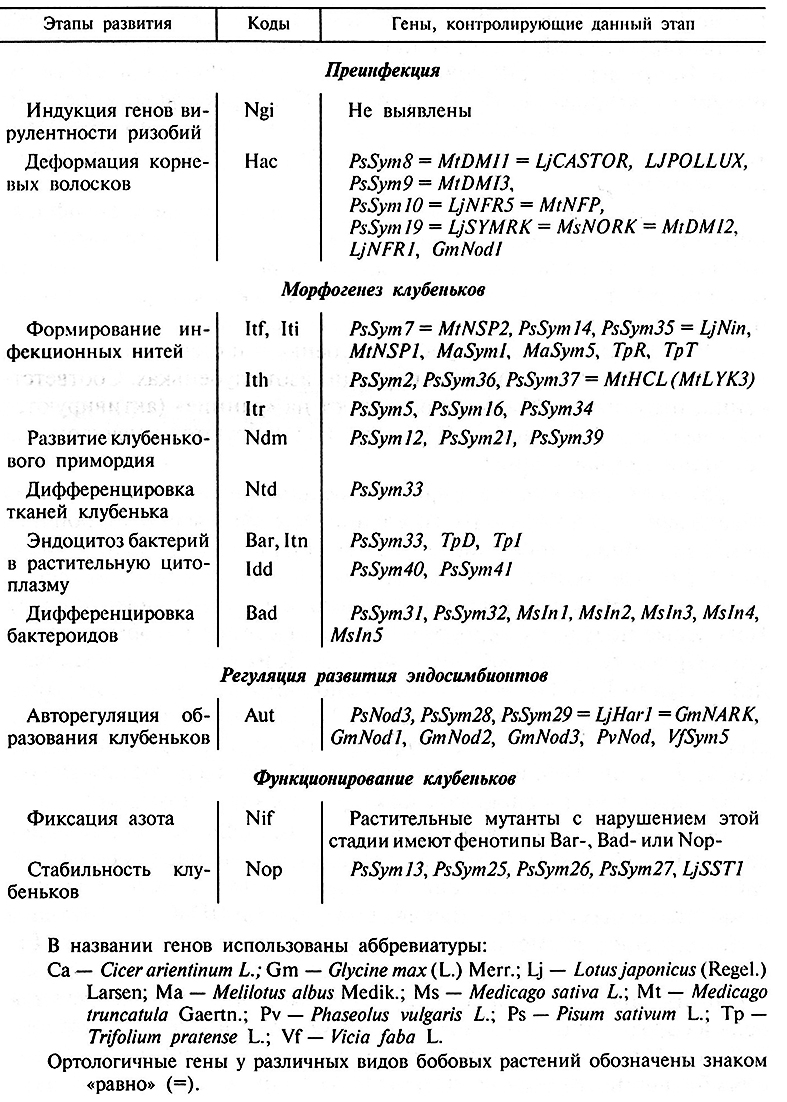
Генанализ развития симбиоза показал, что крупные этапы, выявляемые при изучении клубеньков «дикого типа», могут быть разделены на более мелкие («элементарные») стадии, каждая из которых контролируется небольшим количеством (или даже единичными) генами. Например, этап Itf может быть разделен натри стадии: Iti (инициация формирования ИН), Ith (рост ИН в корневом волоске) и Itr (рост И Н в кортексе корня), а этап Ваr – на две стадии: Itn (рост И Н в тканях и клетках клубенька) и Idd (дифференцировка «инфекционной капли»).
Симбиотические гены бобовых, выявляемые путем идентификации их продуктов (а часто и сами эти продукты), называют нодулинами (если в клубеньках они активируются de novo) или Nst-генами (если их активность существенно возрастает в клубеньках по сравнению с корнями). Для выявления этих генов сравнивают спектры белков (РНК), синтезируемых либо в клубеньках и стерильных корнях»; либо в фиксирующих и нефиксирующих азот клубеньках. Соответственно, нодулины и Nst-гены разделяют на «ранние» (активируются до начала азотфиксации) и «поздние» (активируются с началом или во время азотфиксации).
Для ряда клубенек-специфичных белков выяснена субклеточная локализация (цитозоль растительной клетки, перибактероидная мембрана, стенка инфекционной нити) или ферментативная активность (многие «поздние» нодулины являются клубенек-специфичными изоформами ферментов азотного или углеродного обмена). Некоторые нодулины непосредственно участвуют в формировании структурной основы симбиоза (табл. 7.3). К их числу относятся ранний нодулин ENOD2, который активно синтезируется в паренхиме клубенька, а также ENOD5 и ENOD12, которые накапливаются в стенках ИН. Нодулин N-26, который синтезируется при эндоцитозе, входит в состав ПБМ и, по-видимому, необходим для транспорта регуляторных или трофических факторов между партнерами.
Таблица 7.3. Ранние нодулины бобовых растений
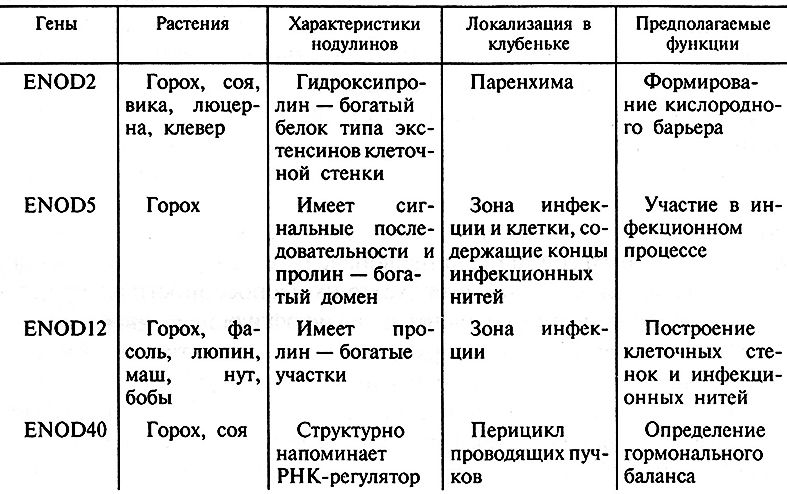
Большой интерес представляет изучение роли фитогормонов в развитии клубеньков. Показано, что обработка корней бобовых ингибиторами транспорта ауксинов может вызывать образование клубенькоподобных структур. Выявлен нодулин ENOD40, участвующий в определении гормонального статуса растущего клубенька. Его функция связана с контролем баланса ауксинов и цитокининов, который изменяется под действием эндосимбионта и играет важную роль в образовании клубеньковых примордиев и в гистогенезе клубеньков. В то же время необходимо отметить, что гипотезы о функциях большинства нодулинов основаны на анализе сходства их аминокислотных последовательностей с выявленными ранее белками. Прямые доказательства того, что нодулины выполняют именно эти функции в ходе развития симбиоза, в большинстве случаев отсутствуют.
Рефляция развития эндосимбионтов
Развитие структурной основы симбиоза сопровождается тесными регуляторными взаимодействиями партнеров, результатом которых является оптимизация развития симбиотических структур и, соответственно, скорости размножения и численности ризобий. Такая регуляция очень важна, так как потенциальная скорость деления у бактерий намного выше, чем у растительных клеток. Неконтролируемое размножение эндосимбиотических микробов часто оказывается вредным для хозяина, и его способность строго контролировать размножение симбионтов является одним из ключевых отличий мутуалистического симбиоза от паразитизма.
Диалог симбионтов с защитными системами хозяина. При образовании симбиоза у бобовых растений индуцируется ряд процессов, весьма сходных с защитными реакциями, наблюдаемыми при внедрении патогенных микробов. Это синтез флавоноидов, фенолов, хитиназ, каллозы и пероксидаз. Однако в клубеньках эти реакции выражены не столь сильно, как при инфицировании патогенами, и их результатом является не инактивация микроорганизмов, а регуляция их размножения и метаболической активности. Это происходит потому, что в процессе развития симбиотической системы наблюдается тонко сбалансированное взаимодействие бактерий с защитными системами растений.
Балансировка отношений партнеров определяется наличием у ризобий ряда генов, благодаря которым происходит диалог с защитными системами хозяина. Мутации в этих генах блокируют развитие симбиоза, и вместо нормальных клубеньков обычно образуются «псевдоклубеньки», которые не содержат инфекционных нитей и бактериальных клеток, а заполнены неорганизованной тканью (фенотип таких мутантов обозначен Nod+lnf–). Среди бактериальных генов, ответственных за «выяснение отношений» с хозяином, наиболее изучены гены, кодирующие синтез различных компонентов клеточной поверхности – экзополисахаридов и циклических глюканов. Мутанты по этим генам были первоначально отобраны по измененной морфологии колоний, а также по их неспособности адсорбировать флуоресцирующий краситель калькофлуор.
Наиболее изученным поверхностным компонентом ризобий, ответственным за диалог с защитными системами растений, является кислый экзополисахарид или сукциноглюкан (ЭПС-1). У ризобий люцерны (Rhizobium meliloti) его синтез контролируется более чем 20 ехо-генами, большая часть которых располагается кластером на одной из двух имеющихся у этих бактерий мегаплазмид. Для ряда ехо-генов выяснена первичная структура и механизмы экспрессии, что позволяет построить достаточно целостную картину синтеза ЭПС-1, включающую: образование предшественников, синтез из них мономеров (состоящих из восьми моносахаридных остатков), их модификации (присоединение сукцинильных, пирувипьных и ацетильных групп), полимеризацию и экспорт в периплазму.
Авторегуляция образования клубеньков. Регуляция развития симбиоза, осуществляемая защитными системами бобовых, не исчерпывает всего многообразия механизмов, при помощи которых растения контролируют развитие . эндосимбиотических микроорганизмов. Большой интерес представляют также специфичные для бобовых механизмы авторегуляции процесса образования клубеньков, которые позволяют растениям избегать избыточного клубенькообразования и тем самым экономить энергию, которая при симбиозе всегда в дефиците. Бобовые способны к достаточно жесткой авторегуляции клубенькообразования, которая опосредована надземной частью, т. е. имеет «системный» характер.
Мутации, нарушающие авторегуляцию образования клубеньков, получены у ряда бобовых. Их отбирают по фенотипу суперклубенькообразования (Nod++), который заключается в повышении числа клубеньков (в 2–10 раз по сравнению с «диким типом»). Обычно такие мутанты формируют клубеньки в присутствии высоких доз нитратов, ингибирующих развитие симбиоза у исходных растений (фенотип Nts – Nitrate tolerant symbiosis). У Nod++ мутантов общая нитрогеназная активность (вычисляемая на одно растение) повышена, а специфическая нитрогеназная активность (на единицу массы клубеньков) снижена.
Важно отметить, что у большинства Nod++ мутантов наблюдается снижение надземной массы растений. По всей видимости, это обусловлено перерасходом энергии на образование большого числа азотфиксирующих клубеньков. Таким образом, на примере данных мутантов видно, что строгий контроль над количеством эндосимбионтов является важным условием поддержания мутуалистического характера взаимодействия. При ослаблении этого контроля отношения партнеров могут переходить в паразитарные несмотря на то, что ключевой биохимический процесс, который лежит в основе симбиоза (фиксация N2), не нарушен.
Фиксация азота
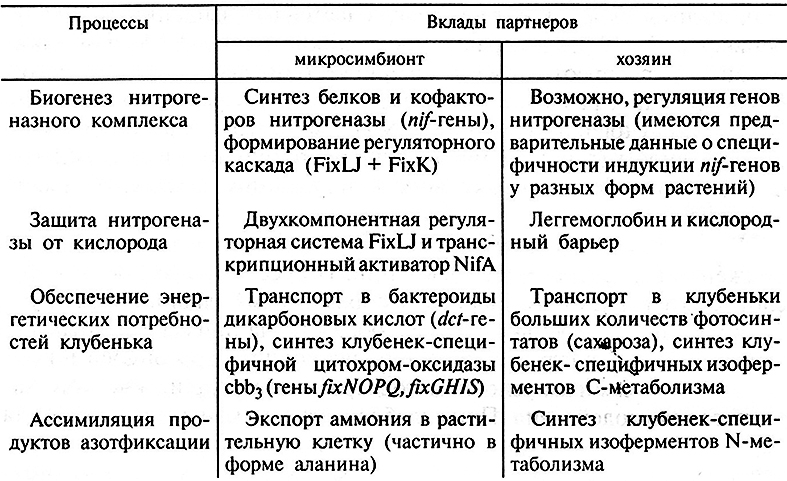
Заключительный этап развития симбиоза, на котором ризобии переходят к активной азотфиксации и к экспорту ее продуктов в растение, у большинства бобовых начинается после эндоцитоза бактерий в растительные клетки и формирования бактероидов. В бактероидах очень активно синтезируется нитрогеназа, которая может составлять до 30 % от их общего белка. Однако образование нитрогеназы – это наиболее важный, но не единственный Процесс, определяющий функционирование клубеньков как органов симбиотической азотфиксации. Другими значимыми процессами являются: формирование систем защиты нитрогеназы от молекулярного кислорода, обеспечение энергетических потребностей нитрогеназного комплекса и ассимиляция продуктов азотфиксации (табл. 7.4). Все эти функции выполняются бактериями и растениями совместно, что обеспечивается тесной структурной и функциональной интеграцией партнеров симбиоза.
Таблица 7.4. Ключевые биохимические процессы,
обеспечивающие симбнотическую азотфнксацию
Биогенез нитрогеназного комплекса. У ризобий, как и у других азотфиксирующих микроорганизмов, имеются гены nifHDK, кодирующие структуру белков нитрогеназы, а также другие nif-гены, определяющие образование ее кофакторов, регуляцию синтеза и созревание. У ризобий, как и у несимбиотических азотфиксаторов, транскрипция структурных генов нитрогеназы активируется геном nifA.
В то же время у ризобий выявлена специфичная для симбиотической азотфиксации система регуляции, состоящая из генов fixL, fixJи fixК. Гены fizLJ кодируют двухкомпонентную регуляторную систему (FixL – мембранный белок-сенсор, обладающий киназной и фосфатазной активностями; FixJ – цитоплазматический фосфорилируемый регулятор транскрипции). Активация этой регуляторной системы происходит лишь в микроаэрофильных условиях, поскольку FixL выполняет функцию сенсора О2, что обусловлено присутствием гема. Белок FixK – это транскрипционный регулятор, относящийся к семейству Crp-Fnr. У ризобий система регуляции азотфиксации, помимо структурных генов нитрогеназы, контролирует экспрессию генов dctABD (они кодируют транспорт в бактероиды дикарбоновых кислот, являющихся основным источником энергии для азотфиксации), fixNOPQ и fizGHIS (кодируют синтез бактероидной цитохромоксидазы типа cdd3, обеспечивающей транспорт электронов в дыхательных цепях бактероидов) и гены биосинтеза гема.
В отличие от системы регуляции nif-генов у несимбиотических азотфиксаторов ризобиальная система не содержит элементов, ответственных за репрессию nif-генов связанным азотом, подобных гену nifL Klebsiella. Это связано с тем, что азотфиксация в клубеньках происходит в условиях избытка связанного азота, а регуляцию образования клубеньков и азотфиксации при избытке связанного азота осуществляет растение-хозяин.
Защита нитрогеназы от кислорода. Важным условием функционирования клубенька является поддержание в нем анаэробных условий, так как синтезируемая бактериями нитрогеназа быстро и необратимо инактивируется кислородом. Однако энергоемкий процесс азотфиксации возможен лишь при высокой интенсивности окислительного фосфорилирования, для чего необходимо поступление больших количеств О2 к бактериальным цитохромоксидазам. Решение возникающего «кислородного парадокса» происходит благодаря координированной работе генетических систем обоих партнеров. У бактерий кислород-чувствительность синтеза нитрогеназы осуществляется на уровне систем FixLJ и NifA (см. выше). Растения также имеют два механизма «кислородной защиты» азотфиксации: а) многокомпонентный диффузионный барьер в покровных тканях клубенька, где наиболее важную роль в защите от кислорода играет внутренняя кора; б) гемоглобин – подобный белок легоглобин, который связывает кислород и обеспечивает его транспорт к симбиосомам (легоглобин составляет до 30 % от общего количества белка клубеньков).
Долгое время синтез легоглобина рассматривали как наиболее яркое проявление симбиоза на молекулярном уровне. Считалось, что его полипептидная часть (глобин) кодируется растительными генами, а гемовая часть – генами микросимбионта. Это мнение базировалось на данных о неспособности к азотфиксации мутантов ризобий, дефектных по синтезу гема или его предшественника, аминолевулиновой кислоты. Однако последующие работы показали, что обе части молекулы легоглобина синтезируются растительными клетками. Бактероиды, находящиеся в клубеньках, также синтезируют гем, но его участие в азотфиксации состоит в биогенезе цитохромов, обеспечивающих транспорт электронов к нитрогеназе.
У бобовых растений синтез легоглобинов кодируется семейством из нескольких сцепленных Lb-генов. В настоящее время подробно изучена структурно-функциональная организация этих генов: выявлена их интрон-экзонная структура, изучена организация промоторов, расположение кодирующих и некодирующих участков. Экспрессия Lb-генов в клубеньках, по всей видимости, основана на обмене партнеров регуляторными сигналами. Об этом говорит присутствие в промоторах этих генов последовательностей, которые гомологичны некоторым бактериальным промоторам и могут быть мишенями для сигнальных молекул, поступающих в растительные клетки от бактерий. Удалось выявить и бактериальные ДНК-связывающие белки, которые взаимодействуют с промоторами легоглобиновых генов.
В связи с микроаэрофильными условиями в клубеньках эндосимбиотические бактерии стоят перед проблемой совмещения интенсивного дыхания (без которого невозможно поддерживать высокую активность симбиотической азотфиксации) и активной работы нитрогеназы. Это обеспечивается наличием у ризобий разветвленных электронно-транспортных цепей, в которых одни компоненты работают в аэробных условиях (ex planta), а другие – в анаэробных (микроаэрофильных) условиях, в том числе в клубеньках. Наиболее важную для симбиоза роль в этих цепях играет цитохромоксидаза сЬЬз, кодируемая генами fixNOPQ и fixGHIS. Мутации по этим генам нарушают симбиотическую азотфиксацию, но не влияют на дыхательную активность свободноживущих бактерий. В то же время мутации ризобий, нарушающие образование других цитохромоксидаз, не влияют на симбиотическую азотфиксацию.
Энергетическое обеспечение азотфиксации. Основным источником энергии для симбиотической азотфиксации является фотосинтез, осуществляемый в надземных органах растения. Фотосинтаты транспортируются в клубеньки преимущественно в форме сахарозы. Затем растение осуществляет анаэробный этап катаболизма сахарозы (гликолиз), входе которого вырабатывается относительно небольшое количество энергии. На долю микросимбионта приходится выполнение наиболее энергетически выгодной части катаболизма – цикла трикарбоновых кислот (ЦТК). Основными углеводами, поступающими в бактероиды от растения-хозяина, являются С4-дикарбоновые кислоты (главным образом, сукцинат и малат), которые непосредственно включаются в ЦТК. Поэтому интенсивность работы нитрогеназной системы бактероидов в значительной степени определяется генами, обеспечивающими транспорт в бактероиды дикарбоновых кислот. Основную роль в этом процессе играют три гена: dctA (кодирует мембранную сукцинат-пермеазу), dctB и dctD (кодируют белки двухкомпонентной регуляторной системы, определяющие транскрипцию dctA). Белок DctB является сенсором, встроенным в мембрану бактероидов и реагирующим на присутствие дикарбоновых кислот, a DctD взаимодействует с промотором гена dctA, облегчая посадку на него РНК-полимеразы. Важно отметить, что система транспорта дикарбоновых кислот является одним из «узких мест», лимитирующих интенсивность симбиотической азотфиксации. Об этом говорит возможность существенного увеличения азотфиксирующей активности и эффективности симбиоза за счет введения в ризобии дополнительных копий dct-генов.
Со стороны растения-хозяина энергетика клубеньков обеспечивается синтезом клубенек-специфичных изоформ ферментов С-метаболизма (табл. 7.5, рис. 7.5). Среди них одно из центральных мест занимает сахарозосинтаза (SS), гидролизующая сахарозу с участием уридиндифосфата. В клубеньках сои SS составляет 3–4 % от общего количества растворимых белков цитозоля. Образующиеся в результате гидролиза гексозы (глюкоза и фруктоза) претерпевают обычный путь катаболизма – гликолиз. Альтернативный путь – пентозофосфатный цикл, по-видимому, имеет в клубеньках второстепенное значение.
Таблица 7.5. Растительные ферменты, специфичные для азотфиксирующих

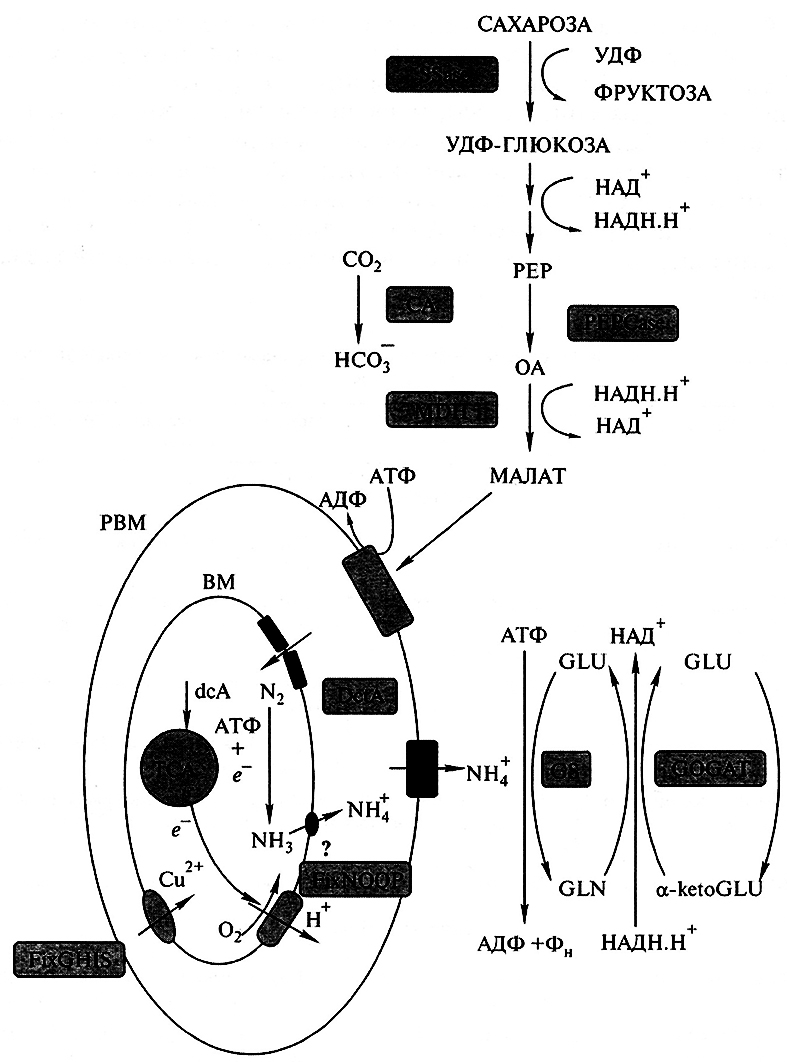
Рис. 7.5. Метаболическая интеграция партнеров при образовании азотфиксирующего симбиоза:
SSase-сахарозосинтаэа; PEP – фосфоенолпируват; PEPCase – фосфоенолпируваткарбоксилаэа; OA – оксалоацетат;
MDH – малатдегидрогеназа; DctA – сукцинатпермеаза: GS – глутаминсинтетаза; GOGAT – глутаматсинтаза;
dcA – дикарбоновые кислоты (сукцинат, мапат); TCA – цикл трикарбоновых кислот; GLU – глутамин;
GLN – глугамат; αketoGLU – α-кетоглутарат; FixGHIS и FixNOQP – специфические для бактероидов цитохромы
с высоким сродством к кислороду; РВМ – перибакгероидная мембрана; ВМ – мембрана бактероида
Поскольку количество углерода в клубеньках является одним из основных факторов, лимитирующих азотфиксацию, важное значение приобретает нефотосинтетическая (темновая) фиксация СО2, катализируемая фосфоенолпируваткарбоксилазой (РЕРС): фосфоенолпируват + СО2 = малат. Эта реакция является источником приблизительно 25 % атомов углерода, поступающих в составе малага и других энергетических субстратов в бактероиды. Таким образом, за счет работы РЕРС рециклизуется существенная часть углекислоты, выделяемой при дыхании, которое в клубеньках происходит очень активно.
Ассимиляция фиксированного азота. С-соединения, поступающие в клубеньки, являются источниками не только энергии для азотфиксации, но и углеродных «скелетов» для ассимиляции фиксированного азота. Образовавшийся в процессе азотфиксации аммоний поступает из бактероидов в цитоплазму растительных клеток клубенька либо в свободной форме, либо в составе аланина (который образуется из-за активности бактериальной аланин-дегидрогеназы). Фиксированный азот и включается в метаболизм растительной клетки. При этом различают стадии первичной ассимиляции азота (вовлечение аммония в клеточный метаболизм), образования транспортных форм фиксированного азота (которые поступают из клубеньков в проводящую систему корня) и транслокации фиксированного азота (его перераспределение между разными органами растения). В первичной ассимиляции и образовании транспортных форм фиксированного азота ключевую роль играют клубенек-специфичные формы ферментов азотного обмена, синтезируемые растением (см. табл. 7.5).
В растительных клетках первичная ассимиляция аммония начинается реакциями, которые контролируются ферментами «глутаматсинтазного цикла» – глутаминсинтетазой (GS) и NADH-зависимой глутаматсинтазой (NADH-GOGAT). GS, выделенная из клубеньков фасоли, представляет собой октамерный фермент, состоящий из субъединиц одинаковой молекулярной массы – около 40 кДа. Выявлены три изофермента (GSn1, GSn2 и GSL2), причем два первых локализованы в цитоплазме, а третий – в пластидах инфицированных растительных клеток. При этом клубенек-специфичной изоформой (нодулином) является только GS n1, а точнее – лишь одна из ее субъединиц.
Вторым ферментом глутаматсинтазного цикла является NADH-GOGAT, локализованная, в отличие от клубенек-специфической GS, в пластидах растительных клеток. Таким образом, в клетках клубенька обнаружено разобщение ферментов глутаматсинтазного цикла (GS – в цитоплазме, a NADH-GOGAT – в пластидах). Многие данные показывают, что именно реакция, катализируемая NADH-GOGAT, является лимитирующей стадией в ассимиляции фиксированного азота: активность NADH-GOGAT невысока даже в эффективных клубеньках. В неэффективных же клубеньках активность этого фермента (как и наличие его мРНК), часто не удается зарегистрировать. Клубеньковая NADH-GOGAT у люпина, люцерны и гороха представлена одной молекулярной формой с массой более 200 кДа, индуцирующейся при клубенькообразовании. В клубеньках фасоли синтезируются два изофермента NADH-GOGAT, один из которых является клубенек-стимулируемым.
Помимо глутамина, главной транспортной формой азота у большинства бобовых растений, произрастающих в умеренных широтах (например, у гороха и люцерны), являются амиды – в основном, аспарагин. Эти бобовые выделяют в «амидный» тип. У других бобовых (фасоль, соя, вигна) транспорт азота происходит в форме уреидов – аллантоина и аллантоиновой кислоты. Эти бобовые относят к «уреидному» типу.
У «амидных» бобовых все основные реакции ассимиляции фиксированного азота происходят в тех же клетках, которые содержат симбиосомы. При этом важную роль играет аспартатаминотрансфераза (ААТ), которая катализирует реакцию образования аспартата – предшественника аспарагина. В метаболизме «уреидных» клубеньков важную роль играет уриказа. Она осуществляет один из конечных этапов биосинтеза уреидов – образование аллантоина путем окисления мочевой кислоты, образующейся при окислении пуринов.
7.3. СИМБИОЗЫ РАСТЕНИЙ С ЦИАНОБАКГЕРИЯМИ
Азотфиксирующие цианобактерии образуют симбиозы с очень широким спектром растений, включающим покрытосемянные, голосемянные, папоротники, мхи и даже одноклеточные морские диатомовые водоросли. Наиболее изученными являются эндосимбиозы гетероцистных цианобактерий Anabaena (Nostoc) с водным папоротником Azolla, а также Nostoc с цветковым Gunnera и печеночником Anthoceros. Симбиоз Nostoc-Gunnera является внутриклеточным, остальные симбиозы – внеклеточными (у Azolla цианобактерия располагается в полости листа, у Anthoceros – в полостях, расположенных на дорзальной стороне таллома).
Микроорганизмы в отсутствие связанного азота могут расти диазотрофно как на свету (на минимальной среде, т. е. при автотрофном С-питании), так и в темноте (на среде с источниками углерода, т. е. при гетеротрофном С-питании). Это открывает широкие возможности для генетического анализа процессов, связанных с азотфиксацией у симбиотических цианобактерий. Для растений зависимость от симбиоза с цианобактериями выражена в разной степени: для Azolla он является облигатным, а для Gunnera и Anthoceros – факультативным.
Некоторые симбиозы, образуемые азотфиксирующими цианобактериями, имеют экологическое и сельскохозяйственное значение. Так, система «Azolla-АпаЬаепа» является весьма эффективным источником азота при выращивании риса. Симбиоз «Nostoc-Gunnera» может рассматриваться как модель, разработка которой позволит придать способность к азотфиксирующим симбиозам широкому кругу небобовых растений.
Клеточная дифференцировка
При переносе АпаЬаепа в безазотную среду приблизительно 10 % клеток, распределенных случайно по длине нити, претерпевает дифференцировку в гетероцисты. Эти клетки увеличиваются в размерах и окружаются плотной оболочкой, которая блокирует доступ в цитоплазму свободного кислорода. Фотосинтез в гетероцистах отсутствует, из-за чего в них создаются микроаэрофильные условия, необходимые для азотфиксации. Это позволяет цианобактериям фиксировать азот в аэробных условиях.
У АnаЬаеnа выявлена сложная система генов, контролирующих образование гетероцист. Среди них наиболее изучен ген hetR, инактивация которого приводит к неспособности формировать гетероцисты. Мутанты по гену hetR могут фиксировать азот при росте на безазотной среде в микроаэрофильных условиях, но не могут – в аэробных условиях. Если же ген hetR амплифицировать в составе многокопийной плазмиды или усилить его экспрессию, поставив под «сильный» промотор, то формирование гетероцист индуцируется даже на среде с аммонием.
У штамма АnаЬаеnа с введенным в него многокопийным геном hetR можно получить транспозоновые мутанты, у которых дополнительные гетероцисты не образуются. Инсерции транспозона у этих мутантов локализованы в генах patA и patB. Мутации в гене patA приводят к необычному нарушению процесса клеточной дифференцировки: гетероцисты образуются только на концах клеточной цепочки. Мутации в гене раtВ приводят к задержке образования гетероцист: если у штамма АпаЬаепа 7120 «дикого типа» они появляются уже через 24 ч после переноса на безазотную среду, то у pat В мутанта – только через 48 ч. Однако общее число гетероцист, образуемых после продолжительного культивирования на безазотной среде, повышено по сравнению со штаммом дикого типа. При совмещении мутации patE с мутацией patA– (или с многокопийностью по гену hetR) цианобактерия гибнет.
Некоторые мутации у Anabaena приводят к образованию морфологически нормальных гетероцист, которые не могут защищать нитрогеназу от кислорода. Поэтому у данных мутантов азотфиксация в аэробных условиях невозможна, хотя в микроаэрофильных условиях она не нарушена. С помощью этих мутаций было выявлено семейство генов hglB, -С, -D, -К, которые контролируют накопление гликолипидов в клеточной стенке гетероцист. По-видимому, эти гены кодируют синтез жирных кислот, которые входят в состав гликолипидов клеточной стенки, препятствующих диффузии О2 в гетероцисты.
Молекулярная дифференцировка
Переход Anabaena к азотфиксации сопровождается репрессией генов, контролирующих фиксацию СО2, благодаря чему в гетероцистах прекращается выработка молекулярного кислорода. Кроме того, активируются некоторые гены азотного метаболизма, необходимые для ассимиляции аммония (например, glnА). Глутамин, образующийся в результате этого процесса, транспортируется в вегетативные клетки цианобактерии или экспортируется в организм хозяина.
Уникальной особенностью азотфиксирующей системы у гетероцистных цианобактерий являются перестройки nif-генов, предшествующие синтезу нитрогеназы. В вегетативных клетках Anabaena синтез нитрогеназы невозможен, так как внутри гена nifD находится фрагмент ДНК размером 11 т.п.н. Этот фрагмент содержит ген xisA, кодирующий эндонуклеазу. При дифференцировке гетероцист эндонуклеаза осуществляет точное вырезание фрагмента, так что целостность гена nifD восстанавливается, а ген xisA переходит в экстрахромосомное состояние. Кроме того, xisA определяет эксцизию еще одного фрагмента ДНК размером 55 т.п.н., который расположен между генами nifS и fdxN. В результате этого в азотфиксирующих гетероцистах из трех исходно разобщенных групп генов возникает единый оперон, который состоит из семи генов и кодирует синтез нитрогеназного комплекса.
Важно отметить, что перестройка nif-генов в гетероцистах Anabaena происходит в значительной степени независимо от генов, контролирующих морфогенез гетероцист. Так, у мутантов по гену hetR в анаэробных условиях эти перестройки происходят нормально, что выражается в индукции нитрогеназной активности. В свою очередь, мутации, инактивирующие структурные гены нитрогеназы (nifHDK) или нарушающие процессинг ДНК (xisA–), приводят к неспособности фиксировать азот, однако формирование гетероцист в безазотной среде сохраняется.
Развитие симбиоза
Развитие симбиоза азотфиксирующих цианобактерий с растениями было изучено на примере системы «Nostoc-Gunnera*, образование которой является факультативным для обоих партнеров. Взаимодействие этих организмов не является высокослецифичным: симбиоз могут формировать штаммы Nostoc, выделенные не только из Gunnera, но также из голосемянного Macrvzamia печеночника Anthoceros и даже из лишайника Peltigera. В то же время, далеко не все изоляты Nostoc могут формировать симбиотическую систему.
Цианобактерии обитают в специальных железах, находящихся у основания черешков листьев. Эти железы содержат папиллы, между которыми имеются каналы, ведущие в глубь растительных тканей. При попадании в железу совместимого штамма цианобактерий у партнеров индуцируется ряд морфогенетических процессов, из которых первым является образование подвижных форм цианобактерий – гормогоний (короткие нити, состоящие из мелких клеток с воздушными вакуолями, не содержат гетероцист), которые активно проникают в глубь железы.
Цианобактерии, проникающие внутрь симбиотической железы, активно размножаются и инфицируют растительные клетки. В местах наиболее тесного контакта партнеров стенки растительных клеток лизируются. После этого эндосимбионты проникают в клетки растения, а затем их стенки восстанавливают свою целостность. Внутри растительных клеток цианобактерии дифференцируются в гетероцисты, в которых индуцируется нитрогеназная активность. У эндосимбиотических цианобактерий гетероцисты образуют 60–80 % клеток, а у свободноживущих – лишь 5–10%. Образование неподвижных спор (акинет), характерных для свободноживущих цианобактерий, внутри симбиотических желез Gunnera не наблюдается.
При симбиозе с Gunnera цианобактерии не ассимилируют аммоний, образовавшийся в результате нитрогеназной реакции, а экспортируют его в растительную клетку. Первичную ассимиляцию аммония в этой симбиотической системе (как и в случае бобово-ризобиального симбиоза) выполняет хозяин.
7.4. КОНЦЕПЦИЯ ГЕНЕТИЧЕСКИХ ОСНОВ
И ЭВОЛЮЦИИ АЗОТФИКСИРУЮЩИХ
СИМБИОТИЧЕСКИХ БИОСИСТЕМ
Симбиозы растений с азотфиксаторами являются одной из наиболее широко распространенных и изученных форм растительно-микробного взаимодействия. Образуемые симбиозы являются в своей основе взаимовыгодными (мутуалистическими), однако при определенных условиях (высокое содержание в среде связанного азота, недостаточное питание, генетические изменения) взаимодействие может переходить в паразитизм. Более того, механизмы взаимен действия бобовых с ризобиями имеют ряд общих стадий со взаимодействием между растениями и фитопатогенами. Таким образом, изучение азотфиксирующих симбиозов подтверждает правильность концепции симбиоза, предложенной более 120 лет назад Антоном Де Бари. Этот ученый предложил считать главным отличительным признаком симбиоза не его «полезность» или «вредность», а длительность взаимодействия партнеров. Такой подход позволяет рассматривать симбиотические системы как стабильные надорганизменные комплексы, входя в которые организмы приобретают новые экологические и метаболические возможности, которых они были лишены в свободноживущем состоянии.
При рассмотрении данных о генетическом контроле двух разных типов азотфиксирующих систем – бобово-ризобиального симбиоза и симбиоза растений с цианобактериями – можно видеть ряд общих черт, характеризующих эти взаимодействия (табл. 7.6). Во-первых, обе группы симбиозов базируются на сигнальных взаимодействиях партнеров, причем сигналы воздействуют непосредственно на экспрессию генов. В результате наблюдается координированная регуляция и дифференциальная экспрессия генов партнеров, которая приводит к морфогенезу симбиотических структур и к тесной метаболической интеграции растений и бактерий. Во-вторых, в обеих системах основные эффекты взаимодействия – азотфиксация и развитие структур симбиоза – контролируются разными генными системами и могут быть разобщены с помощью генетических методов.
Таблица 7.6. Сравнение двух типов азотфиксирующего растительно-микробного симбиоза

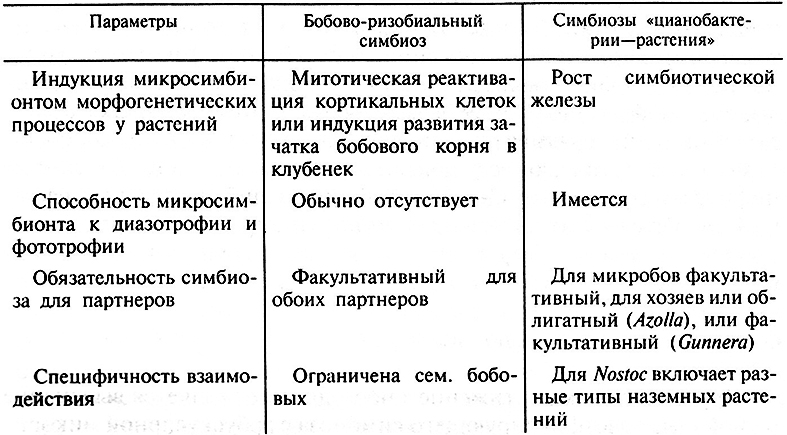
В то же время очевиден и ряд различий между рассмотренными системами. Первое различие связано с тем, что большинство цианобактерий фиксируют азот в чистой культуре, сочетая это с фототрофностью, тогда как большинство ризобий в чистой культуре азот не фиксируют и фототрофами не являются. В связи с этим у цианобактерий имеется специальный механизм образования азотфиксирующих клеточных форм – гетероцист, в которых отсутствует фотосинтез, а защита нитрогеназы от кислорода обеспечивается прочной клеточной стенкой. У цианобактерий имеется сложная система генов дифференцировки гетероцист, которая, по-видимому, сформировалась как адаптация к диазотрофному росту, однако используется и в симбиотической системе. У ризобий цитодифференцировка в норме осуществляется только in planta и не связана с защитой нитрогеназы от кислорода.
Чрезвычайно интересным является вопрос о происхождении и эволюции азотфиксирующих симбиозов. Полученные в последние годы данные о молекулярной структуре симбиотических генов бобовых позволяют пролить свет на эти вопросы. Например, у лядвенца (Lotus japonicus) выявлен ген nin, мутации в котором приводят к отсутствию клубеньков (блокировано развитие инфекционных нитей), однако не влияют на развитие других органов растения. Белковый продукт этого гена оказался гомологичным фактору Mid Chalomydomonas, контролирующему гаметогенез в условиях азотного голодания. Таким образом, в симбиотической системе данный ген сохранил эволюционно древнюю функцию регуляции процессов развития, осуществляемой при воздействии метаболического стресса (недостаток азота). Сходным образом могли эволюционировать системы синтеза различных нодулинов и Nst-белков. Так, гомологи генов леггемоглобина выявлены у широкого спектра растений, не образующих клубеньков, причем белки-продукты этих генов, так же как и леггемоглобин, связывают кислород, выполняя роль его сенсоров. Гомологи практически всех нодулинов, в том числе и клубенек-специфических ферментов С- и N-метаболизма, либо выявлены у растений, не образующих клубеньков, либо функционируют в надземных органах бобовых. Следовательно, на молекулярно-генетическом уровне эволюция симбиоза может быть представлена как вовлечение анцестральных генов, выполнявших не связанные с симбиозом функции, в регуляторную систему растительно-микробных взаимодействий.
Другим важным достижением последних лет является выяснение тесной связи азотфиксирующего симбиоза с арбускулярной микоризой (AM). Применение формально- и молекулярно-генетических методов показало, что развитие бобово-ризобиального симбиоза и AM контролируется рядом «общих» генов. Эти симбиозы сопровождаются синтезом гомологичных растительных продуктов, в том числе белков перибактериодной и периарбускулярной мембран, а также некоторых нодулинов. Особый интерес представляет тот факт, что при образовании AM и клубеньков происходят реакции, характерные для защиты растений от патогенов. Однако по характеру регуляции эти реакции различаются, что может быть связано с выполняемыми функциями: инактивация микроорганизмов при антагонизме и регуляция их активности (численности) при мутуализме. Учитывая древность AM по отношению к другим типам микробно-растительных взаимодействий, логично предположить, что первичной функцией защитных систем растений была регуляция развития эндомикоризных грибов in planta. В ходе дальнейшей эволюции растений эти системы могли приобрести функции защиты от патогенов, а также контроля над поддержанием азотфиксируюших симбионтов.
Общими для образования клубеньков и AM могут быть также гены рецепции и процессинга ризобиальных Nod-факторов, близких к олигомерам хитина – основного компонента клеточной стенки грибов. Nod-факторы, активирующие клубенькообразование, стимулируют и микоризацию, а синтез бобовыми хитиназ, расщепляющих Nod-факторы, индуцируется как ризобиями, так и АМ-грибами. Эти данные показывают, что в процессе коэволюции с растениями ризобии «научились» синтезировать те же сигнальные факторы, что и микоризные грибы.
Таким образом, значительная часть генетической системы, контролирующей развитие клубеньков, возникла в ходе коэволюции растений с АМ-грибами. Поэтому способность к образованию AM необходимо рассматривать как одну из ключевых преадаптаций растений, обусловивших возникновение азотфиксирующих симбиозов. Однако в процессе коэволюции бобовых и ризобий возник ряд новых стадий взаимодействия (наиболее существенными из них был эндоцитоз и формирование автономных симбиосом), обеспечивших усложнение морфологии системы и глубокую функциональную интеграцию партнеров.
Общей чертой всех систем симбиотической азотфиксации является то, что интенсивность этого процесса координируется генами обоих партнеров. Поэтому улучшение азотфиксирующих симбиозов, так же как и других систем растительно-микробного взаимодействия, требует координированной генно-инженерной и селекционной работы с микроорганизмами и растениями. Без выяснения организации функций тесно интегрированных систем симбиотических генов растений и бактерий вряд ли можно серьезно говорить об улучшении симбиотических систем и тем более о создании новых симбиозов. С учетом этого факта проводятся селекционные работы по достижению максимального эффекта синергического эффекта в микробиально-растительной азотфиксирующей системе. Практически уже получены варианты с оптимальным сочетанием эффективных штаммов микроорганизмов и сортов бобовых растений.
Серьезные разработки требуются для создания высокоспецифичных систем узнавания, улучшения совместимости микросимбионтов с защитными и метаболическими системами растений. В связи с высокой энергоемкостью многих симбиозов весьма актуальной задачей является оптимизация взаимодействия эндосимбионтов с системами обеспечения растений энергией, в первую очередь, с аппаратом фотосинтеза. Решение всего этого комплекса фундаментальных и прикладных проблем требует проведения междисциплинарных исследований, в которых участвуют специалисты разных профилей. Природные симбиотические системы могут быть познаны и улучшены только «научными симбиозами» – сообществами ученых, владеющих знаниями и методами в областях изучения растений и микробов. Организация таких сообществ – очень актуальная задача, для решения которой должны быть использованы организационные и финансовые возможности современной науки.

