Существующие на сегодняшний день способы активации дрожжей различаются механизмом влияния на дрожжевую клетку. Одни из них (химические) связаны с активацией ферментных систем клетки, другие (физические) — в значительной мере с проницаемостью цитоплазматических мембран дрожжей.
В одном из предложенных Т. П. Богатырь, М. В. Васюковым, В. Ф. Пучковой способов активации дрожжи находятся в составе водно-мучной суспензии с введением дробленых взорванных зерен (“Креки са”). Обработка смеси, проводимая во взбивальной машине МВ-35, заключается в воздействии на систему длительного перемешивания повышенной температуры, что не может не сказаться на последующих процессах замеса и созревания теста и качестве хлеба.
Для выяснения механизма воздействия перемешивания на отдельные компоненты активируемой системы М. В. Васюковым, В. Ф. Пучковой и Т. П. Богатырь проведены исследования по биотехнологии производства дрожжевого теста.
Комплексное воздействие различных факторов среды на дрожжевые клетки при их активации предложенным способом может оказать влияние на активность ферментов, микровязкость цитоплазматических мембран, размеры конгломератов суспендированных в воде дрожжевых клеток. Указанное не может не повлиять на физиолого-биохимические функции дрожжей после обработки, а следовательно, и на их функционально-технологические свойства в условиях тестоприготовления.
Поэтому при обработке дрожжей, возможно, происходит изменение состояния популяции клеток, для которого существенную роль играет наличие конгломератов, уменьшающих поверхность контакта клеток со средой, что сможет проявляться в снижении скорости брожения.
В прессованных дрожжах клетки находятся в составе конгломератов, размеры которых на несколько порядков выше размеров единичной клетки, что влияет на условия массообмена. Структура конгломератов может значительно изменяться, как утверждают Л. И. Пучкова, Р. Д. Поландова и И. В. Матвеева, в зависимости от условий среды.
Для выяснения высказанного предположения Т. П. Богатырь и В. Ф. Пучковой проведена оценка состояния дрожжевой популяции методами, принятыми в технической микробиологии.
Изучение механизма влияния обработки дрожжей во взбивальной машине МВ-35 проводили на модельной системе, а именно суспензии в воде прессованных дрожжей без муки, взятых в соотношении 1:15. Эту систему перемешивали во взбивальной машине в течение 20 мин при температуре 35 °С. Контролем служили исходные дрожжи, подвергнутые брожению без перемешивания.
Об изменении состояния популяции судили по числу мертвых и почкующихся клеток, а также по наличию конгломератов в дрожжевой массе. Наряду с этим исследовали физиологию роста клеток и уровень их энергетического обмена.
Исследование числа мертвых и почкующихся клеток проводили путем микроскопирования с использованием микроскопа МБИ-11 при увеличении в 600 раз в тонком слое с помощью “счетной камеры” Горяева. Для подсчета числа мертвых клеток препарат окрашивали метиленовым синим. Количество почкующихся клеток определяли сразу после обработки.
Результаты этой серии опытов представлены в табл. 3.1.

При подсчете числа мертвых клеток в суспензии обработанных дрожжей установлено, что их количество незначительно выше (на 1,1%), чем у исходных дрожжей. Число почкующихся клеток в результате обработки уменьшилось на 11,5% по сравнению с контрольным образцом.
В результате механического воздействия число почкующихся клеток уменьшилось за счет отделения дочерних клеток от материнских. Однако число мертвых клеток, которое практически осталось на прежнем уровне, указывает на достаточно высокую их жизнеспособность.
Сведения, полученные на основании поставленных опытов, свидетельствуют об увеличении числа “единичных” особей и сохранении их жизнеспособности после обработки. Как известно, каждая живая клетка при посеве на плотную среду образует колонию, что является подтверждением ее жизнеспособности. Поэтому при анализе результатов обработки опытных образцов суспензии в МВ-35 установлена дезагрегация конгломератов прессованных дрожжей, приводящая к увеличению поверхности контакта клеток со средой. Мучной полуфабрикат представляет собой анаэробно-мальтозную среду с небольшим содержанием глюкозы и фруктозы. Дрожжи, соответственно, в такой среде имеют высокоактивные бродильные ферменты. Это в свою очередь будет способствовать ускорению обменных процессов дрожжевых клеток в условиях тестоведения, повышению эффективности опарного и безопарного способов приготовления теста, снижению расхода используемых дрожжей без ухудшения качества готовых изделий.
Наряду с оценкой состояния популяции в целом Т. П. Богатырь и В. Ф. Пучкова исследовали влияние обработки в МВ-35 на физиологию роста клеток дрожжей. В процессе эксперимента дрожжи засевали из расчета 1 млн клеток на 1 мл пивного сусла. Наблюдали рост, т. е. увеличение числа клеток при высеве дрожжей в среду неохмеленного пивного сусла 11%-ной концентрации при температуре 32 °С. Полученные данные сравнивали с показателями, имеющимися в литературе. Определение числа клеток проводили через каждый час культивирования в течение 9 ч.
На основе полученных данных об увеличении этого показателя в растущей культуре вычисляли константу скорости деления клеток V ,ч-1 и выражали ее числом удвоений клеток за 1 ч. Вместе с этим показателем определяли время генерации культуры (величину, обратную константе скорости деления клеток).
Известно, что дрожжи размножаются чаще всего делением надвое, и поэтому число их растет в геометрической прогрессии:
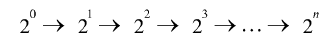
Если на единицу объема растущей периодической культуры приходится N0клеток, то после п делений число клеток будет N0·•2n.
Логарифмируя, получаем IgN = lgN0 + nlg2, откуда число клеточных делений:
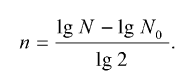
Число клеточных делений за 1 ч, или константа скорости деления V, определялась по формуле
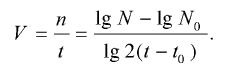
Время, необходимое для одного цикла деления, или время генерации:
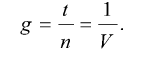
Полученные результаты представлены на рис. 3.1 и в табл. 3.2.
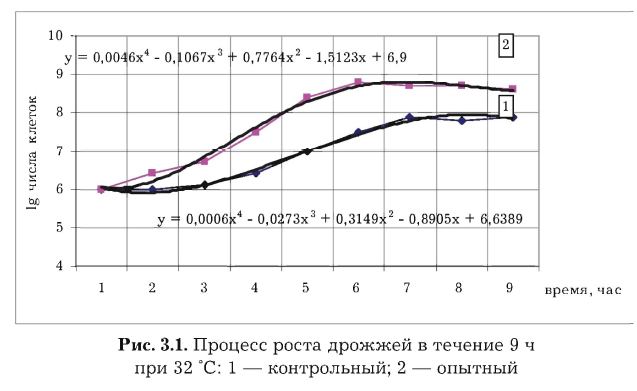

Из графиков видно, что кривая роста дрожжей имеет S-образную форму и позволяет различать несколько фаз роста, сменяющих друг друга в определенной последовательности: лагфаза, логарифмическая, стационарная фазы.
Кривые роста клеток в опытном и контрольном образцах отличаются по каждой из фаз и указывают на улучшение показателей физиолого-биохимических свойств в результате обработки в МВ-35.
Так, продолжительность лагфазы в опытном образце составляет 55 мин против 2 ч в контрольном, что является следствием лучшей приспосабливаемости клеток к условиям среды культивирования после обработки. Достижение стационарной фазы роста дрожжей, обработанных в МВ-35, происходит на 1 ч быстрее по сравнению с контрольным образцом. В опытном образце константа скорости размножения в стадии логарифмического роста выше, чем в контрольном, в 2,5 раза. Время одного цикла деления клетки сокращается на 0,15 ч. Общий урожай клеток в опытном выше, чем в контрольном, в 1,8 раза.
Таким образом, данные результаты подтверждают эффективность обработки дрожжей в МВ-35 для улучшения их физиологического состояния.
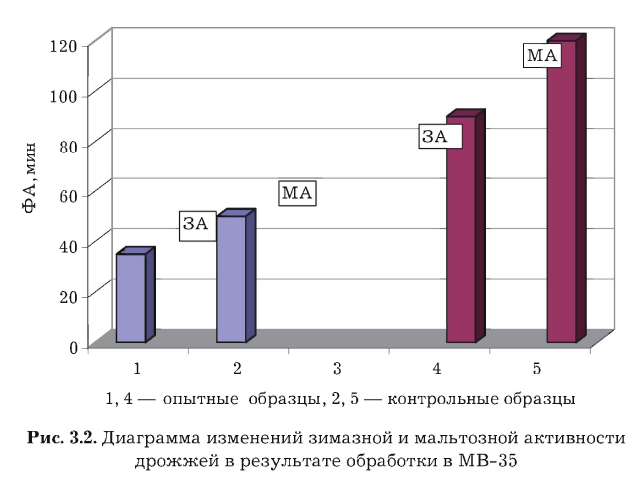
Об уровне энергетического обмена дрожжей можно судить по активности ферментов гликолиза — зимазного комплекса клеток и в значительной степени по величине мальтозной активности.
Мальтозную (МА) и зимазную (ЗА) активность дрожжей определяли с помощью микрогазометра Елецкого по стандартным методикам и выражали временем в минутах, затраченным для выделения 10 см3 диоксида углерода при сбраживании 5%-ного раствора глюкозы или мальтозы. Ферментативную активность (ФА) определяли у исходных дрожжей (контрольный образец) и сразу после обработки (опытный). Результаты экспериментов приведены на рис. 3.2.
Из диаграммы видно, что активность ферментов зимазного комплекса возрастает при обработке на 36,2%, а мальтозного — на 23,1% по сравнению с контрольным образцом, что является предпосылкой интенсификации процессов энергетического обмена у обработанных дрожжей.
Для оценки изменений физиолого-биохимических функций дрожжей в экспериментах использовали жидкие среды (неохмеленное пивное сусло, стерильные растворы сахаров), которые обеспечивают интенсивный обмен клеток со средой и позволяют достаточно объективно оценивать характер изменений, произошедших в клетках дрожжей после обработки в МВ-35.
В то же время при традиционном тестоприготовлении жизнедеятельность дрожжей происходит в совершенно иных условиях. Высокая плотность среды затрудняет диффузионные процессы и обмен веществ клеток с ней, иная концентрация сбраживаемых сахаров и усвояемых форм азотистых веществ приводит к изменению скорости роста клеток. Поэтому в хлебопечении было введено понятие о биотехнологических свойствах дрожжей, которые следует характеризовать как свойства дрожжей при их созревании в мучных полуфабрикатах, выделять продукты метаболизма и обусловливать ту или иную продолжительность процесса, способствовать формированию показателей технологических свойств полуфабрикатов, а значит, и качеству хлеба.
Анализ научно-технической литературы свидетельствует о большом разнообразии показателей и методов определения биотехнологических свойств дрожжей. Как правило, они основаны на определении интенсивности выделения С02 в различных средах. На наш взгляд, наиболее точной является методика оценки биотехнологических свойств дрожжей, предложенная русскими учеными. Согласно этой методике показателями биотехнологических свойств дрожжей являются: максимальное количество С02, выделившегося при брожении теста из муки 1-го сорта, бродильная активность (БА) и —время вторичного перегиба кривой скорости газообразования в нем т . В основу методики положены теоретические воззрения Елецкого о двухстадийном изменении скорости газообразования при использовании его прибора.
Эту методику использовали в следующей серии опытов. Эксперименты проводили на модельных образцах теста, приготовленного по рецептуре пробной лабораторной выпечки с использованием активированной водной суспензии дрожжей и дрожжей без активации (контроль). Обработку в МВ-35, как и в предыдущей серии опытов, осуществляли при условиях, принятых в предложенном способе активации дрожжей. Наблюдения проводили в течение 4 ч брожения с интервалом в 0,5 ч. Наряду с определениями количества углекислого газа, выделившегося при брожении теста, рассчитывали скорость брожения.
Результаты этой серии опытов представлены на рис. 3.3 и 3.4 и в табл. 3.3.
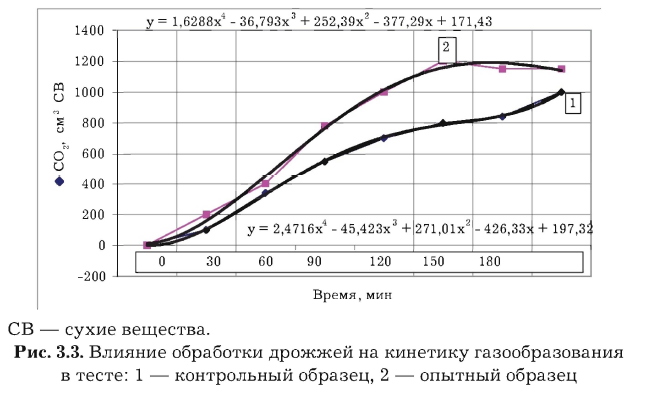
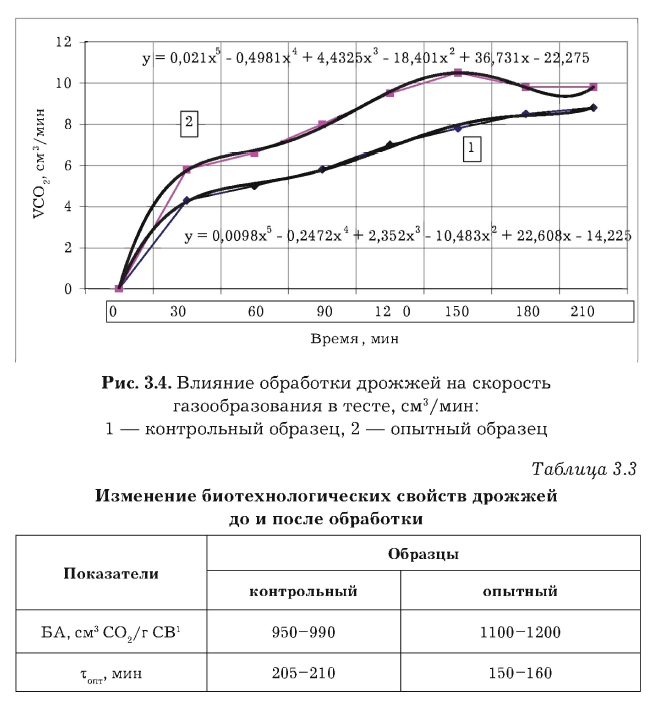
Данные исследований показывают, что в ходе брожения теста в опытных образцах бродильная активность дрожжей повышается более интенсивно уже в первый час. Именно в это время происходит потребление дрожжами собственных сахаров муки. Кривые скорости газообразования имеют два характерных экстремальных значения (пика). Первый обусловлен снижением в субстрате легкодоступных собственных сахаров муки и началом индукции мальтозы дрожжей. Затем скорость газообразования снова повышается вследствие накопления мальтозы, полученной в результате расщепления крахмала, и интенсивного ее сбраживания. Второй экстремум скорости газообразования связан с дефицитом в среде мальтозы. При использовании обработанных дрожжей достижение этого максимального значения скорости процесса происходит на 1 ч раньше.
Оптимальное время брожения опытного образца — 160 мин, контрольного— 210 мин, что является предпосылкой обязательного сокращения продолжительности брожения теста с использованием обработанных дрожжей.
Как видно из табл. 3.3, в опытном образце бродильная активность дрожжей составляет в среднем 1150 см3/г СВ, что на 22,5% выше, чем в контрольном.
Таким образом, обработка дрожжей в МВ-35 увеличивает их бродильную активность, что в условиях тестоведения позволит улучшить разрыхленность полуфабриката и сократить продолжительность процесса созревания теста.
Учитывая, что при обработке в МВ-35 имеет место комплексное воздействие факторов, в том числе перемешивания и создания однородной среды, необходимо исследовать их влияние на показатели качества дрожжей. Суспензия подвергалась воздействию интенсивного перемешивания и диспергирования. Параметры обработки в этой серии опытов были аналогичными таковым в предлагаемом способе, эффект воздействия обработки водно-дрожжевой суспензии (без введения муки) оценивали по подъемной силе (ПС) и осмочувствительности (ОЧ).
Для исследований использовали исходные прессованные дрожжи с подъемной силой — 68 мин и осмочувствительностью -17 мин.
Результаты исследований приведены в табл. 3.4, в которой также для сравнения приведены показатели качества дрожжей после их обработки в МВ-35.

Данные результаты подтверждают правильность выдвинутого нами предположения о решающей роли перемешивания для активации дрожжей в МВ-35. Под действием перемешивания подъемная сила дрожжей выше на 20%, осмочувствительность — 17% по сравнению с дрожжами, где из среды удалены частицы.
Таким образом, важным фактором при обработке водно-дрожжевой суспензии, оказывающим влияние на клетки дрожжей, является перемешивание среды в МВ-35.
Суммируя сказанное, можно отметить, что условия обработки в МВ-35 приводят к улучшению биотехнологических свойств дрожжей за счет как интенсивного перемешивания, так и температуры водно-мучной суспензии.

