Вторичные метаболиты, называемые также идиолитами, низкомолекулярные соединения, не требующиеся для роста в чистой культуре. Они производятся ограниченным числом таксономических групп и часто представляют собой смесь близкородственных соединений, относящихся к одной и той же химической группе. К вторичным метаболитам относятся антибиотики, алкалоиды, гормоны роста растений и токсины.
Микроорганизмы, производящие вторичные метаболиты, вначале проходят стадию быстрого роста, тропофазу, во время которой синтез вторичных веществ незначителен. По мере замедления роста из-за истощения одного или нескольких необходимых питательных веществ в культуральной среде микроорганизм переходит в идиофазу; именно в этот период синтезируются идиолиты. В случае антибиотиков большинство микроорганизмов в процессе тропофазы чувствительно к собственным антибиотикам, однако во время идиофазы они становятся к ним устойчивыми. Чтобы уберечь микроорганизмы, продуцирующие антибиотики, от самоуничтожения, важно быстро достичь идиофазы и затем культивировать микроорганизмы в этой фазе.
Антибиотики -самый большой класс фармацевтических соединений, синтез которых осуществляется микробными клетками. К этому же классу относятся противогрибковые агенты, противоопухолевые лекарства и алкалоиды. Экономическая важность антибиотиков наглядно проявляется в стоимости мирового сбыта четырех наиболее распространенных групп антибиотиков пенициллинов, цефалоспоринов, тетрациклинов и эритромицинов: в 1978 г. она составляла свыше 4 млрд. долл.
Шесть родов филаментозных грибов производят около 1000 различных антибиотиков, в том числе цефалоспорины (Cephalosporium) и пенициллины (Penicillium). Два рода нефиламентозных бактерий синтезируют 500 антибиотиков, а три рода актиномицетов -около 3000 антибиотиков. Среди актиномицетов наибольший вклад вносит род Streptomyces, включая тетрациклины (один только вид Streptomyces griseus синтезирует более пятидесяти антибиотиков). В 1945 г. Бротзу из Института гигиены в Кальари (Сардиния) выделил из пробы морской воды плесень Cephalosporium acremonium, синтезирующую несколько антибиотиков; один из них, цефалоспорин С особенно эффективен против устойчивых к пенициллину грамположительных бактерий.
В период между концом 1940-х и началом 1970-х гг. количество ежегодно открываемых антибиотиков возрастало линейно: ежегодно описывали примерно 200 новых соединений. В конце 1970-х гг. антибиотики обнаруживали со скоростью 300 соединений в год, из них 150 продуцировались актиномицетами.
К 1978 r. из 5500 известных антибиотиков в продаже имелись только 100, большая часть которых (69) была получена из стрептомицетов. Наиболее распространенными с коммерческой точки зрения оказались пенициллины, цефалоспорины и тетрациклины. Из общей стоимости сбыта антибиотиков, в 1978 г. составляющей 4,2 млрд. долл., около 1 млрд. долл. приходилось на долю пенициллинов, примерно 500 млн. долл.-на долю цефалоспоринов и 1 млрд. долл. на долю тетрациклинов. В 1980 г. мировое производство антибиотиков составляло примерно 25 000 т, из них 17 000 т-пенициллины, 5000 т тетрациклины, 1200 т-цефалоспорины и 800 т эритромицины.
Начиная с середины 1%0-х гг. в связи с возросшей сложностью выделения эффективных антибиотиков и распространением устойчивости к наиболее широко применяемым соединениям у большого числа патогенных бактерий исследователи перешли от поиска новых антибиотиков к модификации структуры уже имеющихся. Они стремились повысить эффективность антибиотиков, найти защиту от инактивации ферментами устойчивых бактерий и улучшить фармакологические свойства препаратов. Большинство исследований было сосредоточено на пенициллинах и цефалоспоринах, структура которых включает четырехчленное β-лактамное кольцо. Добавление к β-лактамному кольцу метоксильной (СН3O–)-группы привело к появлению цефамицинов, близких к цефалоспоринам и эффективных как против грамотрицательных, так «против пенициллинустойчивых микробов. Полусинтез состоит в замене химическим путем одной боковой цепи β-лактамного кольца на другую в полученной ферментацией молекуле.
В случае пенициллинов полусинтетический подход реализуется для пенициллина G, который непрерывно синтезируется Penicillium chrysogenum в присутствии фенил-уксусной кислоты. Например, 14 ферментеров емкостью 100 000 л производят после 200 ч ферментации и 15 ч экстракции и очистки натриевую соль пенициллина G 99,5%-ной чистоты. Фенилуксусная кислотапредшественник бензильной боковой цепи молекулы антибиотика. Пенициллин G вводят в ферментационный бульон бактерий, секретирующих ацилазы. Эти ферменты удаляют бензильную группу молекулы, в результате появляется 6-аминопенициллановая кислота (6-АРК). Эта кислотаслабый антибиотик, но она очень удобна для присоединения боковых групп, которые повышают активность антибиотика (рис. 10-12).
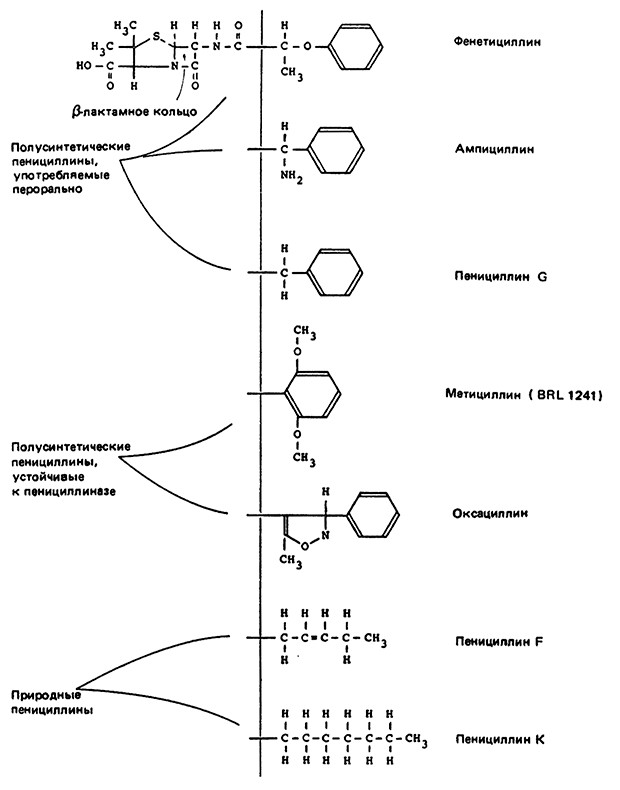
Рис. 10. Структура некоторых природных и полусинтетических пенициллинов.
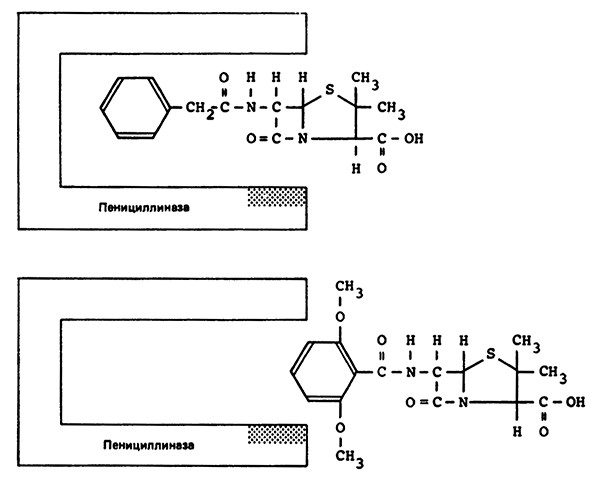
Рис. 11. Действие пенициллиназы.
Пенициллин индуцирует синтез пенициллиназы, которая его разрушает, а метициллин (BRL 1241), который также индуцирует синтез фермента, не разрушается из-за особой структуры боковой цепи молекулы антибиотика.

Рис. 12. Разрушение пенициллина пенциллиназой (β-лактамазой).
В случае цефалоспорина С полусинтетический подход состоит в присоединении боковых цепей к 7-α-аминоцефалоспориновой кислоте (7-АСА), которую получают, удаляя амидную боковую цепь цефалоспорина С. Таким путем получают набор полусинтетических цефалоспоринов (рис. 13).
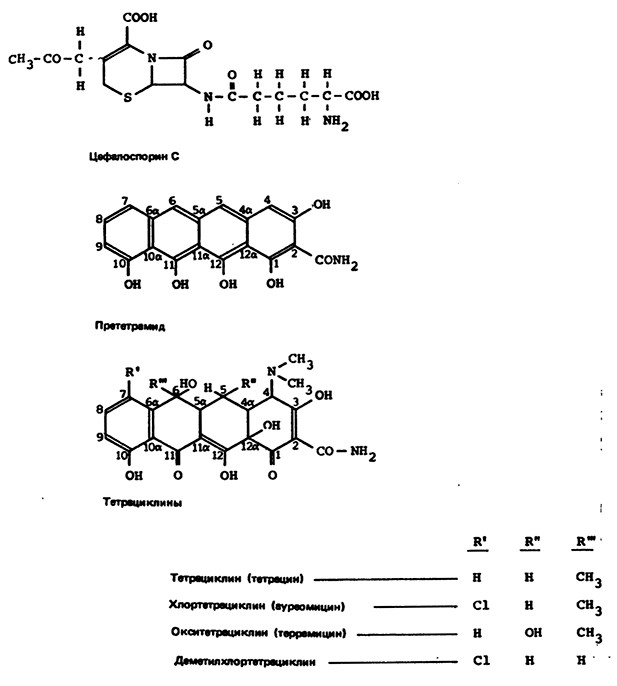
Рис. 13. Структура основных тетрациклинов, прететрамида и цефалоспорина С.
К 1974 г. производство полусинтетических антибиотиков достигло следующих объемов: пенициллинов - 20 000, цефалоспоринов - 4000, тетрациклинов - 2500, рифамицинов - 1000, канамицинов - 500, хлорамфениколов - 500 т.
Устойчивость к пенициллинам и цефалоспоринам связана с наличием ферментов, так называемых βлактамаз, которые широко распространены среди бактерий, актиномицетов, цианобактерий и дрожжей. Так как гены, кодирующие эти ферменты, находятся в составе плазмид, устойчивость может передаваться при переносе плазмид от одного бактериального штамма к другому. Исследователи фирмы «Мерк, Шарп и Доум» открыли новый класс β-лактамных антибиотиков, тиенамицины, продуцируемых Streptomyces cattleya. Тиенамицины чрезвычайно эффективны против грамположительных и грамотрицательных бактерий, а также способны ингибировать β-лактамазы, что значительно повышает возможности этих антибиотиков. К ингибиторам β-лактамаз относятся также клавулановая и оливановая кислоты, идентифицированные исследователями английской фармацевтической компании «Бичем». Компания вьшустила новый антибиотик, аугментин, который представляет собой комбинацию лактамного антибиотика амоксициллина и клавулановой кислоты.
Антибиотики вырабатываются в результате совместного действия продуктов 10-30 генов, поэтому практически невозможно обнаружить отдельные спонтанные мутации, которые могли бы повысить выход антибиотика с нескольких миллиграммов на литр в штамме дикого типа до 20 г/л и более пенициллина или тетрациклина в промышленных штаммах Penicillium chrysogenum или Streptomyces auerofaciens. Эти высокопродуктивные штаммы были получены в результате последовательных циклов мутагенеза и селекции. После того как микробная культура обрабатывалась мутагеном, исследовались и проверялись тысячи колоний, образованных выжившими клетками. Когда обнаруживали мутанта, дающего большее количество антибиотика, он становился исходным материалом для новых циклов мутагенеза и скрининга. Тем самым эволюция микроорганизма направлялась в неестественную для него сторону до тех пор, пока не удавалось получить высокопродуктивные штаммы.
На первом этапе работы по увеличению выхода пенициллина в штамме Penicillium chrysogenum (NRRL-1951), который производил 60 мг/л пенициллина, была отобрана спонтанная мутация, приведшая к возникновению штамма (NRRL-1951•B25) с выходом пенициллина 150 мг/л (Управление сельскохозяйственными лабораториями США, Пеория, шт. Иллинойс). После рентгеновского облучения был выделен мутант (Х-1612), дающий 300 мг/л пенициллина (Институт Карнеrи, Вашингтон, и Миннесотский университет, Миннеаполис). Исследователи из Висконсинского университета подвергли этот штамм ультрафиолетовому облучению и выделили штамм (WIS Q-176), который давал 550 мr/л пенициллина. Штамм WIS Q-176 послужил исходным материалом для нескольких циклов мутагенеза и селе ции, в которых помимо ультрафиолетового облучения применяли иприт. В лабораториях фирмы «Эли Лилли» из одного из штаммов, выведенного в Висконсинском университете, удалось вьmести еще более высокопродуктивный штамм (Е-15·1), который производил 7 г/л пенициллина. В качестве мутагена в этом случае выступал иприт.
Итак, 21 цикл мутагенеза и селекции, продолжавшийся более двух десятков лет, позволил четырем группам исследователей увеличить выход пенициллина в 55 раз. Такой выход был следствием не только мутационных экспериментов, но и улучшения техники ферментации. С тех пор технологические усовершенствования и дальнейшая селекция позволили добиться промышленного выхода пенициллина 20 г/л и более, что в 10 000 раз превышает выход, полученный в 1941 г. Флори, Чейном и их коллегами в Оксфордском университете. Генетический скрининг был также значительно усовершенствован при помощи автоматических методов проверки тыtяч выживших после индуцированного мутагенеза ·клеток для выявления высокопродуrр-ивных мутантов.
В результате мутаций появились новые вторичные метаболиты, в том числе 6-деметилхлортетрациклин и 6-деметилтетрациклин. Определенные мутанты, так называемые идиотрофы, способны синтезировать только половину молекулы антибиотика, а среда должна быть обогащена другой ее половиной. Такая форма мутационного биосинтеза привела к открытию новых производных антибиотиков, среди них принадлежащие к аминоциклитольной группе.
Группа ученых во главе с Хопвудом (Институт Джона Иннеса, Норвич, Великобритания) обнаружила, что синтез некоторых антибиотиков, осуществляемый различными видами Streptomyces, определяется не хромосомными генами, а плазмидой. Ввведение в одну клетку Streptomyces нескольких плазмид такого типа могло бы способствовать объединению различных метаболических путей и биосинтезу новых антнбиотиков.
Число противоопухолевых веществ микробного происхождения довольно ограниченно. Блеомицин, выделенный Умезавой с сотр. в Токийском институте микробной химии из культур Streptomyces Nrddllus представляет собой гликопептид, который действует, разрывая ДНК опухолевых клеток и нарушая репликацию ДНК и РНК. Другая группа противоопухолевых агентов создана на основе комбинации аминогликозидной единицы и молекулы антрациклина. Недостатком обоих соединений является их потенциальная опсность для сердца.
Производство ферментов
Поскольку ферменты представляют собой макромолекулы, активность которых зависит от их первичной структуры, т. е. от последовательности аминокислот, крупномасштабный химический синтез не всегда возможен и желателен. Поэтому ферменты экстрагируют и животных и растительных клеток или производят при помощи микроорганизмов. За исключением папаина, который экстрагируют из плодов папайи и который служит размягчителем мяса, все остальные ферменты, используемые в промышленных или полупромышленных процессах, имеют микробное происхождение. В наибольших количествах производятся четыре типа ферментов: протеазы, глюкоамилаза, α-милаза и глюкозоизомераза. Для гидролиза крахмала, пивоварения, производства фруктовых соков, хлеба, молока, вина и моющих средств нужны, большие количества ферментов, производимых микроорганизмами (табл. 9).
Таблица 9. Области промышленного использования микроорганизмов и применение оаювиьп микробиых ферментов (основные виды микробов)



В 1980 г. было произведено 530 т протеаз, 350 т rлюкоамилазы, 320 т α-амилазы и 70 т глюкозоизомеразы. В этом промышленном производстве доминируют европейские фирмы: только компании «Ново индастри» (Дания) и «Гист-Брокейдз» (Нидерланды) контролируют 60% мирового рынка.
Микроорганизмы очень удобные источники ферментов, так как концентрация ферментов в клетке может быть значительно повышена за счет воздействия на условия роста или генетических манипуляций. Среди других преи wуществ микроорганизмов необходимо отметить скорость роста, способность расти на недорогих средах и существование различных ферментов, катализирующих одну и ту же реакцию, в разных штаммах (что позволяет варьировать условия процесса ферментац и в соответствии с физико-химическими свойствами ферментов).
Микробные ферменты все активнее заменяют растительные и животные ферменты. Так, амилазы из Bacillus и Aspergillus заменили аналогичные ферменты из пшеничного солода и ячмечя в пивоварении, хлебопечении и производстве сухого печенья, а также в текстильной промышленности; протеазы из Aspergillus-живoтныe и растительные протеазы, употребляемые для размягчения мяса; протеазы из Aspergillus и Bacillus licheniformis заменили панкреатические протеазы в процессе размягчения кожи (дубления) и в производстве моющих средств; реннины из Мисоr - сычужный фермент из желудка телят в сыроварении.
Наглядной демонстрацией роли ферментов, синтезируемых микробами, служит процесс превращения зернового крахмала в смесь глюкозы и фруктозы или в высокофруктозную зерновую патоку, которая заменяет сахарозу при подслащивании безалкогольных напитков и других пищевых продуктов. Этот процесс происходит в три этапа, на которых последовательно действуют а-амилаза, глюкоамилаза и глюкозоизомераза. В 1980 г. мировое производство фруктозной зерновой патоки достигало 2 млн. т, причем более половины этого количества производилось в США.
Выход конечного продукта при таком превращении зависит от эффективности получения необходимых ферментов. Маруо и его коллеги в Университете Нихон добились 200-кратного увеличения выхода α-амилазы из Bacillus subtilis, сочетая традиционные методы мутагенеза и селекции с методами генной инженерии. Японские исследователи обнаружили ряд уровней регуляции синтеза фермента, координированное изменение которых значительно увеличивает выход α-амилазы в отобранных штаммах В. subtilis. Если фермент может катализировать гидролиз крахмала при более высоких температурах, производство подслащивающих добавок ускорится. Шиномийя с сотр. (Токийский университет) добились повышенного выхода термостабильной а-амилазы путем введения гена α-амилазы из термофильной бактерии в клетки В. subtilis. Повышения производства фруктозной патоки можно добиться также, объединив все три этапа процесса в один. Это потребует включения генов всех трех ферментов в хромосому одного микроорганизма; в итоге крахмал превратится в фруктозную патоку в одном ферментационном чане.
Среди других ферментов, применение которых представляет интерес, следует отметить аминоацилазу, которая используется для разделения смесей аминокислот на Dи L-изомеры, пенициллинацилазу, идущую на производство полусинтетических пенициллинов, β-галактозв,цазу, осуществляющую гидролиз лактозы в глюкозу и галактозу, а также целлюлазы, гемицеллюлазы и ферменты деградирующие лигнин. Среди 2000 ферментов, описанных в специальной литературе, только 200 пригодны для промышленного использования.
Ряд ферментов играет все возрастающую роль в медицинской диагностике. Так, холестериноксидаза позволяет определить уровень холестерина в сыворотке крови, а уреаза-уровень мочевой кислоты. В исследованиях по генной инженерии используются рестрикционные эндонуклеазы, которые разрезают ДНК, и лигазы, сшивающие разрезанные концы ДНК. Группе американских исследователей во главе с Дэвисом (Медицинская школа Станфордского университета) удалось повысить выход лигазы в 500 раз за счет введения нескольких копий лигазного гена в клетки Е. coli. Пренатальную диагностику серповидноклеточной анемии можно осуществить, обрабатывая рестрикционными эндонуклеазами ДНК зародышевых клеток амниотической жидкости вместо тоrо, чтобы отбирать пробы крови зародыша.
Полученные микробиологическим путем ферменты могут также найти важное применение в производстве пластмасс; в 1980 г. годовой доход этой отрасли промышленности составлял 50 млрд. долл. Некоторые пластмассы создаются полимеризацией окислов алкенов, т. е. окислов прямоцепочечных углеродных соединений, содержащих по крайней мере одну двойную связь. Окислы алкенов химически синтезируются из нефтехимикатов, однако Нейдлмен из корпорации «Цетус» разработал ферментативный синтез окиси пропилена. По мнению президента корпорации, этот ферментативно произведенный продукт может быть коммерчески освоен до 1990 г., прибыль от его сбыта в мире может достигнуть 2-3 млрд. долл. В синтезе участвуют три фермента: пиранозо-2-оксидаза из гриба базидиомицета Oudemansiella mucida, которая катализирует образование перекиси водорода, используя в качестве субстрата и источника энергии глюкозу; галопероксидаза из другого гриба, Caldariomyces, которая катализирует объединение перекиси водорода с алкеном и ионом галогена (фтора, хлора или брома), так что образуется алкен, соединенный с гидроксильной (ОН) группой и галогеном; эпоксидаза из FlavoЬacterium, которая удаляет водород с гидроксильной группы и галоген-ион с окисла алкена. Преимущества такоrо ферментативного синтеза над химическим состоят в следующем. Ион галогена может быть введен в виде простой соли, например хлористого натрия, что дешевле, чем использовать элементарный галоген, который требуется для химического синтеза. Побочные продукты, образующиеся в процессе биосинтеза, в частности фруктоза и глюконовая кислота, очень полезны: первая в силу своей высокой подслащающей способности, вторая, так как она добавляется к посудомоющим средствам и препятствует оседанию солей кальция и магния. Кроме того, превращение глюкозы сначала в глюкозон и затем во фруктозу происходит со 100%-ным: выходом, тогда как максимальный выход при гидролизе крахмала во фруктозную патоку составляет 50%. Изменяя субстрат галопероксидазы, можно получить различные окислы алкенов, такие, как окись проnилепа для получения полипропилена или окись этилена для полиэтилена. Еще одним преимуществом биосинтеза является отсутствие загрязнения окружающей среды, так как галоген может быть использован в повторных циклах. Методами генной инженерии можно повысить выход трех рассмотренных ферментов из соответствующих микробов и в дальнейшем модифицировать их активные центры для усиления каталитической активности. Такуюзадачу в числе прочих ставит перед собой корпорация «Цетус».
Иммобилизация ферментов сулит следующие преимущества: возрастание стабильности, оптимизацию рН для каталитической активности, получение более чистых продуктов реакции, облегчение восстановления и повторного использования биокатализаторов, сниженное ингибирование ферментов.

