Одно из направлений клеточных технологий – это использование их в селекции, которое облегчает и ускоряет традиционный селекционный процесс в создании новых форм и сортов растений. Существующие методы культивирования изолированных клеток и тканей in vitro условно можно разделить на две группы.
Первая группа – это вспомогательные технологии, которые не подменяют обычную селекцию, а служат ей. К ним можно отнести: оплодотворение in vitro (преодоление прогамной несовместимости), культивирование семяпочек и незрелых гибридных зародышей (преодоление постгамной несовместимости), получение гаплоидов путем культивирования пыльников и микроспор, криосохранение изолированных клеток, тканей и органов, клональное микроразмножение отдаленных гибридов.
Вторая группа методов ведет к самостоятельному, независимому от традиционных методов селекции, получению новых форм и сортов растений: клеточная селекция с использованием каллусной ткани, соматическая гибридизация (слияние изолированных протопластов и получение неполовых гибридов), применение методов генной инженерии.
Вспомогательное использование методов in vitro в селекции растений
В отдаленной гибридизации находят применение такие методы культуры изолированных тканей, как оплодотворение in vitro, эмбриокультура (выращивание изолированных зародышей на искусственных питательных средах), клональное микроразмножение ценных гибридов, а также получение гаплоидов in vitro и криосохранение.
Оплодотворение in vitro (преодоление прогамной несовместимости) проводится в том случае, когда невозможно осуществить оплодотворение между выбранными парами в естественных условиях. Это вызвано несколькими причинами:
1) физиологические (несоответствие во времени созревания пыльцы и т. д.);
2) морфологические (короткая пыльцевая трубка или блокирование ее роста на разных этапах развития и т. д.).
Оплодотворение in vitro можно осуществить двумя способами:
а) культивирование на искусственной агаризованной питательной среде завязи с нанесенной на нее готовой пыльцой;
б) завязь вскрывается, и на питательную среду переносятся кусочки плаценты с семяпочками, вблизи которых или непосредственно на ткани плаценты культивируется готовая пыльца.
Визуально определить, прошло оплодотворение in vitro или нет, можно по быстроувеличивающимся в размерах семяпочкам. Сформировавшийся зародыш, как правило, не переходит в состояние покоя, а сразу прорастает и дает начало гибридному поколению. Плацентарное оплодотворение in vitro позволило преодолеть несовместимость в скрещивании сортов культурного табака N. tabacum с дикими видами N. rosulata и N. debneyi и сделало возможным получение межвидовых гибридов табака в опытах М.Ф. Терновского и др. (1976), И.К. Шинкаревой (1986).
Преодоление постгамной несовместимости. Постгамная несовместимость при отдаленной гибридизации возникает после оплодотворения. Часто при этом образуются щуплые невсхожие семена. Причиной может быть расхождение во времени развития зародыша и эндосперма. Из-за слабого развития эндосперма зародыш бывает неспособен к нормальному прорастанию. В таких случаях из зрелой щуплой зерновки изолируют зародыш и выращивают его в питательной среде.
Выращивание зародышей в искусственной питательной среде называется эмбриокультурой. Среда для выращивания зрелого зародыша может быть простой, без добавок физиологически активных веществ (например, среда Уайта) или любая другая, содержащая минеральные соли и сахарозу. При более отдаленных скрещиваниях нарушения в развитии зародыша могут наблюдаться уже на ранних этапах, что выражается в отсутствии дифференцировки, замедленном росте. В этом случае культура зародыша состоит из двух этапов – эмбрионального рост зародыша, во время которого продолжается его дифференцировка, и прорастания подросшего зародыша. Для первого этапа требуется более сложная по составу среда с повышенным содержанием сахарозы, с добавками различных аминокислот, витаминов и гормонов.
Применение эмбриокультуры в селекции приобретает в последнее время большое значение для получения отдаленных гибридов зерновых, злаковых и других сельскохозяйственных культур. Показана возможность увеличения выхода пшенично-ржаных гибридов путем доращивания незрелых зародышей, а также использования эмбриокультуры для преодоления постгамной несовместимости при гибридизации пшеницы с колосняком.
Метод эмбриокультуры находит все более широкое применение в межвидовой гибридизации овощных растений. Для лука разработаны приемы выращивания in vitro абортивных зародышей от гибридных семян с разных этапов эмбриогенеза, выращивание зародышей от частично фертильных межвидовых гибридов. Культура изолированных зародышей используется в селекции томатов и других овощных растений.
Исследована гормональная регуляция роста и развития зародышей томата in vitro. Обсуждается возможность применения эмбриокультуры для получения отдаленных гибридов подсолнечника, изучаются факторы, контролирующие рост и развитие in vitro зародышей подсолнечника, выделенных в разные сроки после опыления.
Культура изолированных зародышей как вспомогательный метод при отдаленной гибридизации применяется не только для преодоления постгамной несовместимости, но также с целью микроразмножения ценных гибридов. В этом случае микроразмножение идет путем каллусогенеза, индукции морфогенеза и получения растений-регенерантов из каллусной ткани. Техника клонирования незрелых зародышей позволяет размножать ценные генотипы растений на ранних стадиях жизненного цикла. Еще одна возможность применения культуры зародышей – использование ее в клеточной селекции.
Клональное микроразмножение отдаленных гибридов. Эмбриокультура дает возможность вырастить гибридные растения из неполноценных зародышей. Однако выход гибридных растений мал, и гибриды часто бывают стерильны. Иногда, например, при селекции гречихи, трудно воспроизвести в потомстве уникальные генотипы из-за перекрестного опыления культуры. Поэтому перед исследователями часто встает задача – размножить и сохранить полученные растения. В этом помогает метод клонального микроразмножения. Размножают гибриды путем активации развития меристемы пазушных почек (черенкованием стерильных побегов), адвентивными почками или регенерацией растений из каллусной ткани, в частности полученной при культивировании зародышей.
Получение гаплоидов in vitro и использование их в селекции. Роль гаплоидных растений в селекции очень велика. Применение их позволяет быстрее найти нужную комбинацию, сокращает время для создания сорта. Гаплоиды используются для получения стабильных гомозиготных линий. Для мутагенеза также удобнее использовать гаплоиды, поскольку на гаплоидном уровне облегчается отбор рецессивных мутаций.
В диплоидных растениях мутации редко затрагивают оба аллельных гена в гомологичных хромосомах. Особь обычно гетерозиготна (два гена различаются), при этом проявляется действие только доминантного (но не рецессивного) гена. Поскольку мутации чаще рецессивны, чем доминантны, их довольно сложно выявить. В гаплоидных же растениях, которые содержат только одну из каждой пары гомологичных хромосом, мутации проявляются немедленно. Селекция на гаплоидном уровне позволяет вести прямой отбор не только доминантных, но и рецессивных признаков.
Гаплоидные особи стерильны, но можно искусственно удвоить набор их хромосом с помощью колхицина и получить диплоидные гомозиготные растения.
Гаплоиды могут возникать спонтанно, но частота их спонтанного возникновения очень мала. Искусственным путем с использованием методов in vitro удается получить большие количества гаплоидных растений. Существует три способа получения гаплоидов с использованием метода культуры изолированных тканей:
- андрогенез – получение гаплоидных растений на искусственной питательной среде из изолированных пыльников и микроспор (рис. 3.17);
- гиногенез – получение гаплоидных растений на искусственной питательной среде из изолированных семяпочек;
- партеногенез – получение гаплоидов из гибридного зародыша, у которого из-за несовместимости хромосом родителей потеряны отцовские хромосомы.
Рис. 3.17. Прямая регенерация соматических эмбриоидов из изолированных пыльников пшеницы (С.С. Беккужина, 1993)
Образовавшиеся в результате элиминации хромосом отцовского генома гаплоидные эмбриоиды культивируют на искусственных питательных средах и получают гаплоидные растения. Сорта ячменя Исток и Одесская-15 были получены комбинацией партеногенетического метода с культурой изолированных зародышей за четыре года вместо обычных 10–12 лет. Методом культуры пыльников из сортов и гибридов мягкой и твердой пшеницы в НПО «Элита Поволжья» за четыре года получено более 2,5 тыс. дигаплоидных линий, которые характеризуются гомогенностью и стабильностью.
Продолжается разработка технологии получения гаплоидов посредством культуры пыльников пшеницы, ячменя, кукурузы, озимой ржи, картофеля. В культуре пыльников возможны два пути образования гаплоидных растений. Первый – образование растений путем эмбриогенеза в пыльцевых зернах. При этом внутри пыльников из отдельных пыльцевых зерен возникают эмбриоиды. Они прорастают и дают гаплоидные растения. Второй – образование каллуса из клеток пыльника. В дальнейшем в результате морфогенеза из каллусных клеток регенерируют растения. В этом случае образовавшиеся растения не всегда бывают гаплоидными и часто отличаются по плоидности. До конца не выяснено, образуются ли они от полиплоидизированных гаплоидных клеток или от слившихся клеток.
Гаплоиды, полученные in vitro, могут применяться не только в практической селекции, но и в работах по генетической инженерии, а также по клеточной селекции. Пыльцевые зерна являются в некоторых случаях более удобными, чем протопласты, объектами для исследований по генетической трансформации.
Криосохранение растений. Криосохранение соматических клеток растений в жидком азоте (температура –196 °С) – новое направление в биотехнологии, которое широко стало развиваться с начала 70-х годов XX столетия. Цель данной технологии заключается в сохранении в культуре in vitro генофонда, а также в обеспечении селекционеров в любое время генотипом, имеющим искомые признаки: необходимая пыльца для проведения гибридизации; уникальные и единичные семена, в том числе не выносящие обезвоживания; трансформированные, мутантные, гибридные клетки разных видов растений, способных к морфогенезу in vitro; зиготические и соматические зародыши и т. д. В настоящее время разработаны условия криосохранения для культивируемых клеток (более 30 видов), каллусных культур (около 10 видов), изолированных протопластов (8 видов), сохранения меристем (25 видов) и кончиков стебля (13 видов). Приоритет в этом направлении принадлежит Институту физиологии растений РАН и, в частности, отделу культуры тканей и морфогенеза, возглавляемому в настоящее время проф. А.М. Носовым.
При проведении работ по криосохранению необходимо, прежде всего, учитывать специфику растительных клеток; отбирать мелкие клетки, с маленькой вакуолью и пониженным содержанием воды; разрабатывать в каждом отдельном случае подходы замораживания и последующего оттаивания растительных клеток. При криосохранении встречается ряд трудностей, одна из которых связана с защитой замораживаемых клеток и тканей от осмотического стресса и механического разрушения структур в результате образования и роста кристаллов льда внутри клетки. Одновременно с этим необходимо правильно подбирать условия, обеспечивающие высокую выживаемость клеток при оттаивании и рекультивации.
Несмотря на многообразие работ в этом направлении, в них все же наметились общие приемы, лежащие в основе криосохранения: обработка клеток перед замораживанием, применение криопротекторов, соблюдение определенного режима замораживания в интервале от 0 до –40 °С (в редких случаях до –70 °С), а также специальные предосторожности при оттаивании объектов.
Процесс криоконсервации, как правило, начинается с подготовки культуры клеток к замораживанию. Это может быть достигнуто несколькими способами, предусматривающими культивирование клеток на питательных средах, содержащих различные осмотически активные вещества: маннитили сорбит в концентрации 2–6 %, аминокислоты и среди них, в первую очередь, пролин, чье значение для связывания воды в клетках растений широко известно, а также γ-аминомасляная кислота.
Подбор криопротекторов, веществ, уменьшающих повреждение клеток от осмотического и механического стресса, проводят эмпирически по принципу наименьшей токсичности и оптимального эффекта. Среди всех известных криопротекторов выделяются такие легко проникающие в клетки вещества, как диметилсульфоксид (ДМСО, 5–10 %), глицерин (10–20 %), атакже непроникающие высокомолекулярные – поливинилпиролидон (ПВП), декстран, полиэтиленгликоль (ПЭГ) с молекулярной массой 6000.
Большое значение при криосохранении имеет правильно подобранный режим замораживания от 0 до –40 °С. Как правило, для всех объектов устанавливается скорость замораживания 0,5–1 °С в минуту и всю эту работу проводят на специальном оборудовании, обеспечивающем программное замораживание. Такие приборы выпускает специальное конструкторское технологическое бюро с опытным производством при Институте проблем криобиологии и криомедицины (г. Харьков).
Таким образом, медленное замораживание и использование криопротекторов позволяет освободить клетку от свободной воды, и при -40°С клетки становятся полностью обезвоженными, что дает возможность проводить дальнейшее замораживание, а именно погружать ампулы с растительным материалом в жидкий азот.
Хранение материала в жидком азоте практически не лимитировано. Например, в криобанке Института физиологии растений РАН хранятся клетки моркови, которые находятся в жидком азоте около 20 лет, меристемы картофеля – более 10 лет и др.
Оттаивание и проверка жизнеспособности клеток после хранения в жидком азоте является последним этапом технологии криосохранения. Если замораживание осуществляют медленно, постепенно, то оттаивание должно быть проведено как можно быстрее. Для этого ампулы помещают в водяную баню с температурой 40°, а иногда и 60 °С и выдерживают до полного исчезновения последнего кристаллика льда.
Для определения жизнеспособности клеток после оттаивания применяют наиболее простой, быстрый и вполне удовлетворительный способ – окраска витальным красителем (0,1 %-м феносафранином или 0,25 %-м раствором сини Эванса), в результате которой мертвые клетки окрашиваются, а живые нет. Окончательным критерием, безусловно, служит четкое возобновление роста и деления клеток при рекультивации на искусственных питательных средах после оттаивания.
Экспериментально было показано, что клетки после хранения в жидком азоте не теряют способности к делению, регенерации растений, не уменьшается продуктивность синтеза вторичных метаболитов (клетки продуценты) и т. д. Так, Институтом физиологии растений РАН совместно с НПО по картофелеводству разработаны методы криосохранения меристем четырех сортов картофеля и показана возможность из 20 % хранящихся меристем регенерировать целые растения, которые при высадке в поле не отличались по всем признакам, включая темпы роста и продуктивность, от обычных пробирочных растений (С. Манжулин и др., 1982). Более подробно о технике криосохранения можно узнать из обзорных работ А.С. Попова.
Таким образом, технология, связанная с криосохранением растительных объектов, развивается и постоянно совершенствуется. Несомненно, эта технология имеет свое будущее, так как уже сегодня криобанки могут значительно облегчить работу селекционеров, предоставив им возможность широко использовать пул генов сортов, в том числе старой селекции и диких видов, а также исчезающих видов растений.
Клеточная селекция растений
Сомаклональная вариабельность. Клеточная селекция растений in vitro – метод выделения генетически модифицированных мутантных клеток и сомаклональных вариаций при помощи селективных условий. Значительный интерес представляет вопрос об использовании клеточной селекции в комплексе с получением сомаклонов. Одна из наиболее сильных сторон культуры in vitro в создании технологий для сельского хозяйства – возможность на основе сомаклональных вариаций или индуцированных мутаций отбирать в жестких селективных условиях клетки, характеризующиеся искомыми признаками.
Для проведения клеточной селекции используют следующие приемы:
- прямая (позитивная) селекция, при которой выживает лишь определенный искомый мутантный тип клеток;
- непрямая (негативная) селекция, основанная на избирательной гибели неустойчивых делящихся клеток, но требующая дополнительной идентификации у них мутационных изменений;
- тотальная селекция, при которой индивидуально тестируются все клеточные клоны;
- визуальная селекция и неселективный отбор, когда вариантная линия может быть идентифицирована среди всей популяции клеток визуально или при использовании биохимических методов (тонкослойная или жидкостная хроматография, радиоиммунный анализ, микроспектрофотометрия и др.).
Из перечисленных выше приемов клеточной селекции прямая селекция является наиболее распространенным методом и используется главным образом для выделения растений-регенерантов, устойчивых, например, к гербицидам, антибиотикам, токсинам, тяжелым металлам, солям и другим антиметаболитам.
Для проведения работ по клеточной селекции растений в условиях in vitro в качестве объекта исследования могут быть использованы каллусные, суспензионные культуры или изолированные протопласты. Выбор объекта зависит от наличия разработанных технологий применительно к различным видам растений, а также от конечных целей исследования.
Каллусная ткань представляет собой легко доступный материал, который наиболее часто используют для клеточной селекции. Как правило, работу проводят на первичной или пересадочной каллусной ткани, которая не утрачивает способности к регенерации на протяжении ряда субкультивирований. Однако при работе с каллусными культурами многие исследователи отмечают существенные недостатки данного объекта: медленный рост ткани, неравноценное для всех клеток действие токсических веществ, которые применяются в качестве селективного фактора, а также потеря регенерационной способности в процессе культивирования каллусных клеток. Несомненно, проводить селекцию целесообразно на уровне одиночных клеток (суспензионная культура, протопласты). Однако для многих видов растений не разработаны эффективные технологии и способы культивирования одиночных клеток. Поэтому, несмотря на перечисленные выше недостатки использования каллусных культур, этот способ селекции остается для некоторых видов растений пока единственным.
Получение стабильно устойчивых линий – процесс длительный. Как правило, селекция начинается с получения достаточного количества каллусной массы из изолированных растительных эксплантов, использующейся в дальнейшем для определения концентрации селективного фактора (построение дозовой кривой), при которой наблюдается одновременно рост каллусной ткани, и в то же время часть каллусных колоний погибает. Выбранная концентрация селективного фактора признается оптимальной и используется в дальнейших экспериментах. Так как первично полученные на средах с селективными факторами колонии клеток могли возникнуть вследствие физиологической адаптации или определенного состояния дифференцировки клеток и не быть генетически устойчивыми, то в течение последующих 4–6 субкультивирований на селективной среде проверяется стабильность устойчивости полученных клонов. Затем их переносят на среду без селективного фактора и субкультивируют еще 2–3 пассажа. И только после повторного возвращения в селективные условия отбирают стабильные клоны, из которых пытаются получить растения-регенеранты. Однако работы, проведенные с получением растений, устойчивых к повышенным солям, атакже ктоксинам, выделенным из грибов – возбудителей болезней, показали, что устойчивость клетки и растения к исследуемому селективному фактору может совпадать и не совпадать. Прямая корреляция между устойчивостью растений и клеток in vitro отмечена лишь для низких температур, устойчивостью к гербицидам, высоким концентрациям алюминия и другим факторам.
Большое число работ по культивированию каллуса с целью получения нового селекционного материала проведено на пшенице, ячмене, рисе, сорго, а также на картофеле, томатах, люцерне и, крайне редко, на древесных. Уже достигнуты первые положительные результаты по получению растений пшеницы, риса, картофеля, устойчивых к NaCI или Na2SО4. Получены клетки, а из них растения моркови, которые синтезируют в 20 раз больше метионина, в 30 раз – триптофана, в 5 раз – лизина путем добавления в питательную среду токсичных аналогов аминокислот. Для картофеля получены растения, устойчивые к кольцевой гнили. Что касается древесных, то для них работы в этом направлении крайне редки и часто имеют поисковый характер. Таким образом, использование каллусной культуры в селекционных целях открывает огромные возможности в создании новых форм растений, несущих ценные признаки, необходимые для человечества.
Наряду с перечисленными выше объектами (каллусная, суспензионная культура, изолированные протопласты), в качестве исходного материала для селекции могут быть использованы культуры соматических или андрогенных эмбриоидов: такие органогенные экспланты, как сегменты листьев или различные меристематические и стеблевые части растений, а также культура изолированных зародышей. Например, путем культивирования и селекции in vitro зародышей из семян получены растения ячменя, устойчивые к аналогам аминокислот, с улучшенным содержанием белка. Для картофеля разработан эффективный метод обработки побегов и черенков мутагеном, приводивший к получению химерных мутантов хлорофиллдефектности и антибиотикоустойчивости. При культивировании пыльников яровой пшеницы сорта Саратовская 29 и Московская 35 на питательных средах с повышенным содержанием солей хлорида натрия получены соматические эмбриоиды, а в дальнейшем растения-регенеранты, проявившие повышенную солеустойчивость (С.С. Беккужина, 1993).
Таким образом, проведение селекции на клеточном уровне позволяет создавать новые формы растений в 2–4 раза быстрее по сравнению с традиционными способами селекции.
Генетические, эпигенетические и морфофизиологические
изменения клеток при селекции in vitro
Метод культуры изолированных клеток, тканей и органов растений in vitro, широко используемый для решения многих фундаментальных вопросов клеточной биологии, физиологии и генетики растений, в настоящее время находит все большее применение и при создании новых биотехнологий. Начиная с первых работ по культивированию растительных клеток, тканей и органов особый интерес у исследователей вызывал вопрос о том, какие клеточные изменения могут происходить в изолированных клетках, развивающихся на искуственных питательных средах, и причины, их вызывающие. С разработкой техники получения растений-регенерантов из каллусной ткани появилась возможность создавать новые формы растений, отличающиеся как по фенотипическим, так и по генетическим признакам от исходных растений. Такое разнообразие клеточных линий и растений-регенерантов называют «сомаклоны», хотя в 70–80-е годы XX столетия было принято называть растения, регенерировавшие из каллусной ткани, «калликлонами», а из протопластов – «протоклонами».
Генетическая природа и механизм возникновения сомаклональной изменчивости пока мало изучены. Однако можно четко выделить зависимость возникновения сомаклональных вариантов, прежде всего, от генотипической и эпигенетической изменчивости, индуцируемой условиями культивирования in vitro, составом питательных сред и уровнем концентраций солей и регуляторов роста растений, а также от генотипа и исходного экспланта.
Дифференцированные клетки в нормальном растении могут иметь разную степень плоидности, но для отдельных видов характерно наличие только диплоидных клеток, плоидность которых может изменяться в процессе онтогенеза. Однако в процессе онтогенеза могут возникнуть клетки с разной плоидностью. Например, экспериментально доказано, что в меристемных тканях, наряду с факторами видового постоянства числа хромосом, почти у 80 % покрытосеменных растений в процессе дифференцировки в соматических клетках может происходить эндоредупликация хромосом и формирование тканей различного уровня плоидности. Для вегетативно размножаемых и апомиктичных растений характерно образование с высокой частотой анеуплоидных клеток. Усиление хромосомных перестроек, приводящих к появлению химерности и миксоплоидии у растений, наблюдается при изменении условий произрастания, особенно при их резком ухудшении: засоление почв, повышенные или пониженные температуры, применение гербицидов или пестицидов, минеральных удобрений в повышенных дозах. Эти и другие факторы могут приводить к физиологическим нарушениям, связанным, в первую очередь, с появлением аномальных митозов и формированием клеток с числом хромосом, отличающихся от такового в материнской ткани.
Цитологические исследования показали, что вариабельность, индуцируемая условиями культивирования in vitro, связана с генетическими изменениями. Прежде всего одним из основных источников появления фенотипических вариантов являются различные кариологические изменения и перестройки (З.Б. Шамина, 1989). Однако выявить, какие из них будут иметь фенотипический эффект и наследоваться как стабильная мутация генов, часто сложно. Как грубые, так и тонкие хромосомные изменения могут вызывать существенные фенотипические изменения как в растениях-регенерантах, так и в последующем потомстве. Хромосомные изменения часто наблюдаются при мейозе. Анализ мейоза клетки в регенерантах показал такие интенсивные перестройки хромосом, как транслокация, инверсия, субхроматидный обмен, частичная утрата хромосом.
Некоторые случаи соматической изменчивости могут быть объяснены соматическим кроссинговером, который индуцируется условиями культуры тканей. Например, при культивировании сои в условиях in vitro частота соматического кроссинговера увеличивалась от 5,7 • 10-5 до 7,7 • 10-6. В этом случае обмены происходят несимметрично или даже между негомологичными хромосомами, причем в условиях культуры частота сестринских обменов очень велика. Мелкие делеции часто обусловливают потерю гена, например выпадение доминантной аллели, следствием чего часто бывают рецессивные мутации. В литературе это явление названо культуральным индуцированием гемизигот (Л.A. Лутова, 2003). Это также является доказательством того, что большая часть фенотипических изменений обусловлена генетическими механизмами.Генетическая природа сомаклональных изменений может быть успешно установлена при помощи анализа фрагментов рестрикции ДНК, который в настоящее время широко используется для классификации и идентификации разновидностей, биоформ и даже сомаклональных вариантов. Одной из основных задач, связанных с проблемой изучения сомаклональных вариантов, является разработка методов, позволяющих выявлять генетические различия между регенерантами, полученными из каллусной ткани или из клеток, подвергшихся действию стрессового фактора.
Ранее молекулярный анализ сомаклональных вариантов проводился с использованием метода RFLP (restriction fragment length polymorphism), основанном на выявлении полиморфизма рестрикционных фрагментов ДНК. Показано, что метод RFLP может быть использован для классификации и идентификации сомаклональных вариантов. При помощи этого метода был выявлен полиморфизм сомаклональных регенерантов кукурузы, полученных из каллусной культуры, который выражался в изменении копийности гена и ряда других небольших изменений специфических локусов; приведены данные о перестройках нуклеотидной последовательности и метилировании ДНК у растений риса, полученных из каллусной ткани.
В настоящее время наибольшее распространение при анализе генома растений приобрел метод RAPD PCR (random amplyfied polymorphic DNA polymerase chain reaction), основанный на амплификации геномной ДНК при помощи случайных десятичленных праймеров. Метод RAPD по сравнению с методом RFLP является более дешевым и быстрым и не требует большого количества растительного материала для анализа, что позволяет анализировать индивидуальные растения и отдельные каллусы.
Молекулярные методы исследования применяются, например, для определения уровня геномного полиморфизма у длительно культивируемых клеточных культур. На примере сахарного тростника, а также ряда других культур было показано, что RAPD-спектры растений-регенерантов, полученных из каллусной ткани, культивируемой в условиях in vitro в течение двух лет, более полиморфны, чем спектры растений-регенерантов, полученных из молодых эмбриональных культур.
Высокая разрешающая способность метода RAPD позволяет обнаружить изменения наследственной информации клеток на разных этапах их культивирования, что может способствовать изучению природы сомаклональной изменчивости.
Сказанное выше позволяет утверждать, что при клональном микроразмножении, клеточной селекции или при получении веществ вторичного синтеза для различных культур следует учитывать возможность возникновения сомаклональной изменчивости в процессе их длительного культивирования in vitro.
Кроме сомаклональной вариабельности, связанной с наследуемыми перестройками генома, отмечены фенотипические изменения («эпигенетические»), которые могут стабильно передаваться дочерним клеткам, но не проявляться в растениях-регенерантах или их половом потомстве (рис. 3.18).
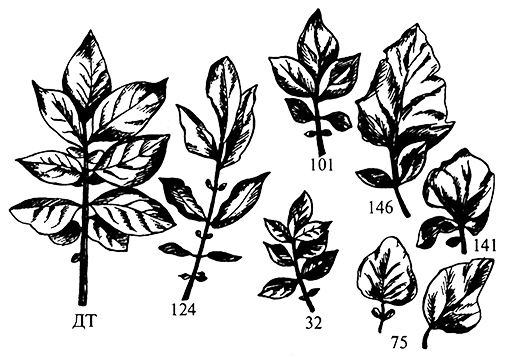
Рис. 3.18. Изменение формы листьев у сомаклональных вариантов картофеля сорта Смена.
ДТ – исходный тип, цифрами обозначены номера различных линий (JI. Хромова и др., 1984)
Высокая степень разнообразия сомаклонов зависит от исходного генотипа, природы и стадии развития экспланта. Например, у различных злаков степень изменчивости среди сомаклонов может значительно различаться: у пшеницы (2n = 6х = 42) из 192 исследованных растений-регенерантов 29 % были анеуплоидными, у гексаплоидного овса (2n = 6х = 42) выявлены цитогенетические изменения с такой же частотой, а для кукурузы частота возникновения анеуплоидных растений не превышала 2–3 %. Образование полиплоидных и анеуплоидных растений может наблюдаться и у других видов, например, на картофеле. Причем частота появления новых вариантов у диких видов значительно ниже, чем у дигаплоидных линий культивируемого картофеля.
Тип исходного экспланта также влияет на появление сомаклональных вариантов, отличающихся количественными и качественными признаками. Для картофеля, например, аномальные растения получены в 12 % случаев при использовании в качестве первичного экспланта мезофильных тканей листа, а в случае использования лепестков или оси соцветий частота формирования растений с фенотипическими отклонениями от нормы составила 50 %.
Условия культивирования и, в частности, нарушение гормонального баланса питательной среды – одна из причин возникновения генетического разнообразия культивируемых клеток вследствие нарушения клеточного цикла, в частности митоза. От соотношения фитогормонов, входящих в состав питательных сред, во многом зависит цитогенетическая структура клеточных популяций. Одним из наиболее вероятных путей влияния фитогормонов на репрессию и дерепрессию генов является метилирование ДНК, вызывающее усиление или ослабление экспрессии соответствующих генов или полное прекращение их функционирования на том или другом этапе органогенеза. Количество присоединившихся или освободившихся метальных групп, места их локализации в боковых ветвях структур нуклеотидных последовательностей ДНК оказывают при этом существенное влияние на функциональную активность генов, в состав которых входят указанные структуры. Изменения в характере метилирования ДНК влияют на процессы гетерохроматизации и компактизации хромосомного материала. Как известно, гетерохроматиновым участкам свойственна задержка репликации, что может приводить к возникновению анафазных мостов и индукции хромосомных разрывов. В свою очередь, хромосомные разрывы могут активировать мобильные генетические элементы и повышать мутабильность культивируемых клеток растений (Л.A. Лутова, 2003). Известно, что мобильные элементы могут инактивировать структурные гены, изменять генную регуляцию, реактивировать молчащие гены и генерировать дупликации и делеции. Шок развития (выражение П. Ларкина применительно к условиям культивирования in vitro) могут индуцировать транспозиции мобильных элементов, которые являются эффективным способом повышения адаптивности клеток к стрессовым условиям.
В настоящее время известны ферменты, например, ДНК-метилаза, ответственные за метилирование ДНК в соответствии со следующим уравнением реакции:
ДНК + S-аденозилметионин → Метил-ДНК + S-аденозилгомоцистеин.
С этим процессом связаны многочисленные факты возникновения так называемых эпигенетических, ненаследуемых изменений у растений.
Морфологическая и цитогенетическая разнокачественность клеточных популяций может возникнуть и вследствие влияния отдельных компонентов питательной среды: некоторых минеральных солей, сахарозы или другого источника углеродного питания, витаминов, растительных экстрактов, а также от режима выращивания. Длительное культивирование клеток in vitro также способствует повышению генетического разнообразия сомаклонов. Причем для некоторых видов показано, что, несмотря на присутствие в культуре in vitro клеток разной плоидности, регенерировавшие растения были преимущественно диплоидными. Это явление было объяснено тем, что в процессе культивирования отбирались растения-регенеранты с более или менее нормальной морфологией, которые регенерировали, как правило, в первую очередь.
Различные типы морфогенеза – соматический эмбриогенез или органогенез – также могут по-разному сказываться на генетических изменениях и соответственно на фенотипе растений. Экспериментально установлено, что при соматическом эмбриогенезе время прохождения цикла клетка – растение значительно короче, чем при органогенезе, поэтому степень сходства получаемого материала и исходного родительского генотипа может быть значительно выше.
На примере растений-регенерантов кукурузы было показано многообразие природы сомаклональной изменчивости (Ю.И.Долгих, 2005). У растений-регенерантов, полученных из длительно культивируемых каллусных тканей, обнаружены:
1) ненаследуемые модификации, нормализующиеся в процессе онтогенеза;
2) изменения экспрессии генов (как наследуемые, так и ненаследуемые);
3) истинные мутации, связанные с изменением первичной структуры ДНК.
Относительная цитогенетическая стабильность растений-регенерантов позволяет сделать заключение, что причиной значительной вариабельности морфологических и физиологических признаков не являются крупные хромосомные нарушения. Напротив, высокая частота вариабельности ДНК-маркеров свидетельствует о наличии точковых мутаций или микрохромосомных перестроек. Проявление сомаклональных вариаций в гомозиготной форме, нестабильность наследования отдельных признаков указывают, возможно, на участие в становлении сомаклональной изменчивости процессов митотической и мейотической рекомбинации или активации мобильных генетических элементов.
Вероятность проявления различных сомаклональных вариаций неодинакова. По-видимому, наиболее характерным типом сомаклональных изменений являются вариации, так или иначе связанные с дифференциацией и дедифференциацией. Возможно, не последнюю роль играют в этом случае изменения гормонального баланса. Процесс введения в культуру in vitro и последующая регенерация растений индуцируют множественные нарушения экспрессии генов. У самоклонов это проявляется в виде аномалий развития, нарушений тканевой специфичности. Частота подобных изменений достигает у некоторых сомаклонов 100 %. Высокая вариабельность in vitro количественных полигенных признаков (десятки процентов), изменчиво вость большинства качественных признаков, не связанных с развитием, на несколько порядков ниже (Ю.И.Долгих, 2005).
Таким образом, частота, природа изменчивости, стабильность и наследование в половом потомстве генетической и эпигенетической изменчивости различны (табл. 3.8).
Таблица 3.8. Генетическая н эпигенетическая изменчивость (по Р.Г. Бутенко, 1999)

Таким образом, имеющиеся данные свидетельствуют о том, что клетки растений, культивируемые в условиях in vitro, подвергаются ряду генетических, эпигенетических и морфофизиологических изменений. Сохранение клетками генетической стабильности может рассматриваться лишь как исключение. Прямые цитологические наблюдения за числом и структурой хромосом клеток растений свидетельствуют, что кариотип культивируемых клеток легко подвергается модификации. Часть таких клеток погибает, часть может размножаться и вытеснять нормальные клетки. Установлено, что клетки с измененными кариотипами могут обладать морфогенетическими потенциями и давать начало растениям-регенерантам с измененными числом и структурой хромосом. Размер и частота хромосомных нарушений в клетках растений, культивируемых на искусственных питательных средах, достаточно велики.
Установлено, что кроме изменений числа и структуры хромосом в клетках растений in vitro происходят и генные (точечные) мутации, частота которых достаточно велика и может быть использована для повышения генетического разнообразия культивируемых растений.Сомаклональные варианты имеют практическое применение в сельскохозяйственной практике в силу появления форм, отличающихся от родительских по различным биохимическим, качественным и количественным признакам, а также цитогенетическим характеристикам. Например, получены сомаклоны картофеля сорта Зарево, отличающиеся высокой урожайностью, повышенной устойчивостью к заболеваниям, более высоким содержанием в клубнях протеина и крахмала. Причем наследование важных признаков при размножении клубнями сохранялось в течение трех лет полевых испытаний (В.В. Сидоров и др., 1984,1985). Для растений табака получены через каллусную культуру сомаклоны, устойчивые к вирусу табачной мозаики, а для сахарного тростника получен новый сорт, характеризующийся высокой урожайностью и повышенной устойчивостью к заболеваниям, в частности к болезни Fiji. В настоящее время метод культуры тканей начал широко использоваться в селекции не только кормовых и технических культур, но и декоративных, и лекарственных растений. Примером может служить новый сорт пеларгонии Velvet Rose, полученный через каллусную культуру.
Таким образом, полученные положительные результаты свидетельствуют о необходимости более эффективного внедрения различных приемов получения сомаклональных вариантов в практику селекционной работы, и наиболее реальным является применение сомаклональной изменчивости для улучшения или «доработки» уже существующих сортов или линий по отдельным недостающим признакам.
Получение растений-регенерантов,
устойчивых к абиотическим и биотическим
стрессовым факторам методами клеточной инженерии
Засуха. Недостаток воды в почве наносит значительно больший урон растениеводству, чем все остальные стрессовые факторы, вместе взятые. Засуха приводит к возникновению водного дефицита в почве и соответственно в растениях, вызывая у них водный стресс. Хотя термин «засуха» относится главным образом к почвенному водному стрессу, он включает также воздействие жары на растения. Стресс, вызванный водным дефицитом, может быть первичным в случае засухи, а также вторичным при низкотемпературном, тепловом или солевом стрессах. Стресс, вызванный засухой, ведет к прямым или непрямым повреждениям растений, которые обусловлены инактивацией ферментов, нарушением биохимических путей, накоплением токсических веществ, утечкой ионов, дефицитом питания и другими причинами.
С целью имитации in vitro стрессового эффекта засухи могут применяться питательные среды, которые дополнены осмотически активными веществами, понижающими внешний водный потенциал. В качестве такого селективного агента для селекции на устойчивость к засухе были использованы полиэтиленгликоль (ПЭГ), представляющий собой непроникающее в клетку осмотически активное вещество. Первое сообщение о выделении клеточных линий табака, устойчивых к стрессу, индуцированному ПЭГ, появилось в 1979 г. (Heyser, Nabors, 1979). Позже для селекции на засухоустойчивость Р. Брессан с сотр. использовал клеточные линии томата, которые подвергались водному стрессу при культивировании каллусной ткани в присутствии ПЭГ 6000 в концентрации 15 %. В результате опытов были отобраны устойчивые каллусные линии, однако устойчивость быстро терялась при культивировании каллуса на среде без осмотика, что указывает на физиологическую природу адаптации. Тестирование каллусных линий на рост в присутствии ПЭГ предложено для идентификации выносливых к засухе генотипов сои. Анализ роста каллусных тканей десяти сортов сои на средах с 0,15, 20 % ПЭГ 8000 свидетельствовал о корреляции засухоустойчивости у растений и толерантности к ПЭГ культивируемых клеток. Для получения адаптированных к водному стрессу клеточных линий также применялись среды, содержащие в качестве осмотика 99–880 мМ маннитол. Как и в предыдущем случае, осмотически адаптированные клетки обладали повышенной выносливостью к солевому стрессу.
Засоление. Одним из лимитирующих факторов сельскохозяйственной продуктивности является засоление почв. Около 900 млн га всех земель нашей планеты имеют повышенное содержание солей, а количество засоленных почв с каждым годом возрастает. Особую тревогу вызывает увеличение в почвах содержания солей, которое происходит в результате их искусственного орошения. Решение данной проблемы во многом зависит от разработки рациональных агротехнических приемов, правильной методологии орошения, использования для полива частично или полностью обессоленной воды. С развитием биотехнологии растений потенциально возможным является получение солевыносливых генотипов у важных сельскохозяйственных культур путем селекции на уровне соматических клеток, слияния протопластов или переноса генов при использовании техники рекомбинантных молекул ДНК.
Вредное действие засоления имеет комплексный характер и обусловлено как нарушением осмотического баланса клетки, так и прямым токсическим влиянием ионов натрия, хлора на физиологические и биохимические процессы в клетке. Результатом такого действия может быть уменьшение тургора клетки, ингибирование функции мембран и активности ферментов, подавление фотосинтеза, нехватки отдельных ионов из-за нарушения селективного транспорта ионов, использование значительного количества энергии для поддержания толерантности. Основные типы реакций растений, возникающие в ответ на повышение концентрации солей во внешней среде, представлены на рис. 3.19.
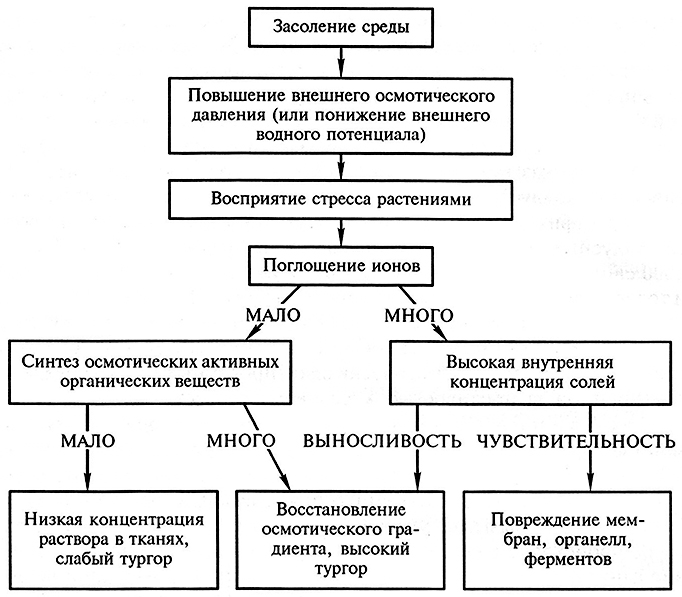
Рис. 3.19. Основные типы ответных реакций растений на засоление (по Epstein, 1980)
Экспериментальные данные, полученные многими учеными, показывают, что клеточные механизмы выносливости к засолению являются сходными для культивируемых in vitro клеток и целых растений и что селекция на клеточном уровне представляет реальную перспективу получения устойчивых к засолению форм растений.Большинство селекционных программ направлены на выделение in vitro клеточных линий, толерантных к присутствию в среде для культивирования клеток хлорида натрия. Так, показано, что выращивая гаплоидные каллусные клетки табака на среде с постоянно увеличивающейся концентрацией солей, получены клеточные линии, способные к росту в присутствии 1 % NaCl. М. Наборе с соав. предварительно обработав суспензионную культуру табака мутагеном (0,15 % ЭМС, 60 мин), путем одноступенчатой селекции выделили клеточные линии, устойчивые к 0,5 % NaCl. Отмечено, что выносливость, полученных регенерантов к засолению, проявлялась на уровне целых растений.
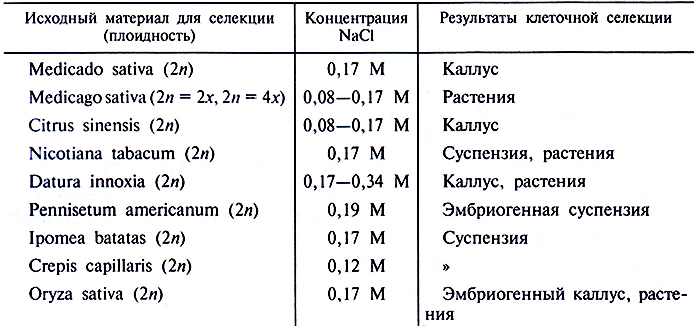
На кафедре сельскохозяйственной биотехнологии РГАУ–МСХА им. К.А. Тимирязева проводились исследования по получению солеустойчивых растений на примере яровых твердых и мягких пшениц. Первичным эксплантом служили как изолированные незрелые зародыши, так и гаплоиды. Клеточную селекцию проводили на каллусной ткани, культивируемой на питательной среде, содержащей 0,3 % NaCl или Na2SО4 в течение 5–6 пассажей. В результате исследований были получены устойчивые клеточные линии, а также растения-регенеранты. Тестирование на солеустойчивость первого семенного поколения растений-регенерантов методом регистрации замедленной флоуроесценции показало, что фотосинтетический аппарат некоторых растений-регенерантов по устойчивости к засолению превосходит исходный сорт (И.Д. Никифорова, 1993, 1994). Другие примеры выделения клеточных линий, устойчивых к различным концентрациям хлорида натрия, и регенерации из них растений, сохраняющих толерантность к соли, представлены в табл. 3.9.
Таблица 3.9. Примеры солевынослевых клеточных линий и растений, полученных через культуру клеток
Солевыносливость растений удается также повысить в результате селекции к одному фактору засоления – осмотическому стрессу. Например, клетки томата, адаптированные к водному стрессу, индуцированному полиэтиленгликолем, обладали повышенной устойчивостью к NaCl. Повышенная толерантность к соли обнаружена у клеточных линий моркови, отобранных на среде, содержащей в качестве осмотика маннитол в высокой концентрации (99–870 мМ). Из этих результатов следует, что адаптация клеток к осмотическому стрессу применима для отбора солевыносливых вариантов, а исследования подобного рода представляют интерес для изучения как во взаимодействии, так и независимо друг от друга.
Металлы. Присутствие в почве в большом количестве ионов металлов, токсически влияющих на растения, или недостаток ионов, используемых растениями в качестве питательных веществ, могут быть причиной ионного (минерального) стресса у растений. Особое внимание ученых привлекает изучение стрессов, обусловленных наличием в почве ионов тяжелых металлов, многие из которых токсически влияют как на растительные, так и на животные организмы. Стрессовое состояние у растений может быть индуцировано ионами таких тяжелых металлов, как цинк, кадмий, медь, ртуть; они также довольно часто встречаются и в почвах. Механизмы устойчивости к токсическим ионам могут включать уменьшение проницаемости плазмалеммы, детоксикацию ионов в результате связывания с органическими веществами, компартментализацию в вакуолях, а также изменения структуры ферментов, которые являются их мишенями.
Работы по клеточной селекции растений на устойчивость к ионным стрессам начаты недавно, но уже имеют положительный результат. Во всех экспериментах используется метод прямой селекции, при котором в качестве селективного агента применяли токсические концентрации солей. Однако создание стрессовых селективных условий in vitro, идентичных таковым в природе, крайне затруднительно. В природных условиях помимо токсического действия ионов накладываются другие факторы, в частности наличие различных веществ, кислотность почвы и т. д. Для селекции на клеточном уровне используют питательные среды, которые хотя не полностью соответствовали естественным стрессовым условиям, все же обеспечивали экспрессию признака устойчивости и давали возможность отбирать нужные варианты.
Путем прямой селекции in vitro отобраны клеточные линии петунии, устойчивые к ртути, сорго – к алюминию, моркови – к алюминию и марганцу одновременно; суспензионные клеточные культуры дурмана – к кадмию. На кафедре сельскохозяйственной биотехнологии РГАУ–МСХА также проводились работы по получению клеточных линий и растений-регенерантов льна-долгунца, устойчивых к соли нитрата кадмия, и изучалось действие этой соли на интактные растения. Экспериментально показано, что присутствие ионов кадмия в почве приводит к торможению роста стеблевой и корневой частей растения, к сокращению на 7–9 дней онтогенетических фаз развития, следующих за фазой «елочки» по сравнению с контролем, культурные виды накапливают ионы кадмия в вегетативной массе, в то время как дикие – нет. Мезо- и ультраструктурный анализ стеблей льна-долгунца показал, что присутствие кадмия в субстрате приводило к уменьшению количества клеток элементарных волоконец в пучке, к некомпактному расположению клеток элементарных волоконец в лубяных пучках, а также к формированию клеток элементарных волоконец неодинаковых размеров в пределах одного пучка и к различным срокам формирования вторичной клеточной стенки. В результате клеточной селекции были получены растения-регенеранты, обладающие устойчивостью к соли кадмия (Е.А. Гончарук, 2000).
Экстремальные температуры. Причиной стрессового фактора у растений могут быть относительно высокие или низкие температуры. Работ по клеточной селекции на устойчивость к этим стрессам немного. В изученной нами литературе сведений о клеточной селекции к тепловому шоку не обнаружено, хотя белки теплового шока являются предметом пристального изучения биологов различного профиля. Что касается работ по клеточной селекции к низкотемпературным факторам, то они имеют место.
Холодовой стресс у растений может быть вызван температурами большого диапазона: от 10–15 до 0 °С. Такому стрессу наиболее подвержены растения тропических и субтропических зон. Стойкость растений кохлаждениюобусловленаспособностьюлипидов мембран оставаться в жидком состоянии благодаря наличию большой пропорции ненасыщенных жирных кислот и/или повышенного содержания стеролов. Повреждения, вызванные промораживанием растений (температура ниже 0 °С), связаны прежде всего с формированием внеклеточного льда. При этом отток воды во внеклеточное пространство приводит к вторичному эффекту, вызванному водным стрессом. Нарушения, вызываемые отрицательными температурами, могут быть предотвращены аккумуляцией антифризных веществ, уменьшением количества несвязанной воды при обезвоживании и увеличением способности переохлаждаться. Большинство авторов отмечают, что у растений происходят глубокие превращения запасных питательных веществ, в частности, у морозоустойчивых древесных растений накопление большого количества жиров, а у менее устойчивых – сахаров.
Первые эксперименты, в которых описана возможность использования культивируемых растительных клеток для отбора выносливых к низким температурам клеточных линий, опубликованы в 1976 г. (Dix, Street, 1976). Работы проводились на суспензионных культурах табака и перца, которые после высева на агаризованные среды подвергались в течение 21 дня соответственно температурам – 3 и 4 °С. Среди отобранных клонов обнаружены линии, стабильно сохраняющие повышенную холодоустойчивость.
Основываясь на имеющихся в этой области исследований данных, однозначный ответ о применимости прямой селекции in vitro растений, выносливых к низкой температуре, давать пока рано. Несомненно, однако, что индукция in vitro генетического разнообразия найдет применение для отбора более выносливых вариантов.
Устойчивость к болезням. Для увеличения производства продуктов питания экономически важным представляется защита растений от болезней и вредителей. Уже сейчас просматриваются реальные перспективы применения клеточной селекции на устойчивость. Если при селекции картофеля на устойчивость к болезням в течение года необходимо в полевых условиях провести оценку от 50 до 100 тыс. сеянцев, то in vitro за один прием можно протестировать около 20 млн протопластов, выделенных из 9 г листьев картофеля. Для клеточной селекции в качестве селективного агента с успехом используют патотоксины, культуральные фильтраты и непосредственно патогены.
Одним из главных защитных механизмов, лежащих в основе сверхчувствительности растений к патогенам, является de novo синтез растениями антимикробных веществ, называемых «фитоалексинами». Защитные реакции у растений, например продукция фитоалексинов, образование белков, связанных с патогенезом, лигнификация, могут быть индуцированы целым рядом веществ биотической или абиотической природы, которые называют «элиситорами». Абиотическими элиситорами могут быть ионы ртути, полиакриловая и салициловая кислоты. К биотическим элиситорам относятся компоненты клеточных стенок грибов, вещества, присутствующие в культуральных фильтрах.
Наиболее простой подход в селекции in vitro на устойчивость к болезням связан с культивированием клеток непосредственно в присутствии патогена. Этот подход может быть особенно полезным, когда мало известно о токсических веществах, ответственных за патогенез, или если патоген не продуцирует токсины. Однако этот способ селекции имеет некоторые сложности в проведении экспериментов. Для правильной схемы селекции прежде всего необходимо знание жизненного цикла патогена. Многие патогены, например грибы, имеют различные стадии жизненного цикла, несколько стадий спороношения, в зависимости от которых могут изменяться выживаемость, рост и эпидемиология. Поэтому необходимо учитывать стадию спороношения, существенным для инфицирования могут быть световой и температурный режимы, относительная влажность, рН, наличие или отсутствие питательных веществ, что сказывается на прорастании спор.
Исследования по культивированию растительных клеток в присутствии патогена были начаты в середине 60-х годов и направлены на изучение корреляции устойчивости/чувствительности к патогену in vivo и in vitro. Непосредственно эксперименты по клеточной селекции на устойчивость к патогенам не всегда были успешными. Однако следует отметить, что китайскими учеными были получены два новых высокоурожайных сорта риса, устойчивых к пирикуляриозу. Селекция проводилась на культуре изолированных пыльников, а в качестве селективного фактора применяли смесь десяти линий гриба. В настоящее время новые сорта занимают в Китае более 140 тыс. га и дают средний урожай 7,5 тыс. кг/га.
Один из перспективных методов селекции устойчивых к болезням растений основан на использовании в качестве селективного агента патотоксинов, которые обычно синтезируются патогенами. Роль токсинов в болезнях растений не всегда ясна. Известно, что только незначительное количество патотоксинов играет существенную роль в инициации и/или развитии болезни. По их действию некоторые авторы делят патотоксины на три категории. К первой относятся токсины, которые не являются определяющими в заболевании, обладают неспецифическим токсическим действием по отношению к хозяину и токсичны для широкого круга растений. Примером может служить табтоксин, продуцируемый Pseudomonas cyringaepv. tabaci, являющийся возбудителем бактериальной рябухи и табака. Другая категория патотоксинов обладает такой же специфичностью по отношению к растениям, как и патоген, но они также не ответственны за развитие болезни. Сюда относится Т-токсин (или HmT) Drechslera maydis (Helminthosporum maydis); патоген, вызывающий гельминтоспороз кукурузы. Третья категория включает патотоксины, которые хозяиноспецифичны и вызывают типичные признаки болезни. Хорошим примером является викторин (принятое сокращение HV-токсин) возбудитель гельминтоспороза овса, вызывающий корневую гниль и пятнистость листьев.
Правомерность схем клеточной селекции на устойчивость может непосредственно зависеть от механизмов действия токсинов. Отдельные виды патогенов поражают клетки, а затем выделяют токсин. Другие – сначала выделяют токсины, которые убивают клетки, затем используют продукты их распада для питания. Естественно, в первом случае не будет корреляции между устойчивостью in vitro и in vivo, проведение селекции на клеточном уровне целесообразно лишь во втором случае.
Возможность отбора in vitro растений, устойчивых к болезням, впервые продемонстрирована П. Карлсоном (1973), который, проводя селекцию табака на устойчивость к метионинсульфоксимину (аналог таботоксина), получил клеточные линии, а затем растения с повышенной устойчивостью к патогену. Некоторые результаты исследований по клеточной селекции на устойчивость к патотоксинам приведены в табл. 3.10.
Таблица 3.10. Примеры клеточной селекции на устойчивость к патотоксинам (по В.А. Сидорову, 1990)
В отношении многих патогенов, для которых патотоксины в чистом виде не выделены или не изучены, для селекции на устойчивость реальным представляется использование культуральных фильтратов. Необходимой предпосылкой их применения, однако, являются определение их роли в заболевании, изучение корреляции устойчивости к патогену у растений и культивируемых in vitro клеток. Первые обнадеживающие результаты по селекции приведены М. Бенке в 1980 г., применявшей нефракционированную культуральную жидкость Phytophthora infestans в клеточной селекции картофеля. Были выделены устойчивые клеточные клоны, давшие начало растениям. При механической инокуляции листьев спорами Phytophthora у 3 из 34 выделенных растений обнаружились очаги поражения, значительно меньшие по сравнению с контролем.
На кафедре сельскохозяйственной биотехнологии РГАУ–МСХА им. К.А. Тимирязева также ведутся исследования по получению форм растений, устойчивых к патогенам: пшеницы к септориозу, моркови–к альтернариозу, картофеля – к ризоктониозу, подсолнечника к склеротиниозу. В качестве селектирующего фактора используют культуральные фильтраты грибов. В результате проведенных исследований были получены растения-регенеранты пшеницы (сорт Энита, Саратовская 29, Московская 35, Фортуна, Gaterin) (рис. 3.20). Семена первого поколения были проверены на устойчивость к патогену Septoria nodorom (по прорастанию). В результате было установлено, что у отобранных семян повышалась устойчивость к культуральному фильтрату гриба на 10–15 % по сравнению с исходными генотипами (Е.А. Калашникова, Лети Джое, 1998). Аналогичные работы были проведены на пяти генотипах моркови. Клеточную селекцию проводили на суспензионной культуре, а в качестве селектирующего фактора использовали культуральный фильтрат гриба Alternaria radicina, в результате чего были отобраны устойчивые клетки, из которых получены растения-регенеранты (рис. 3.21) (Е.А. Калашникова, В.А. Раскалиева, 2000).
Рис. 3.20. Растения-регенеранты пшеницы (сорт Энита), полученные после клеточной селекции на устойчивость к Septoria Nodorum

Рис. 3.21. Растения-регенеранты моркови, устойчивые к Alternaria radicina, полученные после клеточной селекции
Мутагены и их применение при клеточной селекции
В настоящее время накоплены обширные экспериментальные сведения о мутагенной активности различных химических веществ, а также ионизирующих (рентеновские и гамма-лучи) и ультрафиолетового излучений. Например, из химических мутагенов наиболее часто используютэтилметансульфонат (ЭМС). После обработки им клеток растений табака получено 25 фенотипических вариантов. Однако имеются данные, свидетельствующие о незначительном мутагенном эффекте ЭМС. Другой мутаген, заслуживающий внимания при работе с клеточными культурами, – N-этил-М-нитрозомочевина (НЭМ). Данное химическое соединение нестабильно, быстро разрушается в питательной среде и может применяться для обработки клеток без последующей его отмывки. Эффективное мутагенное действие НЭМ продемонстрировано на суспензионной культуре гаплоидного табака, что позволило выделить мутанты, дефектные по нитратредуктазе. Обработка НЭМ гаплоидных протопластов табака увеличивала частоту возникновения хлоратустойчивых клонов в 20 раз, в то время как при мутагенезе диплоидных протопластов этого же вида появление стрептомицинустойчивых клонов возросло в 30 раз. В качестве мутагенов могут быть использованы также N-метил-N-нитpo-N-нитpo- зогуанидин (НГ) и N-нитрозометилмочевина (НММ).
Наиболее широкий спектр мутаций наблюдается при использовании в качестве мутагена ионизирующего излучения. При рентгеновском облучении клеток получены пигментдефектные линии дурмана и петуньи, устойчивые к параквату линии табака. Гамма-облученные растения (лист) служили источником каллусной ткани и протопластов, из которых были выделены линии, устойчивые к гербициду и валину. Устойчивые линии к валину были получены и при обработке культивируемых in vitro клеток табака ультрафиолетовыми лучами. Применение такого способа облучения гаплоидных протопластов табака приводило к возникновению разнообразных ауксотрофных мутантов.
Выживаемость клеточных колоний может быть различной в зависимости оттого, на какой стадии развития культуры применяется обработка мутагеном. При работе с единичными клетками целесообразно проводить обработку их мутагеном до первого деления клеток, так как в другом случае возможно возникновение химерных линий. На изолированных протопластах было показано, что радиочувствительность протопластов зависит от этапов их культивирования. Экспериментально установлено, что облучение протопластов предпочтительнее проводить либо сразу после их выделения, либо на следующий день. Поскольку из-за возможного образования в среде под действием ионизирующего излучения токсических для клеток веществ в любом случае желательно отмыть протопласты от среды, в которой проводили облучение.
При работе с химическими мутагенами нередко проявляется их токсическое действие на клетки. Высокий процент летальности при их использовании может приводить к гибели всей популяции клеток, поэтому при работе с химическими мутагенами используют в основном невысокие дозы. При этом иногда мутагенные вещества не отмывают от протопластов и культивируют их в присутствии мутагена. Ионизирующее излучение вызывает меньший токсический эффект. Более того, даже высокие дозы облучения подавляют лишь репродукционную и регенерационную способности клеток, сохраняя, однако, их метаболическую активность.
Гибридизация соматических клеток
Следующий метод клеточной селекции – создание неполовых гибридов путем слияния изолированных протопластов, полученных из соматических клеток. Этот метод позволяет скрещивать филогенетически отдаленные виды растений, которые невозможно скрестить обычным половым путем, вызывать слияние трех и более родительских клеток, получать асимметричные гибриды, несущие весь генный набор одного из родителей наряду с несколькими хромосомами или генами, или только органеллами и цитоплазмой другого. Гибридизация соматических клеток дает возможность не только соединить в одном ядре гены далеких видов растений, но и сочетать в гибридной клетке цитоплазматические гены партнеров.
Выделение, культивирование
и слияние изолированных протопластов
Для применения методов соматической гибридизации необходима разработка соответствующих технологий получения протопластов, способных делиться и регенерировать растения. Выделение протопластов растительных клеток путем их плазмолизирования и механического разрушения клеточной стенки было осуществлено еще в конце XIX в. Однако метод изолированных протопластов получил развитие лишь после того, как И.К. Коккинг (1960) впервые осуществил ферментативное разрушение клеточной стенки и выделил голые протопласты.
В настоящее время продолжается разработка и совершенствование методов выделения и культивирования протопластов на искусственных питательных средах (рис. 3.22). Для культивирования протопластов применяют те же питательные среды, что и для культуры изолированных клеток и тканей. Отличительной чертой сред для протопластов является повышенное осмотическое давление на начальных этапах культивирования, которое обеспечивается высокой концентрацией маннита или СаСL2.
Рис. 3.22. Изолированные протопласты, полученные из семядольной хвои сосны обыкновенной
В процессе культивирования изолированные протопласты регенерируют новую клеточную стенку и превращаются в клетки, способные делиться и давать начало образованию каллусной ткани. На формирование колоний протопластами влияет состав питательной среды. Дальнейшая задача – получение из каллусной ткани растений-регенерантов. Пока не удалось получить регенеранты из протопластов многих злаковых (пшеницы, ячменя). Однако успешно осуществляется регенерация из протопластов пасленовых (табак, картофель, томаты) и других культур.
Протопласты выделяют из каллусных, суспензионных клеток или из клеток листьев, меристем, стеблей. При выделении протопластов из листьев сначала удаляют эпидермис, лист нарезают на сегменты и затем подвергаютэнзиматической обработке пектиназой и целлюлозой (рис. 3.23).
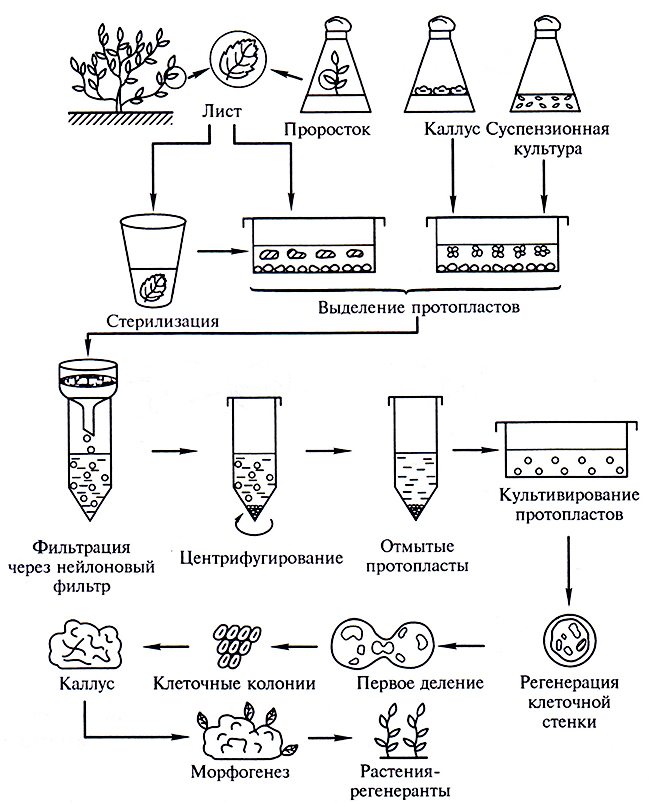
Рис. 3.23. Схема получения и культивирования протопластов из клеток растений
Слияние изолированных протопластов может происходить спонтанно, но довольно редко. Индуцированное слияние изолированных протопластов впервые было получено в лаборатории И. Коккинга в 1970 г. его сотр. С. Пауэром и др. В качестве индуктора они использовали нитрат натрия. Но этот метод оказался малоэффективным, и сейчас найдены другие фьюзогены (индукторы слияния). Наиболее эффективными из них оказались растворы с высоким рН (9–11) и высокой концентрацией ионов кальция (100–300 мМ). Протопласты предварительно агглютинируют концентрированными растворами полиэтиленгликоля с молекулярной массой 1500–6000. У. Циммерман с сотр. разработали физический метод слияния протопластов животных клеток, липосом, в котором в качестве индуктора использовались импульсы электрического тока.
Слияние протопластов приводит к образованию либо гибрида, либо цибрида (рис. 3.24). Цибридная клетка содержит цитоплазму обоих партнеров, а ядро – одного. Это возможно в том случае, если после слияния протопластов не происходит соединения ядер, и одно ядро дегенерирует. Образование цибрида возможно и в том случае, если один из протопластов лишен ядра или оно инактивировано путем облучения.
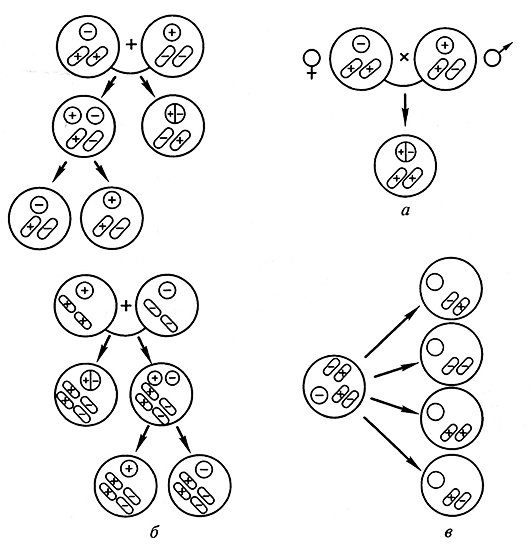
Рис. 3.24. Схемы, иллюстрирующие наследование при парасексуальной гибридизации (Г.С. Муромцев и др., 1984):
а – родительские ядерные (кружок) и внеядерные (овал) детерминанты при парасексуальной (слева) и половой (справа) гибридизациях; б – при парасексуальной гибридизации с учетом как минимум двух независимых внеядерных генофоров; в – генетическое разнообразие парасексуальных потомков, возникающее дополнительно к цитоплазматическим гетерозиготам вследствие соматической сегрегации внеядерных генофоров
Цибридизация позволяет ввести цитоплазматические гены, несущие признаки ЦМС (цитоплазматической мужской стерильности), устойчивости к некоторым гербицидам и патогенам.
Первый неполовой межвидовой гибрид высших растений получен в 1972 г. путем слияния изолированных протопластов двух видов табака: Nicotiana glauca и N. Langsdorfii.В настоящее время методом парасексуальной гибридизации получено большое число межвидовых, межсемейственных и межтрибных гибридов. Однако во многих случаях гибридные растения, полученные таким путем, в той или иной степени ненормальны. Примером может служить соматический гибрид между арабидопсисом и турнепсом, который является растением-монстром. Возникающие аномалии являются результатом хромосомной несбалансированности (Ю.Ю. Глеба, 1982).
Особый интерес представляют межцарственные клеточные гибриды, полученные от слияния протопластов растительных и животных клеток. Описаны гибриды между протопластами эритроцитов крысы и протопластами дрожжевых клеток, между протопластами моркови и человека, табака и человека и др.
При соматической гибридизации эксперимент строится аналогично опытам по генетике микроорганизмов. Иными словами, используются большие популяции клеток обоих родителей. При обработке смешанной суспензии протопластов фьюзогенами часть из них сливается друг с другом, но в суспензии остаются и неслившиеся протопласты. Все они, включая гибридные, в дальнейшем регенерируют клеточные стенки и переходят к делениям. Возникает задача – выделить из общей массы гибридные экземпляры. Селекция гибридов может применяться либо на клеточном уровне, либо на стадии регенерации и осуществляется несколькими методами.
Для идентификации гибридов могут служить пластиды. Например, при слиянии протопластов табака и моркови в качестве селективных маркеров использовались зеленые хлоропласты табака и красно-оранжевые хромопласты моркови.
Другим методом, позволяющим производить отбор гибридов, является генетическая комплементация. Этот метод был применен для обнаружения гибридов табака, при этом использовались хлорофиллдефектные мутации у родителей с последующей комплементацией в гибридных продуктах. Сочетание двух ядерных рецессивных мутаций у табака вызывает светозависимую хлорофильную недостаточность. Растения, гомозиготные по любому из этих генов, выращиваемые при интенсивном освещении, обесцвечиваются и гибнут. После слияния и регенерации клеточные колонии пересаживают на среду, индуцирующую стеблевой органогенез, и культивируют на свету.
Под методом физиологической комплементации, который также используется для обнаружения соматических гибридов, подразумевают способность гибридных клеток жить и размножаться либо переходить к морфогенезу в условиях культуры, при которых родительские клетки этого делать не в состоянии, причем неспособность родительских клеток не связана с какой-нибудь определенной мутацией, а является нормальной физиологической реакцией клетки на физиологические условия. Например, половые гибриды между N. glauca и N. Langsdoifii имеют склонность к опухолеобразованию, а клетки гибридов в условиях in vitro способны расти и размножаться на питательных средах без гормонов. Гормононезависимость клеток гибрида и была положена в основу метода селекции. После индуцированного слияния протопластов из мезофилла листьев обоих видов табака клетки через некоторое время пересаживали на питательную среду, не содержащую фитогормонов, и отбирали колонии, способные расти в этих условиях. Существуют также другие методы селекции соматических гибридов: смешанная физиологогенетическая комплементация, физическое обогащение (метод основан на разделении протопластов при центрифугировании в связи с их различной плотностью), механическая изоляция.
Использование изолированных протопластов в селекции растений не ограничивается возможностью их индуцированного слияния и получения соматических гибридов. Изолированные протопласты способны поглощать из окружающей среды макромолекулы и органеллы, следовательно, в них можно вводить чужеродную информацию, не пересаживая ДНК или органеллы других клеток. Уже проведена успешная трансплантация изолированных ядер в протопласты петунии и табака. Вместе с тем поглощение протопластами чужеродных ядер не всегда ведет к образованию гибридов. Кроме ядер в изолированные протопласты удалось трансплантировать чужеродные хлоропласты. Из этих протопластов Д. Карлсон получил растения-регенеранты, содержащие хлоропласты другого организма.
Однако работы по переносу чужеродных органелл и ДНК только начинают развиваться. В целом использование изолированных протопластов в генетической реконструкции клетки, как видим, открывает перспективы перед клеточной селекцией.

