Оксигенные фотосинтезирующие прокариоты включают две отдельные группы. Одну группу, основательно изученную и описанную, составляют цианобактерии. Это широко распространенные и разнообразные фотосинтезирующие бактерии, от одноклеточных до многоклеточных, которые содержат хлорофилл α и осуществляют оксигенный фотосинтез. Сравнительно недавно открыта вторая группа прокариот, осуществляющих оксигенный фотосинтез, – порядок Pruchlorales. Во многих отношениях прохлорофиты сходны с цианобактериями, но наряду с хлорофиллом а содержат хлорофилл Ь, не имеют фикобилиновых пигментов и отличаются по ряду других свойств. В филогенетическом отношении эта группа гетерогенна. На основе данных о последовательности оснований 16S-pPHK можно предполагать, что прохлорофиты эволюционно близки различным группам цианобактерий, но точно их родственные связи пока не установлены.
Ключ для определения оксигенных фотосинтезирующие бактерий
I. Присутствуют хлорофилл а и фикобилины.
I.Цианобактерии
II.Присутствуют хлорофиллы b и а, фикобилины отсутствуют.
III. Прохлорофиты (Порядок Prvchlorales)
I. Цианобактерии
Разнообразная и дивергентная группа одноклеточных, колониальных и нитчатых оксигенных фотосинтеэирующих бактерий. У нитчатых форм нити простые или с ложным либо настоящим ветвлением (иногда оба типа ветвления встречаются одновременно); некоторые нитчатые формы образуют многорядные структуры в виде сложных многоклеточных талломов. Ширина или диаметр клеток варьируют от менее чем 0,5 мкм до свыше 100 мкм. Грамотрицательные: поверх слоя пептидогликана толщиной 2–200 нм имеют наружную мембрану (данные просвечивающей электронной микроскопии, П.Э.М.). У большинства нитчатых форм клетки соединены через тонкие поры микроплазмодесмами (П.Э.М.). Могут быть окружены внеклеточным чехлом, гликокаликсом (капсулой), или просто слизью. Многие представители имеют пили (Э.М.). Жгутики отсутствуют, но штаммы одного рода одноклеточных цианобактерий способны к движению по типу плавания. Для многих родов и видов, особенно среди нитчатых форм, характерно скользящее движение [со скоростью менее 1–6(10) мкм • с-1]. Механизм этого движения неясен, Но косвенные данные указывают на его связь с лентами белковых микрофибрилл, расположенных в периплазме, вероятно между слоем пептидогликана и наружной мембраной.
Одноклеточные, колониальные и некоторые нитчатые цианобактерии осуществляют бинарное деление с образованием перетяжки, тогда как многие нитчатые формы делятся за счет инвагинации только клеточной мембраны и слоя пептидогликана (П.Э.М.). Для нескольких одноклеточных форм характерно деление путем почкования. У представителей одной подгруппы размножение полностью или частично происходит путем множественных внутренних делений.
Светособирающие пигменты включают фикобилипротеины (фикобилины) – фикоэритрин (ФЭ, у некоторых), фикоэритроцианин (ФЭЦ, у некоторых), фикоцианин (ФЦ, у всех) и аллофикоцианин (АФЦ, у всех), хлорофилл α (хл α) и каротиноиды (в большинстве случаев β-каротин, зеаксантин, эхиненон, мнксоксантофилл и осциллоксантин). ФЭ может содержать только фикоэритробилнн в качестве хромофора (С-ФЭ) или смесь фикоэритробилина и фикоуробилина. Все известные цианобактерии содержат некоторое количество ФЦ и АФЦ.
Цвет клеток может быть красным, сине-зеленым, пурпурным, зеленым, коричневым или почти черным (в зависимости от вида, интенсивности освещения или распределения спектральных максимумов). Чехлы или гликокаликс также могут содержать желтый пигмент (сцитонемнн) или красно-голубой пигмент (глеокапсин), способные маскировать пигментацию клеток.
Некоторым ФЭ- или ФЭЦ-содержащим цианобактериям свойственна хроматическая адаптация (в классическом смысле). Обычно при освещении преимущественно зеленым светом низкой интенсивности происходит непрерывный синтез ФЭ, тогда как в случае большего преобладания красного света – частичное или полное подавление синтеза ФЭ, иногда при усилении синтеза ФЦ. Фикобилипротеиновые пигменты образуют фикобилисомы на обеих обращенных к строме поверхностях двойных внутриклеточных мембран (тилакоидов). В состав тилакоидных мембран входят хлорофилл а и каротиноиды (исключение составляет один род, у клеток которого фотосистемы содержатся только в цитогхлазматической мембране за отсутствием внутренних тилакоидов).
Фотосинтез у всех видов окснгенный и автотрофный, но некоторые способны к сульфидзависимой анаэробной анокснгекной фотоавтотрофии, когда сульфид ингибирует фотосистему II и, в результате, оксигенный фотосинтез. Встречается фотогетеротрофия, а также аэробная (дыхательная) и анаэробная (бродильного типа) хемогетеротрофия, но эти типы метаболизма обычно могут обеспечивать только поддержание или слабый рост. У одного организма описана гетеротрофия, активируемая светом, и этот же механизм, возможно, имеет место и в других случаях так называемой гетеротрофии (см.: Anderson, Mcintosh, J. Bacterid. 173: 2761-2767, 1991).
Продукты фотосинтеза цианобактерии запасают в форме гликогена; редко они содержат поли-β-гидроксибутират. Другие характерные клеточные включения – мульти-L-аргинил-поли-[L-аспарагиновая кислота] (цианофицин, или структурированные гранулы), гранулы полифосфатов, карбоксисомы (полиэдральные тела) и газовые везикулы (последние преимущественно у планктонных видов).
Представители некоторых групп способны к дифференцировке с образованием специализированных клеток – гетероцист (содержат модифицированные тилакоиды, обычно лишены фикобилисом, не способны к автотрофии и выделению кислорода, имеют дополнительные слои клеточной стенки и осуществляют главным образом фиксацию молекулярного азота) и акинет (обладающие толстой оболочкой устойчивые покоящиеся клетки, которые встречаются у большинства видов, способных к образованию гетероцист).
Большинство видов – свободноживущие, пресноводные, морские или сухопутные, планктонные или бентосные организмы; некоторые виды способствуют отложению мергеля; как основные компоненты цианобактерии входят в состав микробных матов. Освещенность в местах обитания от высокой до крайне низкой, температура от <2°С (антарктические соленые водоемы) до 74°С (горячие источники). Известно небольшое число видов – эндосимбионтов эукариот (например, грибов, диатомовых водорослей, динофлaгeллят), и ряд видов – азотфиксирующих экзосимбионтов (например, в «тканях» лишайников, печеночников, роголистников, водных папоротников и немногих цветковых растений). В ряде случаев эндосимбионты лишены типичной цианобактериальной клеточной стенки; такие организмы называют цианеллами. Некоторые цианобактерии, как установлено, близкородственны хлоропластам эукариотических водорослей.
Информация о культурах, в случаях когда она важна, приведена в описаниях конкретных родов, о составе некоторых сред для культивирования – в табл. 11.1, 11.2 и 11.3.
Таблица 11.1. Состав питательных сред для пресноводных цианобактерий1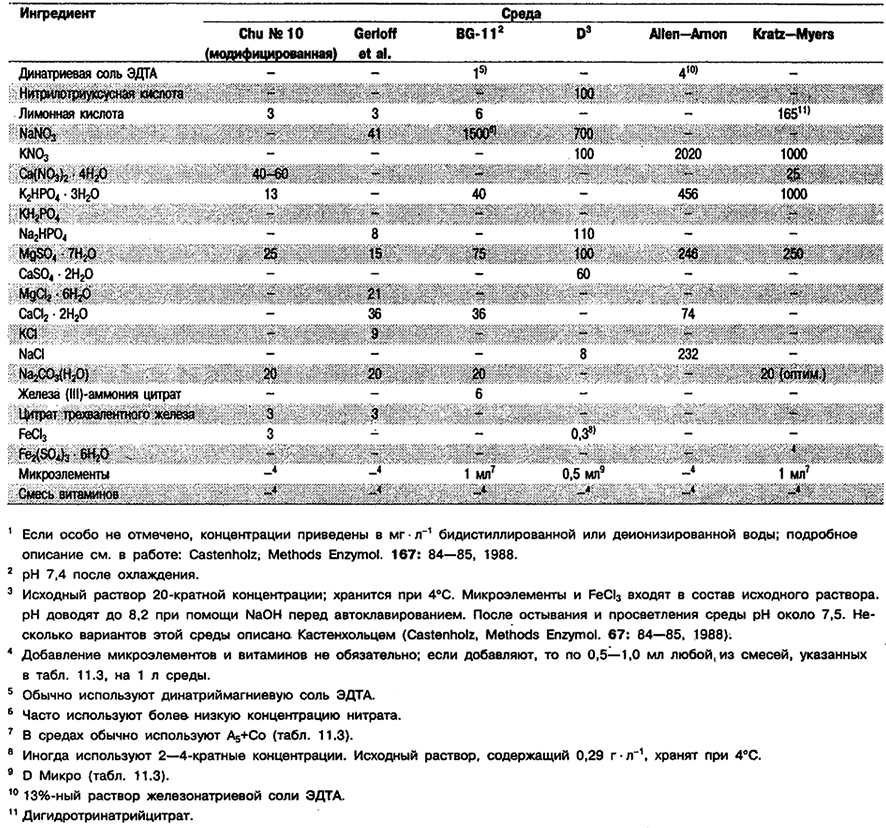
Таблица 11.2. Состав сред на основе морской воды
и сред с очень высокой соленостью для цианобактерий1
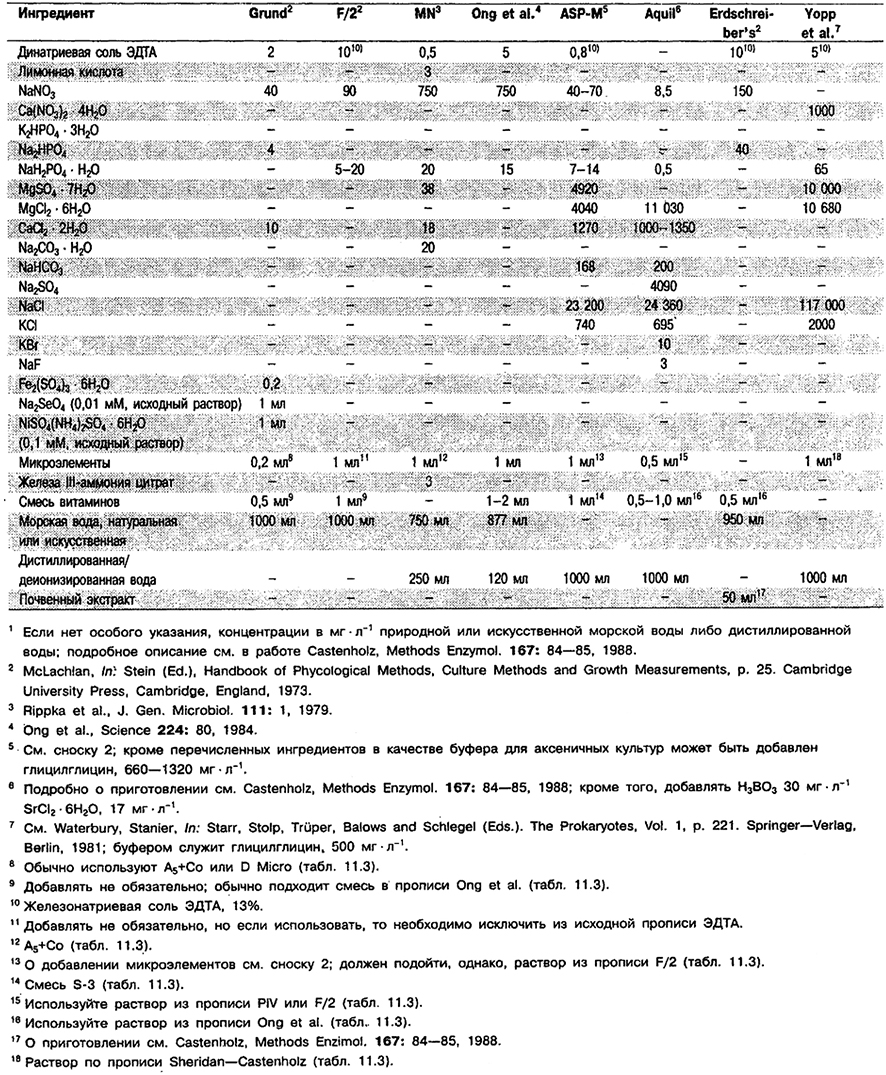
Таблица 11.3. Состав растворов микроэлементов и смесей витаминов 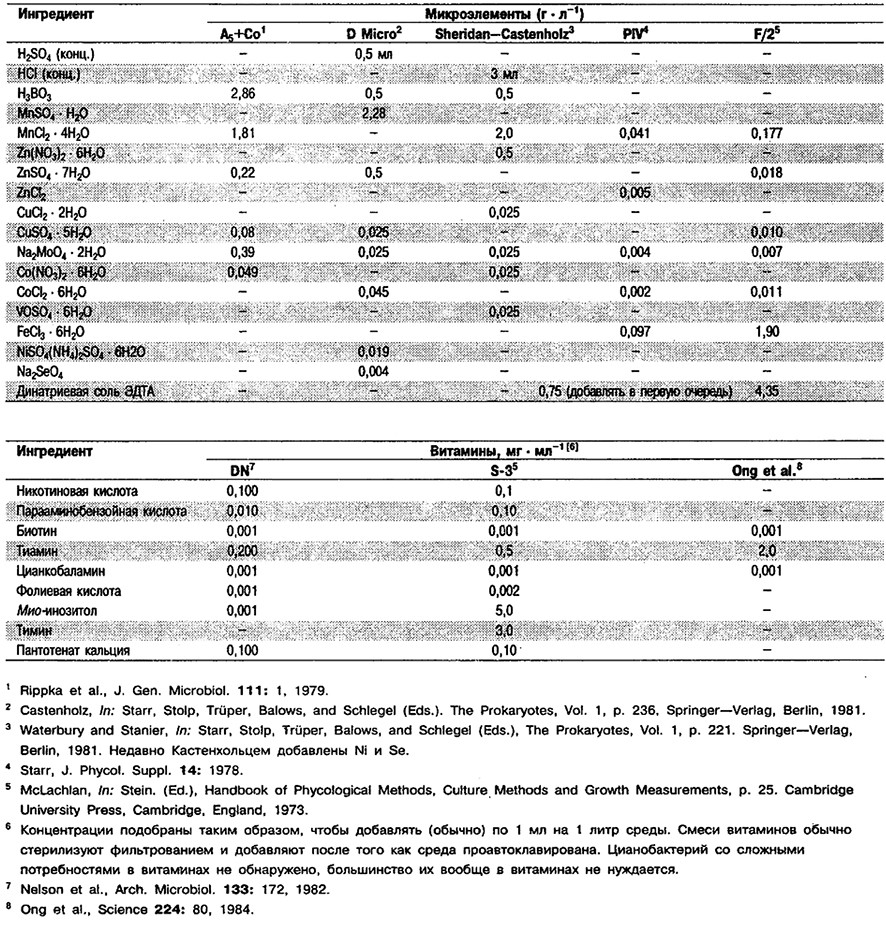
Для микроскопической идентификации микроорганизма как цианобактерии рекомендуются следующие критерии:
1. Прокариотическая организация клеток, т. е. отсутствие в них хлоропластов и ядра (часто это можно установить только при помощи фазово-контрастной оптики).
2. Неспособность клеток к «плаванию» (возможна подвижность за счет медленного скольжения в контакте с субстратом). Есть одно исключение: см. некоторые штаммы рода Synechococcus.
3. Цвет клеток может варьировать (см. выше), но присутствие фгасобилинов и хлорофилла подтверждает видимая оранжевая или красная флуоресценция при эпифлуоресцентной микроскопии. У нитчатых и одноклеточных аноксигенных бактерий (они содержат бактериохлорофиллы и лишены фикобилинов) окраска также может варьировать от красноватой до зеленоватой, но флуоресценция будет только в области ближнего инфракрасного света, не в видимой части спектра.
4. Исключить принадлежность организма к Prochlorates – прокариотам, обладающим хлорофилл ами α и b и не содержащим фикобилинов, можно путем экстракции соответствующего образца метиловым спиртом или ацетоном: клетки цианобактерий после такой обработки сохраняют окраску (от голубой до красной), поскольку в них остаются фикобилины, не растворимые в органических растворителях.
Классификация цианобактерий
Классификация цианобактерий находится в стадии развития и, по-существу, все приведенные здесь роды следует рассматривать как временные и подлежащие значительной модификации. В настоящее время возможно и даже желательно использовать комбинацию тех или иных из 5 приведенных ниже систем. В таких случаях важно при обозначении организма, с которым предполагается вести работу, указывать его альтернативные названия.
Даже сравнительно новые системы (т. е. приведенные под номерами 1 и 5) по-прежнему в значительной степени представляют собой феиотипические классификации. Однако система 1 особенно приближается отчасти к генотипической классификации. Как эта система, так и система 5 переходные; обе они в основном носят предварительный характер. Генотипическая классификация (отражающая филогению и генетическое родство), какой бы она ни была, никогда не заменит полностью фенотипическую систему, так как последняя позволяет определять образцы простым способом, что особенно важно при работе с коллекциями из природных местообитаний. Во всех последующих системах скорее всего будут сгруппированы вместе цианобактерии, сходные по морфологии и способу размножения, несмотря на то, что некоторые из них, возможно, генетически неродственны. К сожалению, традиционно используемые при классификации бактерий фенотипические критерии почти не приходится применять в случае цианобактерий, поскольку по многим физиологическим признакам они не различаются (так, все они фотоавтотрофы с приблизительно одинаковыми потребностями в питательных веществах).
Системы классификации цианобактерий
1. Наиболее простая система (приведенная здесь) основана почти исключительно на изучении ограниченного числа цианобактерий, а именно тех, что имеются в культурах (см. Rippka et al., J. Gen, Microbiol. Ill: 1–61, 1979; Rippka, In; Methods Enzymol. 167: 28–67, 1988). Критерии, используемые в данной системе, включают морфологические признаки, способ размножения, ультраструктуру, физиологические особенности, химический состав и иногда Генетические данные (Betsey's Manual of Systematic Bacteriology, Vol. 3, pp. 1710–1727). Сведения о выделении и истории большинства штаммов, приведенных в «Bergey's Manual of Systematic Bacteriology», можно найти в статье Риппка с соавт. (Rippka et al., J. Gen. Microbiol. Ill: 1–61, 1979).
2. Простая, но неприемлемая система Друэ (Drouet, Beih, Nova Hedwigia 66: 135–209, 1981), основанная преимущественно на морфологии организмов из гербарных образцов; в настоящее время она используется редко.
3. Система Гейтлера, сложная и основанная почти исключительно на морфологических признаках организмов из природных образцов (Geitler, Rabenhorst's Kryptogame nflora 14: 1–1196, 1932).
4. Система, созданная в результате критической переоценки родов Гейтлера и также основанная прежде всего на морфологических признаках и способе размножения (Bourrelly, Les algues d'eau douce III, 2nd ed., 606 pp, N, ВоuЬeе, Paris, 1985).
5. Современная и расширенная система, созданная Анагностидисом и Комареком, представляет собой сложную модификацию системы Гейтлера, проведенную на основе данных по морфологии, ультраструктуре, способу размножения, изменчивости и других, полученных на природном материале и культурах (Anagnostidis, Komirek, Arch. Hydrobiol. Suppl. 71: 291– 302, 1985; Suppl. 73: 157–226, 1986; Suppl. 80: 327–472, 1988; Suppl. 82: 247–345, 1989; Suppl. 86: 1–73, 1990). Здесь роды определены более узко, чем в системе 1. Указанные публикации важны для более углубленного изучения классификации цианобактерий.
Ключ для определения пяти подгрупп цианобактерий
I. Одноклеточные формы или ненитчатые агрегаты (колонии) клеток, объединенных наружными слоями клеточной стенки или гелеподобным матриксом.
А. Бинарное деление в одной, двух или трех плоскостях, симметричное или асимметричное; или почкование.
Подгруппа I
Б. Размножение путем внутренних множественных делений с образованием дочерних клеток размерами менее 1/2 родительской клетки или путем множественного и бинарного деления.
Подгруппа 2
II. Нитчатые организмы; трихомы разветвленные или неразветвленные, однорядные или многорядные.
A. Бинарное деление происходит только в одной плоскости, в результате чего образуются однорядные не ветвящиеся трихомы, хотя может иметь место ложное ветвление.
1. Трихомы состоят их клеток, которые не дифференцируются в гетероцисты или акинеты
Подгруппа 3
2. Одна или несколько клеток в каждом трихоме дифференцируются в гетероцисты, по крайней мере при низкой концентрации источника связанного азота в среде; некоторые образуют также акинеты.
Подгруппа 4
В. Бинарное деление происходит периодически или постоянно более чем в одной плоскости, в результате чего образуются многорядные трихомы или трихомы с настоящим ветвлением, или и те и другие
Подгруппа 5
Подгруппа 1. (= Порядок: Chroococcales)
Одиночные клетки или агрегаты клеток, или правильные колонии. Размножение происходит путем бинарного деления или почкования. Клетки от округлых до удлиненных (<0,5–30 мкм диаметром или толщиной). Бинарное деление в 1, 2 или 3 плоскостях либо неупорядоченное; клетки в агрегатах или колониях удерживаются вместе за счет плотных чехлов или слизи, иногда малозаметной. Для точного определения истинных родственных связей (и родовой принадлежности) необходимы данные о нуклеотидных последовательностях. Сравнение по физиологическим и морфологическим признакам обычно позволяет только предварительно дифференцировать роды. Некоторые из описанных здесь родов обозначены как «группы культур» или «сверхроды», и различные группы внутри каждого из них в конце концов могут оправданно получить статус самостоятельного рода. Дальнейшее увеличение количества выделенных культур и расширение генетических исследований несомненно приведут к признанию дополнительных родов и видов. Поскольку у многих представителей этой подгруппы очевидны лишь немногие диагностические фенотипические свойства, нужна их классификация на генотнпическом уровне. См, рис. 11,1, 11,2 и оригинальные статьи (Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol. 3, pp. 1729-1731; Rippka, Methods En2ymol. 167: 28–67, 1988).

Рис. 11.1. Схематическое изображение представителей родов, входящих в Подгруппу 1.
A. Chamaesiphon sp, на трех стадиях деления.
Б. Chamaesiphon: два «вида» с чехлами (псевдовлагалищами).
В. Cyanothece sp. (ср. Synechococcus minervae): неделящаяся клетка из горячего источника.
Г. Cyanothece sp.: неделящаяся и делящаяся клетки.
Д. Gloeotoacfer (G. violaceus) с чехлом, показанным сплошной линией.
Е и Ж. Gioeocapsa spp. со слоистым чехлом.
3. Gloeothece sp. со слоистым чехлом.
И. Microcystis sp.; пять клеток планктонной колонии, заключенные в гелевый матрикс; внутри клеток изображены газовые вакуоли.
К. Microcystis sp.: планктонная колония; шкала – 40 мкм.
Л. Gomphosphaeria: часть колонии с клетками, образующими слизистые стебельки.
М. Gomphosphaeria-подобный организм (ср. Snowella sp.): часть колонии с клетками, образующими нитевидные стебельки.
Н. Coelosphaerium-подобный планктонный организм (ср. Woronichinia sp.): часть колонии с клетками, образующими слизистые стебельки. В клетках обозначены газовые вакуоли.
О. Myxobaktron sp. (=Dactyfococcopsis safina): одна планктонная неделящаяся клетка с газовыми вакуолями.
П Synechococcus sp. (ср. S. lividus): неделящаяся и делящаяся клетки из горячего источника.
P. Synechococcus sp.: клетки перед делением и в процессе деления.
С. Synec/rococcus sp.: клетки перед делением и в процессе деления.
Т. Synechococcus sp.; клетки перед делением и в процессе деления; пикопланктонная морская форма.
У. Synechococcus sp.: пикопланктонная форма.
Шкала – 5 мкм для всех изображений, кроме К, где указан другой масштаб.
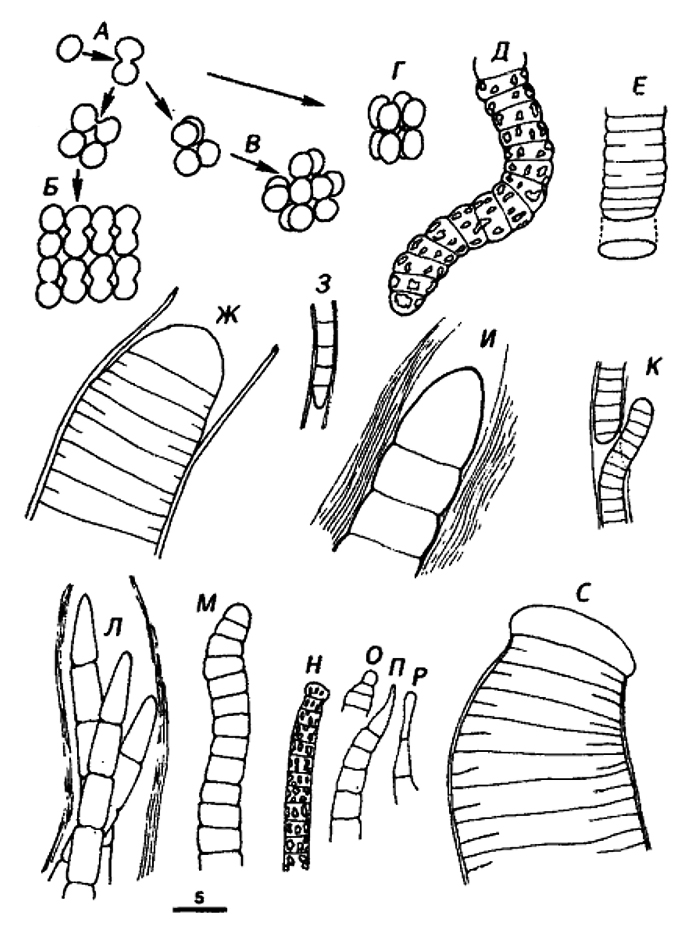
Рис. 11.2. Схематическое изображение представителей родов, входящих в Подгруппы 1 и 3.
Подгруппа 1 (продолжение).
A. Synechocystis sp.: клетка перед делением и в процессе деления.
Б. Synechocystis sp.: типичное деление в двух плоскостях и синхронное деление с образованием пластинчатых колоний «Merismopedia».
В. Synechocystis sp,: беспорядочное деление в трех плоскостях.
Г. Synechocystis sp.: синхронное деление в трех плоскостях с образованием кубических колоний «Eucapsis.
Подгруппа 3.
Д. Arthrospira sp.: планктонная форма с газовыми вакуолями.
Е Crinalium (С. epipsammum): нижняя клетка показана перевернутой на 90°.
Ж и 3. Lyngbya spp.
И. Lyngbya sp. с многослойным чехлом (ср. Porphyrociphon sp.).
К. Lyngbia sp. с ложной ветвью (ср. Pfectonema sp.).
Л. Microcoleus sp.: три трихома в общем чехле.
М-С. Oscillatoria spp.; разнообразие толщины и изогнутости трихомов, суженности концов и форм терминальных клеток.
Н. Планктонная форма, содержащая газовые вакуоли (ср. О. rubescens или Pianktothrix rubescens).
С. Центрипетально образующиеся поперечные перегородки.
Шкала – 5 мкм для всех изображений.
Комарек и Анагностидис (Komarek, Anagnostidis, Arch. Hydrobiol. Suppl. 73: 157–226, 1986) недавно осуществили глубокую ревизию традиционных порядков Chroococcales (Подгруппа 1), Pleurocapsales (Подгруппа 2) и Chamaesiphotiales с объединением их в один порядок (Chroococcales), включающий семь хорошо различимых и поддающихся определению семейств. Среди групп, которые соответствуют Подгруппе 1, приведенной в настоящем определителе, эти авторы признают 43 рода. Классификация многих уникальных одноклеточных и колониальных цианобактерий, изученных преимущественно в образцах из природных мест обитания, здесь не будет рассмотрена, поскольку они не представлены в культурах или их культуры не были изучены в достаточной мере. Для классификации форм, относящихся к Подгруппе 1, одним главным критерием служит характер бинарного деления – в одной, двух, трех или более плоскостях (см. приведенный ниже ключ). Достоверность этого критерия подтверждают результаты подробного исследования 20 штаммов, представляющих 6 родов (Kovacik, Arch. Hydrobiol. Suppl. 80: 149-190, 1988).
Ключ для определения родов Подгруппы 1
[П.Э.М, – необходимы данные просвечивающей электронной микроскопии]
I. Бинарное деление (дочерние клетки одинаковы по размерам)
А. Клетки с тилакоидами [П.Э.М.]
1. Деление только в одной плоскости
а. Диаметр или толщина клеток >3 мкм
1) Клетки сильно удлиненные, sy обоих полюсов суженные
Род Myxobaktron
2) Палочковидные клетки, окруженные чехлом
Род Gloeothece
3) Палочковидные клетки без чехла
«Группа культур» Cyanothece
б. Диаметр или толщина клеток <3 мкм
«Группа культур» Synechococcus
2. Деление в двух или трех плоскостях
а. Клетки объединены в многоклеточные агрегаты или пары многослойным чехлом; форма клеток от кокковидной до полусферической
«Группа культур» Gloeocapsa
б. Клетки одиночные, в парах или агрегатах, связанные аморфной слизью или чехлом; кокковидные
«Группа культур» Synechocystis и род Microcystis
Б. Клетки без тилакоидов [П.Э.М.1, У известного вида мелкие (~1,5 мкм шириной), палочковидные, с чехлом; деление в одной плоскости (единственный род, лишенный тилакоидов)
Род Gloeobacter
II. Размножение почкованием: асимметричное клеточное деление, после которого более крупная «материнская» клетка продолжает делиться и образовывать более мелкие «почки»; клетки яйцевидные, тилакоиды присутствуют [П.Э.М.]
Род Chamaesiphon
Род Chamaesiphon
Клетки от округлых до овальноудлиненных, с различными по форме полюсами – удлиненные и суженные на одном конце; деление асимметричное, с осью, приближенной к более узкому полюсу; в результате деления высвобождается меньшая из двух дочерних клеток («почка», экзоспора, или экзоцит). Более крупная базальная, или материнская, клетка в естественной среде обычно прикреплена противоположным полюсом к субстрату (например, к водным растениям, водорослям, камням); она продолжает образовывать почки (рис, 11.1, А, Б). Деление происходит в одной плоскости. Чехол (псевдовлагалище) может окружать только базальную клетку. Несколько округлых почек могут сохранять связь с материнской клеткой, образуя цепочку.
Данное описание основано преимущественно на представлении о роде Chamaesiphon, сформулированном Уотербури и Риппка (Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol. 3, pp. 1729–1731). Комарек и Анагностидис (Kom£rek, Anagnostidis, Arch. Hydrobiol. Suppl. 73: 193–199, 1986) признают существование нескольких других родов цианобактерий, подобных Chamaesiphon.
У двух имеющихся в культурах штаммов или видов диаметр клеток варьирует в пределах 3–5 мкм, длина материнских клеток 5–7 мкм. Оба организма выделены из пресной воды, характеризуются высоким содержанием полиненасыщенных жирных кислот, растут в питательной среде BG-11 или сходных с ней средах. Максимальная температура для роста 27–30°С. Один из штаммов – факультативный фотогетеротроф (использует глюкозу, фруктозу или сахарозу). Другой штамм содержит С-ФЭ и способен к хроматической адаптации. Клетки обоих штаммов неподвижные и не обнаруживают нитрогеназной активности в анаэробных условиях. Мол.% G+C в ДНК 46,7–46,9 (у двух штаммов). См. табл. 11.4.
Таблица 11.4. Признаки родов Подгруппы 1,
для которых характерно деление клеток только в одной плоскости (исключая Myxobaktron)1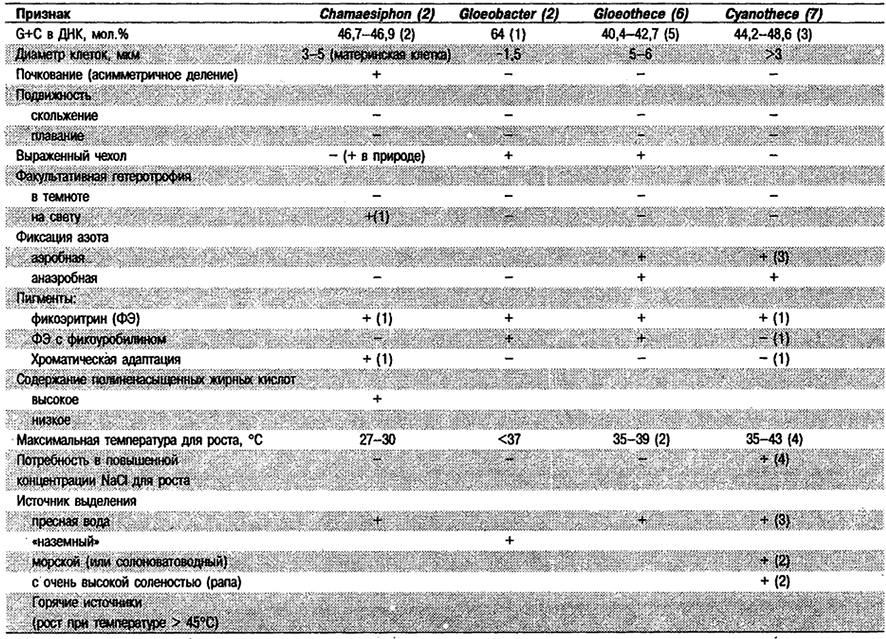
Комарек и Анагностидис признают 24 вида Chamaesiphon (Komarek, Anagnostidis, Arch. Hydrobiol. Suppl. 73: 195, 1986).
Отличия Chamaesiphon от других родов: Это единственные одноклеточные цианобактерии удлиненной формы с асимметричным делением и способностью к образованию экзоцитов (меньшая из 2 образующихся при делении клеток). Обычно перед делением клетка имеет удлиненную или овальную форму и один полюс уже другого. Представители других родов одноклеточных цианобактерий, имеющих чехол или лишенных его (Synechococcus, Gloeothece, Cyanothece, Gloeobacter) и делящихся в одной плоскости, не асимметричны по форме (относительно оси) и не обнаруживают неравного деления. См., впрочем, род Pleurocapsa в Подгруппе 2.
Род Cyanothece
Род Cyanothece (в понимании Уотербури и Риппка; Waterbury, Rippka, In: Beigey's Manual of Systematic Bacteriology, Vol. 3, pp. 1739–1741) в настоящее время рассматривается как «сверхрод» или «группа культур» и поэтому в дальнейшем может быть подразделен на ряд дополнительных родов, но с сохранением рода Cyanothece.
Одноклеточные цианобактерии, по форме от палочковидных до кокковидных. Размножаются центральным поперечным бинарным делением и одной плоскости. Диаметр клеток у известных штаммов ≥3 мкм. Содержат внутриклеточные тилакоиды; заметных чехлов не имеют (рис. 11.1, В, Г; табл. 11.4). Все семь изученных штаммов облитатные фототрофы; все фотоавтотрофы. Растут на разных средах. Некоторые штаммы выделены из пресной воды, некоторые из морской и два штамма из открытых бассейнов (с очень высокой соленостью) для выпаривания соли из морской воды. Имеются галофильные штаммы (известные также как Aphanothece halophytica; Yopp et al., Phycologia 17: 172-177, 1978). Для роста галофильных штаммов оптимальна концентрация NaCl 0,7–2,0 М и нужны повышенные концентрации Mg2+ и Са2+. Все галофильные штаммы, кроме одного, обнаруживают нитрогеназную активность, иногда даже в аэробных условиях. Один штамм содержит С-ФЭ. Максимальные температуры известны для двух штаммов (соответственно 43 и 35°С). Выделены из рисовых полей, «матов» из мангровых зарослей и открытых бассейнов для выпаривания соли из морской воды. Cyanothece (Aphanothece halophytica) часто доминирует среди цианобактерий на поверхности микробных матов в прудах с содержанием NaCl до 2–3 М. Содержание G+C в ДНК (известно для трех штаммов) 41,2–48,6 мол.%.
Отличия Cyanothece от других родов: См. табл. 11,4.
Род Gloeobacter
Клетки от овальных до палочковидных, одиночные или в агрегатах неправильной формы, где окружены общим многослойным чехлом; размеры клеток 2,0–3,0 х 1,5 мкм. Размножаются путем центрального поперечного бинарного деления в одной плоскости. Тилакоиды отсутствуют; фотосистемы и светособирающие фикобилипротеины ассоциированы только с цитоплазматической мембраной. Описан единственный вид G. violaceus (Rippka et ah, Arch. Microbiol. 100: 419-436, 1974) (рис. 11.1, Д).
Представители G, violaceus встречаются на суше на поверхности известковых скал. Клетки в массе имеют фиолетовый цвет. ФЭ содержит фикоуробилины. Отношение фикоцианин/фикоэритрин – 3:2. О хроматической адаптации данных нет. Обингатные фотоавтотрофы; верхний температурный предел между 25 и 37°С. Неподвижные; нитрогеназной активности в анаэробных условиях не обнаруживают. Содержание G+C в ДНК равно 64 мол.% (для одного штамма) (см. табл. 11.4).
Отличия Gloeobacter от других родов: Gloeobacter сходен с Gloeothece по всем морфологическим признакам за исключением того, что. у Gloeobacter отсугствуют тилакоиды (для подтверждения этого признака необходима П.Э.М.). Хотя клетки штаммов Gloeothece, доступных сейчас в культурах, имеют больший диаметр, чем клетки Gloeobacter, это отличие может не подтвердиться при изучении дополнительных штаммов. У других мелких одноклеточных представителей Подгруппы 1, возможно, также обнаружится отсутствие тилакоидов при изучении с помощью П.Э.М.
Клетки G. violaceus содержат крупные преломляющие свет гранулы (полифосфаты), в основном вблизи полюсов.
Род Gloeocapsa
Род Gloeocapsa (в понимании Уотербури и Риппка; Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol. 3, pp. 1741–1742) здесь рассматривается как условный «сверхрод» или «группа культур». Он включает виды двух традиционных «ботанических» родов – Gloeocapsa и Chroococcus. В системе Комарека и Анагностидиса (Komirek, Anagnostidis, Arch. Hydrobiol. Suppl. 73: 212–214; 188–191, 1986) эти два рода помещены в отдельные «семейства».
Одноклеточные или клетки в агрегатах либо пакетах. Клетки от округлых до полусферических; бинарное деление центральное, с образованием одинаковых по размерам дочерних клеток; деление в 2–3 плоскостях, обычно последовательно и под прямым утлом к плоскости предшествующего деления. Каждая клетка или пара клеток окружена отчетливо различимым чехлом, который растягивается при делении клеток; вокруг дочерних клеток образуются новые чехлы, в результате чего чехлы становятся многослойными (рис. 11.1, Е, Ж; табл. 11.5).
Диаметр клеток у шести изученных штаммов варьирует от 3 до приблизительно 30 мкм. Тип среды культивирования зависит от источников выделения клеток, которые варьируют от морских до пресноводных (включая горячие источники и слабокислые болота, а также наземные места обитания). Некоторые штаммы обнаруживают способность к медленному скользящему движению. Некоторые представители – факультативные гетеротрофы (субстратами, обеспечивавшими рост, служили глюкоза, фруктоза, рибоза и сахароза), Некоторые штаммы содержат ФЭ. У одного штамма в состав ФЭ входит фикоуробилин. Хроматическая адаптация отсутствует. Содержание G+C в ДНК от 39,8 до 48,9 мол.%.
Отличия Gloeocapsa от других родов: Gloeocapsa отличает от Synechocystis присутствие слоистого чехла, а от Microcystis – наличие у представителей последнего газовых вакуолей и аморфного чехла. См. табл. 11.5.
Таблица 11.5. Признаки родов Подгруппы 1,
для которых характерно деление клеток в двух или трех плоскостях1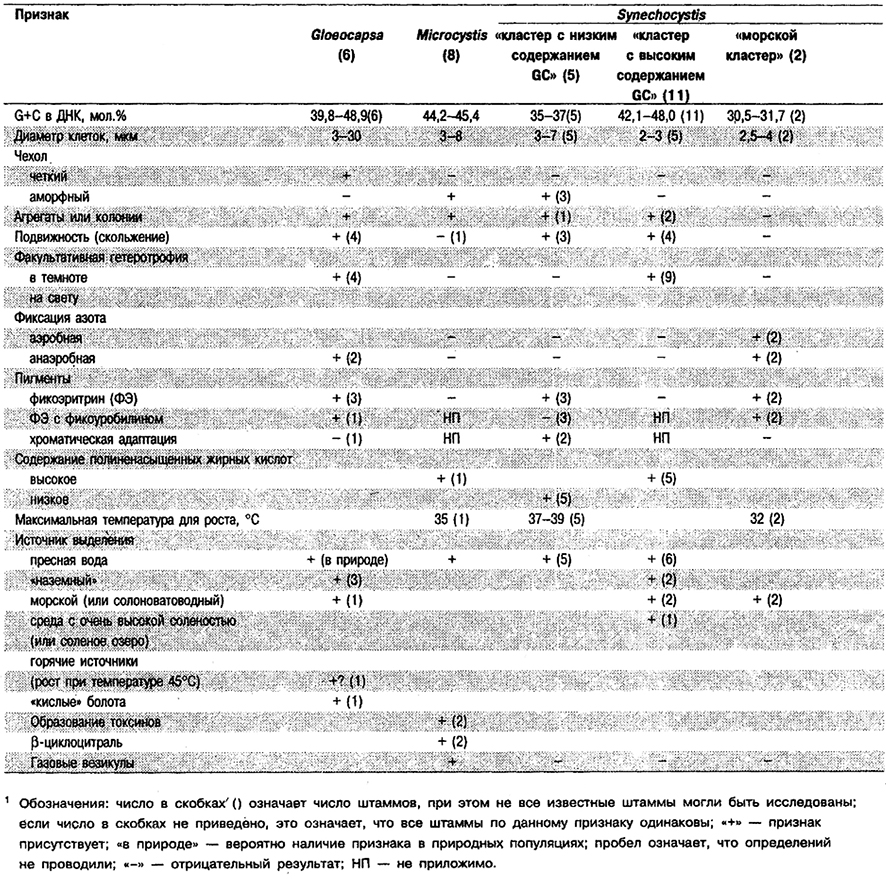
Род Gloeothece
Одноклеточные палочковидные цианобактерии; размножаются путем центрального поперечного бинарного деления с образованием дочерних клеток одинаковых размеров; деление только в одной плоскости. Имеется четко выраженный чехол, окружающий агрегаты из многих клеток. Диаметр клеток у шести культивируемых штаммов 5–6 мкм. Тилакоиды присутствуют (П.Э.М.). Все штаммы содержат ФЭ с фикоуробилином и фикоэритробилином, но в большем количестве – ФЦ. О хроматической адаптации данных нет. Облигатные фотоавтотрофы. Все штаммы фиксируют молекулярный азот в аэробных условиях. Содержание G+C в ДНК у пяти штаммов – 40,8–42,7 мол,% (рис. 11.1, 3).
Отличия Gloeothece от других родов: От «групп культур» Synechococcus и Cyanothece род Gloeothece отличает наличие четко выраженного чехла. От Gloeobacter род Gloeothece отличается присутствием тилакоидов. Деление клеток только в одной плоскости отличает Gloeothece от рода Gloeocapsa, представители которого также имеют выраженный чехол. См. табл. 11.4.
Род Microcystis
Уотербури и Риппка (Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol. 3, pp. 1743–1746) рассматривают семь штаммов из «группы Synechocystis» как «Мiсrосystis-кластер». На основе дополнительной информации (Fahrenkrug et alM Int. J. Syst. Bacteriol. 42: 182–184, 1992) эта группа охарактеризована с большей определенностью, и в настоящее время, по-видимому, оправданно относить все 11 штаммов к роду Microcystis.
Клетки от овальных до сферических, диаметром 3–8 мкм, в образцах из природных источников содержат газовые везикулы и собраны в аморфные агрегаты (колонии), где удерживаются вместе аморфным «слизистым» чехлом. У некоторых культур способность к образованию агрегатов, чехлов или газовых везикул может быть утрачена, что зависит от условий культивирования (Doers, Parker, J. Phycol. 24: 502-508, 1988; Parker, J. Phycol. 18: 471–477, 1982). Размножение происходит путем бинарного деления в трех плоскостях, однако клетки в агрегатах расположены беспорядочно. Агрегаты в виде планктонных колоний всплывают из-за наличия в клетках газовых везикул; обычно клетки образуют и выделяют в среду токсичные пептиды микроцнетин и цианогинозин (Codd, Poon, In: Biochemistry of the Algae and Cyanobacteria, Rogers, Gallon, eds., pp. 283– 296, 1988). Выделяют также β-циклоцитраль – одно из соединений, определяющих запах старых пятен цветения Microcystis в озерах и прудах (Juttner, Z. Naturforsch. С. 39: 867-871, 1984), Содержание G+C в ДНК 39,0–45,4 мол.% (4 штамма) (см. табл, 11.5, рис. 11.1 И, К).
Отличия Microcystis от других родов: Условно данный род можно отличить от «группы кульгур» Synechocystis по наличию газовых везикул, тенденции к образованию трехмерных агрегатов, токсинов и β-циклоцитраля, а также по диапазону значений мол.% G+C (38–45), который занимает промежуточное положение между таковыми для кластеров пресноводных представителей Synechocystis с «низким содержанием G+С» и «высоким содержанием G+С». Способность образовывать трехмерные агрегаты в результате клеточного деления в 2–3 плоскостях служит также признаком рода Gloeocapsa, для которого характерны четко выраженные чехлы или капсулы.
За Microcystis можно ошибочно принять 4 отдельных и легко распознаваемых рода пресноводных, обычно планктонных цианобактерий, пока не изученных в культуре (Coelosphaerium, Snowelia, Worvnichinia, и Gomphosphaeria). Представители этих родов образуют более или менее шаровидные колонии, в которых большинство клеток расположены радиально вблизи поверхностного слоя слизистого матрикса и обычно прикреплены к слизистым стебелькам, радиально отходящим от центра колонии (рис. 11.1, Л–М). См. Котйгек, Hinddk, Arch. Hydrobiol. Suppl. 80: 203-225, 1988.
Род Myxobaktron (= Dactylococcopsis)
Удлиненные одиночные клетки с заостренными концами (рис. 11.1, Н); в культуре получен один вид (штамм); ширина клеток 4–8 мкм, длина 35–80 мкм (см. Walsby et al., Proc. Roy. Soc. Lond. B. Biol. Sci. 217: 417-447, 1983; Komarek, Anagnostidis, Arch. Hydrobiol. Suppl, 73: 157–226, 1986). Размножение путем поперечного бинарного деления на две дочерние клетки одинаковых размеров, у каждой из которых один из полюсов имеет полусферическую форму, пока клетка не удлинится и не произойдет дифференцировка. Деление только в одной плоскости. Единственный штамм, имеющийся в культуре, – морской. Клетки Myxobaktron (Dactylococcopsis) salina в культуре содержат многочисленные газовые везикулы (периферические и терминальные) и не образуют «колоний». Содержат ФЦ, но не ФЭ. Хорошо растут при 34°С в средах с соленостью, соответствующей или превышающей соленость морской воды. Встречаются в планктоне оз. Солар-Лейк, Синай, Египет.
Отличия Myxobaktron от других родов: Эти цианобактерии благодаря их удлиненным клеткам с заостренными концами невозможно спутать с другими. Однако генетических данных для этого рода нет, и он помещен в Подгруппу 1 только по признаку одноклеточности.
Род Synechococcus
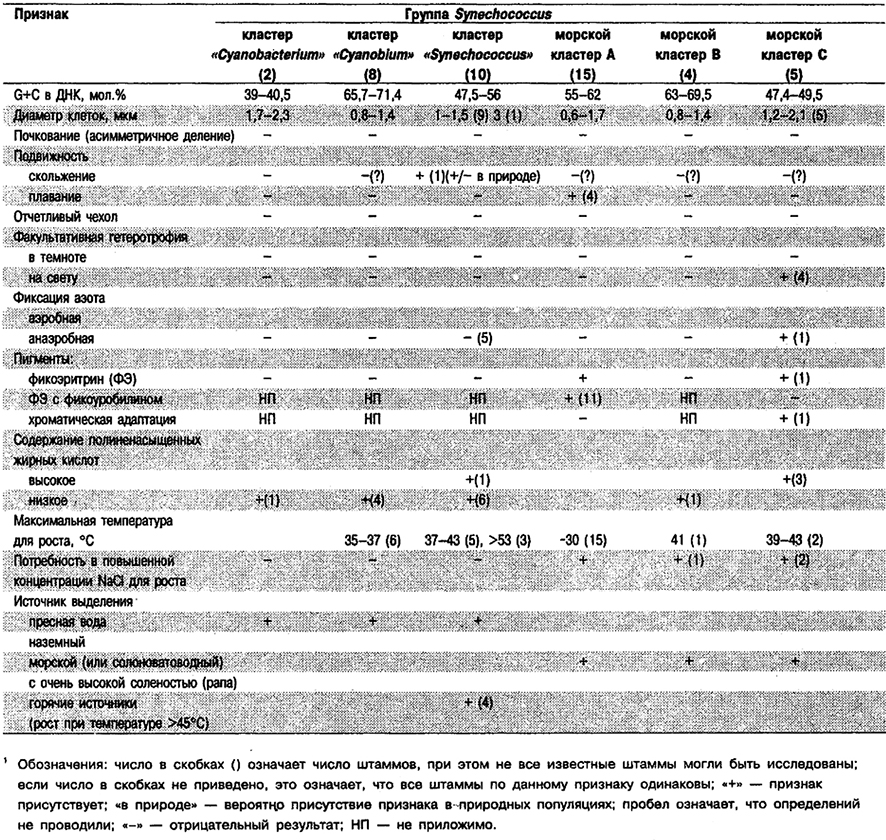
Род Synechococcus (в понимании Уотербури и Риппка; Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol. 3, pp. 1731–1738) в настоящее время рассматривается как временный «сверхрод» или «группа культур», которые в дальнейшем будут подразделены по крайней мере на несколько родов, включая и род Synechococcus. Он подразделен здесь на шесть кластеров, прежде всего на основе различий по мол.% G+C в ДНК. Во всей «группе культур» Synechococcus этот показатель варьирует в пределах 39–71%, т. е. почти столь же широко, как и у прокариот в целом.
В настоящее время «группа культур» Synechococcus определена следующим образом: одноклеточные формы; клетки от палочковидных до кокковидных, диаметром менее 3 мкм; бинарное деление по типу центрального поперечного, только в одной плоскости; тилакоиды присутствуют – периферические и концентрические.
Сведения по каждому из «кластеров штаммов» см. в «Bergey's Manual of Systematic Bacteriology» (Vol, 3, pp, 1731–1738), а также в табл. 11.4 и на рис. 11.1, П–У)
а. «Cyanobacterium-кластер». Мол.% G+C = 39–56,0 (2 штамма). Клетки диаметром 1,7–2,3 мкм неподвижные; содержат ФЦ, но не ФЭ. Облнгатные фотоавтотрофы. Пресноводные.
б. «Synechococcus-кластер». Мол.% G+C = 47,5–55,6 (10 штаммов). Диаметр клеток 1–2–(3) мкм; некоторые представители способны к скользящему движению; содержат ФЦ, но не ФЭ. Облигатные фотоавтотрофы. Пресноводные, встречаются в том числе в горячих источниках. Высокотемпературные штаммы (т. е. растущие при 55–73°С), вероятно, попадают в этот кластер.
в. «Cyanobium-кластер». Мол.% G+C = 65,7–71,4 (8 штаммов). Клетки 0,8–1,4 мкм в диаметре, неподвижные, содержат ФЦ, но не ФЭ. Облнгатные фотоавтотрофы. Пресноводные (один штамм выделен из солоноватой воды).
г. «Морской кластер С». Мол.% G+C = 47,5–49,5 (5 штаммов). Клетки 1,2–2,0 мкм В диаметре, неподвижные; содержат ФЦ; один штамм, обнаруживающий хроматическую адаптацию, содержит С-ФЭ. Этот же штамм в анаэробных условиях синтезирует нитрогеназу. Этот и три других штамма способны к фотогетеротрофному росту (в присутствии дихлорфенилдиметилмочевины). Два штамма галофильные, другие галотолераншые; все из прибрежных морских или солоноватых вод.
д. «Морской кластер А». Мол.% G+C = 55–62 (15 штаммов). Клетки диаметром 0,6–1,7 мкм; у большинства штаммов неподвижные, у четырех обладают способностью к плаванию, уникальной для этого кластера. Все штаммы содержат ФЭ с фикоуробилином или без него. Неспособны к хроматической адаптации. Все штаммы облнгатные фотоавтотрофы. Все обнаруживают потребность в Na+, Cl–, Mg2+ и Са2+ в концентрациях, соответствующих концентрациям этих элементов в морской воде. Нитрогеназу в условиях анаэробиоза ни один из штаммов не синтезирует. Выделены из прибрежных или океанических вод.
е. «Морской кластер В». Мол.% G+C = 63–69,5 (4 штамма). Клетки 0,8–1,4 мкм в диаметре, неподвижные, содержат ФЦ, но не ФЭ. Облигатные фотоавтотрофы. Нитрогеназная активность отсутствует. Один штамм галофиль- ный, другие галотолерантные. Выделены из прибрежных вод.
Отличия Synechococcus от других родов: Одноклеточные цианобактерии Synechococcus, которые делятся только в одной плоскости с образованием двух одинаковых по размерам дочерних клеток, отличает от Gloeothece и Gloebacter отсутствие чехла и от Cyanothece – диаметр клеток, составляющий менее 3 мкм.
Род Synechocystis
Род Synechocystis (с некоторыми изменениями, но в понимании Уотербури и Риппка; Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol, 3, pp. 1742–1746) рассматривается как условный «сверхрод» или «группа культур», которая в дальнейшем, по всей вероятности, будет подразделена. Здесь род разбит на три кластера, которые не перекрываются по величинам мол.% G+C в ДНК. Дополнительный «кластер», выделенный главным образом на основе культуральных признаков, рассмотрен здесь в составе рода Microcystis (см. табл. 11.5).
Одноклеточные цианобактерии кокковидной или сферической формы; бинарное деление центральное, но последовательно в 2 или 3 взаимно перпендикулярных плоскостях. Иногда образуют агрегаты, в которых клетки соединены аморфной слизью. Клетки диаметром 2–7 мкм, у большинства штаммов в пределах 2–4 мкм; тилакоиды присутствуют (рис. 11.2, А–Г).
Сведения по каждому «кластеру» штаммов приведены в руководстве по систематике (Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol. 3, pp. 1742–1746), а также в табл. 11.4.
а. «Морской кластер». Мол.% G+C = 30,5–31,7 (2 штамма). Клетки сферические, диаметром 2,5–4 мкм, одиночные или в парах, неподвижные, делятся в 2 плоскостях, не имеют слизистых чехлов и не образуют агрегаты. Облигатные фотоавтотрофы; обнаруживают нитрогеназную активность в аэробных условиях; все содержат ФЭ с высоким содержанием фикоуробилина. Температура для роста 26–32°С. Тропические. Обнаруживают повышенную потребность в Na+, Сl–, Mg2+ и Са2+.
б. «Кластер с низким содержанием GC». Мол.% G+C = 35–37 (5 штаммов). Клетки диаметром 3–7 мкм, от сферических до овальных; деление в двух (или более) плоскостях (деление в двух плоскостях установлено только у одного штамма). Если деление происходит только в двух плоскостях, клетки могут формировать колонии в виде плоских пластинок [см. род Merismopedia в системе Гейтлера (Geitler, Rabenhorst's Kryptogamenflora 14: 258–266, 1932)], (см. рис. 11.2, Б). Образуют аморфные чехлы (два штамма). Обладают способностью к медленному скользящему движению (три штамма). Облигатные фотоавтотрофы; клетки трех штаммов содержат С-ФЭ. Два штамма способны к хроматической адаптации типа II (см. Tandeau de Marsac, J. Bacteriol. 130: 82– 91, 1977). Максимальная температура для роста 37–39°С (для 5 штаммов). Все организмы выделены из пресной воды.
в. «Кластер с высоким содержанием GC». Мол.% G+C = 42,1–48,0 (11 штаммов). Клетки диаметром 2–3 мкм, от сферических до овальных; деление предположительно в 2–3 плоскостях [для одного штамма установлено деление в трех плоскостях; см. род Eucapsis в системе Гейтлера (Geitler, Rabenhorst's Kryptogamenflora 14: 257–258, 1932)], (см. рис. 11.2, Г). Клетки одного штамма имеют чехол из аморфного вещества. У четырех штаммов описано медленное скользящее движение. Фотогетеротрофы: девять штаммов способны к активируемому светом гетеротрофному росту (Anderson, Mcintosh, J. Bacteriol. 173: 2761–2767, 1991). He содержат ФЭ. Максимальная температура для роста 37–39°С (5 штаммов). Все организмы выделены из пресной воды.
Отличия Synechocystis от других родов: Организмы, отнесенные к Synechocystis, в большинстве одноклеточные, отличаются от других одноклеточных циано бактерий делением более чем в одной плоскости. Synechococcus и Cyanothece, не имеющие чехлов, делятся только в одной плоскости. На ранних одноклеточных стадиях развития представителей нескольких родов Подгруппы 2 можно принять за Synechocystis. Поэтому выделенные культуры необходимо проследить в развитии. Кроме того, за Synechocystis можно принять представителей некоторых родов Подгруппы 2, находящихся на ранних стадиях образования пакетов или агрегатов (см. также Myxosarcina и Chroococcidiopsis, Подгруппа 2). Для Microcystis характерно образование клетками агрегатов, от мелких до крупных, присутствие в клетках газовых везикул, деление также в 2–3 плоскостях, аморфный чехол, покрывающий агрегат клеток (см. род Microcystis). У Synechocystis иногда может происходить образование агрегатов клеток, удерживаемых вместе аморфной слизью или слизистым чехлом, отличным от четких слоистых чехлов Gloeocapsa (также деление в двух или более плоскостях) или оформленных чехлов Gioeothece (деление только в одной плоскости).
Подгруппа 2. (= Порядок: Pleurocapsales)
Клетки от одиночных до соединенных в агрегаты, иногда с нитеподобными выростами (псевдонити). Размножение (по крайней мере частично) путем множественных внутренних делений с образованием мелких сферических клеток (беоциты = нанноциты = «эндоспоры»), которые высвобождаются при разрыве наружного фибриллярного слоя клеточной стенки материнской клетки. Представители родов одноклеточных цианобактерий этой подгруппы размножаются исключительно путем множественных внутренних делений. Агрегаты и псевдонити у других родов образуются за счет бинарного деления клеток, часть которых затем претерпевает внутренние множественные деления с высвобождением беоцитов.
У представителей этой подгруппы каждый цикл внутренних делений не сопровождается увеличением объема дочерних клеток, или беоцитов, (вплоть до их выхода); это отличает данный тип деления от серии бинарных делений, при которых каждый цикл деления сопровождается клеточным ростом (например, у представителей Подгруппы 1). При этом наружный фибриллярный слой клеточной стенки материнской клетки сохраняется в период образования в ней беоцитов, Беоциты сначала окружены только типичной клеточной стенкой грамотрицательного типа; фибриллярный наружный слой стенки может быть образован до или после их выхода из материнской клетки. В некоторых случаях беоциты обнаруживают скользящее движение и фототаксис. У таких беоцитов подвижность прекращается после образования фибриллярного наружного слоя клеточной стенки.
Подгруппу 2 обычно рассматривают как самостоятельную (равнозначную порядку Pleurocapsales), но в системе Комарека и Анагностидиса (Komdrek, Anagnostidis, Arch. Hydrobiol. Suppl. 73: 157–226, 1986) в нее включены представители Подгруппы 1. По мнению этих авторов более 20 родов Подгруппы 1 следовало бы отнести к рассматриваемой здесь Подгруппе 2. В настоящем определителе принята система Уотербури и Риппка (Watterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol, 3, pp. 1746–1770).
Ряд представителей Подгруппы 2, у которых бинарное деление происходит в двух и более плоскостях, в тех случаях, когда не реализуется их способность к образованию беоцитов, могут быть ошибочно приняты за некоторых представителей Подгруппы 1, которые также делятся в двух и более плоскостях (например, Gloeocapsa, Synechocystis, Microcystis).
Ключ для определения родов Подгруппы 2
[П.Э.М. = необходимы данные просвечивающей электронной микроскопии]
I. Размножение только путем множественных внутренних делений (организмы одноклеточные)
А. Беоциты способны к скользящему движению
Род Dermocarpa Б. Беоциты неподвижные Род Хепо coccus
II. Размножение путем множественных внутренних делений, которые следуют за бинарными делениями (сочетание обоих способов деления)
А. Вегетативная клетка, образующаяся в результате удлинения беоцита, претерпевает 1–3 бинарных деления, в результате чего образуется единственная «апикальная» клетка, претерпевающая множественные внутренние деления
Род Dermocarpella
Б. Вегетативная клетка, образующаяся в результате удлинения беоцита, претерпевает несколько последовательных бинарных делений, в результате чего образуются клеточные агрегаты, от которых у некоторых таксонов отходят нити или «псевдонити» различных размеров
1. Бинарные деления происходят последовательно в 3 плоскостях, в результате чего образуются кубические агрегаты (без нитей или псевдонитей), все клетки в которых обычно образуют беоциты
а. Беоциты после выхода обнаруживают скользящее движение
Род Myxosarcina
Б. Беоциты неподвижные
Род Chroococcidiopsis
2. Бинарное деление происходит в нескольких плоскостях, в результате чего образуются агрегаты, или талломы, правильной (кубической) или неправильной формы с нитчатыми или ненитчатыми отростками. Некоторые или все клетки в агрегатах могут образовывать беоциты.
«Группа культур» Pleurocapsa
Род Chroococcidiopsis
Бинарное деление происходит в трех взаимно перпендикулярных плоскостях, в результате чего образуются агрегаты, имеющие форму от неправильной до почти правильной кубической. Обычно каждая клетка в агрегате в результате внутренних множественных делений образует четыре мелких неподвижных беоцита. Беоциты в момент выхода окружены тонким фибриллярным наружным слоем клеточной стенки (П.Э.М.) (рис. 11.3; табл. 11.6).
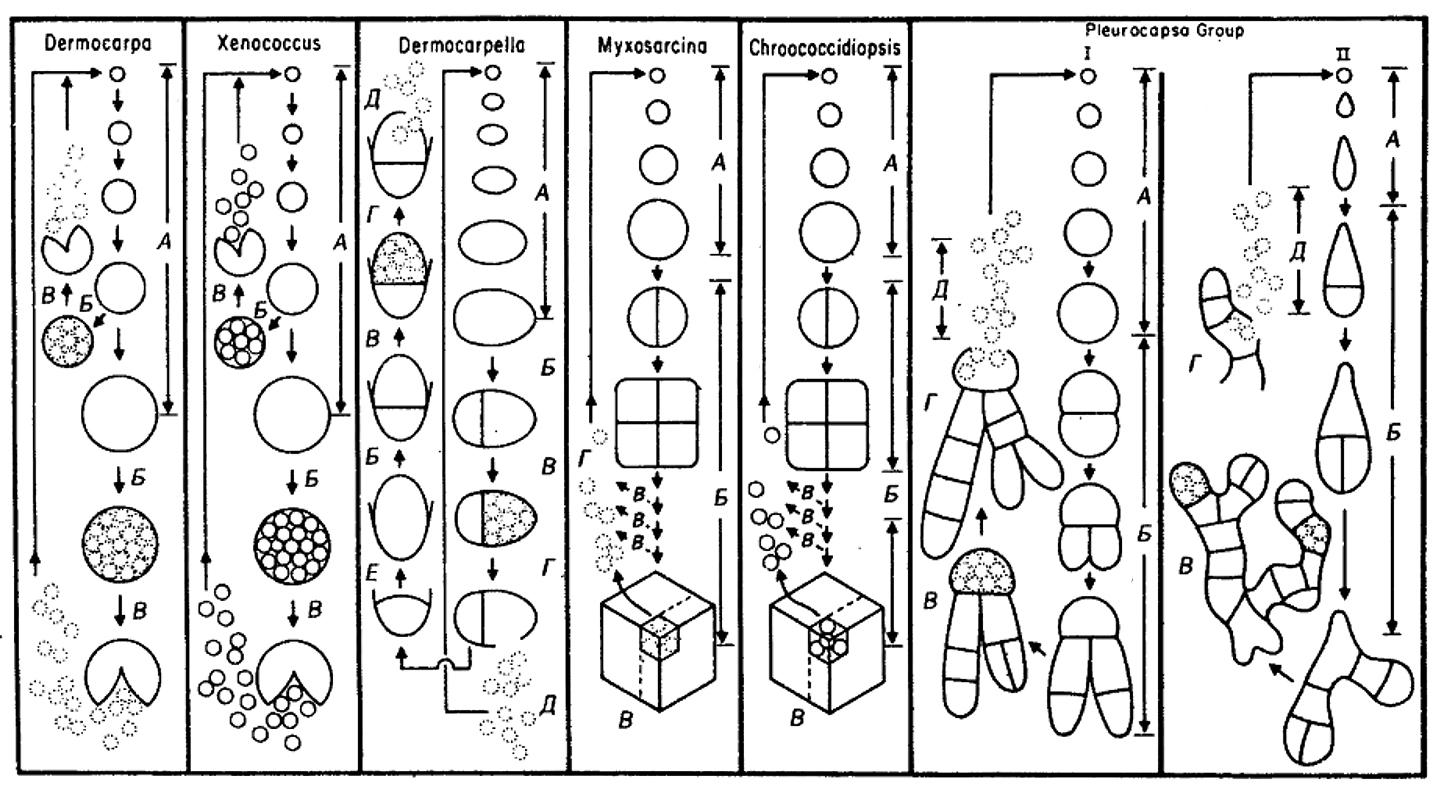
Рис. 11.3. Схематическое изображение представителей родов, входящих в Подгруппу 2. Беоциты, не окруженные в момент их высвобождения фибриллярным поверхностным слоем и, следовательно, подвижные, обозначены кружками из точек, чтобы отличить их от беоцитов, окруженных фибриллярным слоем (кружки, проведенные сплошной линией).
Dermocarpa:
А, симметричное увеличение беоцита;
Б, множественное деление, приводящее к образованию беоцитов;
В, высвобождение беоцитов, подвижных в течение короткого периода.
Xenococcus:
А, асимметричное увеличение беоцита;
Б, множественное деление, приводящее к образованию беоцитов;
В, высвобождение неподвижных беоцитов.
Dermocarpeffa:
А, симметричное увеличение беоцита;
Б, бинарное деление, приводящее к образованию мелкой базальной клетки и более крупной апикальной клетки;
В, множественное деление апикальной клетки, приводящее к образованию беоцитов;
Г, высвобождение беоцитов;
Д, беоциты в период подвижности;
Е, увеличение базальной клетки.
Myxosarcina:
А, симметричное увеличение беоцита до предопределенного размера;
Б, повторное бинарное деление в трех взаимноперпендикулярных плоскостях;
В, множественное деление почти всех клеток в агрегате с последующим высвобождением беоцитов,
Г, беоциты в период подвижностию.
Chroococcidiopsis:
А, симметричное увеличение беоцита до предопределенного размера;
Б, повторное бинарное деление в трех взаимноперпендикулярных плоскостях;
В, множественное деление почти всех клеток в агрегате с последующим высвобождением неподвижных беоцитов.
Pleurocapsa, тип I:
А, симметричное увеличение беоцита;
Б, бинарное деление в различных плоскостях;
В, множественное деление некоторых вегетативных клеток;
Г, высвобождение беоцитов;
Д, беоциты в период подвижности.
Pleurocapsa, тип II:
А, асимметричное увеличение беоцита;
Б, бинарное деление в различных плоскостях;
В, множественное деление некоторых вегетативных клеток;
Г, высвобождение беоцитов;
Д, беоциты в период подвижности.
разрешения по Waterbury, in: The Prokaryotes, 2nd ed.( v, 2 Balows, A., et al., eds., pp, 2058–2078, 1992.
Таблица 11.6. Признаки родов Подгруппы 21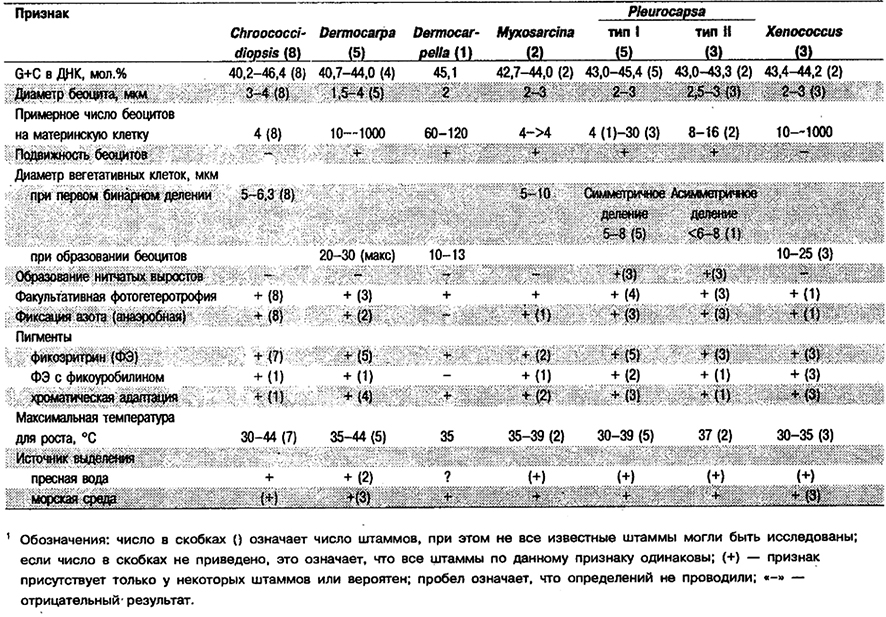
У восьми изученных, штаммов диаметр вегетативных клеток в момент бинарного деления составляет 5–6,3 мкм, диаметр беоцитов 3–4 мкм. Для всех штаммов известна способность к факультативной фотогетеротрофии с использованием глюкозы, сахарозы или фруктозы (у большинства штаммов). Все штаммы в условиях анаэробиоза обнаруживают нитрогеназную активность. У шести штаммов присутствует фикоэритроцианин (ФЭЦ), один штамм содержит ФЭ, в состав которого входит фикоуробилин, и способен к хроматической адаптации. Максимальная температура для роста 39–44°С (семь штаммов). Все организмы выделены из пресной воды. Мол.% G+C в ДНК составляет 40,2–46,4 (табл. 11.6, рис. 11.3).
Отличия Chroococcidiopsis от других родов: Род Chroococcidiopsis (Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol. 3, pp. 1758–1762) отличается от рода Myxosarcina особенностями беоцитов, которые неподвижны у Chroococcidiopsis и обнаруживают медленное скользящее движение после выхода из материнской клетки у Myxosarcina, Увеличенные (перед образованием беоцитов) кубические агрегаты клеток Chroococcidiopsis и Myxosarcina можно ошибочно принять за колонии представителей «кластера с высоким содержанием GC» в «группе культур» Synechocystis Подгруппы 1, также способных образовывать кубические агрегаты в результате последовательных делений в трех взаимноперпендикулярных плоскостях, но никогда не образуют беоциты за счет множественных внутренних делений. Кубические пакеты могут образовывать также представители Gloeocapsa (Подгруппа 1), но у них каждая клетка окружена хорошо выраженным чехлом.
Род Dermocarpa
К Dermocarpa (в понимании Уотербури и Риппка; Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology», Vol. 3, pp. 1751–1754) относятся одноклеточные цианобактерии сферической формы, неспособные к бинарному делению и размножающиеся исключительно путем внутренних множественных делений, в результате которых в клетке образуется 10–1000 беоцитов, способных после высвобождения к скользящему движению.
Диаметр беоцитов варьирует в пределах 1,5–4 мкм (пять штаммов). Родительская клетка перед образованием беоцитов может достигать в диаметре 20–30 мкм. Удлиненная «родительская клетка» при формировании в плотном скоплении может приобретать грушевидную или булавовидную форму. У трех из пяти штаммов наблюдается факультативная фотогетеротрофия с использованием глюкозы (у всех трех штаммов), сахарозы и фруктозы (у двух штаммов). В анаэробных условиях обнаруживают нитрогеназную активность (два штамма). Четыре штамма содержат С-ФЭ, три способны к хроматической адаптации; один штамм содержит ФЭ, в состав которого входит фикоуробилин, и также способен к хроматической адаптации. Витамин В12 стимулирует рост двух штаммов и необходим для роста остальных. Выделены из морской (три штамма) или пресной (два штамма) воды. Мол.% G+C в ДНК составляет 40,7–44,0 (четыре штамма). См. табл. 11.6, рис. 11.3.
Отличия Dermocarpa от других родов: Представителей Dermocarpa легко спутать с Xenococcus. Согласно определению, они различаются только тем, что у последних беоциты неподвижные, а клеточная стенка беоцитов к моменту их выхода из материнской клетки, имеет, кроме обычных для грамотрицательных бактерий слоев, еще дополнительный тонкий фибриллярный поверхностный слой (П.Э.М.). Клетки представителей обоих родов отличаются от одиночных зрелых родительских клеток Chroococcidiopsis и Myxosarcina (которые образуются путем бинарного деления перед «созреванием») тем, что формируют 10 и более беоцитов в каждой материнской клетке вместо типичных четырех у последних двух упомянутых родов.
Увеличивающиеся в размерах клетки Dermocarpa и Xenococcus обычно сферические, тогда как у Dermocarpella они овальные и обнаруживают полярность – присутствие по крайней мере одной базальной вегетативной клетки помимо образующей беоциты материнской клетки на противоположном полюсе (см. ниже). Однако одиночная, неделящаяся клетка Dermocarpa (или Xenococcus) перед образование беоцитов фактически неотличима от неделящихся сферических клеток многих представителей Подгруппы 1 (например, некоторых штаммов Cyanothece, Synechococcus, Synechocystis).
Род Dermocarpella
Яйцевидные агрегаты клеток с одной крупной «апикальной» клеткой и 1–3 более мелкими «вязальными» клетками. В процессе превращения вышедшего из материнской клетки беоцита в начальную вегетативную клетку происходит 1–3 асимметричных бинарных деления, в результате чего образуется яйцевидный полярный агрегат, или таллом. При созревании «апикальная» клетка за счет внутренних множественных делений образует обычно 60–120 беоцитов. Свойственная этому роду полярность – наличие в агрегате одной репродуктивной клетки, образующей беоциты, – уникальна среди цианобактерий Подгруппы 2. Данные получены в результате изучения одного штамма, выделенного из морской среды и имеющего мол.% G-+-C в ДНК, равный 45,1. См. табл. 11.6; рис. 11.3.
Отличия Dermocarpella от других родов. Полярность агрегатов и «специализированная» апикальная клетка, образующая беоциты, – это уникальные свойства, но их можно ошибочно принять за признаки некоторых ранних стаций развития цианобактерий, относящихся к типу II «группы культур» Pleurocapsa, которое также начинается с асимметричного удлинения увеличенного в размерах беоцита и асимметричного бинарного деления (см. рис. 11.3). На ранних одноклеточных стадиях развития представителей Dermocarpella легко принять за многочисленные клетки цианобактерий сферической или овальной формы. Обсуждение таксономии этого рода, особенно в связи с системой Комарека и Анагностидиса (Коmarek, Anagnostidis, Arch. Hydrobiol. Suppl, 73: 196– 204, 1986), см. в статье Уотербури и Риппка (Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol 3, pp. 1754–1758).
Род Myxosarcina
Более подробное описание см. в разд. «Род Chroococcidiopsis». В понимании Уотербури и Риппка (Waterbury, Rippka, In: Sergey's Manual of Systematic Bacteriology, Vol. 3, pp. 1758–1762), Myxosarcina отличается от Chroococcidiopsis только образованием подвижных беоцитов; последнее означает, что на структурном уровне подвижные беоциты еще не приобрели фибриллярный наружный слой стенки, подобный слою, окружающему беоциты Chroococcidiopsis. Таким образом, у Myxosarcina в результате бинарных делений в трех последовательных плоскостях также образуются кубические агрегаты клеток, и каждая вегетативная клетка высвобождает по крайней мере четыре беоцита. Для более детального сравнения см. табл. 11.6 и рис. 11.3.
Род Pleurocapsa
Род Pleurocapsa (в понимании Уотербури и Риппка; Waterbury, Rippka, In: «Bergey's Manual of Systematic Bacteriology», Vol. 3, pp. 1762–1769) рассматривается как условный «сверхрод» или «группа культур», из которой в дальнейшем будут выделены и другие роды.
В настоящее время этот род определяют как род цианобактерий, размножающихся бинарным делением в нескольких плоскостях, с образованием агрегатов клеток в виде компактных масс неправильной формы или масс клеток, от которых отходят нити, от однорядных до неровных многорядных. В результате множественных внутренних делений некоторые клетки в агрегатах или нитях образуют беоциты. Беоциты подвижные. В группе Pleurocapsa различают два типа форм. Тип I: перед первым бинарным делением, при котором образуются две одинаковые клетки, беоцит увеличивается в размерах до сферической клетки. Тип II: перед первым бинарным делением беоцит увеличивается в размерах асимметрично, образуя удлиненную или грушевидную клетку, плоскость деления которой может быть ближе к более широкому полюсу. См. рис. 11.3.
Число бинарных делений, предшествующих образованию беоцитов, не определенно. Благоприятные для роста условия способствуют более раннему образованию беоцитов. Множественное деление может произойти лишь после небольшого количества бинарных делений, даже у штаммов, способных к вегетативному росту с образованием сложных морфологических структур, включая нити и псевдонити. Другие факторы могут также влиять на морфологию агрегатов. У некоторых штаммов при фотогетеротрофном росте образуются кубические агрегаты, тогда как при фотоавтотрофном – агрегаты с псевдонитчатыми выростами. У других штаммов в результате добавления сахарозы однорядная апикальная часть нитей становится многорядной.
Pleurocapsa и ffyella (по Geitler, Rabenhorst's Kryptogamenflora 14: 344–375, 1932) различаются главным образом по характеру роста в природной среде. Представители Pleurocapsa – это эпифиты или эпилиты, a Hyella – эндолиты, проникающие в известковые субстраты, такие как раковины моллюсков. Здесь род Hyella не будет описан отдельно (см. Al-Thukair, Golubic, Algol. Stud. 64: 167–197, 1991). Среди учтенных в данном определителе восьми морских штаммов Pleurocapsa только один растет как эндолит в обломках устричных раковин, и в этом случае может быть необходимым присутствие в культуре гетеротрофных бактерий, образующих кислоту.
Из восьми штаммов семь способны к фотогетеротрофии; шесть обнаруживают нитрогеназную активность в анаэробных условиях. Все восемь штаммов содержат ФЭ, причем у трех в его состав входит фикоуробилин; четыре штамма обнаруживают хроматическую адаптацию (два из них содержат фикоуробилин). Максимальная температура для роста варьирует в пределах 30–39°С. Все восемь штаммов морского происхождения, но известны также представители группы Pleutvcapsa, выделенные из пресной воды (Rippka et al., J. Gen. Microbiol. Ill: 22–23, 1979) и из горячих источников. Последние растут при температуре до 55°С (Wickstrom, Castenhote, J. Phycol. 14: 84– 88, 1978). Мол.% G+C в ДНК составляет 43,0–45,4 (8 штаммов). См. табл. 11,6, рис. 11.3.
Отличия Pleurocapsa от других родов: Из образующих беоциты цианобактерий только для представителей Pleurocapsa характерны крупные аморфные клеточные агрегаты с нитеподобными выростами. Однако в некоторых условиях культивирования штаммы Pleurocapsa могут образовывать подобно Chroococcidiopsis или Myxosarcina кубические агрегаты правильной формы. У представителей двух последних родов беоциты обычно образуются во всех клетках (чаще всего по четыре), тогда как у Pleurocapsa множественное деление претерпевает меньшее число клеток, и обычно в каждой родительской клетке образуется несколько больше беоцитов.
Некоторые из аморфных и псевдонитчатых представителей группы Pleurocapsa напоминают различные формы Chlorogloeopsls (Подгруппа 5). Однако в отличие от Pleurocapsa цианобактерии рода Chlorogloeopsls при недостатке связанного азота в среде способны к образованию гетероцист.
Род Xenococcus
Одноклеточные; клетки сферические, к бинарному делению не способны н размножаются исключительно путем множественных делений: в одной родительской клетке образуется 10–1000 беоцитов. Неподвижные. Фибриллярный наружный слой клеточной стенки формируется у беоцитов до их выхода из материнской клетки (П.Э.М.). У трех штаммов диаметр беоцитов 2–3 мкм, родительских клеток 10–25 мкм. Один штамм – фотоге- теротроф (использует глюкозу и сахарозу), из других штаммов у одного обнаружена нитрогеназная активность в анаэробных условиях. Все три штамма содержат ФЭ, в состав которого входит фикоуробилин, и способны к хроматической адаптации. Максимальная температура для роста 30–35°С. Выделены из морской воды, Мол.% G+C в ДНК составляет 43,3–44,2 (два штамма). См. табл. 11.6 и рис, 11.3.
Отличия Xenococcus от других родов: Род Xenococcus (в понимании Уотербури и Риппка; Waterbury, Rippka, In: Bergey's Manual of Systematic Bacteriology, Vol. 3, pp. 1751–1754) отличается от Dermocarpa только отсутствием подвижных беоцитов. Возможность принять его представителей в период нерепродуктивной стадии за цианобактерии других родов обсуждается в разд. «Род Dermocarpa».
Подгруппа 3. (= Порядок: Oscillatoriales)
Нитчатые цианобактерии; осуществляют бинарное деление в одной плоскости и образуют только «вегетативные» клетки. Гетероцисты или акинеты отсутствуют. У некоторых родов может наблюдаться ложное ветвление. Диаметр трихомов варьирует от приблизительно 0,4 до более чем 100 мкм (редко). Терминальные клетки у некоторых видов могут быть дифференцированными (суженными, иногда с колпачком) и часто менее пигментироваными; у некоторых видов суженный конец трихома может состоять из нескольких субтерминальных клеток. Обычно у одного штамма диаметр центральной части трихома мало варьирует (<10%) в противоположность тому, что характерно для некоторых других подгрупп цианобактерий. Обычно все клетки сохраняют способность к делению, но некоторые части трихома могут быть более активны как меристемы, чем его терминальные участки. Терминальная клетка у некоторых штаммов, будучи дифференцирована, может никогда не делиться. Трихомы могут быть гибкими или полуригидными. Весь трихом может быть закручен в рыхлую или плотную спираль; у некоторых форм только терминальная часть трихома может быть явно спирализована.
Может присутствовать чехол, но даже формы без хорошо заметного чехла при скольжении оставляют позади по крайней мере очень тонкий и эластичный чехол либо слизистый след. У видов с утолщенными (иногда слоистыми) чехлами нити могут лишь медленно передвигаться внутри этих ограничивающих образований. Короткие фрагменты трихома, состоящие из нескольких клеток, иногда отделяются от остальной части трихома около свободного открытого конца чехла; эти свободные трихомы (гормогонии) могут выскальзывать из чехла и передвигаться по субстрату, постепенно формируя новый чехол. Хотя трихомы у форм, лишенных выраженных чехлов, тоже фрагментируются, фазу отделения и миграции гормогониев у них трудно определить, поскольку весь трихом в целом подвижен. Скользящее движение возможно по поверхности твердого или уплотненного субстрата. Движение вперед или назад обычно или всегда сопровождается лево- или правонаправленным вращением трихома. У некоторых форм фрагментация трихомов происходит по участкам, где находятся клетки, потерявшие большую часть своего содержимого и отмершие. В некоторых случаях, по-видимому, происходит упорядоченная «жертвенная» гибель этих некридиальных клеток, определяющая места разрывов трихома.
Состав оснований ДНК широко варьирует (40–67 мол.% G+C). Величина генома тоже сильно варьирует (2,14–5,19 х 109 дальтон), но почти всегда меньше, чем у представителей Подгрупп 4 и 5.
Диапазон состава оснований ДНК и размеров генома свидетельствует о том, что объединение организмов в Подгруппе 3 носит характер весьма искусственного; этот вывод подтверждает значительная степень различий в нуклеотидных последовательностях 16S-pPHK у нескольких штаммов, в настоящее время относимых к этой подгруппе (Giovannoni et al., J. Bacteriol. 170: 3584–3592, 1988; Wilmotte; Golubic, Algol. Stud. 64: 1-24, 1991). Следует подчеркнуть незначительность и предварительный характер некоторых использованных здесь критериев родовых различий. Часто используется лишь единственный (но удобный) признак; это различие может быть результатом лишь незначительных изменений в генотипе.
Представители Подгруппы 3 (порядок Oscillatoriales) встречаются в самых разнообразных местах обитания: пресных и морских водоемах – в планктоне, матах и перифитоне, и часто также в виде наземных корок, матов или дерновинок. В горячих источниках маты, образованные некоторыми цианобактериями этой подгруппы, развиваются при температуре ~62°С. Тесные симбиотические взаимоотношения встречаются редко. Более подробное описание этой подгруппы см. в обзорах (Castenholz, In: Bergey's Manual of Systematic Bacteriology, Vol 3, pp. 1771–1780; Rippka, Methods Enzymol. 167: 41–48, 1988; Anagnostidis, Komdrek, Arch. Hydrobiol. Suppl. 80: 327–472, 1988). В последнем, наиболее обширном обзоре выделены 43, относящиеся к этой подгруппе рода, причем 9 из них новые.
Ключ для определения родов Подгруппы 3
I. Трихомы не цилиндрические (уплощенные или трехлопастные на поперечных срезах
А. Трихомы уплощенные, т. е. эллиптические в поперечном сечении
Род CrinQlium
Б. Трихомы трехлопастные в поперечном сечении
Род Starria
II. Трихомы цилиндрические
А. Трихомы спирально закрученные (спирали открытые или закрытые), обычно по всей длине
1. Спираль трихома обычно почти закрытая (т. е. подобна сжатой пружине); поперечные перегородки тонкие н обычно не видны в световой микроскоп. С помощью П.Э.М. различимы поры в полукруглых изгибах клеточной стенки у перегородок на вогнутой стороне витка
Род Spirulina
2. Спираль трихома обычно открытая (т. е. в виде растянутой пружины); клеточные перегородки видны в световой микроскоп. При П.Э.М. в стенках у перегородок видны многочисленные круговые ряды соединительных пор
Род Arthrospira
Б. Трихомы прямые или изогнуты только на отдельных участках
1. Трихомы, обычно неподвижные, находятся внутри постоянных чехлов (иногда из чехлов могут выходить гормогонии)
а. Два или более трихомов находятся в общем чехле
Род Microcoleus
б. В чехле находится один трихом (у некоторых форм чехлы могут сливаться или ос- лизняться, что приводит к образованию матов или пленок)
Род Lyngbya (включая Porphyrosiphon и Phormidium)
2. Трихомы обычно подвижные; постоянных чехлов нет (трихомы при скольжении могут оставлять за собой почти прозрачный, подобный чехлу, или слизистый след)
а. Перетяжки у перегородок отсутствуют или слабо выражены и не превышают 1/8 диаметра трихома
Роды Oscillatoria и Trichodesmium
б. Перетяжки у перегородок от хорошо заметных до средне выраженных и превышают 1/8 диаметра трихома
Род Pseudanabaena
Род Arthrospira
Нитчатые цианобактерии; размножаются исключительно бинарным делением клеток в одной плоскости. Трихом представляет собой открытую спираль; поперечные перегородки видны в световой микроскоп. Длина клеток обычно меньше их ширины или клетки квадратные, но иногда могут быть и удлиненными (см. Komarek, Lund, Arch. Hydrobiol. Suppl. 85: 1–13, 1990). Перетяжки у перегородок могут быть или отсутствуют. При П.Э.М. можно видеть одиночный полный круг соединительных пор. Постоянный чехол не образуется. Большинство штаммов обнаруживает способность к скользящему движению. Толщина трихомов у разных форм варьирует примерно в пределах 3–12 мкм. Трихом образует открытую спираль шириной около 35–60 мкм. При выращивании на плотной среде объемная спираль превращается в «плоскую». У некоторых штаммов шаг спирали значительно варьирует, и в культурах встречаются почти прямые варианты. Мол.% G+C у эталонного штамма 44,3.
Один штамм представляет собой морскую цианобактерию с толщиной трихома 16 мкм, содержащую газовые вакуоли. Как и все другие известные штаммы, это облигатный фотоавтотроф; способностью к синтезу нитрогеназы в анаэробных условиях не обладает. Содержит ФЦ, АФЦ и ФЭ, лишенный фикоуробилина. Многие штаммы, однако, не содержат и ФЭ. Arthrospira (Spirulina) maxima и А. (Spirulina) platensis используются как источники белковой добавки в пищу человека.
«Жизненный цикл» Arthrospira в культуре вюибчает стадию распада трихомов в участок некридий (лизирующихся клеток), которые расположены регулярно через 4–6 клеток. Образующиеся короткие нейтрализованные гормогонии представляют кратковременную миграционную стадию, или стадию распространения. Клетки каждого гормогония затем делятся, и гормогоний вырастает в новый спиральный трихом.
Представители этой группы цианобактерий, имеющих спиральные трихомы и заметные клеточные перегородки, встречаются в море, солоноватых водах и соленых озерах в поясе тропического и субтропического климата. Многие изоляты используются для аквакультуры. Некоторые формы – планктонные и содержат газовые везикулы, другие – бентосные и лишены газовых вакуолей. Arthrospira часто доминирует в планктоне теплых озер с высоким содержанием карбоната/бикарбоната и высокой щелочностью воды (рН до 11). См. рис. 11.2, Д.
Отличия Arthrospira от других родов: Формы Arthrospira обычно помещали в род Spirulina. По-видимому, более плотно спирализованные и лишенные легко различимых перегородок штаммы Spirulina могут составить самостоятельный естественный таксон. За Arthrospira могут быть также ошибочно приняты виды Oscillatoria, варьирующие по степени спирализации концов трихома; представители этого последнего рода могут даже соответствовать современному описанию Arthrospira.
Род Crinalium
Oscillatoria-подобные цианобактерии; трихомы в поперечном сечении эллиптические, а не круглые (или трехлопастные, как у Starria) (рис. 11.2, Е). У одного имеющегося в культуре вида размеры клеток на поперечном срезе 2–2,5 х 5–7 мкм, в длину клетки короткие (1–1,5 мкм). Терминальные клетки не дифференцированные. Бинарное деление происходит так же, как у Oscillatoria, Клетки неподвижные; тилакоиды расположены преимущественно параллельно и близко к периферии клетки (П.Э.М). ФЭ отсутствует; основные каротиноиды – β-каротин и эхиненон. Фиксацию молекулярного азота не осуществляют ни в анаэробных, ни в аэробных условиях. «Пресноводные»-наземные, встречаются в поверхностном слое леска; засухоустойчивые; при культивировании в среде BG-11 оптимальная для роста температура 25°С. Содержание G+C в ДНК 33,9 мол.%. Более подробное описание см. в работе De Winder et al., J. Gen. Microbiol. 136: 1645-1653, 1990,
Отличия Crinalium от других родов: Только у этих нитчатых цианобактерий трихомы уплощенные (эллиптические на поперечных срезах).
Род Lyngbya
Нитчатые организмы, во всех отношениях сходные с Oscillatoria, но образующие выраженный и постоянно присутствующий чехол. Чехол может быть тонким, но тем не менее различимым с помощью фазово-контрастной оптики, особенно на конце трихома, где чехол заходит за терминальную клетку трихома (рис. 11.2, Ж–К). Диаметр трихома варьирует приблизительно от 1 до 80 мкм. Характеристики клеток совпадают с приведенными в описании рода Oscillatoria, включая окраску.
Трихомы, находящиеся внутри чехла, обычно неподвижны, но при перенесении на свежую агаризованную среду короткие участки трихома (гормогонии) иногда медленно выползают из чехла. У некоторых штаммов гормогонии образуются в большом количестве; они свободно выскальзывают из чехлов и похожи на Oscillatoria, пока не потеряют способность к движению в результате синтеза новых чехлов. В некоторых случаях при быстром росте трихомы выступают из старых чехлов, и их терминальные участки кажутся лишенными чехла.
У одного эталонного штамма содержание G+C в ДНК составляет 43,4 мол.%, а величина генома около 4,58 х 109 дальтон. Однако если принять представленную здесь характеристику рода Lyngbya, в его границы попадает несколько штаммов из «группы LPP» (Rippka et al., J. Gen. Microbiol., Ill: 1–61, 1979), поскольку большинство из них имеет хотя бы тонкий чехол (см. табл. 15 в работе Rippka et al.). Исследование методом гибридизации ДНК-ДНК нескольких форм «осциллаторий», имеющих чехол, показало величины мол.% G+C у этих штаммов в пределах 42–49 (Stam, Arch. Hydrobiol. Suppl. 56: 351-374, 1980).
У некоторых штаммов чехлы очень развитые и прочные, так что при выращивании цианобактерий в жидкой среде спутанные трихомы образуют массу, отделить от которой небольшую часть при помощи пинцета затруднительно. Слоистые чехлы встречаются обычно у видов с большим диаметром трихомов, как у пресноводных, так и у морских форм. У некоторых морских видов, образующих маты, чехлы обычно содержат желтый пигмент (сцитонемин), поглощающий в ближнем ультрафиолетовом диапазоне и придающий всей нити коричневатую окраску (см. Garcia–Pichel, Castenholz, J. Phycol 27: 395–409, 1991). Широкий максимум поглощения этого пигмента лежит в области ближнего ультрафиолетового диапазона, фиолетового и синего участков спектра. У некоторых видов многослойные чехлы содержат пигменты от яр ко-пурпурного до красного (например, род Porphyrosiphon, рис. 11.2, И).
В противоположность Oscillatoria, лишь немногие виды Lyngbya являются планктонными, Формы, содержащие газовые везикулы, не относятся к обычным. Представители Lyngbya (включая Symploca и Porphyrosiphori) обычно образуют наземные дерновидные маты. Кроме того, представители Lyngbya (включая Phormidium) образуют бентосные пленчатые маты в мелких морских (включая литораль) и пресноводных местах обитания.
В общем, виды Lyngbya с более толстыми чехлами труднее выделить в культуру, чем Oscillatoria spp. На агаризованных средах образование подвижных гормогониев происходит не всегда, а к старым чехлам иногда в большом количестве прикреплены клетки загрязняющих культуру бактерий, Скорость роста в культуре видов с толстыми чехлами может быть низкой (менее одного удвоения за 24 ч).
Поскольку род Lyngbya слабо изучен в культуре, мало что известно в отношении его физиологии. У одного эталонного штамма, относящегося к группе образующих маты морских цианобактерий, при инкубации в анаэробных условиях наблюдался синтез нитрогеназы.
Отличия Lyngbya от других родов: В соответствии с принятой здесь предварительной характеристикой род Lyngbya отличается от всех других родов «осциллаториевых» цианобактерий (Подгруппа 3) образованием постоянно присутствующего чехла вокруг индивидуального трихома. Вышедшие из чехлов свободные трихомы (гормогонии), представляющие стадию распространения, легко принять за трихомы цианобактерий рода Oscillatoria. Поэтому необходим длительный период наблюдений за ростом в культуре.
Остается неясность в тех случаях, когда чехлы очень тонкие и прозрачные. Некоторые из форм с тонкими чехлами, равно как и формы с более слизистыми диффузными чехлами, могли быть отнесены к «ботаническим» родам Phormidium или Symploca. Бурелли (Boureliy, Les Algues d'eau douce – algues blues et rouges III, N. Boubee et Cie, pp. 428–453, 1985) также считает, что различия между этими родами слишком незначительны, чтобы разделить их, и поэтому признает только род Lyngbya, основываясь на праве номенклатурного приоритета. Представители другого входящего в «группу LPP» рода Plectonema, для которых характерно более частое ложное ветвление трихомов по сравнению с другими имеющими чехлы формами, могут также быть отнесены к роду Lyngbya, если ложное ветвление не рассматривать как родовой признак (см. рис. 11.2, К). Сходен с Lyngbya и род Porphyrosiphon, отличающийся, однако, образованием многослойных чехлов, содержащих красный или коричневый пигмент (см. рис. 11.2, И). Еще бблыиие трудности возникают при разграничении нескольких «ботанических» родов цианобактерий, у которых помногу неветвящихся трихомов заключено в общий чехол. Это Microcoleus, Hydrocoleum, Siroco- leus, Schizothrix и ряд других, менее известных родов (см. Geitler, Rabenhorst's Kryptogamenftira 14: 1068–1160, 1932: Anagnostidis Komirek, Arch. Hydrobiol. Suppl. 80: 327-472, 1988).
Род Microcoleus
Несколько Oscillatoria-подобных трихомов в общем гомогенном чехле. Обычно несколько параллельных трихомов спирализованы и плотно перекручены (рис. 11.2, Л). Описаны как морские, так и пресноводные виды (Geitier, Rabenhorst's Kryptogamenflora 14: 1131–1146, 1932). Диаметр трихомов у нескольких видов 2–10 мкм. Одному виду было посвящено особенно много исследований, но в основном на материале из матов, образующихся на литорали (М. chthonoplastes). Хотя были исследованы и культуры (включая аксеничные), их изучение мало дало для характеристики рода Microcoleus.
Некоторые исследователи обнаружили, что при выращивании аксеничной культуры общие чехлы исчезают. В других культурах, особенно при направленном освещении, сохраняются пучки трихомов в тонких общих чехлах.
Отличия Microcoleus от других родов: Существует несколько других родов, по своим особенностям весьма сходных с Microcoleus. Эти родовые наименования (например, Hydrocoleum, Schizothrix, Slrocoleus) используются в ботанической литературе, но изучение культивируемых штаммов дало пока недостаточно данных для их характеристики. Поэтому эти роды не включены в настоящий определитель.
Род Oscillatoria
Нитчатые цианобактерии, размножающиеся только бинарным делением клеток и только в одной плоскости. Трихомы от прямых до слабо волнистых, особенно около концов, гибкие или умеренно ригидные. Поперечные перегородки обычно видны в световой микроскоп. Перетяжки у перегородок могут быть или отсутствуют, но никогда не бывают более 1/8 диаметра трихома. Обычно перегородки тоньше, чем боковые клеточные стенки. При делении цитоплазматическая мембрана образует инвагинации вместе с тонким слоем пептидогликана, разделяющим новые мембраны дочерних клеток (П.Э.М.). Помимо Oscillatoria, этот признак присущ родам Spirulina, Arthrospira и Lyngbya.
Длина клеток может быть гораздо меньше их ширины (трихом в этом случае выглядит как пачка дисков) или в несколько раз больше. Диаметр трихомов варьирует от примерно 1 мкм до иногда более чем 100 мкм. У более широких трихомов (>15 мкм диаметром) ширина клеток всегда больше их длины. Трихомы обычно подвижные и при движении вращаются влево и вправо относительно его направления. Если терминальные участки трихомов не находятся в контакте с субстратом, свободный конец может колебаться при вращении трихома, особенно если он изогнут. Скорость движения варьирует от менее чем 1 мкм • с–1 до примерно 11 мкм • с–1. Постоянные чехлы обычно отсутствуют, однако при движении трихома по плотной поверхности за ним остаются почти невидимые тончайшие трубки или просто слизь. Иногда вокруг некоторых трихомов образуется более заметный чехол – особенно в тот период, когда клетки становятся неподвижными в старых культурах в жидкой среде. Трихомы одиночные; если они находятся в скоплениях или в кожистых матах, то окружены морфологически выраженным общим чехлом. Однако в жидких, особенно аксеничных, культурах могут накапливаться значительные количества гелеподобного материала.
У многих видов Oscillatoria терминальные клетки претерпевают дифференцировку и приобретают форму, отличную от той, что наблюдается сразу после фрагментации трихома – просто с выпуклой перегородкой. Форма терминальных клеток специфична для вида; эти клетки могут быть округленными, притуплёнными, усеченными, коническими, постепенно сужающимися и головчатыми. Кроме того, иногда терминальные клетки приобретают поверхностное утолщение наружного слоя клеточной стенки, называемое колпачком. Трихом может быть утоньшен, но только в области нескольких концевых клеток. Концы только что распавшихся трихомов обычно отличаются от окончаний трихомов, прошедших дифференцировку. У многих видов конец трихома загнут (заужен или нет), и искривление может распространяться на участок длиной в несколько клеток. Дифференцированные концевые клетки могут утрачивать способность к дальнейшему делению.
Цвет биомассы может быть разным – от ярко-сине-зеленого до темно-красного. Несколько видов обнаруживают «хроматическую адаптацию» (см. Tandeau de Marsac, J, Bacteriol. 130: 82–91, 1977). Некоторые виды, для которых характерна почти черная окраска, содержат большое количество С-ФЭ и фикоцианина. У некоторых видов Oscillatoria, обитающих в затененных участках (R. W. Castenholz, неопубликованные данные), и у морского планктонного Trichodesmium (= Oscillatoria по мнению некоторых авторов) присутствует содержащий фикоуробилин ФЭ, имеющий широкий максимум поглощения в области 493–495 нм в дополнение к максимуму в области 543–546 нм.
В коллекции культур Пастеровского института содержание G+C в ДНК у 10 штаммов, отнесенных к роду Oscillatoria, варьировало в пределах 40–50 мол.%, а величина генома у 6 изученных штаммов установлена в пределах 2,50–4,38 х 109 дальтон.
Виды Oscillatoria распространены в пресных, морских и солоноватых водах. Они встречаются также в материковых соленых озерах, а несколько видов выдерживают температуру до 56–60°С в некоторых горячих источниках. Ряд видов образует маты в водяных потоках. Ряд видов – планктонные в пресных водах (например, О. agardhii, О, rubescens, О. borneti) или теплых морских водах [например, Trichodesmium (Oscillatoria) spp.]. Эти формы почти всегда содержат газовые везикулы (исключение – О, borneti). Несколько видов известны как подвижные (скользящие) компоненты сообществ микробных матов, которые часто встречаются в местах обитания, богатых сульфидами, Виды Oscillatoria обычны также для других анаэробных сульфид-содержащих мест обитания, таких как осадки стратифицированных эвтрофных озер. Несколько видов встречается в наземных местах обитания, подвергаемых сильному иссушению, или в полярных районах в мелких пресноводных прудах, которые ежегодно замерзают более чем на 9 месяцев.
Все виды Oscillatoria способны к фотоавто- трофии, а некоторые – облигатные фотоавтотрофы. Ни один из штаммов, имеющихся в коллекции Пастеровского института, не обладает способностью к хемогетеротрофии, но некоторые способны к фотогетеротрофии. Несколько видов (например, О. terebriformis) способны к очень медленному росту в темноте в анаэробных условиях за счет сбраживания экзогенных Сахаров, У нескольких видов осциллаториевых цианобактерий обнаружен сульфид-зависимый аноксигенный фотосинтез. Некоторые синтезируют нитрогеназу в анаэробных условиях. Морские планктонные формы [Trichodesmium (Oscillatoria) spp.] фиксируют молекулярный азот, когда растут как пучки трихомов в природных условиях. Один термофильный вид способен использовать азот только в восстановленной форме.
Выделение культур обычно можно осуществить, используя «самоизоляцию» трихомов за счет скользящего, иногда быстрого, движения по поверхности агара (Castenholz, In: Parker, Glazer (eds.), Methods Enzymol. 167: 68–93, 1988). Однако многие виды исключительно плохо поддаются культивированию современными методами; это, в частности, многочисленные, вероятно олитгрофные, морские формы, включая виды Trichodesmium, которые трудно поддерживать в лабораторных условиях.
Отличия Oscillatoria от других родов: Lyngbya, Phormidium, Microcoleus, Symploca, Plectonema, Porphyrosiphon, Borzia, Schizothrix и другие обычные, давно признанные «ботанические» роды почти идентичны Oscillatoria в том смысле, что для каждого из них описан сходный набор типов клеток и трихомов (см. Rippka, Methods Enzymol. 167: 41-48, 1988; Anagnostidis, Коmarек, Arch. Hydrobiol. Suppl. 80: 327-472, 1988). Границы этих и нескольких других родов основаны на признаках, которые могут быть изменчивыми, такие как присутствие или отсутствие плотного или диффузного чехла, количество трихомов в каждом чехле, частота ложного ветвления и длина трихома. Кроме того, нити Oscillatoria при скольжении тоже образуют очень тонкий подобный чехлу футляр. Таким образом существует разнообразие чехлов – от исключительно тонких до более толстых и даже многослойных, причем с каждым типом чехла могут сочетаться сходные варианты осциллаториевых клеток и трихомов.
Род Oscillatoria рассматривается здесь в не столь строгих границах, как в работе Риппка с соавт. (Rippka et al., J. Gen. Microbiol. Ill: 1–61, 1979). Тем не менее, данные о последовательностях оснований 16S-pPHK свидетельствуют о значительных различиях между некоторыми видами этого временного рода (Giovannoni et al., J. Bac- teriol. 170: 3584–3592, 1988). В данном определителе род Oscillatoria включает штаммы с изодиаметрическими или удлиненными клетками (а не только те, у которых клетки укороченные дисковидные) и штаммы, у которых имеются перетяжки – от слабо до умеренно выраженных, но не превышающие 1/8 диаметра трихома (рис. 11.2, М– С; 11.4, А–В). Последний критерий искусственный. При определении таксономических единиц могут помочь критерии на основе данных П.Э.М., предложенные Гильельми и Коэн–Бэзир (Guglielmi, Cohen–Bazire, ProtistoLogica 18: 151–165, 167–177, 1982), если будет исследовано больше штаммов.
Виды рода Trichodesmimum некоторые цианобактериологи рассматривают как виды Oscillatoria, но эта легко определяемая группа морских планктонных организмов обнаруживает специфичные цитологические и другие признаки, что оправдывает отделение ее от рода Oscillatoria (см. род Trichodesmium, рис. 11.4, Б).

Рис. 11.4. Схематическое изображение представителей родов, входящих а Подгруппы 3 и 4.
Подгруппа 3 (продолжение).
A Oscillatoria sp,: форма с большим диаметром клеток, имеющая «вакуоли с соком» и внутриклеточные «цитоплазматические нити» (обозначены линиями).
Б. Trichodesmium (Oscillatoria) sp.: морская планктонная форма, показаны газовые вакуоли. Трихомы обычно в крупных пучках или скоплениях звездчатой формы.
В. Oscillatoria sp.: пресноводная планктонная форма с полярными газовыми вакуолями (ср. О, redekei или Limnothrix redekei)
Г. Pseudanabaena sp. с полярными газовыми вакуолями.
Д. Spirulina sp. в форме плотнозакрученной спирали; поперечные перегородки не показаны.
Е. Starria sp. (трехмерное изображение, показывающее латеральный и лицевой виды трихома).
Подгруппа 4. Ж–К. Anabaena sp.:
Ж, Планктонный вид. показаны газовые вакуоли.
К. Anabaena ( = Апа- baenopsis) sp.; трихом с интеркалярной гетероцистой, по которой происходит разделение трихома, а результате чего гетероциста становится терминальной.
Везде: стрелками указаны гетероцисты; клетки, подрытые точками, – акинеты.
Шкала – (5 мкм) относится ко всем изображениям.
Недавно некоторые исследователи выделили хорошо известные виды, для которых характерны газовые вакуоли, периферические тилакоиды и форма клеток от иэодиаметрической до вытянутой, в род Limnothrix (например, О. redefcef). Это всего лишь один из многих «кластеров» внутри искусственного рода Oscillatoria, которые заслуживают выделения в отдельные роды после более детального изучения культур (см. Anagnostidis, KomArek, Arch. Hydrobiol. SuppL 80: 327-342, 1988).
Род Pseudanabaena
Нитчатые организмы, размножающиеся только бинарным делением в одной плоскости и имеющие выраженные перетяжки в местах клеточных перегородок; у большинства штаммов перетяжки заходят в трихом на 1/2 или более его диаметра, или глубже (рис. 11.4). У нескольких штаммов перетяжки менее глубокие, но все же заходят в трихом на более чем 1/8 его диаметра (см. Oscillatoria). Длина клеток больше их ширины или равна ей, так что клетки часто бочонковвдные. У изученных к настоящему времени в культурах штаммов диаметр трихомов варьирует в пределах 1–3 мкм. Перегородка образована частичным центрипетальным врастанием всех слоев клеточной стенки. В некоторых случаях остается лишь очень узкая область контакта между клетками, и они выглядят как бусы. Ригидный (пептидогликановый) слой перегородки в 3–6 раз толще, чем тот, что окружает остальную часть клетки (П.Э.М.). Трихомы обычно прямые и очень часто короткие, иногда состоящие всего из нескольких клеток. В большинстве культур присутствуют многочисленные одиночные, отделившиеся от трихомов клетки. Трихомы и отдельные клетки обнаруживают способность к скользящему движению без вращения. У нескольких культивируемых штаммов эта способность, по-видимому, утрачена.
У одного вида образуются агрегаты из множества трихомов, напоминающие по форме комету и способные к скользящему движению, обычно с большей скоростью, чем та, что характерна для отдельных трихомов (Castenholz, In: Biology of Cyanobacteria, Carr, Whitton, eds., Blackwell, pp. 413-439, 1982).
У многих штаммов на полюсах клеток имеются скопления газовых везикул, но этот признак обычно бывает выражен не во всех условиях культивирования; у некоторых клонов он, по-видимому, полностью утрачен. Представители рода Pseudanabaena, хотя внешне сходны с некоторыми формами Anabaena из Подгруппы 4, определены здесь как неспособные к образованию специализированных клеток, таких как гетероцисты или акинеты.
Терминальные клетки трихомов не дифференцированы по форме, как это имеет место у многих видов Oscillatoria и Lyngbya, и лишены колпачка. У штаммов Pseudanabaena и некоторых штаммов, сходных с Pseudanabaena, около полюсов клеток расположены кольца (шириной 400–500 нм) из многочисленных (в количестве 300–500) пор, в отличие от штаммов Oscillatoria, для которых характерны одиночные кольца пор (П.Э.М. (см. Guglielmi, Cohen-Bazire, Protistologica, 18: 167-177, 1982).
Цвет цианобактерий Pseudanabaena может быть от сине-зеленого до красноватого, в зависимости от присутствия или отсутствия ФЭ. Содержание G+C в ДНК у 11 штаммов варьирует в пределах 42–48 мол.%, а величина генома у 10 штаммов – в пределах 2,14–5,19 х 109 дальтон.
Pseudanabaena встречается в горячих источниках (вероятно при температуре не выше 55°С) и на морских и пресноводных илах. Особенно эти цианобактерии распространены в анаэробных сульфид-содержащих осадках. Некоторые формы известны в составе пресноводного планктона; их клетки часто присутствуют в слизи других планктонных цианобактерий.
Все известные штаммы – облигатные фотоавтотрофы. Некоторые представители способны синтезировать нитрогеназу в анаэробных условиях. Выделение культур обычно осуществляют с использованием «самоизоляции» за счет скользящего движения.
Отличия Pseudanabaena от других родов: Род Pseudanabaena, как он определен здесь, не столь строго ограничен, как это было предложено ранее (Rippka et al., J. Gen. Microbiol, 111: 1061, 1979), но близко соответствует переописанию этого рода, данному Гильельми и Коэн-Бэзир (Guglielmi, Cohen-Bazire, Protistologica, 20: 377– 391, 393–413, 1984). Риппка с соавт. рассматривали способность Pseudanabaena к скользящему движению в качестве признака, отграничивающего ее (включая одиночные клетки) от некоторых штаммов или видов одноклеточных цианобактерий, относящихся к роду Synechococcus (Подгруппа 1), иногда образующих наряду с одиночными клетками короткие цепочки. Этот критерий, однако, несовершенен, поскольку некоторые штаммы Pseudanabaena потеряли способность к скольжению, а некоторые штаммы Synechococcus ею обладают. В противоположность критерию, предложенному Риппка с соавт., присутствие полярных газовых везикул не рассматривается в качестве надежного признака, поскольку у некоторых культур он утрачен. С другой стороны, в популяциях явно одноклеточного Synechococcus из горячего источника клетки иногда имеют полярные газовые вакуоли.
Сравнительные данные о последовательностях нуклеотидов 16S-pPHK у двух штаммов Pseudanabaena, соответствующих данному здесь определению этого рода, свидетельствуют о значительном отличии последнего от других членов Подгруппы 3 и всех остальных подгрупп (Giovannoni et at., J. Bacteriol. 170: 3584–3592, 1988). Это еще раз подчеркивает искусственность объединения приведенных здесь таксонов в Подгруппу 3.
Род Spirulina
Нитчатые организмы, размножающиеся исключительно бинарным делением клеток только в одной плоскости, но растущие в виде плотно закрытых или почти плотно закрытых лево- или правозакручейных спиралей. Перегородки тонкие, невидимые или плохо различимые в световой микроскоп (рис, 11.4, Д). Чехлы в световой микроскоп не видны; «здоровые» трихомы находятся в постоянном движении. Скользящее движение состоит в винтовом вращении и приводит к интенсивному перемещению в поперечном направлении с незначительномым продвижением вперед. Трихом в действительности не вращается, но движется по наружной поверхности спирали. Свободные концы трихома, не находящиеся в контакте с субстратом, могут сильно колебаться при повороте витка. Верхушка трихома имеет либо притупленную, либо заостренную форму. У различных видов ширина трихома может быть от менее чем 1 мкм до примерно 5 мкм. В последнем случае ширина плотной спирали может достигать 12 мкм. Цвет культур варьирует от сине-зеленого до красного; некоторые морские штаммы, содержащие в качестве основного свето- собирающего пигмента ФЭ, имеют интенсивно красный цвет. Плотность укладки трихома в спираль варьирует, и некоторые штаммы в культуре почти потеряли спиральную структуру.
С помощью П.Э.М. видны группы пор в перегородках (по крайней мере у 4 исследованных штаммов), но только на внутренней (вогнутой) поверхности спирали. У эталонного штамма содержание G+C в ДНК составляет 54,6 мол.%, а величина генома – 2,53 х 109 дальтон.
Встречаются в пресных, морских и солоноватых водах. Отдельные виды обнаружены в соленых озерах и некоторых горячих источниках при температуре до 50°С. Во многих местах обитания обнаруживают устойчивость к свободному сульфиду. Водные организмы; для наземных мест обитания, подверженных периодическому пересыханию, не характерны. Эндо- или экзосимбионты неизвестны.
Физиология Spirulina мало изучена. Один штамм известен как строгий фотоавтотроф, способный в анаэробных условиях синтезировать нитрогеназу. Некоторые красные (адаптированные к низкой интенсивности света) морские штаммы требуют «олиготрофной» среды и растут очень медленно. Термофильный штамм (ср. S. labyrinthiformis) способен к сульфид-зависимому ан оке иге иному фотосинтезу.
Наилучший метод выделения – это использование самоизоляции трихомов за счет скольжения, причем, посколыф на поверхности агара клетки слабо продвигаются вперед, более успешный результат часто дает выделение с поверхности стекла или пластика в жидкой среде.
Отличия Spirulina от других родов. По мнению ряда авторов род Spirulina включает род Arthrospira (см., например, Geitier, Rabenhorst's Kryptogamenflora 14: 916–931, 1932). По данному здесь определению Spirulina трихом у этих цианобактерий закручен в спираль, клеточные перегородки в нем тонкие, невидимые в световой микроскоп, характер расположенных в перегородках пор, возможно, имеет диагностическое значение. У рода Arthrospira, который наиболее вероятно спутать со Spirulina, трихом также уложен в спираль, но клеточные перегородки ясно видны в световой микроскоп. Для видов Arthrospira, описанных на основе морфологических признаков, характерны открытые спирали. У некоторых форм спираль трихома настолько растянута, что они вполне могут быть определены как виды рода Oscillatoria, у многих представителей которого трихомы извитые или образуют очень растянутую спираль вблизи конца.
Род Starria
Нитчатые неветвящиеся цианобактерии, уникальные тем, что их короткие трихомы в поперечном сеченнн трехлопастные. Трихомы от прямых до спирально закрученных, диаметром ~15 мкм. Клетки короткие (1–2 мкм), в плоскости поперечного сечения трехлопастные – широкие лопасти, разделенные U-образными углублениями, расходятся под углом друг к другу (рис. 11,4, Е). Пигменты локализованы преимущественно в лопастях. Трихом покрыт тонким чехлом (3 мкм толщиной). Перегородки, как и у представителей рода Oscillatoria, образованы инвагинациями слоя пептидогликана, но не наружной мембраны. В относительно толстом слое пептидогликана на продольных участках клеточных стенок имеются равномерно распределенные углубления диаметром 70 нм, как у некоторых видов Oscillatoria (например, О. princeps).
Данные организмы известны только по одному штамму, выделенному из образца почвы в Зимбабве, Африка (см. Lang, J. Phycol. 13: 288– 296, 1977). Для его выращивания применяли среду, обычно используемую для цианобактерий, с добавлением почвенной вытяжки; при этом, как отмечено, росту благоприятствовала низкая интенсивность света.
Сведений по физиологии и биохимии мало; очень необычное строение документировано данными световой и электронной микроскопии.
Отличие Starria от других родов: Хотя из клона дикого типа были получены морфологически различающиеся варианты, все они имели характерное трехлопастное строение. Со Starria лишь отдаленно сходен только род лентовидных цианобактерий Crinalium (тоже относящийся к Подгруппе 3) и «ботанический» род Gomontiella, для которого характерна форма поперечного сечения в виде буквы U с почти сомкнутыми концами.
Род Trichodesmium
По морфологическим признакам род трудноотличим от Oscillatoria. Нитчатые, сходные с Oscillatoria цианобактерни, образующие скопления расположенных параллельно (в виде пучков) или радиально расходящихся нитей в планктоне теплых, тропических или субтропических морей. Диаметр трихомов 6–22 мкм (рис. 11.4, Б). В клетках из естественных популяций тилакоиды расположены беспорядочно. Образуют некоторое количество слизи. Поддержание в культуре представляет трудности (см. Castenholz, Methods Enzymology 167: 89, 1988). Описано несколько видов (см, Anagnostidis, Komdrek, Arch. Hydrobiol, Suppl. 80: 416–419, 1988). У всех видов клетки содержат многочисленные газовые везикулы, не спадающиеся даже при высоком гидростатическом давлении (12–37 бар). Для всех представителей характерна красноватая окраска за счет ФЭ, в состав которого входит фикоуробилин. Клетки способны к медленному скользящему движению по поверхности плотной среды. Наличие нитрогеназной активности подтверждено у одного вида или штамма, но предполагается для всех. Образуют крупные популяции, покрывающие обширные океанические пространства. Описаны и два пресноводных вида.
Отличия Trichodesmium от других родов: Представители этого рода могут быть ошибочно приняты за несколько обычных планктонных видов Oscillatoria, имеющих газовые везикулы. Однако эти виды Oscillatoria – пресноводные, a Trichodesmium распространен в морской среде. Кроме того, главная особенность Trichodesmium, отличающая его от Oscillatoriaг – это способность образовывать пучки трихомов, расположенных параллельно или радиально. Пучки того или другого типа образуют также пресноводные планктонные цианобактерии родов Gloeotrichia и Aphanizomenon соответственно, однако для этих двух родов характерно образование гетероцист и, периодически, акинет.
Подгруппа 4 (= Порядок: Nostocales)
Представители этой подгруппы отличаются от всех других цианобактерий как нитчатые организмы, размножающиеся исключительно бинарным делением клеток в одной плоскости (у некоторых возможно ложное ветвление) и способные к образованию гетероцист. У некоторых из этих организмов гетероцисты присутствуют практически в любых условиях окружающей среды. У других дифферен- цировка гетероцист происходит только при низкой концентрации ионов аммония (или нитрата) в среде. У представителей некоторых родов может часто встречаться ложное ветвление, которое, однако, не сопровождается делением более чем в одной плоскости. См. рис. 11.4, 11.5, 11.6 и 11.7.
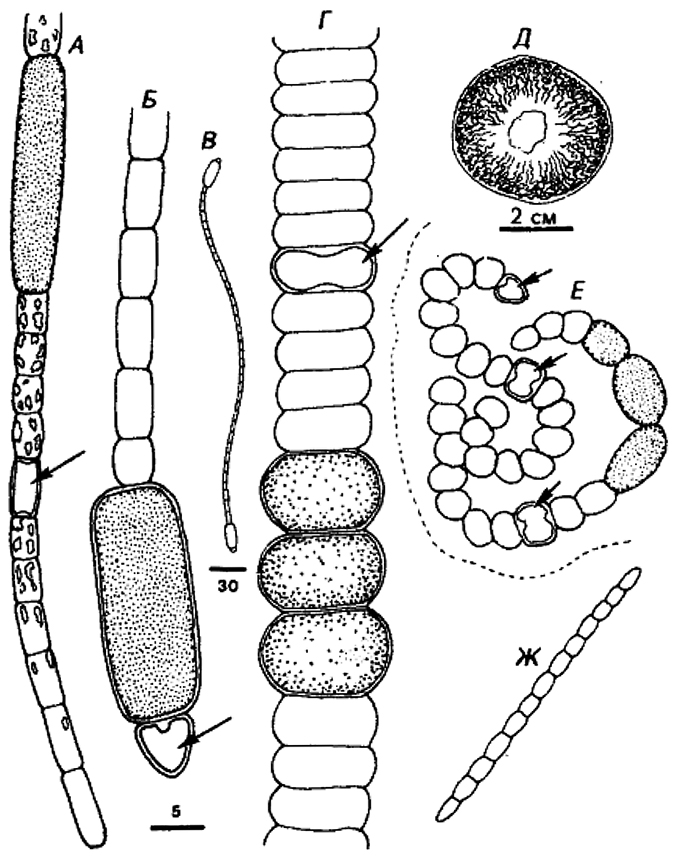
Рис. 11.5. Схематическое изображение представителей родов, входящих в Подгруппу 4 (продолжение).
А. Aphanizomenon sp.: планктонная форма, показаны газовые вакуоли.
Б. Cylindrospermum sp.
В. Cyiindrospermum sp. в уменьшенном масштабе (шкала 30 мкм). На обоих концах трихома расположены гетероциста и акинета.
Г. Nodularis sp. Д. Nostoc sp.: слизистая «колония» в уменьшенном масштабе (шкала 2 см).
Е Nostoc sp.: трихомы внутри слизистой «колонии». Край «колонии» обозначен прерывистой линией.
Ж. Nostoc sp.: подвижный гормогоний.
Стрелками указаны гетероцисты; клетки, покрытые точками, – акинеты. Маркер (5 мкм) относится ко всем изображениям, кроме В и Д, для которых указан другой масштаб.
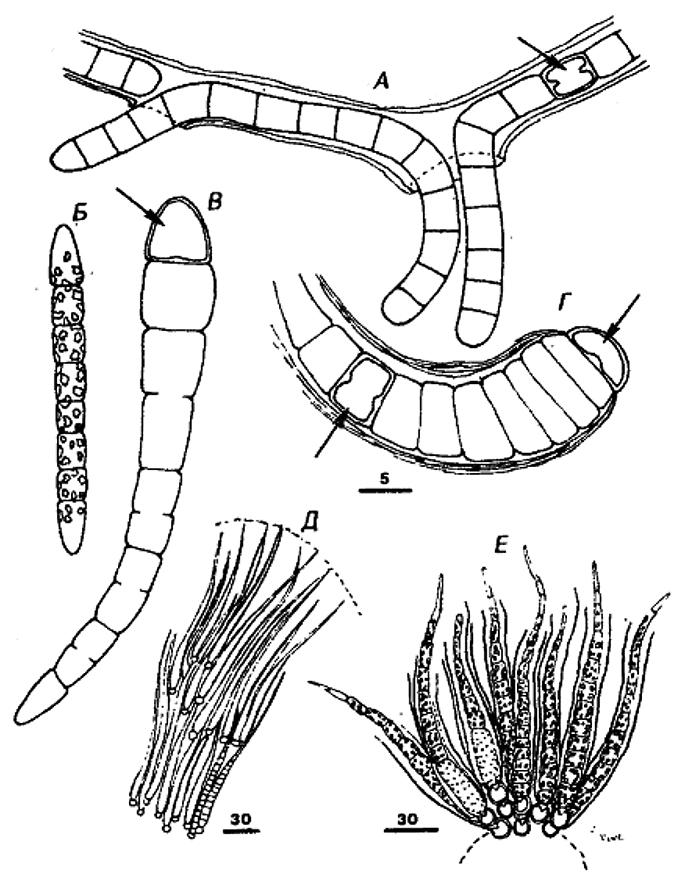
Рис. 11.6. Схематическое изображение представителей родов, входящих в Подгруппу 4 (продолжение).
А. Scytonema sp.: одинарное и двойное ложное ветвление. Присутствует чехол.
Б. Calothrix sp.; гормогоний с газовыми вакуолями.
В. Calothrix sp,: молодой трихом, образовавшийся из гормогония.
Г. Calothrix sp.: многослойный чехол.
Д. Rivularia sp.: часть многоярусной колонии; трихомы с полярными гетероцистами (маркер = 30 мкм).
Е Gloeotrichia sp.: часть планктонной слизистой колонии; показаны газовые вакуоли; все трихомы содержат полярные гетероцисты и некоторые – субтерминальные акинеты (шкала 30 мкм).
Стрелками указаны гетероцисты; клетки, покрытые точками, – акинеты; маркер (5 мкм) относится ко всем изображениям, кроме Д и Е.
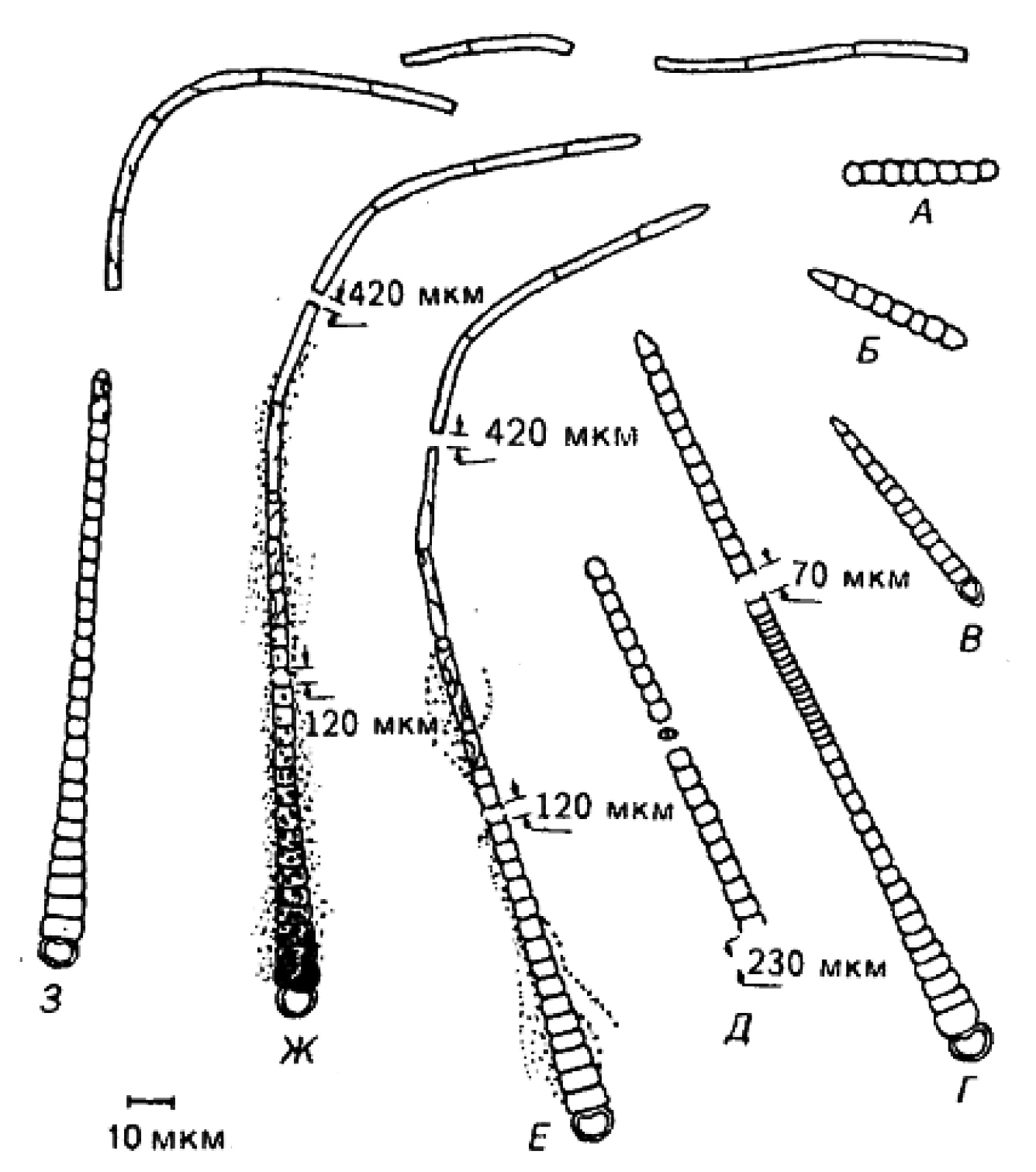
Рис. 11. 7. Морфологические изменения у Cafothrix parfetfna в периодической культуре, выращенной при недостатке фосфора (А–Е) с последующим добавлением фосфата (Ж, 3). Гранулярные включения показаны только на Ж; пунктиром обозначен чехол. А. Стадия I, гормогоний. Б. Стадия I, асимметричный гормогоний. в, Стадия II, образование гетероцист. Г. Стадия И, трихом перед образованием волоска. Д. Высвобождение гормогония в стадии II из трихома в стадии II. В. Стадия III, трихом с волоском, Ж. Стадия IV, образование гранул полифосфата после добавления фосфата, 3. Стадия IV, клетки волоска отделяются от трихома перед высвобождением гормогония (стадия I). (С разрешения по Livingstone, Whitton, Brit. Phycol. J. 18: 29-38, 1983).
Диаметр трихомов у различных видов, трихомы которых не сужаются к верхнему концу, может варьировать в диапазоне 1–30 мкм. У форм с сужающимися трихомами базальная гетероциста имеет диаметр до 25 мкм, тогда как клетки, образующие терминальный волосок, всего 1 мкм. Деление клеток происходит по всей длине трихома или только в его базальной либо центральной части.
Многие представители Подгруппы 4 образуют гелеподобные или слизистые чехлы либо внеклеточный матрикс, консистенция которого может быть от плотной и кожистой до очень мягкой и слизистой. Однако наиболее выраженные чехлы толстые и слоистые. «Ветвящиеся» чехлы у таких родов как Dichothrix и Gardnerula формируют одни из наиболее упорядоченных и морфологически сложных талломных структур у цианобактерий.
Содержание G+C у многих (35) штаммов Подгруппы 4 сходно и варьирует лишь в пределах 35–47 мол.%. Однако величина генома может сильно различаться в пределах 3,17–8,58–109 Да. Результаты секвестрования нуклеотидной последовательности 16S-pPHK у отдельных штаммов 5 различных родов, представляющих три секции Подгруппы 4, свидетельствуют о высокой степени генетического родства этих форм, а также их родства с родами Подгруппы 5, но не с какими-либо родами других подгрупп цианобактерий (Giovannoni, J. Bacteriol. 170: 3584–3592, 1988).
Цианобактерии, относящиеся к Подгруппе 4, могут встречаться в более разнообразных местообитаниях, чем представители других подгрупп, и часто входят в симбиотические ассоциации. Несколько планктонных видов Anabaena, Nodularia, Aphanizomenon и Gloeotrichia служат главными возбудителями цветения в озерах, особенно если вода круглый год остается теплой, а в зонах умеренного климата летом или осенью. Цианобактерии родов Nodularia и Anabaena вызывают цветение в соленых озерах и в солоноватых водах, например в Балтийском море. Однако в океаническом планктоне свободноживущие цианобактерии Подгруппы 4 не составляют существенного компонента. Все планктонные формы образуют газовые везикулы. Некоторые виды Anabaena и Aphanizomenon широко известны как возбудители цветения эвтрофных озер, а отдельные штаммы образуют токсины, представляющие опасность для животных. Представители многих видов большинства родов обычно прикреплены к субстрату в пресноводных и морских местах обитания: цианобактерии видов Calothrix, а также родов Gloeotrichia, Rivularia, Dichothrix и Gardnerula образуют подушки, от плотных до студенистых, на поверхности твердых субстратов; для некоторых видов характерна инкрустация СаСО3. Цианобактерии Nostoc в пресных водоемах образуют плотные сферические или аморфные слизистые колонии, величина которых варьирует от микроскопической до размеров кегельного шара. Calothrix, Scitonema и близкие им роды более других характерны для наземных мест обитания, особенно в условиях влажного или тропического климата. Однако многие цианобактерии этой подгруппы, по-видимому, устойчивы к полному высушиванию. Для Nostoc хорошо известно образование наземных матов, высыхающих в определенные сезоны. Представители этой подгруппы не встречаются при очень высоких температурах в горячих источниках; для большинства известных термофильных штаммов (Calothrix sp.) максимальная температура 52–54°С.
Представители этой подгруппы известны как внутри- и внеклеточные симбионты, которые в одних ассоциациях выделяют связанные углерод и азот, а в других, по-видимому, непосредственно используются хозяином как источник связанного азота. В симбиотических ассоциациях встречаются главным образом виды Nostoc и Anctbaena, хотя и представители рода Richelia обнаружены в клетках некоторых морских планктонных центрических диатомовых водорослей. Наиболее распространенные ассоциации – лишайники, но известны симбиозы цианобактерий и с зелеными растениями, такими как печеночники, роголистники, папоротники, цикадовые и из покрытосеменных – Gunnera.
Определить с помощью световой микроскопии, что цианобактерии относятся к Подгруппе 4, часто легче, чем установить принадлежность к первым трем подгруппам. Ключевым признаком служит наличие гетероцист; однако, если присутствие их дает решающее доказательство, то отсутствие еще не позволяет делать выводы. В некоторых природных популяциях гетероцисты встречаются редко, а в культурах иногда необходимо индуцировать их образование. Кроме того, представители некоторых родов, возможно родственные тем представителям Подгруппы 4, у которых трихомы на концах сужены, не образуют гетероцист ни при каких известных условиях.
Подгруппа 4 распадается на 3 секции, в кото-, рые могут быть помещены все роды за исключением нескольких. Комарек и Анагностидис (Коmarek, Anagnostidis, Arch. Hydrobiol. Suppl. 82: 247–345, 1989) различают в ней 4 секции (семейства) и 32 рода.
А. Секция А (семейство: Nostocaceae). Все вегетативные клетки в норме делятся; положение гетероцист (интеркалярное или терминальное) и а кинет часто служит критерием для разграничения родов; трихомы состоят из вегетативных клеток одинакового диаметра (т. е. концы трихомов не сужены); ложное ветвление отсутствует. Трихомы способны к скользящему движению или неподвижные; подвижность может быть характерна только для гормогониев (стадия распространения); при скольжении трихомы, по-видимому, не вращаются.
Б. Секция В (семейство: Scytonemataceae), У всех родов имеет место ложное ветвление трихомов; трихомы на концах не сужены (за исключением одного рода неясного систематического положения, у которого концы трихомов слегка сужены); клеточное деление обычно происходит в субтерминальном участке трихома или «ветви». Гетероцисты часто расположены около мест ложного ветвления; присутствуют акинеты.
В. Секция С (семейство: Rivulariaceae). Трихомы слегка или сильно сужены к вершине, т. е. имеют полюса – основание и вершину). Вершина часто оканчивается длинным бесцветным многоклеточным «волоском». Деление клеток обычно происходит только в базальном или интеркалярном участке трихома; гетероциста чаще всего служит базальной клеткой трихома, но может быть также интеркалярной. Акинеты могут образовываться или отсутствуют; ложное ветвление имеет место или отсутствует.
Ключ для определения родов Подгруппы 4
(Гетероцисты потенциально имеются у всех родов)
I. Размножение путем деления клеток по всей длине трихома и, кроме того, распада трихома; трихомы не сужены на одном конце или только слегка сужены и обычно способны к скользящему движению (часто очень медленному)
А. Гетероцисты интеркалярные и часто также терминальные; расположение акинет (если они присутствуют) разнообразное
Б. Гетероцисты исключительно терминальные, обычно только на одном конце трихома, но иногда на обоих его концах; акинета или акинеты примыкают к гетероцистам
Род Cylin drospennum (Секция А)
1. Вегетативные клетки сферические, овальные или цилиндрические удлиненные
а. Вегетативные клетки цилиндрические (обычно в трихомах, расположенных параллельно в пучках); клетки более удлиненные и в основном бесцветные около концов трихома
Род Aphanizomenon (Секция А)
б. Вегетативные клетки цилиндрические, овальные или сферические
Род Anabaena (Секция А) (включает Anabaenopsis и Cyanospira)
2. Вегетативные клетки имеют длину меньше ширины, могут быть диско видной формы
Род Nodularia (Секция А)
II. Размножение путем диффузного (по всей нити) или локализованного клеточного деления; трихомы суженные или не суженные, имеют чехол, или много трихомов находится в общем матриксе; неподвижные, за исключением коротких мигрирующих и лишенных гетероцист цепочек клеток (т. е. гормогониев)
А. Трихомы суженные на одном конце и с чехлами; гетероциста (если таковая присутствует) служит базальной клеткой на широком конце трихома; не суженные на конце подвижные гормогонии (состоят из клеток меньшей ширины по сравнению с вегетативными) образуют базальную гетероцисту, когда прекращают движение
Род Calothrix (Секция С) (включает R'tvuiaria, Gloeoirichia и другие роды)
Б. Трихомы не суженные на концах и с выраженными чехлами; характерно ложное ветвление, часто около интеркалярной гетероцисты; гормогонии состоят из клеток такого же диаметра, как и вегетативные клетки; гормогонии также образуют базальную гетероцисту, когда прекращают движение
Род Scytonema (Секция В) (включает Totypothrix)
В. Трихомы не суженные на концах и без ложного ветвления. Группу трихомов окружает общий гелеподобный матрикс, по крайней мере в природных условиях; гормогонии того же диаметра, что и вегетативные трихомы, или диаметр гормогониев меньше; после прекращения движения гормогония в нем образуются терминальные гетероцисты, обычно на обоих концах
Род Nosioc (Секция А)
Подгруппа 4, Секция А (Семейство: Nostocaceae)
В культурах эта секция представленна преимущественно штаммами, которые подпадают под описания родов Anabaena, Nostoc, Nodularia, Cylindrospermum и Aphanizomenon. Организмы всех этих родов лишены полярности, в том смысле, что их трихомы не сужены на одном конце и не имеют ложного или настоящего ветвления (= семейство Nostocaceae).
Имеются и другие роды, описанные здесь не полностью, которые были включены в секцию А или в ботаническое семейство Nostocaceae Гейтлером (Geitier, Rabenhorst's Kryptogamenflora 14: 801–905, 1932), Дезикачари (Desikachary, Cyanophyta, New Dehli, pp. 349–433., 1959) и Бурелли (BoureOy, Les Algues d'eau Douce III, Paris, pp. 414–428, 1985). Некоторые из них перечислены ниже.
Richelia: неразветвленные и не суженные на верхнем конце короткие трихомы; гетероцисты, если присутствуют, полярные. Встречаются внутри клеток планктонных морских диатомовых водорослей, в основном Rhizosolenia spp.; в культуре не получены.
Wollea: этот род отличается от Nostoc наличием мешковидных слизистых талломов, в которых трихомы расположены параллельно друг другу; описан один вид.
Anabaenopsis: род, возможно отличающийся от Anabaena или Cylindrospermum (рис. 11.4, К). Основными критериями для его выделения служат терминальное расположение гетероцист (во время дифференцировки непосредственно перед разделением они расположены интеркалярно и в парах) и образование акинет на максимальном удалении от гетероцист (в отличие от Cylindrospermum). Поскольку у видов Anabaenopsis иногда встречаются одиночные интеркалярные гетероцисты, нет оснований для отделения Anabaenopsis от Anabaena по этому признаку, хотя результаты изучения культур в дальнейшем могут доказать обратное. Род Cyanospira (Florenzano et ah, Arch. Microbiol. 140: 301–306, 1985), вероятно, может быть включен в эту группу (см. род Anabaena).
Hormothamnion: род, хорошо известный по морским образцам; представители образуют кустистые пучки ложноразветвленных нитей; гетероцисты только интекалярные.
Aulosira: род включает несколько видов, обычно встречающихся в тропиках, в пресных водах. Сходен с Anabaena, но отличается наличием постоянного чехла; гетероцисты интеркалярные; акинеты часто расположены цепочками. Бурелли (Bourelly, Les Algues d'eau Douce III, Paris, p. 416, 581, 1985) включает Aulosira в Nodularia.
Род Anabaena
Трихомы не суженные на концах; перетяжки в местах клеточных перегородок отчетливые. Трихомы могут бьггь прямыми, изогнутыми или спиральными. Клетки цилиндрические, сферические или бочонковидные. Длина клеток не меньше ширины или только слегка меньше, ширина варьирует в пределах 2–10 мкм, но у некоторых видов превышает 20 мкм. Зрелые терминальные клетки могут быть округлыми, суженными или коническими. Гетероцисты интеркалярные или терминальные, или и те и другие (рис. 11.4 Ж–К). Интеркалярные гетероцисты от почти сферических до цилиндрических с закругленными концами; терминальные гетероцисты сходной формы или иногда конические. Акинеты обычно образуются к концу сезона роста, и их положение в трихоме различно у разных видов. Отчетливые индивидуальные чехлы у трихомов отсутствуют, но часто имеется слизистый покров.
Трихомы, свободные от клейкой слизи, в норме подвижны (скорость движения обычно меньше 1 мкм/с), и колоний не образуют. Размножение происходит путем распада «родительских» трихомов на более короткие, неотличимые по размерам клеток от исходного трихома. Газовые везикулы присутствуют у многих видов, преимущественно планктонных. Многие виды распространены повсеместно как основные компоненты пресноводного планктона, а также во многих соленых озерах. Другие встречаются в тихопланктоне или перифитоне. Симбиотические организмы из рода Anabaena (например, A. azollae в ассоциации с водным папоротником Azolla), вероятно, должны рассматриваться как вид рода Nostoc (см. Rippka, Methods Enzymol. 167: 28–67, 1988). В морском планктоне виды Anabaena не бывают главными компонентами. В пресноводном планктоне встречается по крайней мере 15 видов, содержащих газовые везикулы, среди наиболее обычных – А. spiroides, A. circinalis и A. jlos-aquae.
Физиология и биохимия штаммов Anabaena изучена довольно подробно. Штаммы Anabaena служили объектами наиболее серьезных исследований в области азотфиксации, а также строения и дифференцировки гетероцист у цианобактерий.
Из семи штаммов, изученных Риппка с соавт., все были облигатными автотрофами и содержали кроме ФЦ фикоэритроцианин (ФЭЦ), однако сушествуют и виды, содержащие ФЭ (культуры красноватого цвета). Некоторые культивируемые штаммы Anabaena – факультативные гетеротро- фы. Содержание G+C в ДНК примерно у 20 штаммов варьирует в пределах приблизительно 35–47 мол.%. Размеры генома у 6 штаммов варьируют в пределах 3,17–3,89 х 109 дальтон.
Как и для получения чистых культур многих других нитчатых скользящих цианобактерий, для выделения штаммов Anabaena эффективен метод отмывания или метод самоизоляции за счет скольжения, но важен также предварительный этап получения накопительной культуры в среде, не содержащей связанного азота. Через несколько дней, часто после начального периода пожелтения трихомов (недостаток азота), в них образуются гетероцисты (если они не присутствуют конститутивно), и начинает происходить фиксация азота. Для поддержания культур следует использовать среду без связанного азота или с низким его содержанием, чтобы трихомы проходили «нормальное» развитие и имели характерный вид.
Отличия рода Anabaena от других родов: Риппка с соавт. (Rippka et al., J. Gen. Microbiol. Ill: 34– 46, 1988), основываясь только на изучении культивируемых штаммов, дифференцировали Anabaena от Nostoc по критерию подвижности. У Anabaena все вегетативные трихомы в норме подвижны, и любые более короткие фрагментированные трихомы выглядят неотличимыми от «родительского» трихома, тогда как у Nostoc вегетативные трихомы неподвижны. Nostoc неотличим от Anabaena практически по всем морфологическим критериям, но подвижны у него только гормогонии – короткие, лишенные гетероцист цепочки клеток, часто меньшей толщины по сравнению с нормальными вегетативными трихомами. В культурах, однако, подвижность обычно утрачена, но все же Nostoc можно отличить по образованию не содержащих гетероцист коротких трихомов (гормогониев), в которых клетки часто меньше по ширине, чем в типичных трихомах, и содержат газовые везикулы, даже если в клетках родительских трихомов они отсутствуют.
Nostoc традиционно отличают от Anabaena по образованию крупных или мелких слизистых колоний, часто имеющих определенную форму. Однако в некоторых культурах роста колоний не происходит. В некоторых аксеничных культурах колонии все же образуются; в природных условиях это свойство хорошо коррелирует со стадией неподвижности, за которой следует распространение подвижных гормогониев.
Anabaena здесь отделена от Nodularia, хотя, возможно, основания для этого незначительны. У Nodularia длина клеток заметно меньше ширины, и форма их обычно дисковидная. Как и у Anabaena, выраженные гормогонии не образуются, и вегетативные трихомы подвижны. Anabaena отличается также по одному главному признаку от хорошо известного рода Aphanizomenon, хотя несколько других ее свойств характерны также и для немногих видов, составляющих этот последний род. У Aphanizomenon длина клеток больше их ширины, но несколько клеток у концов трихома постепенно становятся более вытянутыми, суженными и почти прозрачными (рис. 11.5, А). Другие специфические особенности Aphanizomenon приведены в описании этого рода.
Anabaena отличается от Cylindrospermum, для трихомов которого характерна (в начале развития) единственная терминальная гетероциста, впоследствии примыкающая к субтерминальной акинете (но см. род Trichormus по Кошйгек, Anagnostidis, Arch. Hydrobiol. Suppl 82; 247–345, 1989). Кроме того, у цианобактерий последнего рода нет специализированных гормогониев и вегетативные трихомы в норме подвижны. Обычно, когда трихом Cylindrospermum достигает достаточной длины, чтобы распасться посередине, до или после фрагментации трихома на противоположном его конце образуется другая терминальная гетероциста (иногда с прилегающей к ней акине- той) (см. рис. 11.5, Б, В).
Anabaenopsis – это род, который в настоящее время следовало бы включить в род Anabaena. У большинства видов трихомы изогнутые или спирально закрученные, только с терминальным расположением гетероцист, за исключением трихомов, достигших значительной длины, у которых сдвоенные гетероцисты расположены в центре; когда удлиненный трихом распадается в участке между двумя гетероцистами, те опять становятся терминальными. Оба известных вида Cyanospira (Florenzano et al., Arch. Microbiol. 140: 301–306, 1985), хотя они и имеют наряду с терминальными интеркалярные гетероцисты, по другим признакам очень сходны с двумя традиционно описанными видами Anabaenopsis, выделенными так же как Cyanospira из щелочных африканских озер (рис. 11.4, К).
Род Aphanizomenon
Трихомы прямые, обычно слегка суженные на обоих концах; клетки вблизи концов трихома более удлиненные и прозрачные (с низким содержанием питментов), выглядят вакуолизованными. Параллельно лежащие трихомы образуют хлопьевидные пучки. Типичные планктонные организм». В пучках трихомы скользят относительно друг друга. Гетероцисты интеркалярные, часто редкие и ббльших размеров (преимущественно в длину), чем вегетативные клетки. Акинеты удалены от гетероцист, а по размерам гораздо длиннее и несколько шире вегетативных клеток. Вегетативные клетки обычно содержат многочисленные газовые везикулы (рис. 11.5, А).
Этот род наиболее известен двумя планктонными видами, A. flos-aquae и A. gracile, распространенными и повсеместно и достигающими высокой численности во многих мезотрофных и эвтрофных озерах в поясе умеренного климата, особенно поздним летом и осенью. Aphanizomenon встречается также в солоноватых водах Балтийского моря наряду с Nodularia spumigena и Anabaena sp.
На чистых культурах Aphanizomenon работ таксономического характера пока проведено мало. Выделение и поддержание культур этих цианобактерий, имеющих практическое значение, представляет значительные трудности (см. О'Flaherty, Phinney, J. Phycol. 6: 95–97, 1970; Heaney, Jaworski, Brit. Phycol. J. 12: 171–174, 1977). В моноциан обактериальных культурах легко удавалось поддерживать образование нормальных хлопьевидных пучков трихомами этих цианобактерий, если среда содержала достаточно железа в доступной для использования форме.
Род Cylindrospermum
Трихомы не суженные на концах, с единственной терминальной гетероцистой (рис. 11.5, Б, В). Однако, когда длина трихома превысит определенную величину, на другом его конце также образуется гетероциста, и впоследствии происходит разрыв посередине трихома. Рядом с гетероцистой образуется единственная акинета или несколько акинет. У большинства видов диаметр клеток 3–6 мкм; акинеты значительно крупнее, до 20 мкм. Трихомы способны к медленному движению; специализированных гормогониев не образуется. Индивидуальные чехлы отсутствуют, но может наблюдаться слизь, удерживающая вместе большое количество трихомов. У трех штаммов содержание G+C в ДНК в среднем варьирует в пределах 43,1–46,7 мол.% при размерах генома у двух штаммов 5,71–6,15 х 109 дальтон. Все три изученных штамма образуют ФЭЦ, два – облигатные фототрофы и один штамм – факультативный аэробный хемогетеротроф, способный расти за счет использования фруктозы или сахарозы.
Cylindrospermum наиболее известен как род не планктонных организмов, а компонентов тихопланктона или перифитона пресных вод. Некоторые виды встречаются также во влажных наземных местах обитания. Растут в среде BG-11 или ее модификациях, в отсутствие связанного азота.
Отличия рода Cylindrospermum от других родов. По признаку полярности трихомов (одна терминальная гетероциста) представителей Cylindrospermum легче всего спутать с Calothrix или каким- либо другим родом секции С подгруппы 4. Трихомы Calothrix при росте в среде, богатой азотом, часто не сужены на концах и не имеют терминальной гетероцисты, из-за чего их и можно принять за трихомы Cylindrospermum либо других родов в сходных условиях. Однако у Cylindrospermum форма клеток в «молодых» трихомах более близка к прямоугольной, чем у Calothrix. Для того чтобы различить роды с полярными трихомами, всегда лучше выращивать материал в условиях дефицита питательных веществ.
Род Nodularia
Вегетативные клетки, акинеты и гетероцисты в длину меньше, чем в ширину, часто дисковидные или близкой формы (рис. 11.5, Г). Ширина клеток постоянна по всей длине трихома и варьирует у нескольких описанных видов в пределах 4–18 мкм. Уплощенные гетероцисты расположены интеркалярно; акинеты, также уплощенные, обычно расположены на отдалении от гетероцист и часто группами. В разных условиях обычно наблюдается медленное скользящее движение. У культивируемых штаммов клетки не содержат ни ФЭ, ни ФЭЦ.
Среднее содержание G+C в ДНК у одного изученного штамма – 40,5 мол.%, размеры генома – 3,89 х 109 дальтон. Этот штамм – факультативный аэробный хемогетеротроф, использующий глюкозу, фруктозу или сахарозу.
Представители данного рода, особенно N. spumigena, известны как широко распространенные, обладающие газовыми везикулами, планктонные организмы, часто доминирующие в планктоне соленых озер и солоноватых морских водоемов, таких как Балтийское море. Соленость, по-видимому, служит главным фактором, определяющим распространение Nodularia. Штаммы выделяют в основном из вод с соленостью 3–67%о. Наилучший рост наблюдается при солености 5–20%о NaCl. Nodularia характерна также для вод с рН 8,2–10,0.
Культуры выращивают в среде BG-11; можно также использовать среду, описанную Букером и Уолсби (см. Walsby, In: The Prokaryotes, Vol, 1. pp. 224–235, 1981). Фототрофный рост в аэробных условиях при избытке N2 медленный . Обычно оптимальная для роста температура 25–30°С.
Отличия рода Nodularis от других родов: Подобно Aphanizomenon, Nodularia отличается от Anabaena в основном по одному признаку. У Nodularia клетки уплощенные (т. е. с длиной меньше ширины). У Anabaena длина клеток больше ширины, либо форма клеток близка к сферической. Пока в результате дальнейших исследований не будут обнаружены дополнительные различия, можно как соглашаться, так и не соглашаться с тем, что этот критерий достаточен, чтобы сохранять Nodularia в качестве самостоятельного рода.
Род Nostoc
Трихомы не суженные на концах и имеют выраженные перетяжки в местах перегородок. Клетки цилиндрические, сферические или овальные (бочонко- видные), с длиной меньше ширины. Гетероцисты в большинстве случаев интеркалярные. У разных видов диаметр трихомов варьирует в пределах 2–8 мкм. В общем описание отдельных трихомов Nostoc совпадает с описанием таковых Anabaena.
Для Nostoc характерно наличие сливающегося желеобразного материала (геля), удерживающего вместе массы трихомов, часто в виде массивного таллома, который может иметь сферическую, овальную или менее определенную форму. Некоторые колонии или талломы приобретают форму уплощенных дисков или крупных листков либо могут быть мягкими и аморфными. Во многих случаях наружный слой колонии твердый и кожистый, и в нем находится большая часть трихомов, тогда как внутренность колонии мягкая, желеобразная и содержит немного трихомов, которые однако могут быть расположены радиально (рис. 11.5, Д–Ж). Размеры колоний варьируют от микроскопических (если колония происходит от единственного остановившегося трихома) до более 20 см в диаметре.
Риппка с соавт. (Rippka et al.3 J. Gen. Microbiol., Ill: 41–46, 1979; Methods Enzymol. 167: 48– 54, 1988) рассматривают образование студенистых колоний в качестве вторичного признака, поскольку некоторые штаммы в культурах не образуют геля и талломов. Отличительной особенностью Nostoc (в отсутствие колоний) служит цикл развития. Вегетативные трихомы не способны к скользящему движению. Однако в них образуются и затем высвобождаются короткие цепочки клеток (гормогонии). Гормогонии, обычно подвижные, вначале примыкают к одиночной гетероцисте или расположены между двумя гетероцистами, но сами лишены гетероцист. После периода «миграции» гормогонии прекращают движение, и в это время в них дифференцируются две терминальные гетероцисты. Затем продолжается клеточное деление и рост, сопровождаемые в природных условиях и иногда в культурах образованием геля. Гормогонии обычно уже, чем вегетативные трихомы; в отличие от вегетативных трихомов гормогонии часто содержат газовые везикулы и обладают плавучестью. Эти признаки позволяют отличить гормогонии, даже если их подвижность не очевидна (как у некоторых культивируемых штаммов).
Содержание G+C в ДНК у 13 штаммов Nostoc варьирует в пределах 39–45 мол.%, размеры генома у 11 из этих штаммов 4,00–6,42 х 109 дальтон.
Из 13 штаммов, исследованных Риппка с соавт. (Rippka et al., J. Gen. Microbiol. Ill: 41–46, 1979), только три были неспособны расти фотогетеротрофно. У нескольких видов и штаммов Nostoc другими авторами описана способность к медленному хемогетеротрофному росту в темноте. Из упомянутых выше 13 штаммов четыре синтезировали, кроме фико цианина, С-ФЭ. Семь других штаммов синтезировали ФЭЦ вместо ФЭ. Некоторые, по-видимому, потеряли способность к фиксации молекулярного азота в аэробных условиях, несмотря на присутствие у них гетероцист. У 10 штаммов можно индуцировать образование акинет. У двух штаммов трихомы в старых культурах обычно распадаются на отдельные клетки. Такие клетки обычно присутствуют в массе в развивающихся колониях, а также в симбиотических ассоциациях.
У нескольких видов Nostoc вегетативные клетки содержат газовые везикулы, хотя лишь немногие колонии достаточно плавучи, чтобы быть планктонными. Различные виды Nostoc известны как компоненты бентоса пресноводных озер. Во многих случаях полусферические колонии не прикреплены, но просто лежат на поверхности плотных или незатвердевших осадков. Для некоторых видов характерно прикрепление к твердым субстратам в озерах или в водных потоках и для многих видов – образование в пресной воде или во влажных наземных местах обитания аморфных пластинок или массы соединенных гелем трихомов. Известно, что цианобактерии Nostoc образуют толстые мягкие маты в полярных районах, где, по-видимому, служат основными поставщиками связанного азота. Как симбионты (основные фикобионты) виды Nostoc присутствуют в цианолишайниках, а также встречаются в качестве азотфиксирующих симбионтов в трехкомпонентных цефалодийных лишайниках, нескольких эмбриофитах, таких как мхи и цикадовые, и в ассоциациях с покрытосеменными растениями рода Gunnera.
Многие культуры растут в среде BG-11 без NH4+ и N03– (среда для азотфиксирующих пресноводных цианобактерий) (табл. 11.1). Однако для разнообразных видов и штаммов Nostoc могут быть пригодны и многие другие цианобактериальные среды. При выделении новых штаммов обычно используют способность Nostoc образовывать подвижные или плавучие (содержащие газовые везикулы) гормогонии; последние появляются на поверхности агара или жидкой среды, когда свежесобранный природный материал (или стареющие накопительные культуры) помещают на или в богатую питательную среду.
Отличия рода Nostoc от других родов: Род Anabaeпа, наиболее близко сходный с Nostoc, отличается от него подвижностью вегетативных трихомов и отсутствием цикла развития, включающего дифференцировку гормогониев. Гормогонии у некоторых видов Nostoc морфологически очень сходны с трихомами Pseudanabaena (Подгруппа 3), в том числе по присутствию в них полярных газовых везикул. Однако постепенно гормогонии развиваются в неподвижные, утолщенные и имеющие гетероцисты трихомы Nostoc, образующие или не образующие гель.
Ранее в качестве основного признака, отличающего этот род, рассматривали способность к образованию слизистых колоний или талломов. Этот критерий, безусловно, по-прежнему применим к природным популяциям, а также ко многим культивируемым штаммам.
Подгруппа 4, секция В (Семейство: Scytonemataceae)
Для цианобактерий, образующих эту секцию, характерны однорядные трихомы, обычно не суженные к концам и заключенные в чехлы, а также одинарное или двойное ложное ветвление трихомов, частое или не частое. Участки клеточного деления обычно расположены вблизи вершины трихома, а не по всей его длине. Гетероцисты преимущественно интеркалярные и часто локализованы в участках ложного ветвления. Акинеты отсутствуют или редкие. Могут образовываться (обычно терминально) и высвобождаться гормогонии, не содержащие гетероцист. Представляя собой в отличие от трихомов короткие цепочки клеток, гормогонии имеют такую же толщину, как и родительские трихомы. После прекращения движения в гормогонии происходит дифференцировка одиночной терминальной гетероцисты, Клетки обычно прикреплены к субстрату. Водные (пресноводные или морские) либо наземные организмы, часто образующие макроскопические пучки, подушечки или клубки нитей.
Гейтлер (Geitler, Rebenhorst's Kryptogamenflora 14: 677–801, 1932) считал, что в эту группу входит 12 родов. Бурелли (BourrelJy, Les Algues d'eau Douce HI, Paris, pp. 390–402, 1985) признал 6 или 7 родов. По нескольку штаммов каждого входящего в эту группу рода были детально исследованы в культурах с целью их таксономического описания. Ниже приведены краткие характеристики нескольких родов для их общего распознавания, однако подробно будет описан только род Scytonema. Хотя в эту группу иногда включают род Plectonema, здесь он упомянут выше как представитель Подгруппы 3. В соответствии с принятым в данной системе определением этот род должен быть исключен из Подгруппы 4, поскольку ни при каких условиях не образует гетероцист. Трихом у представителей рода Plectonema обычно окружен чехлом (т. е, Lyngbya-Tvinb) и обнаруживает ложное ветвление, от частого до не частого (рис. 11.2, К).
Ниже приведены краткие описания некоторых дополнительных родов, входящих в Секцию В:
- Tolypothrix: трихомы в чехлах по одному; ложные ветви одиночные и обычно связаны с одиночной гетероцистой или сдвоенными гетероцистами,
- Hydrocoryne: трихомы по нескольку в одном чехле; ложные ветви одиночные, длинные, лежащие вблизи основной нити.
- Coleodesmium (=Desmonema): в одном чехле от немногих до нескольких трихомов; ложные ветви одиночные; таллом с псевдодихотомическим типом ветвления нитей.
- Petalonema: Scytonemа-подобные трихомы внутри многослойного толстого чехла.
- Scytonematopsis: трихомы в чехлах по одному, ложные ветви обычно одиночные, иногда сдвоенные. Единственный признак, отличающий этот род от Scytonema, – утоньшение трихомов на концах.
- Diplocolon: трихомы короткие, искривленные, по нескольку в общей гелевой оболочке; индивидуальные трихомы в чехлах и с ложным ветвлением; образуют корочки на влажных или периодически пересыхающих наземных субстратах.
Род Scytonema
Трихомы однорядные, окруженные чехлами, со сдвоенными или иногда одиночными ложными ветвями и областью деления клеток вблизи вершины трихома или ложкой ветви (рис. 11.6, А). Длина клеток может быть больше или меньше их ширины. Диаметр трихомов варьирует у разных видов (~2 → 20 мкм), причем толщина нити может быть значительно больше за счет чехла. Род Tolypothrix может быть включен в род Scytonema или исключен из него, но у Tolypothrix, согласно определению, двойное ложное ветвление отсутствует или встречается редко.
У основной части исследованных штаммов образуются гормогонии, по диаметру не отличающиеся от вегетативных трихомов. После прекращения периода подвижности в гормогонии происходит дифференцировка единственной терминальной гетероцисты, а затем начинается деление клеток и рост трихома. У одного штамма содержание G+C в ДНК составляет 44,4 мол.%. Размеры генома 7,40 х Ю9, наибольшие среди всех изученных циано- бактерий, за исключением некоторых штаммов Calothrix (см. Секцию С).
Один штамм (культивируемый в среде BG-11, табл. 11-1), кроме ФЦ, содержит ФЭЦ. Эта цианобактерия – факультативный аэробный хемогетеротроф, т. е. способна расти в темноте за счет использования глюкозы, фруктозы или сахарозы. На агаризованных средах наблюдается рост прямостоячих воздушных нитей. Изучение другого вида Scytonema в моноцианобактериальной неаксеничной культуре показало, что частота двойного, множественного или одинарного ложного ветвления положительно коррелирует с количеством образующихся гетероцист и, следовательно, обратно пропорциональна концентрации питательного субстрата (т. е. связанного азота) в среде (Jeeji-Bai, Schweiz. Z. Hydrol. 38: 55–62, 1976). Наиболее типичный для Scytonema характер роста наблюдается при использовании бедной среды. Ложное ветвление часто происходит, когда неподвижная гетеро- циста, по-видимому, начинает препятствовать дальнейшему росту трихома, что приводит к вздутию чехла и прорыву через него трихома.
Если рассматривать слегка выраженную полярность трихомов и их одинарное ложное ветвление как надежные признаки, основываясь при этом на генетических критериях (см. Rippka, Methods En- zymol. 167: 48–58, 1988; Котйгек, Anagnostidis, Arch. Hydrobiol, Suppl. 82: 284–289, 1989), то, вероятно, резонно считать род Tolypothrix и, возможно, другие роды самостоятельными таксонами. На аксеничной культуре Tolypothrix tenuis (содержит С-ФЭ) выполнены хорошо известные исследования хроматической адаптации, но не проведено существенного таксономического анализа.
Отличия Scytonema от других родов: Трихомы tonema легко можно принять за Lyngbya (Подгруппа 3), если в момент исследования отсутствуют гетероцисты или ложные ветви. Если ложное ветвление имеет место (даже нечастое), но нет гетероцист, этот род можно принять за ботанический род Plectonema, который в настоящем определителе включен в род Lyngbya (Подгруппа 3). Во всех случаях чехол хорошо различим.
Подгруппа 4, Секция С (Семейство: Rivulariaceae)
Основные отличительные признаки: трихомы на концах суженные, по крайней мере в условиях низкой концентрации связанного азота, однорядные, без ветвления. При низком содержании связанного азота в среде образуются терминальные гетероцисты (могут также присутствовать интеркалярные гетероцисты). Участки клеточного деления расположены интеркалярно и часто локализованные, Суженный конец трихома иногда продолжается в длинный бледный многоклеточный волосок (особенно при дефиците в среде фосфора).
Диаметр гормогоннев меньше диаметра наиболее крупных клеток вегетативного трихома. Гормогонии образуются в культуре в ответ на внесение в среду фосфора после истощения по нему. Когда заканчивается период скольжения, гормогонии останавливаются, в них происходит дифференцировка базальной гетероцисты и начинается рост, приводящий к образованию суженных на конце трихомов. Трихомы обычно прикреплены к субстрату по одному или группами, образующими полусферические или шаровидные «подушки». Колониальные планктонные формы с радиально расположенными трихомами образуют шары; эти формы содержат газовые везикулы, так же как гормогонии многих сидячих цианобактерий этой группы,
В Секцию С включено много «традиционных», или ботанических, родов. Цианобактерии родов Calothrix и, в меньшей степени, Gloeotrichia и Rivularia подробно исследованы в культуре. Здесь детально будет описан только Calothrix. Несколько видов Gloeotrichia и Rivularia, однако, хорошо известны по описаниям природных популяций.
Ниже приведены многие «традиционные» роды семейства Rivulariaceae. Другие описаны Гейтлером (Geitler, Rabenhorst's Rryptogamenflora 14: 581-673, 1932), Т. В. Дезихачари (Т. V. Desikachary, In: Cyanophyta, New Delhi, pp. 507–565, 1959) и Бурелли (Bourrelly, In: Les Algues d'eau Douce III, Paris, pp. 402–412, 1985).
С гетероцистами:
- Calothrix: гетероциста базальная, иногда имеется многоклеточный терминальный волосок; акинеты редкие – если образуются, то рядом с гетероцистами; может присутствовать слизистый чехол; нити иногда образуют агрегаты.
- Gloeotrichia: род сходен с Calothrix, но трихомы, радиально расположенные и имеющие чехлы, образуют сферические (планктонные) или полусферические (прикрепленные) колонии; на поздней стадии роста рядом с гетероцистами образуются акинеты.
- Rivularia: род сходен с Gloeotrichia; слизистые или корковатые полусферические прикрепленные колонии состоят из Calothrix-подобных нитей, однако акинеты не образуются.
- Sacconema: колониальные организмы; мягкие толстые чехлы, окружающие Calothrix-подобные трихомы, сливаются между собой.
- Isactis: корочки, образованные Cabthrix-поцрбными нитями.
- Dichothrix: Calothrix-подобные трихомы с многочисленными ложными ветвями; по нескольку или много трихомов в общем чехле; трихомы часто образуют щеткоподобные макроскопические талломы.
- Gardnerula (= Polythrix): усложненный вариант Dichothrix; прикрепленный таллом ветвится дихотомически или субдихотомически, достигая высоты 1–3 см.
- Microchaete (= Fremyella): отличается от Calothrix тем, что трихомы менее суженные или не суженные, терминальные волоски отсутствуют и имеется больше интеркалярных гетероцист. Комарек и Анагностидис (Коmarек, Anagnostidis, Hydrobiol. Suppl. 82: 284– 289, 1989) и другие авторы помещают этот род в отдельное семейство (Microchaetaceae).
Без гетероцист:
- Описано несколько родов, у которых трихомы постоянно суженные на одном конце, как у Calothrix, однако гетероцисты отсутствуют. Поскольку индукция дифференцировки гетероцист обычно зависит от концентрации в среде аммония или нитрата, оценить правомерность выделения этих родов возможно лишь в том случае, если они будут критически изучены в культурах. Примерами могут служить роды Homoeothrix, Leptochaete, Аттоtoidea и Эти роды, поскольку они характеризуются отсутствием гетероцист, вероятно, должны быть помещены в Подгруппу 3.
Род Calothrix
Зрелые трихомы имеют суженный конец и вязальную гетероцисту с одной порой, обычно окружены чехлом, часто слоистым, открытым на суженном конце трихома (рис. 11.6, Б-Г; 11.7). Базальный (широкий) конец трихома примерно от 2,5 до 18 мкм в диаметре, а нить (трихом + чехол) у некоторых видов может достигать толщины 30 мкм. Более детальное описание Calothrix см. в работе: Whitton, In: The Cyanobacteria. Fay, Van Baalen, eds., Elsevier, pp. 513–534, 1987.
Хотя в данном обзоре не приводится описание многочисленных видов Calothrix, необходимо указать для их дифференциации следующие морфологические признаки: ширина трихома, степень расширения трихома у основания, наличие или отсутствие удлиненного бесцветного многоклеточного «волоска», отходящего от суженного конца трихома, степень агрегации в пучки и образование акинет (редко). На проявление некоторых из этих признаков влияют внешние условия, поэтому судить о них можно лишь по результатам изучения культур. У большинства штаммов существенное утоньшение конца трихома и дифференцировка базальной гетероцисты наблюдаются только в средах, дефицитных по связанному азоту. При росте культур в богатых фосфором средах в апикальной части трихома образуется гормогоний, обычно из 8–10 клеток. Гормогонии часто содержат газовые вакуоли, обладают плавучестью и иногда очень тонкие – могут быть в 4 раза тоньше основания зрелого трихома, так что их легко принять за гормогонии Oscillatoria или Pseudanabaena (Подгруппа 3). Подвижные гормогонии часто агрегируют, образуя комки. Для родственных «традиционных» ботанических родов характерно постоянное во многих случаях формирование таких агрегатов гормогониев, дающих начало макроскопическим колониям.
На одном конце каждого гормогония дифференцируется гетероциста с одной порой. Обычно у основания гормогония образуется только одна гетероциста. Однако, если кроме азота лимитирующими компонентами среды оказываются железо и молибден, после разрушения предшествующей гетероцисты базальная вегетативная клетка может развиться в новую однопоровую гетероцисту.
Трихом удлиняется за счет удлинения клеток и за счет деления клеток. Деление клеток происходит только в базальной части трихома. Однако при высокой концентрации фосфата на вершине трихома образуется гормогоний; у некоторых видов образование новых гормогониев происходит неоднократно. В некоторых случаях гормогоний изолируется от остальной части трихома в результате отмирания интеркалярной клетки (т. е. некридиальной клетки).
Образование и выход гормогониев прекращаются при исчерпании фосфора в среде. У некоторых штаммов суженный конец трихома при этом начинает дифференцироваться в многоклеточный волосок. Клеточных делений не происходит, просто несколько терминальных и субтерминальных клеток начинают утоньшаться и удлиняться. Эти клетки становятся бесцветными и теряют большую часть своей цитоплазмы. Последующее добавление в среду неорганического или органического фосфора приводит к тому, что у трихомов, имеющих волоски, большая часть вегетативных клеток апикального района ниже волоска дифференцируется в гормогоний (в отсутствие клеточного деления), а волосок отпадает. Волоски могут иногда образовываться и при недостатке железа.
Многие ФЭ-содержащие штаммы Calothrix обнаруживают «хроматическую адаптацию». Другие в качестве основного фикобилина содержат только ФЭЦ или ФЦ. Большинство штаммов – факультативнее фотогетеротрофы, способные расти за счет использования глюкозы, фруктозы, сахарозы, рибозы или 2–3 из этих сахаров.
Существуют различия между видами Calothrix в расположении и структуре чехлов. Иногда чехол покрывает базальную гетероцисту или может достигать только наиболее базально расположенной вегетативной клетки. Чехлы часто содержат сцитонемин, и их цвет варьирует от золотисто- коричневого до очень темного коричневого.
Содержание G+C в ДНК варьирует у одиннадцати штаммов Calothrix в пределах 39,8–44,5 мол.%. По размерам генома десять из них распадаются на 2 группы: семь штаммов – примерно 5,07 х 109 дальтон и три штамма в пределах 7,75–8,58 х 109 дальтон. Однако разделение рода по этому признаку не сочетается с различиями по каким-либо известным фенотипическим признакам.
Представителей большинства видов Calothrix, особенно тех, которые развиваются в условиях чередования увлажнения и высушивания, легко выделить в культуру. Если перенести нити из истощенной по фосфору культуры на агаризованную среду с высоким содержанием фосфора, можно получить образование гормогониев, по крайней мере при благоприятных освещении и температуре. Агаровые пластинки следует просматривать под микроскопом с интервалами в несколько часов, чтобы как можно скорее отделить гормогоний после его выхода из родительского чехла. Можно также осуществить выделение, используя жидкую культуру, поскольку в ней содержащие газовые везикулы гормогонии имеют тенденцию всплывать к поверхности.
Хотя большинство штаммов Calothrix растет в различных лабораторных средах, необходимо обратить внимание на выбор среды, если желательно, чтобы морфология организма была сходной с той, что обычно наблюдается в природных уело- виях. Следует использовать среду с низким содержанием фосфата и связанного азота. Штаммы, поддерживаемые в течение долгого периода на средах с высоким содержанием фосфата, часто претерпевают странные морфологические изменения даже в тех случаях, когда рост быстрый.
Отличия Calothrix от других родов: Многие другие роды сходны С Calothrix по признаку сужения одного конца трихома. Род Homoeothrix, который включает формы с суженными трихомами, но при этом не образующие гетероцист, служил предметом детального исследования с использованием классических ботанических подходов (Коmarек, Каnn, Arch. Protistenk. 115: 173–283, 1973). Некоторые виды выглядят несколько похожими на Lyngbya с сужающимися трихомами (Подгруппа 3), другие похожи на виды Calothrix без гетероцист. Рост штаммов Calothrix в присутствии связанных форм азота обычно приводит к выраженным морфологическим изменениям. У Calothrix в присутствии высоких концентрации NH4+ или NO3– подавлено образование гетероцист и трихомы в большинстве случаев не сужены. Если в этих условиях трихомы все же на одном конце сужены, они напоминают трихомы Homoeothrix; в случае утоньшения обоих концов трихомов возникает сходство с Ammotoidea.
Rivularia и Gloeotrichia – это «классические» ботанические роды, которые имеют общие признаки с Calothrix, но отличаются от него образованием макроскопических колоний, обычно в виде шара или полусферы. У представителей этих родов трихомы суженные и расположены так, что конец трихома с базальной гетероцистой направлен внутрь колонии (рис. 11.6, Д, Е). В большинстве случаев колонии, очевидно, развиваются в результате агрегации множества гормогониев. Почти для всех видов этих родов в природных условиях характерно образование длинных волосков, Цианобактерии Rivularia не образуют акинет, тогда как Gloeotrichia образуют их обычно по одной в трихоме рядом с терминальной гетероцистой.
Использование родовых наименований Gloeotrichia и Rivularia имеет преимущества для целей описания цианобактерии в естественных условиях обитания. Эти роды следует сохранить по крайней мере до тех пор, пока организмы не будут детально изучены с использованием дополнительных критериев.
Выше, в описании Секции С Подгруппы 4, представлен перечень других «традиционных» родов (Saccortema, Isactis, Dichotrix, Gardnerula, Microchaete и др.) с кратким описанием каждого. Возможность их выделения в самостоятельные таксоны на родовом уровне может быть оценена только после критического изучения культур.
Подгруппа 5. (= Порядок: Stigonematales)
Эту подгруппу потенциально нитчатых цианобактерий отличает высокая степень морфологической сложности и дифференцировки. Дополнительно к поперечному клеточному делению происходит продольное и/или диагональное деление. Это приводит к периодическому настоящему ветвлению (все роды) и часто (некоторые виды) к образованию многорядных трихомов (два или более рядов клеток) (см, рис. 11.8, 11.9). У представителей некоторых родов наряду с настоящим ветвлением встречается и ложное ветвление. Для части родов характерны туннелеобразные синапсы, или поровые каналы, между клетками трихома (вероятно, в результате неполного формирования перегородки). Гетероцисты интеркалярные и/или терминальные и иногда латеральные. Хотя размножение осуществляется в результате случайного распада трихомов, у большинства штаммов происходит также образование гормогониев. У некоторых родов образуются акинетоподобные клетки (или псевдоакинеты). Чехлы возможны или отсутствуют.
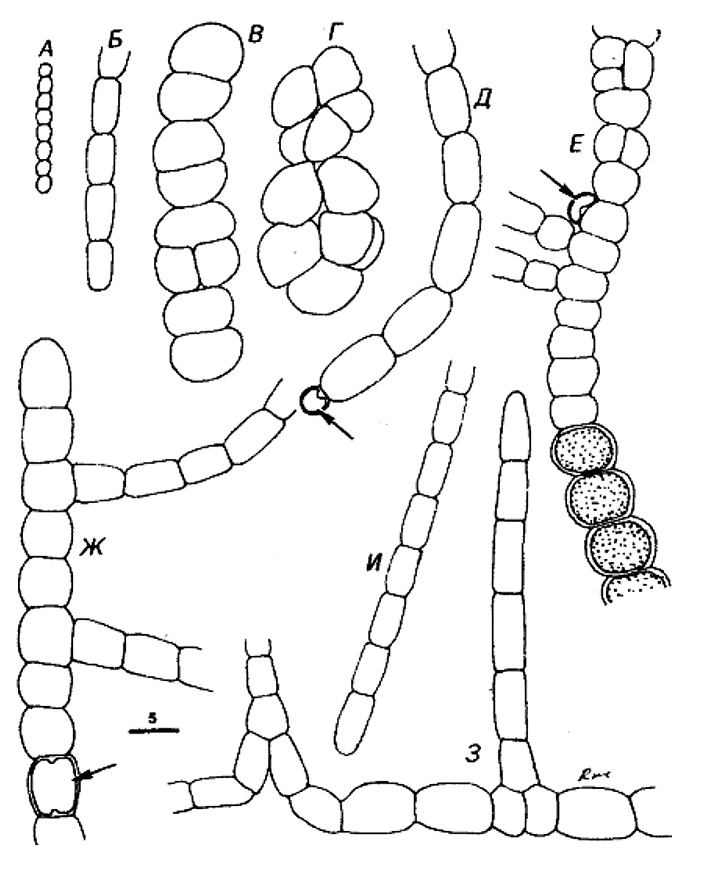
Рис. 11.8. Схематическое изображение представителей родов, входящих в Подгруппу 5. А–Д. Chlorogloeopsis sp.
А. Подвижный гормогоний.
Б. Неподвижный трихом, разнившийся из гормогония.
В. Трихом в период развития аморфной стадии (с одним делением во второй плоскости).
Г. Аморфная стадия, образующаяся в результате делений в трех и более плоскостях.
Д. Трихом при росте в среде, не содержащее связанного азота.
E. Fischerella sp.: трихом с настоящими ветвями и «акинетами» (псевдоакинетами).
Ж-И. Fischerella sp. (= Mastigoctadus laminosus из горячих источников),
Ж. Нить с настоящим ветвлением.
3. Нить с обратным Y-ветвлением.
И. Подвижный гормогоний. Стрелками указаны гетероцисты; клетки, покрытые точками, – «акинеты» (псеадоакинеты).
Шкала – (5 мкм) относится ко всем изображениям.
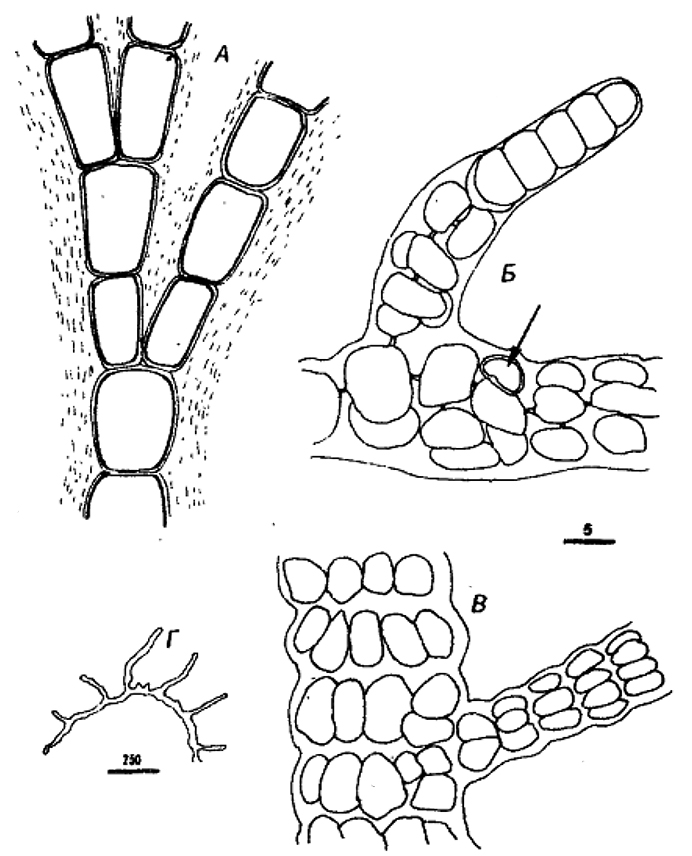
Рис. 11.9. Схематическое изображение представителей родов, входящих в Подгруппу 5 (продолжение).
А. Geitleria sp.: отложения СаСО3 (показаны черточками).
Б. Stigonema sp,: «лоровые каналы», сохранившиеся между клетками после деления. Гормогоний в чехле на вершине ветви.
В. Stigonema sp. Г. Stigonema sp,: таллом в уменьшенном масштабе (шкала 250 мкм).
Стрелкой указана гетероциста.
Шкала (5 мкм) относится ко всем изображениям, кроме Г.
В большинстве случаев ширина трихомов сильно варьирует даже внутри одного клона, поскольку регулярно появляются более узкие вторичные трихомы, образующиеся как ветви более толстых первичных трихомов, даже у видов с однорядными трихомами. Хотя размеры нитей и талломов могут быть значительными, даже макроскопическими, размеры клеток сходны с таковыми обычных цианобактерий (т. е. 5–30 мкм).
Содержание G+C в ДНК у девяти изученных штаммов варьирует лишь в пределах 41,9–46,3 мол,%. Однако эти штаммы представляют только два рода и к тому же, вероятно, только два вида. У шести штаммов размер генома варьирует в пределах 3,62–5,24 х 109 дальтон. Эти два рода, насколько можно судить по сходству нуклеотидных последовательностей их 165-рРНК, лежат относительно близко друг к другу на главной эволюционной ветви, включающей роды Подгруппы 4 (Gtovannoni, J. Bacteriol. 170: 3584-3592, 1988).
В культуре наиболее известны различные изоляты Fischerella (т. е. Mastigocladus laminosus), типичные для текущей воды многих горячих источников с температурой ниже 57–58°С. Однако, кроме того, известно большое число не выделенных в культуру или плохо изученных стигонемовых цианобактерий, встречающихся в олиготрофных озерах со слабо кислой водой и в быстрых водных потоках. Столь же большое число этих цианобактерий встречается во влажных наземных местообитаниях, особенно в тропиках. Немногие представляют собой морские энаолиты и симбионты в лишайниках. Планктонные формы неизвестны.
Только два рода (Fischerella и Chlorogloeopsis) подробно охарактеризованы на основе изучения аксеничных культур; см., однако, работу по Stigonema (Aziz, Nova Hedwigia 49: 447–454, 1989). Из полевых наблюдений очевидно, что существуют и другие четко отличимые роды, хотя в большинстве они еще не получены в культуре. Бурелли (Bourelly, In: Les algues d'eau douce III, 2 ed. pp. 350–387, Boudee, Paris, 1985) относит к порядку Stigonematales 35 родов. Гейтлер (Geitler, Rabenhorst's Kryptgamenflora 14: 459–561, 1932) не признавал существование этого порядка; тем не менее он включал сходное количество родов в 5 семейств. Анагностидис и Комарек (Anagnostidis, Komarek, Arch. Hydrobiol. Suppl. 86: 1–73, 1990) провели существенную ревизию Подгруппы 5 (порядок Stigonematales), в которую они включают восемь семейств и 48 родов (не временно выделяемого большого числа родов и сколько из них не имеют четкого определения). Здесь будет описано только четыре рода, поскольку в культуре известны лишь немногие из временно выделяемого большого числа родов и видов. Приведенный ниже упрощенный ключ включает несколько дополнительных определяемых родов.
Ключ для определения избранных родов Подгруппы 5
I. Настоящее ветвление дихотомическое или субдихотомическое (нити обычно окружены известковыми отложениями)
А. Гетероцисты отсутствуют
Род Geitleria
Б. Гетероцисты имеются
Род Loriella
II. Настоящее ветвление латеральное, нерегулярное или многорядное; нитчатое строение часто неочевидно
А. Гетероцисты – отдельные латеральные одиночные клетки или терминальные на коротких латеральных ветвях, но не интеркалярные
Род Nosiochopsis и Mastigocladopsis
Или, если организмы морские и эндолитические в карбонатах
Род Masllgocoleus
Б. Гетероцисты интеркалярные, иногда также терминальные
1. Образуют гормоцисты и гормогонии; трихомы однорядные
Род Westiella
2. Могут образовываться гормогонии, но не гормоцисты; трихомы однорядные, многорядные или неопределенного строения
а. Настоящие ветви, расположенные упорядочение или беспорядочно, и состоящие из клеток, не отличающихся от клеток главной нити
1) Трихомы по всей длине однорядные
Род Hapalosiphon
2) Трихомы многорядные, по крайней мере в старых участках
Род Stigonema
3) Трихомы обычно многорядные с латеральными ветвями, которые освобождают одиночные клетки (фрагмоциты)
Род Cyanobotrys
4) Зрелые трихомы делятся более чем в одной плоскости, но распадаются на Gloeocapsa-подобные агрегаты неправильной формы (см. Подгруппу 1)
Род Chlorogloeopsis
б. Настоящие ветви образованы клетками, отличающимися по размерам от клеток основной нити
Род Fischerella (включает Mastigocladus)
Род Chlorogloeopsis
Нитчатое строение этого организма часто неясно до тех пор, пока не образуются гормогонии. Гормогонии состоят из коротких цепочек цилиндрических или бочонковидных клеток, которые после прекращения движения увеличиваются и раздуваются, превращаясь в полусферические клетки (рис. 11.8, А– Д). При низком содержаниии в среде NH4+ и NО3– образуются гетероцисты, как интеркалярные, так и терминальные. В процессе роста клеточное деление происходит более чем в одной плоскости (рис. 11.8, В, Г), так что образуются многорядные трихомы или «агрегаты» неправильной формы. Однако нитчатое строение, как правило, утрачивается, поскольку растущая масса клеток обычно распадается на группы или аморфные агрегаты клеток, часто находящиеся внутри слизистого чехла (рис. 11.8, Г). Из таких агрегатов появляются гормогонии. Массы вегетативных клеток могут увеличиваться в размерах при образовании клеток с утолщенными стенками (псевдо- акинет). При прорастании таких клеток происходит деление в нескольких плоскостях и утрата дополнительных слоев клеточной стенки. Синаптические «поровые каналы», характерные для многих родов Подгруппы 5, здесь отсутствуют.
Содержание G+C в ДНК у 2 штаммов составляет 42,1 и 42,9 мол.%. Размеры генома 4,20 и 5,24 х 109 дальтон. Оба штамма факультативные аэробы, хемогетеротрофы, использующие предпочтительно сахарозу, но также глюкозу, фруктозу или рибозу (Rippka et al., J. Gen. Microbiol. Ill: 51–58, 1979). Оба штамма образуют ФЭЦ, но не ФЭ.
Chlorogloeopsis – одни из цианобактерий, у которых наиболее легко получить хемогетеротрофный рост. Средой для фотоавтотрофного роста обычно служит среда Кратца и Майерса с добавлением NaHCО3 (1г • л–1) (табл. 11.1). При необходимости в состав среды включают сахарозу (10 мМ). В фотоавтотрофных условиях наблюдается образование (сразу после инокуляции) из коротких трихомов или гормогониев (рис. 11.8, А) многорядных трихомов, а затем неупорядоченных групп или агрегатов клеток. Однако при росте на свету в присутствии сахарозы образования трихомов не происходило. Одиночные клетки или небольшие группы клеток давали начало более крупным сферическим группам клеток и постепенно еще более крупным, не содержащим нитей агрегатам (рис. 11.8, В, Г). При хемогетеротрофном росте в темноте за счет использования сахарозы культура состояла из неупорядоченных групп клеток, и трихомы также не образовывались (Evans et al., J. Gen, Microbiol. 92: 147– 155, 1976).
Отличия рода Chlorogloeopsis от других родов: На определенных стадиях цикла развития у Chlorogloeopsis наблюдается большое сходство с некоторыми видами Nostoc (Подгруппа 4, Секция А). На стадиях развития, когда нити не образуются, Nostoc трудноотличим от Chlorogloeopsis на сходных стадиях, Подвижные гормогонии также сходны. Однако у Chlorogloeopsis явно выражено деление клеток более чем в одной плоскости, например у прекративших движение гормогониев и у «одноклеточной» стадии и стадии образования групп клеток. У Nostoc на безнитевых стадиях клетки не соединены друг с другом и расположены беспорядочно, но деления в двух или более плоскостях не происходит.
Можно считать, что с Chlorogloeopsis в основных чертах сходны термофильные цианобактерии, недавно определенные как «высокотемпературная форма (high temperature form, HTF) Mastigocladus», хотя в настоящее время мы располагаем сведениями лишь о немногих их признаках кроме морфологических (Castenholz, Mitt. Int. Ver. Theor. Angew. Limnol. 21: 296–315, 1978). Они встречаются по всему земному шару в горячих источниках с температурой воды до 63–64°С. В культурах этих цианобактерий, как состоящих из агрегатов одиночных клеток, так и состоящих из неупорядоченных скоплений клеток, образуются гормогонии, сходные с таковыми Chlorogloeopsis (рис. 11,8, А), Содержание G+C в ДНК у трех штаммов «HTF Mastigocladus» составляет 43,2, 43,5 и 44,8 мол.%.
Ранее авторы, наблюдавшие в природе формы, соответствующие «HTF Mastigocladus», обозначали их просто как формы или варианты Mastigocladus (= Fischerella) laminosus или Hapalosiphon laminosus, Для Mastigocladus laminosus в узком смысле характерны настоящие ветви и инвертированные «V»-ветви, поэтому здесь этот организм включен в род Fischerella (см. Castenholz, In: Вегgey's Manual of Systematic Bacteriology, Vol. 3, pp. 1784-1797).
Род Fischerella
Нитчатые цианобактерии; настоящие ветви однорядные и образованы клетками, у которых обычно длина больше ширины, причем особенно это выражено у клеток, удаленных от основания. Осевая нить (первичный трихом), от которой отходят ветви, в основном однорядная, но может становиться многорвдной в участках» где происходит деление более чем в одной плоскости. Старые осевые нити, однако, редко бывают более 2–3 клеток толщиной. Кроме того, клетки осевых нитей увеличиваются в размерах и часто приобретают полусферическую форму, Старые клетки главной осевой нити может разделять материал чехла, и они могут выполнять функцию акинет (псевдоакинеты). Большая часть расширенных клеток осевого трихома, однако, образует типичную нитевую структуру, в которой клетки разделены перегородкой, состоящей только из пептидогликана и клеточной мембраны. Первичная осевая нить образуется» когда гормогоний прекращает движение, клетки увеличиваются в размерах и у некоторых из них деление начинает происходить в продольной или диагональной (косой) плоскости; часть из возникших таким образом клеток удлиняется и продолжает деление в одной плоскости» в результате чего возникают ветви (вторичные трихомы) (рис, 11.8, Е–И). В некоторых нитях происходит также обратное Y-ветвление (см, рис. 11.8, 3 и словарь в конце разд. «Группа 11).
Узкие вторичные трихомы (которые могут быть несколько суженными на концах) удлиняются по мере удлинения клеток и продолжающегося поперечного деления. Природные популяции Fischerella (Mastigocladus) laminosus в текущей из горячих источников воде почти полностью состоят из пучков или лент, иногда длиной несколько сантиметров, образованных вторичными трихомами; ветвление заметно только в массе распростертых прикрепленных первичных трихомов (главные осевые нити). Вторичные трихомы термофильной Fischerella могут, по крайней мере в культурах, в конце концов дифференцироваться в цепочки сферических толстостенных акинетоподобных клеток (псевдоакинеты) (рис. 11.8, Е), Типичные цианобактериальные типы акинет (характерные для Подгруппы 4) здесь трудно найти.
Гормогоний Fischerella представляет собой скользящий трихом из нескольких (примерно 11–16) узких, морфологически однородных клеток, цилиндрических или слегка бочонковидных (рис. 11.8, И). Они образуются в дистальных частях ветвей. Дифференцировки гетероцист не происходит, пока гормогонии не потеряют подвижность. Гетероцисты у Fischerella (Mastigocladus) laminosus удлиненные, сферические и/или даже уплощенные (длина меньше ширины) и расположены латерально, терминально или интеркалярно (рис. 11,8, Е, Ж). Гетероцисты, по крайней мере у термофильных штаммов, отличаются от гетероцист, типичных для Подгруппы 4, в том отношении, что окружены лишь одним дополнительным слоем клеточной стенки (гомогенного типа) и содержат плотные стопки ламеллярных мембран (П.Э.М. см. Nierzwicki-Bauer et al., Arch Microbiol 137: 97-103, 1984).
Данные о Fischerella в культуре получены в основном для термофильного вида, встречающегося по всему земному шару в горячих источниках с нейтральной или щелочной реакцией воды (см. Castenholz, Mitt. Int. Ver, Theor. Angew. Limnol. 21: 296–315, 1978). Кроме того, опубликованы результаты сравнительного исследования физиологии шести штаммов стигонемовых цианобактерий, включая пять штаммов трех видов Fischerella, ни один из которых не термофильный (Martin, Wyatt, J. Phycoi. 10: 57-65, 1974). Помимо настоящего ветвления, нетермофилъные представители характеризуются также большим разнообразием форм. У другого нетермофильного вида Fischerella между клетками вторичных трихомов обнаружены микроплазмодесмы, обеспечивающие синаптическую связь (Thurston, Ingra, J. Phycoi. 7: 203-210, 1971).
Все семь штаммов Fischerella, исследованные Риппка с соавт. (Rippka et al., J. Gen. Microbiol. Ill: 1–61, 1979), синтезируют ФЭЦ и способны к фотогетеротрофному и темновому хемогетеротрофному росту с использованием глюкозы, фруктозы или сахарозы и в двух случаях – рибозы.
Содержание G+C в ДНК у семи штаммов варьирует в пределах 41,9–46,3 мол.%, а размеры генома у четырех штаммов – в пределах 3,62– 4,75 х 109 дальтон.
Если Fischerella (Mastigocladus) laminosus образует доминирующие, почти однотипные популяции во многих горячих источниках, то нетермофильные виды Fischerella обычно не столь заметны и часто встречаются во влажных наземных местах обитания, таких как поверхность скал и стволов деревьев. Морские формы, по-видимому, редки или отсутствуют.
Использованные для описания рода Fischerella несколько штаммов (Rippka et al., J. Gen. Microbiol. Ill: 1–61, 1979) – все без исключения термофильные организмы, ранее отнесенные к роду Mastigocladus. Культуры легко поддерживать на различных средах, содержащих или не содержащих связанный азот (например, BG-11, среда D; см. табл. 11.1). При посеве зрелой культуры на агаризованную среду сразу образуются подвижные гормогонии. Хотя термофильные формы представляют собой космополитную «растительность» горячих источников, среда с высоким содержанием аммония (т. е. >2 мМ) обычно неблагоприятна для роста. Нетермофильные виды Fischerella обычно выращивают на различных средах для пресноводных цианобактерий.
Отличия рода Fischerella от других родов: Сложное разнообразие форм или стадий развития, среди которых могут быть первичные и вторичные трихомы, гормогонии, одиночные клетки и аморфные агрегаты клеток, делает затруднительной идентификацию Fischerella по какой-либо одной стадии. Наиболее вероятно спутать Fischerella с родами Stigonema и Hapalosiphon. У Stigonema старые главные осевые иити и ветви становятся явио многорядными, однако растущие верхушки обычно на некотором протяжении однорядные. Для Fischerella же характерны вторичные трихомы (ветви) с более удлиненными и узкими клетками, чем в первичном трихоме (главной осевой шгги). Более старые главные осевые нити могут быть многорядными, но не более чем в 2–3 клетки толщиной. Род Hapalosiphon (здесь не описан) определен как организмы с целиком однорядными нитями и ветвями, которые существенно не отличаются от главной осевой нити. Эти три рода четко не разграничены.
Род Geitleria
Ветвление псевдодихотомическое или дихотомическое и латеральное (рис. 11.9, А). Чехлы сильно кальцифицируются и только клетки около вершины трихома способны дать начало латеральным ветвям или ложному дихотомическому ветвлению, при котором апикальная клетка делится в косой плоскости, но еле чего происходит дальнейшее деление обеих образовавшихся клеток. Изучена ультраструктура (П.Э.М.) декальцифицированных образцов, в том числе поровых каналов, или «туннельных соединений». В культуре организмы, относящиеся к этому роду, по-видимому, получены не были. Кальцифицированная цианобактерия Geitleria calcarea обычно встречается в известняковых пещерах.
Род Stigonema
Многие виды этого рода служат примерами наибольшей сложности многоклеточной организации у цианобактерий. Главная осевая нить с многочисленными ветвями может достигать толщины 1 мм (рис. 11.9, Б–Г). Поровые каналы (возможно, результат неполного замыкания поперечных перегородок) обычно присутствуют между всеми клетками, образовавшимися в результате деления (главным образом данные П.Э.М). Ветви, вначале однорядные, постепенно могут становиться столь же сложными, как и главная осевая нить. Вершины ветвей могут быть однорядными на отрезке из нескольких клеток.
Несколько видов Stigonema получены в культуре (моноцианобактериальной), но значительных таксономических исследований с ними проведено не было (см. Aziz, Nova Nedwigia 49: 447–454, 1989).
Stigonema – это род пресноводных или наземных (почвенных) цианобактерий; обычно их обнаруживают на влажных скалах или почве (часто в виде дерновинок) либо в олиготрофных озерах со слегка кислой реакцией воды и иногда в водных потоках. В бентосе некоторых олиготрофных озер цианобактерии Stigonema образуют заметные кустистые маты.
II. Прохлорофиты. (Порядок Prochlorates)
Одноклеточные или нитчатые, разветвленные или неразветвленные прокариоты, напоминающие цианофиты, т. е. цианобактерии, от которых отличаются тем, что содержат хлорофиллы α и b и лишены дополнительных красных или синих билиновых пигментов.
В настоящее время известны два признанных рода; Prochloron – одноклеточные организмы – и Prochlorothrix – нитчатые организмы. Более подробная дифференциация приведена в табл. 11.7.
Таблица 11.7. Признаки различия Prochloron и Prochlorothrix1
Род Prochloron
Одноклеточные организмы сферической формы без выраженного слизистого чехла. Единственный способ размножения, известный к настоящему времени, – бинарное деление с образованием экваториальной перетяжки. До настоящего времени представители этого рода обнаружены исключительно как внеклеточные симбионты в ассоциациях с колониальными асцндиямн (главным образом дидемнидами) в субтропических или тропических морских прибрежных водах.
Типовой (и единственный) вид: Prochloron didemni.
Признаки вида: Как для рода.
Род Prochlorothrix
Иеразветвленные трихомы неопределенной длины. Клеточная дифференцировка отсутствует. Грамот- ртщательные. Фотосннтетнческие мембраны лишены фикобилисом. Клетки содержат хлорофиллы а и Фикобилиновые пигменты отсутствуют. Окси- генные фотоавтотрофы; в темноте поглощают кислород в процессе дыхания. Содержание G+C в ДНК равно 53 мол,% (один вид, один штамм).
Типовой (и единственный) вид: Prochlorothrix hollandica.
Признаки вида: Как для рода.
Необходимые указания для пользования данным определителем
Если в сносках под таблицей нет других пояснений, то используемые обозначения имеют следующий смысл:
«+» – 90% и более штаммов положительные
«–» – 90% и белее штаммов отрицательные
«d» – 11-89% штаммов положительные
«V» – нестабильность на уровне штаммов (не равнозначно «d»
«D» – различные реакции у разных таксонов (видов одного рода или родов одного семейства)
Для других обозначений пояснения приведены в сносках под таблицами.

